


2. 新疆维吾尔自治区药物研究所,;
3. 新疆维吾尔药实验室,新疆 乌鲁木齐 830002;
4. 新疆维吾尔自治区维吾尔医药研究所,新疆 乌鲁木齐 830049
邢建国(1968-),男,研究员,博士生导师,研究方向:中药药理学、新药研发,通信作者,E-mail:xjguodd@163.com
 ,
SU Wen-ling2,3,
XU Lei2,3,
LI Zhi-jian4,
LIU Di-wei2,
ZHENG Rui-fang2,3
,
SU Wen-ling2,3,
XU Lei2,3,
LI Zhi-jian4,
LIU Di-wei2,
ZHENG Rui-fang2,3
 ,
XING Jian-guo2,3
,
XING Jian-guo2,3

2. Xinjiang Medicine Research Institute,;
3. Xinjiang Uygur Medicine Laboratory, Urumqi 830002, China;
4. Xinjiang Uygur Medical Research Institute, Urumqi 830049, China
随着医疗质量和诊疗能力的提升,癌症患者生存率呈现逐渐上升趋势,但其治疗过程中的心脏毒性已引起社会的广泛关注。阿霉素(doxorubicin,DOX)是一种蒽环类抗癌药物,能有效治疗各种恶性肿瘤,但因其剂量依赖性的心脏毒性限制了其临床应用[1]。研究表明,内皮细胞是心血管系统的重要组成部分,在维持血管系统稳态方面发挥重要作用[2]。DOX所致心脏毒性小鼠可见冠状动脉微血管损伤,心脏毛细血管面积明显减少,抑制内皮功能,造成心肌损伤[3]。因此,探讨内皮功能障碍在DOX心脏毒性中的作用及机制,可能为防治阿霉素心脏毒性提供新的方向。
血管内皮生长因子B(vascular endothelial growth factor B,VEGF-B)是血管内皮生长因子家族成员之一,在心脏中的表达最为丰富,VEGF-B在病理条件下对血管存活至关重要[4]。有研究报道,VEGF-B可促进冠状动脉生成、缺血抵抗,抑制DOX诱导的心肌萎缩,抑制内皮功能障碍,保护内皮细胞,是预防DOX所致心脏毒性有意义的候选指标[4-6]。
香青兰又名巴迪然吉布亚,为唇形科野芝麻亚科青兰属植物香青兰Dracocephalum moldavica L.的干燥地上部分,在新疆地区资源尤其丰富,临床上主要用于心血管疾病的治疗且疗效确切。前期研究发现,香青兰总黄酮(total flavonoids of Dracocephalum moldavica L.,TFDM)可以提高DOX损伤的大鼠心肌细胞的存活率,抑制心肌细胞线粒体功能障碍[7],从而发挥抑制DOX心脏毒性作用,但其对内皮细胞的保护作用尚未研究。因此,本研究拟探讨TFDM对DOX诱导HUVEC细胞损伤和内皮功能障碍的保护作用及分子机制,进而寻找新的治疗靶点。
1 材料与方法 1.1 药物与试剂TFDM(质量分数:60.60%~62.35%)由新疆维吾尔自治区药物研究所自制[8](批号: 20180406);DMEM无糖培养基、胎牛血清购自美国Gibco公司;0.25% 胰酶、DMEM高糖培养基购自美国HyClone公司;CCK-8试剂盒、广谱磷酸酶抑制剂购自美国博士德生物;乳酸脱氢酶(lactate dehydrogenase,LDH)和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自南京建成生物工程研究所; SDS-PAGE凝胶快速配制试剂盒购自中国碧云天生物技术有限公司;BCA蛋白定量试剂盒购自美国Pierce公司;RIPA强裂解液、苯甲基黄酰氟化物PMSF试剂、线粒体膜电位检测试剂盒(JC-1)购自北京索莱宝科技有限公司;彩色蛋白marker购自美国Thermo Fisher公司;VEGF-B抗体(ab185696)、VEGF Receptor 1抗体(ab32152)、Neuropilin 1抗体(ab81321)、p-eNOS抗体(Ab215717)、SRC抗体(ab40660)、ET-1抗体(ab2786)购自英国Abcam公司;AMPKα抗体(CST2532)、p-AMPKα抗体(CST2535)、eNOS抗体(CST32027s)、FAK抗体(3285s)购自美国Cell Signaling Technology公司;GAPDH抗体、辣根酶标记的山羊抗兔IgG、辣根酶标记的山羊抗小鼠IgG购自中国中杉金桥公司;ECL发光液购自美国Millipore。
1.2 主要仪器细胞培养箱购自美国Thermo Fisher公司;多功能微孔板检测仪购自瑞士TECAN SPARK公司;多功能成像系统购自法国VILBER公司;电泳仪和电泳槽装置购自美国BIO-RAD公司;台式高速冷冻离心机TGL-16k购自湖南湘仪实验室仪器开发有限公司。
1.3 细胞株及细胞培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自深圳市豪地华拓生物科技有限公司,培养于含10% FBS的DMEM高糖培养基中。当内皮细胞生长至融合度达85%~90%时,用胰酶-EDTA(0.25%)溶液消化细胞,并将其置于细胞培养箱中(37 ℃、5% CO2)进行传代培养,在细胞对数生长期进行实验。
1.4 DOX损伤细胞模型建立及分组给药HUVEC细胞随机分为对照组、模型组和TFDM各浓度组(25、50、100 mg·L-1)。TFDM预处理12 h后用1 μmol·L-1的DOX诱导24 h[9-10],模拟DOX损伤内皮细胞的病理变化。
1.5 细胞活力检测将HUVEC细胞(5×107个·L-1)接种于96孔板中,每组设6个复孔,按照“1.4”项下分组及处理,按照CCK-8试剂盒说明书方法检测细胞活力,多功能微孔板检测仪在450 nm波长处测定各组吸光度值(optical density,OD)。
细胞存活率/% =(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%
1.6 HUVEC细胞形态学观察取对数生长期HUVEC细胞,制备成细胞悬液,计数,调整细胞密度为2.5×108个·L-1, 每孔2 mL,将细胞接种于6孔培养板。按照“1.4”项下方法分组及处理,倒置显微镜下观察HUVEC形态改变。
1.7 细胞内LDH和SOD检测将HUVEC细胞(5×107个·L-1)接种于96孔板,按照“1.4”项下方法分组和给药造模,每组设置6个复孔,按照检测试剂盒说明书测定细胞损伤后释放的乳酸脱氢酶(LDH)和超氧化物歧化酶(SOD)的水平。本实验进行3次独立实验。
1.8 MMP检测取对数生长期HUVEC细胞,将细胞接种于6孔培养板,细胞按1.4项下方法分组和给药造模,每个实验组设置3个复孔。去除培养基,PBS清洗2次,加入1 mL培养基和1 mL配制好的JC-1染色工作液,混匀,置于细胞培养箱(37 ℃,5% CO2)中于孵育20 min。孵育结束后,JC-1染色缓冲液清洗2次,加入细胞培养液,在同一放大倍数荧光显微镜下观察,每孔随机选取3个视野进行拍照,采用ImageJ软件对拍照结果红绿荧光的荧光强度进行分析,取各孔3个视野的均值进行统计。本实验进行3次独立实验。
1.9 HUVEC细胞迁移能力检测消化、重悬各组待测细胞,以无糖培养基调整细胞密度为1×109个·L-1,取200 μL接种至Transwell小室上室,下室中则加入500 μL含10% FBS的高糖培养基。孵育适当时间后将小室取出,轻轻擦拭掉上室未迁移的细胞,PBS清洗,4%中性甲醛固定20 min,苏木精染色30 min。最后在光学显微镜200倍视野下观察,每组每孔随机选取5个视野进行计数,取平均值进行统计分析。本实验进行3次独立实验。
1.10 免疫印迹法(Western blot)检测相关蛋白表达取对数生长期HUVEC细胞,接种于6孔板,按照“1.4”项下分组和给药造模。弃去细胞上清,用预冷的PBS洗涤3遍,加入RIPA(强)裂解液(含1% 蛋白磷酸酶抑制剂和1% PMSF),冰上裂解30 min。低温离心(12 000 r·min-1、10 min),使用BCA试剂盒测定蛋白样品浓度,按比例加入蛋白上样缓冲液,金属浴煮蛋白(95 ℃、5 min)使其变性,-20 ℃冷冻保存。配制SDS-多聚丙烯酰胺凝胶,上样、电泳、转膜至PVDF膜,5%脱脂奶粉封闭。分别加入稀释好的VEGF-B(ab185696,1 ∶ 1 000)、VEGF Receptor 1(ab32152,1 ∶ 1 000)、Neuropilin 1(ab81321,1 ∶ 1 000)、p-eNOS(Ab215717, 1 ∶ 1 000)、SRC(ab40660,1 ∶ 1 000)、ET-1(ab2786,1 ∶ 1 000)、AMPKα(CST2532, 1 ∶ 1 000)、p-AMPKα(CST2535, 1 ∶ 1 000)、eNOS(CST32027s,1 ∶ 1 000)、FAK(3285s,1 ∶ 1 000)、GAPDH(1 ∶ 2 000)一抗孵育过夜(4 ℃)、TBST(1×)充分漂洗3次,10 min/次,然后加入辣根酶标记的山羊抗兔IgG(1 ∶ 2 000)、山羊抗小鼠IgG(1 ∶ 2000)二抗室温孵育2 h,TBST(1×)充分漂洗3次,10 min/次,用ECL显色液进行显影。多功能成像系统采集显影后的图像,使用ImageJ软件分析条带灰度(以GAPDH为内参)。
1.11 数据处理采用GraphPad Prism 8.0软件进行数据处理和作图,以x±s表示,3次独立实验,采用单因素方差ANOVA进行多组数据间比较分析。
2 结果 2.1 TFDM对DOX损伤的HUVEC细胞活力的影响如Fig 1A所示,不同浓度的TFDM(1.25、2.5、5、10、25、50和100 mg·L-1)作用于HUVEC细胞36 h,对细胞存活率均无明显影响,均为无毒浓度。为确定TFDM对DOX损伤是否具有改善作用,本研究采用相应浓度TFDM干预,对HUVEC细胞活力进行测定。与对照组相比较,模型组细胞活力明显下降;与模型组比较,TFDM的质量浓度分别为5、10、25、50和100 mg·L-1时,细胞存活率明显升高(P < 0.05,Fig 1B)。上述结果提示,TFDM可改善DOX损伤,使HUVEC细胞活力增强。因此,后续实验选用的TFDM质量浓度分别为25、50和100 mg·L-1。
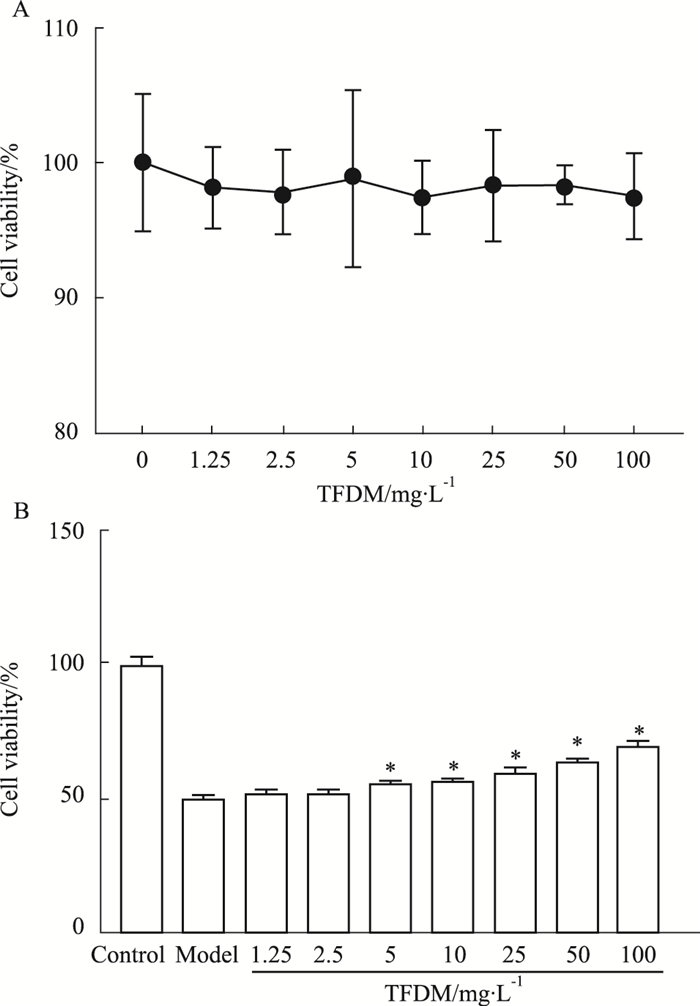
|
| Fig 1 The protective effects of TFDM on HUVECs (x±s, n=3) A: HUVECs were treated with TFDM (0, 1.25, 2.5, 5, 10, 25, 50 and 100 mg·L-1) for 36 h, respectively, and cell viability was determined by CCK-8 assay; B: The effect of TFDM on the survival rate of HUVEC cells injured by DOX. *P < 0.05 vs model group |
结果如Fig 2所示,对照组HUVEC细胞生长状态良好,细胞呈长梭形、扁平型、多角形,排列紧密;模型组HUVEC生长停滞,细胞数量减少,体积缩小,胞质中有暗色颗粒,部分变圆,脱落;TFDM低、中、高剂量组细胞多呈长梭形、扁平型、多角形,收缩变圆细胞明显减少。提示TFDM能够明显改善DOX引起的内皮细胞形态学变化。
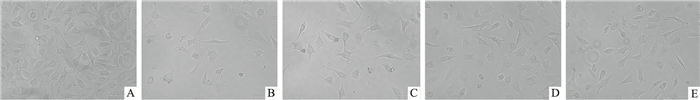
|
| Fig 2 Effect of TFDM on morphology of HUVECs induced by DOX (×100) A: Control group; B: DOX group; C: Low dose TFDM group; D: Medium dose TFDM group; E: High dose TFDM group |
采用LDH和SOD试剂盒检测细胞损伤程度。结果如Fig 3A所示,与对照组比较,模型组细胞LDH释放明显升高(P < 0.05);与模型组比较,TFDM低、中、高剂量给药组则明显降低LDH水平(P < 0.05),提示TFDM能够减轻或恢复DOX引起的HUVEC细胞损伤; 结果如Fig 3B所示,与对照组比较,模型组细胞SOD活性明显降低(P < 0.05);与模型组比较,TFDM干预后呈剂量依赖性地升高DOX损伤细胞内SOD活性(P < 0.05),提示TFDM能够上调HUVEC细胞中的SOD活性。
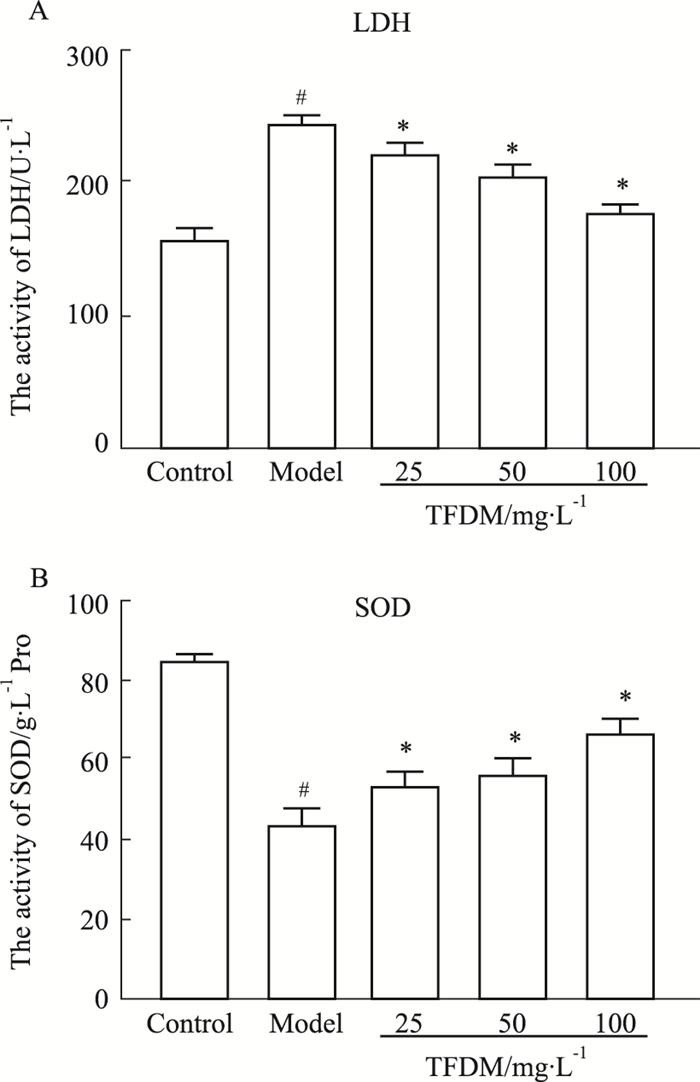
|
| Fig 3 The protective effects of TFDM on HUVECs injured by DOX (x±s, n=3) A: Lactate dehydrogenase (LDH) level; B: Superoxide dismutase (SOD) level; #P < 0.05 vs control group; *P < 0.05 vs model group |
JC-1是一种广泛用于检测MMP的理想荧光探针,采用JC-1标记线粒体膜电位的方法评价线粒体功能。当线粒体膜电位较高时,JC-1大量聚集在线粒体基质中,发射光以红色荧光为主;当线粒体膜电位较低时,JC-1以单体形式存在,不能聚集在线粒体基质中,发射光则以绿色荧光为主。采用红绿荧光相对比例来衡量线粒体膜电位变化。结果如Fig 4所示,与对照组相比较,模型组细胞红色荧光向绿色荧光转移,线粒体膜电位明显降低(P < 0.05),TFDM组与模型组相比,可减少红色荧光向绿色荧光转移,TFDM组细胞膜电位升高(P < 0.05),稳定线粒体功能,发挥细胞保护作用。

|
| Fig 4 Effects of TFDM on MMP in HUVECs injured by DOX (x±s, n=3) A: Cell images stained by the lipophilic cationic probe JC-1. Red signal indicated JC-1 in mitochondria, and green signal indicated cytosolic JC-1; B: Quantitative analysis of MMP based on the cell images stained by JC-1; #P < 0.05 vs control group; *P < 0.05 vs model group |
内皮细胞迁移,对于维持血管功能和结构的稳定具有重要作用。Transwell小室实验检测结果如Fig 5所示,与对照组相比,模型组穿膜细胞数量减少(P < 0.05),模型组细胞迁移能力减弱;与模型组相比,TFDM中、高剂量处理组穿模细胞数量增多(P < 0.05),细胞迁移能力增强;TFDM低剂量处理组与模型组穿膜细胞数量相比差异没有统计学意义(P>0.05)。提示DOX抑制HUVEC细胞迁移,TFDM可以改善DOX诱导的HUVEC细胞迁移能力,维持血管功能。
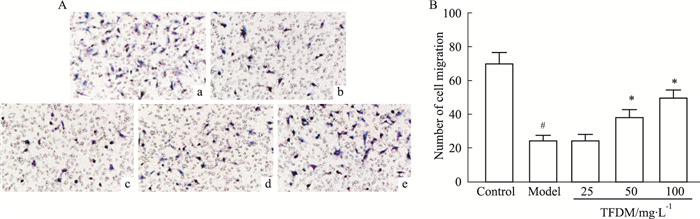
|
| Fig 5 Effects of TFDM on migration of HUVECs treated with DOX detected by Transwell assay (x±s, n=3) A: Control group(a), DOX group(b), Low dose TFDM group(c), Medium dose TFDM group(d), High dose TFDM group(e) (×200); B: Number of cell migration; #P < 0.05 vs control group; *P < 0.05 vs model group |
Src和FAK是血管内皮屏障功能的主要调控因素,内皮素-1(endothelin 1,ET-1)在维持血管张力和血管稳态中发挥重要作用[11]。由内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)催化生成的NO是内皮细胞产生的最重要的舒血管因子,可以维持血管平衡稳态[12]。本研究通过Western blot方法对ET-1、FAK、Src和p-eNOS的蛋白表达进行检测。结果如Fig 6所示,与对照组比较,DOX处理后的HUVEC细胞ET-1蛋白水平明显升高,FAK、Src、p-eNOS蛋白水平降低;但与模型组比,TFDM可明显下调ET-1蛋白水平,升高FAK、Src和p-eNOS的蛋白表达。提示TFDM可能通过调控ET-1、FAK、Src和p-eNOS的蛋白表达水平,维持血管张力和血管稳态,从而发挥抑制DOX诱导HUVEC细胞内皮功能障碍的作用。
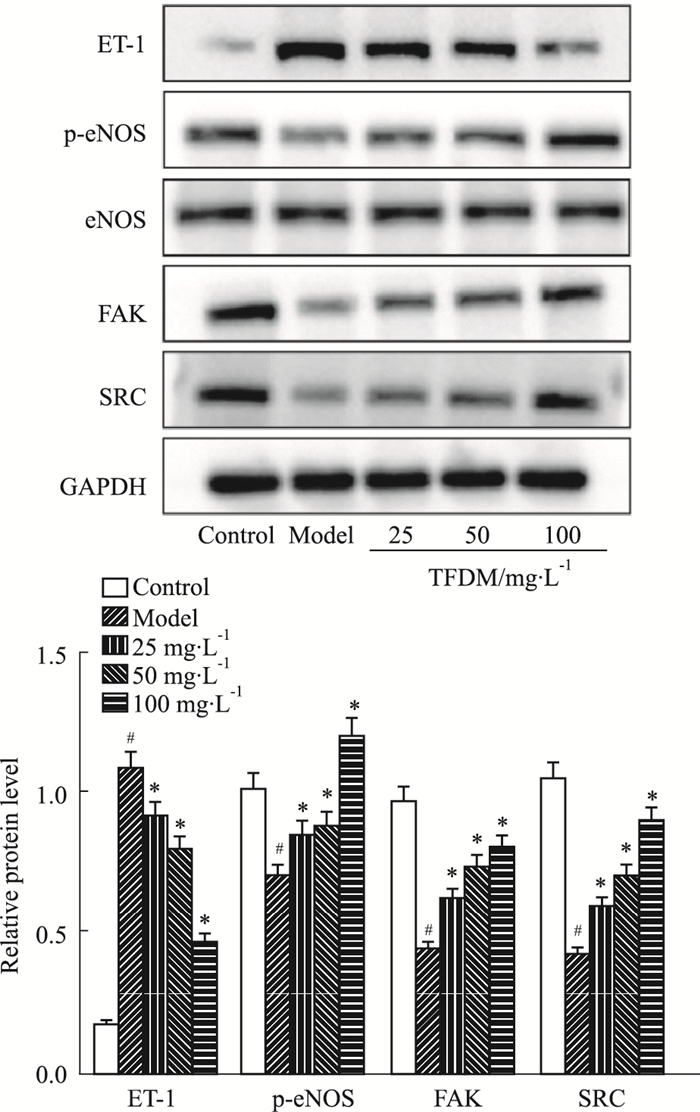
|
| Fig 6 Effects of TFDM on expression of proteins of DOX-induced HUVECs (x±s, n=3) #P < 0.05 vs control group; *P < 0.05 vs model group |
VEGF-B与内皮细胞上的VEGFR1和NRP1受体结合,激活AMPKα,增加了内皮型一氧化氮合酶含量,从而发挥促进微血管内皮细胞增殖,维持血管屏障完整性,促进微血管稳态的作用。结果如Fig 7所示,与对照组比较,DOX损伤后HUVEC细胞VEGF-B、NRP1、VEGFR1蛋白表达水平降低,AMPKα蛋白磷酸化水平降低。而TFDM干预后使VEGF-B、NRP1、VEGFR1、和p-AMPKα蛋白表达水平升高,TFDM抑制阿霉素诱导的内皮细胞损伤的机制可能与激活VEGF-B/AMPKα通路有关。
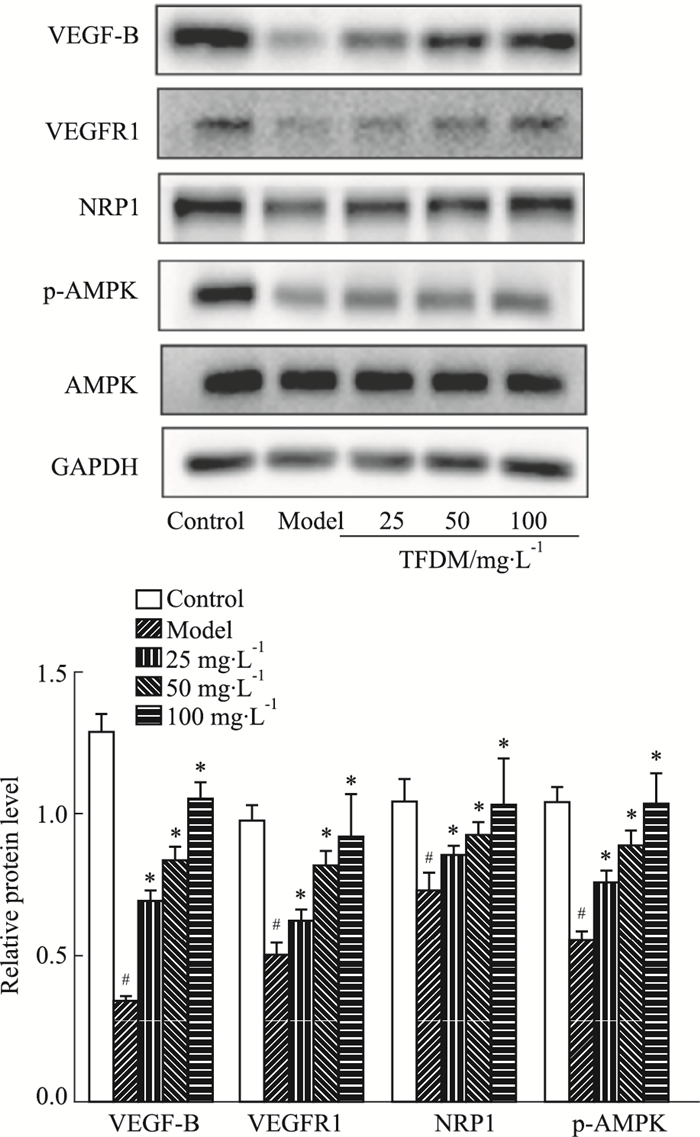
|
| Fig 7 Effects of TFDM on expression of proteins of DOX-induced HUVECs (x±s, n=3) #P < 0.05 vs control group; *P < 0.05 vs model group |
内皮功能障碍是心血管并发症的一系列关键病理生理事件,可能导致出血、梗塞、动脉粥样硬化和再狭窄等。Yin等[13]发现, DOX可以减少心脏内皮细胞迁移,抑制血管网形成,降低心脏血管密度。儿童白血病患者经DOX治疗生存时间超过10年者,其血管内皮功能明显受损,而心脏未见明显影响[14],因此,DOX对心脏的毒性作用可能是其对血管内皮细胞的影响所继发的,说明DOX对血管的损伤可能是其心脏毒性的始动因素。本次实验通过建立DOX诱导HUVEC内皮细胞损伤模型,进行细胞形态学和功能学检测,证实DOX可以抑制内皮细胞增殖,改变内皮细胞形态,增加LDH漏出量,降低SOD活力,降低线粒体膜电位,造成内皮细胞损伤。给予TFDM预保护后,不仅可以促进内皮细胞生存和增殖,改善细胞形态,还可以抑制线粒体功能障碍,从而发挥抑制DOX损伤的HUVEC细胞的作用。
NO是血管内皮细胞分泌的一种重要血管舒张活性物质,与维持心血管稳态密切相关,具有抑制平滑肌增生,避免血管病理重构和管腔狭窄的作用,且主要由eNOS催化生成[12]。内皮素(endothelin,ET)是迄今所知最强的缩血管物质,广泛存在于血管内皮和各种组织、细胞中,分为3种类型,其中以内皮素-1(endothelin 1,ET-1)活性最强,对微循环的调节起着重要作用[15]。一方面eNOS磷酸化水平表达紊乱,可能导致血管内皮细胞的损伤;另一方面,ET-1的异常表达常被认为与各种心血管疾病的发生和发展有关[16]。在结构上,Src和FAK被认为是通过促进VE-钙黏蛋白磷酸化来控制内皮屏障功能的关键因素[14]。本实验对eNOS磷酸化水平、ET-1、FAK、Src蛋白表达水平进行检测,与模型组比较,TFDM可明显下调ET-1蛋白水平,升高FAK、Src和p-eNOS的蛋白表达。提示我们TFDM可能通过调控ET-1、FAK、Src和p-eNOS的蛋白表达水平,维持血管张力和血管稳态,来发挥抑制DOX对内皮屏障功能和微血管稳态的损伤作用。细胞迁移试验中,我们发现,模型组穿过小室的细胞数量明显减少,提示DOX诱导HUVEC细胞迁移能力减弱,内皮细胞功能受到损伤。而TFDM作用后,穿过的细胞数目增多,进一步提示我们TFDM可能通过增强HUVEC细胞迁移能力,保护内皮细胞功能,维持微血管稳态。
血管内皮生长因子B(vascular endothelial growth factor B,VEGF-B)是在1996年作为VEGF同源物被发现,在高代谢活性的组织如心肌、骨骼肌中表达最为丰富。据文献报道,VEGF-B可以改善DOX诱导的小鼠内皮细胞功能障碍,防止心脏毛细血管稀疏,改善线粒体呼吸,保护内皮细胞免于凋亡,并恢复其成管功能[4]。VEGF-B通过与内皮细胞上的血管内皮生长因子受体1(VEGFR1)和神经纤毛蛋白1(NRP1)受体结合[17-18],进一步激活AMPKα,增加了内皮型一氧化氮合酶含量,从而发挥促进微血管内皮细胞增殖,维持血管屏障完整性,促进微血管稳态的作用。此研究中通过Western blot法检测VEGF-B/AMPKα通路相关蛋白表达情况证实,DOX损伤HUVEC细胞后,明显抑制VEGF-B蛋白表达,其受体NRP1、VEGFR1表达也受到抑制,p-AMPKα/AMPKα蛋白表达降低,VEGF-B/AMPKα通路在DOX损伤HUVEC细胞中发挥重要作用。给予TFDM预保护后,TFDM可以激活阿霉素诱导的HUVEC细胞VEGF-B/AMPKα信号通路。
综上所述,TFDM可明显抑制DOX引起的内皮细胞损伤。同时增强了VEGF-B/AMPKα信号通路活性,但TFDM是否通过激活VEGF-B/AMPKα信号通路发挥抑制DOX引起的内皮细胞损伤作用是我们需要进一步探讨的问题。后续试验将主要通过小分子RNA干扰抑制VEGF-B和AMPKα表达,对TFDM如何调控DOX引起的内皮细胞损伤进行蛋白和基因水平上深层次的研究。
| [1] |
简春燕, 郭润民, 刘丹铭, 等. 柚皮苷保护H9c2心肌细胞对抗阿霉素诱导的心肌毒性[J]. 中国药理学通报, 2014, 30(2): 238-43. Jian C Y, Guo R M, Liu D M, et al. Naringin protects H9c2 cells against doxorubicin-induced cardiotoxicity[J]. Chin Pharmacol Bull, 2014, 30(2): 238-43. doi:10.3969/j.issn.1001-1978.2014.02.021 |
| [2] |
Sonowal H, Pal P, Shukla K, et al. Aldose reductase inhibitor, fidarestat prevents doxorubicin induced endothelial cell death and dysfunction[J]. Biochem Pharmacol, 2018, 150: 181-90. doi:10.1016/j.bcp.2018.02.018 |
| [3] |
Melincovici C S, Boşca A B, Şuşman S, et al. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Rom J Morphol Embryol, 2018, 59(2): 455-67. |
| [4] |
Räsänen M, Degerman J, Nissinen T A, et al. VEGF-B gene therapy inhibits doxorubicin-induced cardiotoxicity by endothelial protection[J]. Proc Natl Acad Sci USA, 2016, 113(46): 13144-9. doi:10.1073/pnas.1616168113 |
| [5] |
Chen R, Lee C, Lin X, et al. Novel function of VEGF-B as an antioxidant and therapeutic implications[J]. Pharmacol Res, 2019, 143: 33-9. doi:10.1016/j.phrs.2019.03.002 |
| [6] |
Kivelä R, Bry M, Robciuc M R, et al. VEGF-B-induced vascular growth leads to metabolic reprogramming and ischemia resistance in the heart[J]. EMBO Mol Med, 2014, 6(3): 307-21. doi:10.1002/emmm.201303147 |
| [7] |
都研文, 郑瑞芳, 曾诚, 等. 香青兰总黄酮对阿霉素心肌毒性的保护机制研究[J]. 中草药, 2019, 50(24): 6045-51. Du Y W, Zheng R F, Zeng C, et al. Protective effect and mechanism of total flavonoids of Dracocephalum moldevica on doxorubicin myocardial toxicity[J]. Chin Tradit Herbal Drugs, 2019, 50(24): 6045-51. doi:10.7501/j.issn.0253-2670.2019.24.019 |
| [8] |
邢建国, 何承辉, 于宁, 等. 香青兰提取物及其制备方法和用途: 中国, CN105250366A[P]. 2016-01-20. Xing J G, He C H, Yu N, et al. Extract of Dracocephalum moldavica L. and its preparation and application: CHINA, CN105250366A[P], 2016-01-20. |
| [9] |
Jiang C T, Jiang L P, Li Q N, et al. Pyrroloquinoline quinine ameliorates doxorubicin-induced autophagy-dependent apoptosis via lysosomal-mitochondrial axis in vascular endothelial cells[J]. Toxicology, 2019, 425: 152238. doi:10.1016/j.tox.2019.152238 |
| [10] |
Chen C C, Hong H J, Hao W R, et al. Nicorandil prevents doxorubicin-induced human umbilical vein endothelial cell apoptosis[J]. Eur J Pharmacol, 2019, 859: 172542. doi:10.1016/j.ejphar.2019.172542 |
| [11] |
Homma S, Kimura T, Sakai S, et al. Calcitonin gene-related peptide protects the myocardium from ischemia induced by endothelin-1: Intravital microscopic observation and (31)P-MR spectroscopic studies[J]. Life Sci, 2014, 118(2): 248-54. doi:10.1016/j.lfs.2014.02.024 |
| [12] |
杜智超, 姜睿. 血管外周脂肪组织与血管内皮细胞功能障碍的研究进展[J]. 西南医科大学学报, 2018, 41(3): 284-6. Du Z C, Jiang R. Research advances in perivascular adipose tissue and vascular endothelial dysfunction[J]. J Southwest Med Univ, 2018, 41(3): 284-6. doi:10.3969/j.issn.2096-3351.2018.03.022 |
| [13] |
Yin Z W, Zhao Y R, Li H P, et al. miR-320a mediates doxorubicin-induced cardiotoxicity by targeting VEGF signal pathway[J]. Aging (Albany NY), 2016, 8(1): 192-207. |
| [14] |
Chen X Y, Zhang Y, Zhu Z N, et al. Protective effect of berberine on doxorubicin induced acute hepatorenal toxicity in rats[J]. Mol Med Rep, 2016, 13(5): 3953-60. doi:10.3892/mmr.2016.5017 |
| [15] |
Zhou H, Li D D, Zhu P J, et al. Inhibitory effect of melatonin on necroptosis via repressing the Ripk3-PGAM5-CypD-mPTP pathway attenuates cardiac microvascular ischemia-reperfusion injury[J]. J Pineal Res, 2018, 65(3): e12503. doi:10.1111/jpi.12503 |
| [16] |
Sandoval Y H, Atef M E, Levesque L O, et al. Endothelin-1 signaling in vascular physiology and pathophysiology[J]. Curr Vasc Pharmacol, 2014, 12(2): 202-14. doi:10.2174/1570161112666140226122054 |
| [17] |
Olofsson B, Korpelainen E, Pepper M S, et al. Vascular endothelial growth factor B (VEGF-B) binds to VEGF receptor-1 and regulates plasminogen activator activity in endothelial cells[J]. Proc Natl Acad Sci U S A, 1998, 95(20): 11709-14. doi:10.1073/pnas.95.20.11709 |
| [18] |
Makinen T, Olofsson B, Karpanen T, et al. Differential binding of vascular endothelial growth factor B splice and proteolytic isoforms to neuropilin-1[J]. J Biol Chem, 1999, 274(30): 21217-22. doi:10.1074/jbc.274.30.21217 |