


潘扬(1964-),男,博士,教授,博士生导师,研究方向:中药化学与生物技术,通信作者,E-mail:ypan@njucm.edu.cn
肺癌仍然是全世界癌症死亡的主要原因,来自WHO国际癌症研究机构的最新数据表明,2020年的肺癌发病人数虽居第2位,但仍然是“第一癌症杀手”;且在中国高发癌种和病死人数第一位的仍是肺癌。非小细胞肺癌(non-small cell lung carcinoma,NSCLC)约占所有肺癌的85%。大多数NSCLC患者在诊断时已出现局部晚期或转移性恶变,只得采用化疗的方式进行治疗[1]。
ROCK是一类属于丝氨酸-苏氨酸家族的Rho激酶,参与血管平滑肌细胞收缩、肌动蛋白细胞骨架重组、细胞黏附和移动、胞质分裂、肿瘤细胞浸润等多种功能调节[2]。ROCK的表达增强常出现在多种癌症中,这些癌症(包括NSCLC)更具侵袭性和转移性[3]。
甲基莲心碱(neferine,Nef)是从传统中药材兼茶食材莲子心(Nelumbinis plumula)[4]中得到的一种双苄基异喹啉类生物碱,它对肺癌、胃癌、肝癌、乳腺癌和骨肉瘤均有一定的治疗作用[5]。研究表明,Nef可明显促进人肺腺癌A549细胞的凋亡及自噬,并能增强化疗药物顺铂和阿霉素的抗NSCLC作用[6]。前期在研究Nef松弛血管平滑肌的作用时,我们发现其可能为强力的ROCK1抑制剂[7]。迄今为止,Nef是否通过下调ROCK表达从而抑制NSCLC尚不清楚。在本研究中,我们观察了Nef抑制非小细胞肺癌H1299细胞增殖、迁移和侵袭的作用。为了阐明Nef对这种NSCLC细胞抑制作用的潜在机制,我们检测了Nef对ROCK靶标表达的影响,并用分子对接方法预测了Nef与ROCK1的相互作用方式,为中药莲子心临床应用提供了科学数据。
1 材料与方法 1.1 实验材料 1.1.1 细胞与药品人NSCLC细胞系H1299细胞(江苏凯基生物技术股份有限公司)。H1299细胞是来源于淋巴结的人NSCLC细胞系[8]。
Nef(由本实验室提取制备),通过IR、UV、1H NMR、13C NMR和Tof-MS解析确定分子结构(Fig 1)[7, 9];经HPLC峰面积归一化法分析,纯度大于95%。
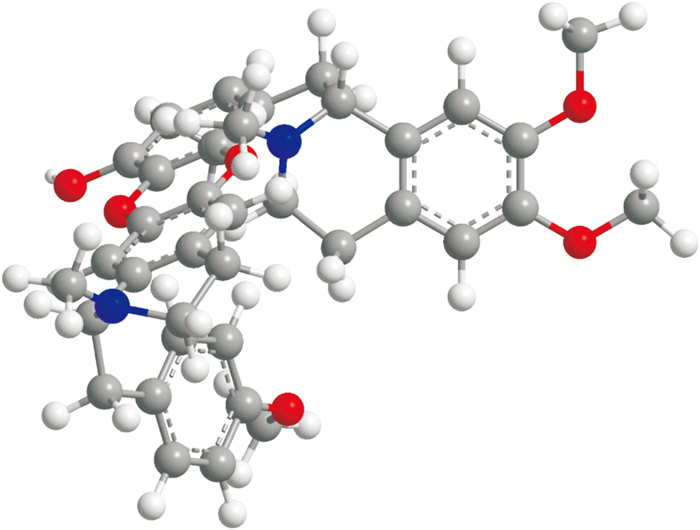
|
| Fig 1 The chemical structure of neferine |
RPMI 1640培养基(批号:28620006);胰蛋白酶(批号:325-042-EL);胎牛血清(维森特生物技术有限公司,批号:086-150);ROCK1一抗(兔单抗,批号:14n3904);GAPDH一抗(兔单抗,批号:9217);E-cadherin一抗(兔单抗,批号:5814);N-cadherin一抗(兔单抗,批号:6N17);Vimentin一抗(兔单抗,批号:5814);辣根过氧化酶(HRP)标记的山羊抗兔二抗(美国Affinity公司,批号:56j9958);RIPA细胞裂解液(批号:030221210521);PVDF膜(批号:30599A02);QuickBlockTM Western二抗稀释液和封闭液(碧云天生物技术研究所,批号:P0258-500);ECL化学发光试剂(美国Advansta公司,批号:102031510、102031511);iTaqTM Universal SYBR® Green超混合液(美国Bio-Rad公司,批号:64367872);Transwell小室(美国Millipore公司,批号:3422);Matrigel基质胶(美国BD公司,批号: 356234)。
靶标蛋白ROCK1与法舒地尔(fasudil, Fas)复合物的三维结构文件来源于RCSB蛋白数据库(http://www.rcsb.org/pdb/home),ID:2ESM。实验数据:X射线衍射法,分辨率:3.20,自由R值:0.269,工作R值:0.245[10],作为计算分子对接的受体模型。
1.1.2 仪器与试剂盒YJ型(垂直流)洁净工作台(苏净净化设备有限公司);东亚牌YDS-50B液氮容器(乐山市东亚机电工贸有限公司);HeraCell 150i二氧化碳培养箱,InvitrogenTM CountessTM细胞自动计数器,NanoDropTM One超微量紫外分光光度计(美国Thermo科技公司);5810 R高速大容量冷冻离心机,ThermoMixer C恒舒适型恒温混匀仪(德国Eppendorf公司);DMI3000 B倒置荧光显微镜(德国Lecia公司);VICTORTM X3酶标仪(美国PerkinElmer公司);Mini-PROTEAN Tetra蛋白电泳仪/伯乐小型垂直电泳槽,TRANS-BLOTTM SD半干转仪,ChemiDocTM XRS+凝胶成像仪带Image LabTM软件,CFX ConnectTM实时荧光定量PCR(美国Bio-Rad公司)。
CCK-8细胞活力检测试剂盒(南京诺唯赞生物科技有限公司,批号:A311-02);MMP-2、MMP-9基质金属蛋白酶ELISA试剂盒(南京金益柏生物科技有限公司,批号:ZN2330);BCA蛋白浓度测定试剂盒(美国Thermo公司,批号:UL295000、UL287201);RNA Easy Fast动物组织/细胞总RNA提取试剂盒(离心柱型,批号:U8628);FastKing gDNA Dispelling RT SuperMix试剂盒(北京天根生化科技有限公司,批号:8511311、B300537)。
1.2 细胞培养和分组取人肺腺癌H1299细胞,复苏后培养在含体积分数为10%胎牛血清的RPMI-1640培养基中,放置在体积分数5% CO2、饱和湿度、37 ℃恒温培养箱中,在倒置显微镜下观察H1299两种细胞的生长状态,每隔1 d更换1次新鲜培养液,待细胞贴壁铺满底部80%以上时,使用0.25%胰蛋白酶消化细胞,以1∶3传代。取对数生长期的H1299细胞接种到6孔板中,37 ℃培养箱过夜培养,弃去旧培养液,加入含不同浓度Nef的培养液,各组H1299细胞分别采用相应时间处理后,检测相关指标。
1.3 CCK-8法检测取对数生长期的H1299细胞,分别以胰酶消化,离心收集细胞,接种到96孔板中,接种密度为5×103/孔,在37 ℃培养箱中继续培养,待细胞贴壁后加入含不同浓度(0、4、6、10、10、20、20、40和80 μmol·L-1)Nef的RPMI 1640培养液,在培养24、48 h后,先在倒置显微镜下进行细胞形态学观察;然后分别向每孔细胞中加入CCK-8溶液100 μL,37 ℃、5% CO2下孵育30 min,在多功能酶标仪上测定450 nm处各孔细胞吸光度(OD)值, 计算细胞活力。
1.4 划痕迁移实验先用马克笔在6孔板背后,用直尺均匀(每隔约1 cm)划横线作为标记,横穿过孔,每孔至少穿过2条线。在孔中加入约5×108·L-1 H1299细胞2 mL,在37 ℃、5% CO2下培养。密切观察细胞状态,当细胞密度达到90%后,用枪头比着直尺,尽量垂直于背后的横线划痕(枪头尽量垂直,不要倾斜)。吸出原培养基废液,用PBS洗细胞(去除划下的细胞),加入含不同浓度(0、4、6和10 μmol·L-1)Nef的无血清培养液。放入CO2培养箱37 ℃孵育。按0、24 h取样,拍照。采用ImageJ软件测量划痕区域的像素面积,按下式计算划痕愈合率,定量分析细胞迁移的速度:划痕愈合率/%=
取孔径为8 μm的Transwell小室,在底部加入50 μL用无血清的细胞培养基稀释的Matrigel基质胶,放置在37 ℃培养箱中聚合成凝胶。用0(空白)、4、6和10 μmol·L-1Nef分别干预H1299细胞24 h后,以胰酶消化,PBS洗涤细胞2次,以无血清的培养液重悬细胞,调整细胞密度为1×109·L-1。取200 μL细胞悬液加入到Transwell小室的上室,下室加入600 μL含10%胎牛血清的培养液,在37 ℃、5% CO2下中孵育24 h。取出小室,吸走培养基,用棉签轻轻擦拭Matrigel和上室内的细胞。取新的24孔板加入4%多聚甲醛600 μL,采用4%多聚甲醛固定10 min。弃固定液,用0.1%结晶紫染色15 min,PBS洗涤(除去未与细胞结合的结晶紫),用棉签轻轻擦拭小室的上侧,将非特异性结合于小室上表面的染料擦掉,以便后续镜检。适当风干后,在高倍显微镜下选取上、下、左、右、中共5个视野观察细胞,使用Image J软件分析并计数穿膜细胞数。
1.6 Western blot检测分成0(空白)、4、6和10 μmol·L-1Nef处理组,分别干预H1299细胞24 h,以胰酶消化,分别收集各组H1299细胞,以RIPA细胞裂解液提取总蛋白。采用BCA蛋白浓度测定试剂盒对提取的总蛋白进行定量分析,分别配制8%分离胶及12%浓缩胶,每孔上样40 μg蛋白样品,以70 V跑浓缩胶,以90 V跑分离胶,电泳结束后再采用湿转法将蛋白转移到PVDF膜上,在室温下5%脱脂奶粉中封闭PVDF膜1 h。加入稀释过的相应一抗,4 ℃低速振荡过夜,以TBST洗膜,加入稀释的二抗,室温孵育2 h,再以TBST洗膜,加入配制好的ECL化学发光液,显影,以Bio-Rad系统采集图像,以GAPDH为内参,采用ImageJ分析软件分别计算各组中H1299细胞的目的蛋白相对表达水平。
1.7 实时荧光定量PCR(RT-qPCR)测定(1) 总RNA的提取:分组和给药同“Western blot检测”。根据RNA Easy Fast细胞总RNA提取试剂盒说明书进行操作,并用NanoDrop超微量紫外分光光度计测定各样品总RNA浓度。(2)逆转录反应:采用FastKing gDNA Dispelling RT SuperMix试剂盒,在20 μL反应体系中,加入5×FastKing-RT SuperMix 4 μL,总RNA 1 μg,剩余体系用RNase-free ddH2O补足到20 μL。首先在42 ℃保持15 min,接着在95 ℃保持3 min,逆转录反应产物在-20 ℃下保存。(3)PCR扩增反应体系:以GAPDH、ROCK1基因分别作为内参基团和目的基因,用水代替逆转录酶检测RT-PCR中DNA污染。在20 μL反应体系中,加入逆转录反应产物2 μL,10 μmol·L-1正反链引物各1 μL,2×iTaqTM Universal SYBR® Green超混合液10 μL,无菌水6 μL。正反链引物序列见Tab 1。(4)PCR反应条件:95 ℃初始变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸40 s,运行40个循环。(5)扩增效率的摸索:将逆转录反应产物进行5倍的倍比稀释,然后进行PCR反应,根据倍比稀释的实验结果,调整GAPDH和3个基因的扩增效率在90%~110%之间。(6)正式实验:在此扩增效率下,采用实时荧光定量PCR仪检测,根据2-ΔΔCt方法计算ROCK1基因在Nef干预下的相对转录水平。
| Gene | Forward primer (5′-3′) | Reverse primer (5′-3′) |
| GAPDH | GGAGCGAGATCCCTCCAAAAT | GGCTGTTGTCATACTTCTCATGG |
| ROCK1 | AACATGCTGCTGGATAAATCTGG | TGTATCACATCGTACCATGCCT |
从RCSB的蛋白质结构数据库(Protein Data Bank,PDB)下载ROCK1与阳性对照Fas复合物(ID:2ESM)的3D结构文件,利用Chemdraw构建小分子Fas和甲基莲心碱(Nef)的结构式,采用Autodock 4.2软件,依次进行解离原结合配体Fas、删除水分子、加上氢键、分离A、B链(AcROCK和BcROCK)、计算点电荷等操作; 导入小分子配体,加氢并且计算电荷,然后依次执行Torsion对话框中列表的处理任务,然后保存前处理好的小分子。根据2ESM的原结合配体Fas定义网格中心,以确定活性位点的位置及对接的范围(即网格盒子),设置5个不同的盒子数值进行模拟对接筛选。
分别打开蛋白AcROCK和BcROCK对接区域选择对话框,添加电荷,然后选择适当的Grid box,导出文件进行AUTO Grid处理,最后进行AUTO Docking处理,将Nef对接到Rock1的A链(AcROCK)和B链(BcROCK)的活性“口袋”。在对接运行过程中,蛋白质保持刚性,小分子设置成柔性,分子的扭转角不受限制,每个小分子分别运行50次独立对接。运用AutoDockTools 1.5.6软件查看能量分布情况,在分析选项中,对结果进行聚类分析和分数排名,得到得分最高的对接模型;同时运用LIGPLOT+(v.4.5.3)软件自动绘制配体-受体(蛋白质)相互作用的力场(氢键、疏水作用)图,确定其结合模式。
1.9 统计学分析每个实验至少重复3次获取有效数据。采用GraphPad Prism 7软件分析数据并制作图表,计量资料经Shapiro-Wilk (S-W) 检验应符合正态分布,均以描述。多组间均值差异比较采用单因素方差(One-way ANOVA)分析。组间两两多重比较采用Bonferroni法,α′=α/6=0.008 3(多重比较时)。
2 结果 2.1 Nef明显抑制肺癌H1299细胞活力H1299细胞经Nef处理后,其形态发生了明显的变化,特别是给药48 h后。未经药物作用的细胞呈贴壁聚集性,多形性或梭状,生长旺盛且排列紧密,形态饱满,边缘清晰;而用药组细胞贴壁能力下降,细胞皱缩,边界开始模糊,细胞突起减少,胞体折光性下降,胞质内可见颗粒。随着Nef浓度增加和处理时间变长,细胞变圆,脱壁悬浮,部分细胞胀大破裂。
CCK-8检测结果发现,Nef对H1299细胞有明显的抑制作用,且呈现明显的剂量-效应以及时间-效应依赖关系。Nef作用24 h、48 h后,对H1299细胞的半数抑制浓度(IC50)分别为63.3 μmol·L-1、26.99 μmol·L-1。为了确保迁移和侵袭实验中的细胞活力(保持在80%以上),Nef给药浓度设置为4、6和10 μmol·L-1,处理时间为24 h。(Fig 2)。

|
| Fig 2 Effects of neferine on viability of H1299 cells **P < 0.01 vs control |
划痕实验结果表明,与空白组相比,Nef的4、6和10 μmol·L-1组迁移细胞数均明显减少,且随着Nef浓度的增加迁移细胞数逐渐减少(P<0.01)(Fig 3)。
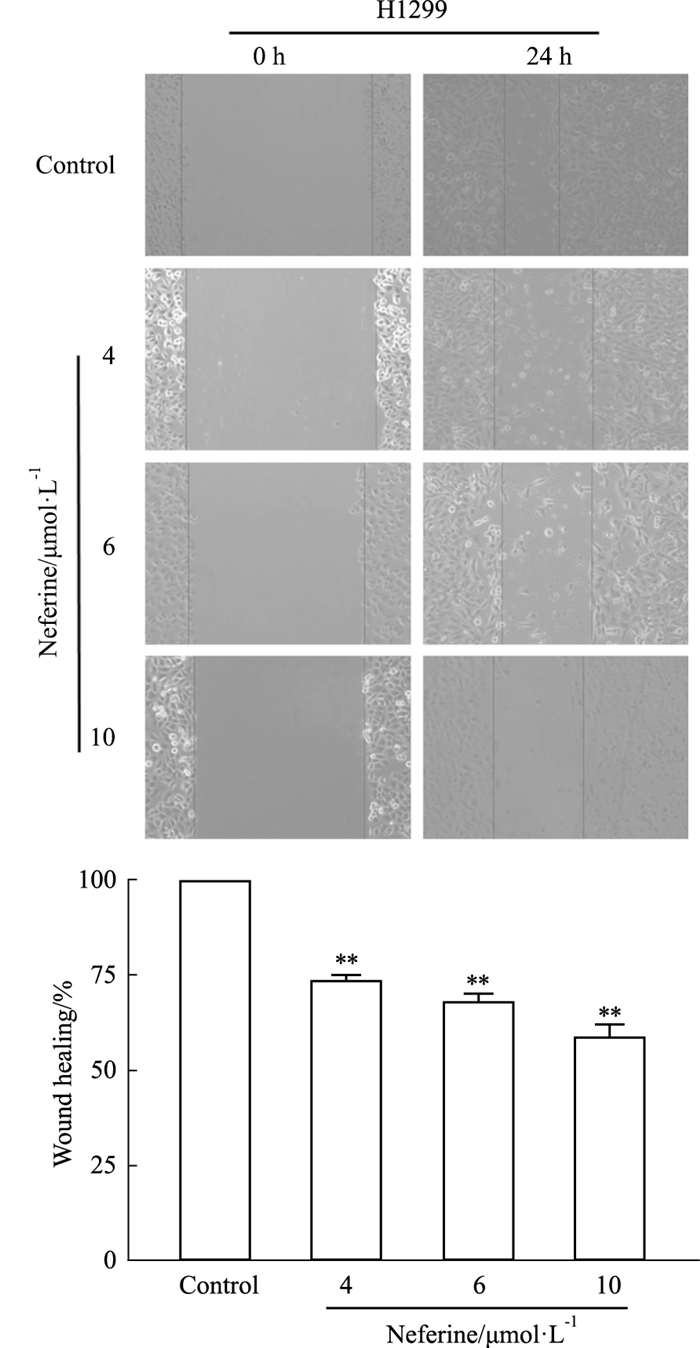
|
| Fig 3 Effects of neferine on migration of H1299 cells (x±s, n=4) **P < 0.01 vs Control. |
Transwell基质胶实验结果显示,与空白组相比,Nef的4、6和10 μmol·L-1组侵袭细胞数均明显减少,且随着Nef浓度的增加侵袭细胞数逐渐减少(P<0.05)(Fig 4)。
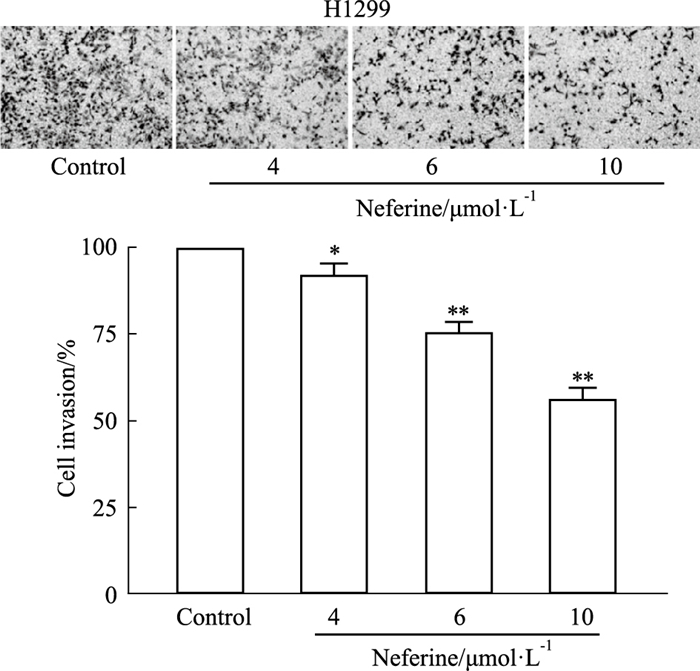
|
| Fig 4 Effects of neferine on invasion of H1299 cells (x±s, n=4) *P < 0.05, **P < 0.01 vs Control. |
ELISA检测结果表明,与空白组相比,Nef的4、6和10 μmol·L-1组细胞上清液中MMP-2、MMP-9的水平明显下降(P<0.01),且随着Nef浓度的增加,其抑制作用增强(Fig 5)。
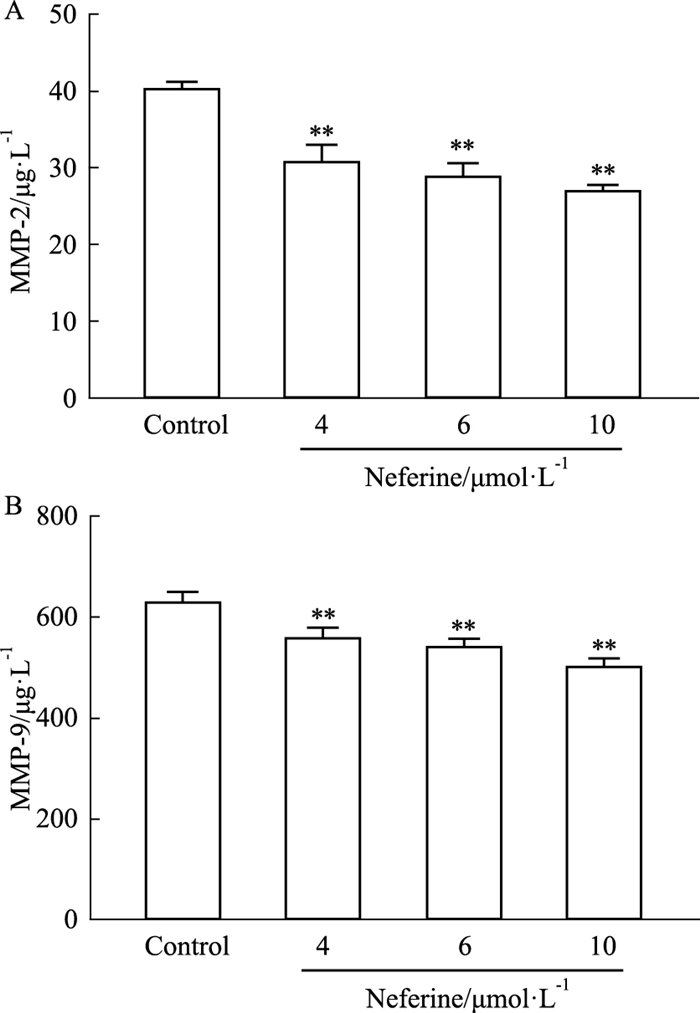
|
| Fig 5 Effects of neferine on secretion of MMPs of H1299 cells (x±s, n=4) A: MMP-2 level; B: MMP-9 level; **P < 0.01 vs Control. |
Western blot检测结果显示,与空白组相比较,Nef的4、6和10 μmol·L-1组细胞中ROCK1的表达显著下调(P<0.01),且随着Nef浓度的增加,其抑制作用增强(Fig 6)。

|
| Fig 6 Effects of neferine on expression of ROCK1 of H1299 cells (x±s, n=4) *P < 0.05, **P < 0.01 vs Control. |
RT-qPCR检测结果显示,与空白组相比较,Nef的4、6和10 μmol·L-1组细胞中ROCK1的转录水平显著下调(P<0.01),且随着甲基莲心碱浓度的增加,其抑制作用增强(Fig 7)。

|
| Fig 7 Effects of neferine on transcription of ROCK1 of H1299 cells (x±s, n=4) **P < 0.01 vs Control. |
AutoDock方法学研究表明,阳性药法舒地尔(Fas)与ROCK1的A链(AcROCK)和B链(BcROCK)对接中心坐标为:AcROCK:X=53.001,Y=100.017,z=28.331;BcROCK:X=-2.503,Y=-136.796,z=-18.922。最佳网格盒子大小为:90 Å ×90 Å ×90 Å;格点间距:0.375 Å。在此条件下,Chemdraw绘制的法舒地尔与ROCK1经对接形成的复合物构象,与原始配体复合物构象大体吻合(Fig 8),说明分子对接盒子参数设置相对合理。
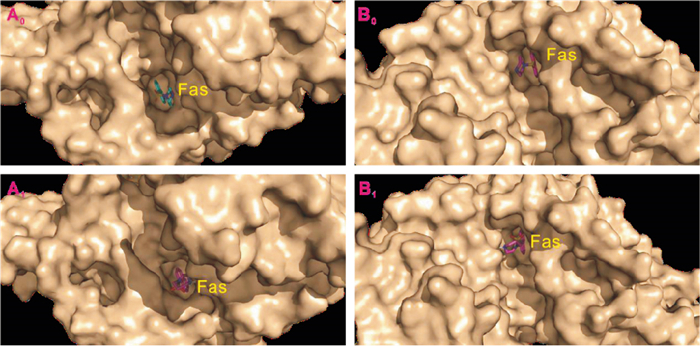
|
| Fig 8 The pocket behaviors of original ligand (fasudil)-ROCK1 complex and drawn ligand-ROCK1 complex A0: The complex of origin fasudil with ROCK1 Chain A; A1: The complex of drawn fasudil with ROCK1 Chain A; B0: The complex of origin fasudil with ROCK1 Chain B; B1: The complex of drawn fasudil with ROCK1 Chain B. |
在相同条件下,Nef与ROCK1的A链和B链分别进行对接,形成复合物的构象(Fig 9)。Fas与AcROCK1和BcROCK1的最低结合能分别为-9.43 KJ·mol-1、-9.63 KJ·mol-1,Nef与AcROCK1和BcROCK1的最低结合能分别为-10.01 KJ·mol-1、-9.84 KJ·mol-1。最低结合能的绝对值越大,表明配体与蛋白的亲合力越大。与ROCK1抑制剂Fas相比,Nef形成的AcROCK1和BcROCK1复合物的最低结合能均明显较低,提示Nef与ROCK1的亲合力明显大于阳性药法舒地尔,且与ROCK1的A链结合力更强。

|
| Fig 9 The binding mode and action field of neferine with ROCK1 A: The binding mode of Nef with ROCK1 Chain A; B: The binding mode of Nef with ROCK1 Chain B; C: The action field of Nef with ROCK1 Chain A; D: The action field of Nef with ROCK1 Chain B. |
从自动绘制配体-蛋白质作用力场图可见,当Nef与ROCK1的A链形成复合物时,其作用残基为:ASP-160、LYS-200、ASP-198、ASN-203、ASP-202、PHE-368、ASP-369、ASP-216、GLY-83、LEU-371、GLY-85、VAL-90、ARG-84、ALA-86、GLY-88、Asp-370、ILE-82、LEU-205、LYS-105、LEU-107,其中ARG-84、ASP-160、ASP-216与Nef存在分子间氢键,键长分别为3.01 Å、2.76 Å和3.06 Å;当Nef与ROCK1的B链形成复合物时,其作用残基为:LEU-205、ASP-160、PHE368、ASN-163、ASP-202、VAL-162、ILE-82、ASP-369、GLY-83、LEU-371、ARG-84和ASN-367,其中ARG-84、ASP-160、ASP-369、ASN- 163、ASP-202与Nef存在分子间氢键,键长分别为2.75 Å 3.31 Å、2.63 Å、2.84 Å、2.75 Å和2.84 Å。
当Fas与ROCK1的A链形成复合物时,其相互作用残基为:ASP-160、ASP-202、GLY-83、VAL-90、ILE-82、ALA-103、LEU-205、MET-156、TYR-155、PHE-368、GLU-154、MET-153、ALA-215、ASP-216,其中MET-156、ASP-160与Nef存在分子间氢键,键长分别为2.76 Å、2.61 Å。当Fas与BcROCK1对接时,其相互作用残基为:ASP-160、TYR-155、ASP-202、ILE-82、LEU-205、PHE-368、MET-156、ALA-103、MET-153、GLU-154、GLY-83、ASP-216,其中MET-156、ASP-160与Nef存在分子间氢键,键长分别为2.96 Å、2.51 Å。
无论是ROCK1的A链还是B链,与Nef相互作用的氨基酸残基数大于明显大于阳性药Fas,这可能与Nef具有两个苄基异喹啉基团组成的独特骨架有关;另外,虽然Nef与A链作用的残基多达20个,而Fas与A链作用的残基只有14个,提示其与ROCK1的A链结合力更强(Fig 10)。
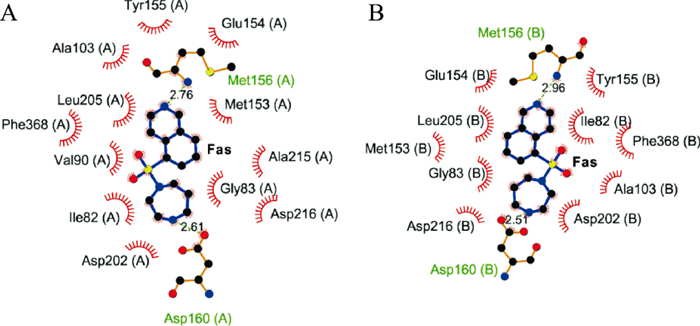
|
| Fig 10 The action field of fasudil with ROCK1 A: The action field of fasudil with ROCK1 Chain A; B: The action field of fasudil with ROCK1 Chain B. |
由于NSCLC表现出极大的异质性(包括鳞癌、腺癌和大细胞癌等),以及其确诊时过于晚期,因此,一线抗癌药铂基化疗对提高这些患者的生存期效果不明显[11]。靶向治疗使很多罹患晚期NSCLC的病人获得长期生存,然而,这种治疗往往伴随着特异性、耐药性以及预后不良等问题[12]。因此,寻找治疗NSCLC的新靶点和靶向药物具有重要的临床意义。
以往研究表明,Nef具有抗癌、降血压、抗心律失常、抗氧化和清除自由基、抗纤维化、抗代谢综合征、神经保护及抗炎等药理作用,近年来其对肿瘤潜在的防治作用越来越被人们关注[13]。CCK-8检测结果发现,Nef对人非小细胞肺癌细胞H1299有明显的抑制作用,且呈现明显的剂量-效应以及时间-效应依赖关系。划痕迁移实验和Transwell侵袭实验结果显示,4、6和10 μmol·L-1 3种浓度的Nef均明显抑制H299细胞的迁移和侵袭;同时Nef下调与这种癌细胞迁移、侵袭有关的MMP-2、MMP-9蛋白表达。
ROCK不仅是NSCLC侵袭和转移的启动子,而且可能是其产生耐药性的关键所在[14]。近期临床数据也支持ROCK可能是治疗NSCLC的有效靶点[15]。本世纪初,就有人研发用于治疗肿瘤的ROCK抑制剂,这类药物能通过阻断细胞迁移和扩散,防止癌细胞扩散至邻近组织[16]。Fas是已上市的ROCK抑制剂类药物,主要用于治疗脑卒中;但它也能通过下调人肺腺癌A549细胞RhoA mRNA表达和ROCK底物p-MLC表达,从而抑制NSCLC的增殖、移行和浸润[17]。
4、6和10 μmol·L-1 3种浓度的Nef对H1299细胞中ROCK1的表达和转录均有一定抑制作用;另外,分子对接结果表明,Nef与ROCK1的亲合力明显大于ROCK抑制剂Fas,且与ROCK1的A链结合力更强。
综上所述,Nef作为一种抗癌天然化合物,通过下调与肿瘤细胞迁移和侵袭相关分子MMP-2、MMP-9和ROCK1的表达,进而发挥抑制非小细胞肺癌迁移和侵袭的作用。在今后的研究中,我们将进一步选用不同恶性程度的多种NSCLC细胞株,比较并研究Nef对其他NSCLC细胞侵袭、转移及黏附能力的影响及作用机制,并通过体内动物实验来进一步探究其作用机制,为中药莲子心用于治疗非小细胞肺癌提供新的思路。
| [1] |
Araujo L H, Horn L, Merritt R E, et al. Ch. 69-Cancer of the Lung: Non-small cell lung cancer and small cell lung cancer[M]// Niederhuber JE, Armitage JO, Doroshow JH, Kastan MB, Tepper JE, eds. Abeloff's Clinical Oncology. 6th. Philadelphia: Elsevier, 2020: 1108-58. e15.
|
| [2] |
Shahbazi R, Baradaran B, Khordadmehr M, et al. Targeting ROCK signaling in health, malignant and non-malignant diseases[J]. Immunology Letters, 2020, 219: 15-26. doi:10.1016/j.imlet.2019.12.012 |
| [3] |
Croft D R, Sahai E, Mavria G, et al. Conditional ROCK activation in vivo induces tumor cell dissemination and angiogenesis[J]. Cancer Res, 2004, 64(24): 8994-9001. doi:10.1158/0008-5472.CAN-04-2052 |
| [4] |
莲子心[M]// 国家药典委员会. 中华人民共和国药典. 北京: 中国医药科技出版社, 2020: 285-6. Plumula Nelumbinis[M]// National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Beijing: China Medical Science and Technology Press, 2020: 285-6. |
| [5] |
周雅君, 时菁, 田耕, 等. Nef体外抑制人肝癌细胞增殖和侵袭的作用机制研究[J]. 中国药理学通报, 2016, 32(11): 1539-42. Zhou Y J, Shi J, Tian G, et al. Effect of neferine on proliferation and invasion of human hepatocellular carcinoma cell line HepG2 and Bel-7402[J]. Chin Pharmacol Bull, 2016, 32(11): 1539-42. doi:10.3969/j.issn.1001-1978.2016.11.012 |
| [6] |
韩广弢, 李皓桓. 甲基莲心碱在治疗肿瘤方面的研究进展[J]. 中国医药, 2020, 15(7): 1126-8. Han G T, Li H H. Progress of research on the treatment of tumor by neptoline[J]. Chin J Medical, 2020, 15(7): 1126-8. |
| [7] |
Yang G M, Sun J, Pan Y, et al. Isolation and identification of a tribenzylisoquinoline alkaloid from Nelumbo nucifera Gaertn, a novel potential smooth muscle relaxant[J]. Fitoterapia, 2018, 124: 58-65. doi:10.1016/j.fitote.2017.10.020 |
| [8] |
Giaccone G, Battey J, Gazdar A F, et al. Neuromedin B is present in lung cancer cell lines[J]. Cancer Res, 1992, 52(9 Suppl): 2732s-6s. |
| [9] |
潘扬, 杨光明, 蔡宝昌. 核磁共振谱分析莲子心中酚性生物碱的结构[J]. 南京中医药大学学报, 2005, 21(6): 371-3. Pan Y, Yang G M, Cai B C. Nuclear magnetic resonance spectroscopy analysis of the structure of phenolic alkaloids in lotus seed heart[J]. J of NUTCM, 2005, 21(6): 371-3. doi:10.3969/j.issn.1000-5005.2005.06.011 |
| [10] |
Jacobs M, Hayakawa K, Swenson L, et al. The structure of dimeric ROCK Ⅰ reveals the mechanism for ligand selectivity[J]. J Biol Chem, 2006, 281: 260-8. doi:10.1074/jbc.M508847200 |
| [11] |
Jamal-Hanjani M, Wilson G A, Mcgranahan N, et al. Tracking the evolution of non-small-cell lung cancer[J]. N Engl J Med, 2017, 376: 2109-21. doi:10.1056/NEJMoa1616288 |
| [12] |
Queiroz A L, Vakifahmetoglu-Norberg H, Norberg E. Resistant to targeted therapy - Aim for metabolic liabilities[J]. Theranostics, 2018, 8(7): 2061-3. doi:10.7150/thno.24454 |
| [13] |
孟雪莲, 陈曼玲, 陈长兰. 莲子心生物碱活性成分的药理作用研究进展[J]. 辽宁大学学报(自然科学版), 2019, 46(3): 229-36. Meng X L, Chen M L, Chen C L. Research progress on the pharmacological effects of the active ingredients of Nelumbo nucifera alkaloids[J]. J Liaoning Univ, 2019, 46(3): 229-36. |
| [14] |
Rath N, Olson M F. Rho-associated kinases in tumorigenesis: re-considering ROCK inhibition for cancer therapy[J]. EMBO Reports, 2012, 13(10): 900-8. doi:10.1038/embor.2012.127 |
| [15] |
余国辉, 舒美玲. ROCK1蛋白在非小细胞肺癌组织中的表达特点及其临床意义[J]. 中华肺部疾病杂志(电子版), 2019, 12(3): 332-4. Yu G H, Shu M L. Expression of ROCK1 protein in non-small cell lung cancer and its clinical significance[J]. Chin J of Pulmonary Diseases, 2019, 12(3): 332-4. doi:10.3877/cma.j.issn.1674-6902.2019.03.014 |
| [16] |
Hahmann C, Schroeter T. Rho-kinase inhibitors as therapeutics: From pan inhibition to isoform selectivity[J]. Cell Mol Life Sci, 2010, 67(2): 171-7. doi:10.1007/s00018-009-0189-x |
| [17] |
Zhang Z, Ren J H, Li Z Y, et al. Fasudil inhibits lung carcinoma-conditioned endothelial cell viability and migration[J]. Oncol Rep, 2012, 27(5): 1561-6. |

