

非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)是非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)的一个重要阶段。有别于可以通过减脂逆转的单纯性脂肪变(nonalcoholic fatty liver, NAFL)[1],NASH是更加危险的疾病阶段[2],会进一步恶化为肝硬化、肝衰竭及肝细胞癌[3]。大量研究提示,NASH的发病机制可能涉及肝脏炎症、氧化应激、肝细胞衰老[4],但NASH发病机制仍未完全阐明。目前,临床缺乏特效药,以对症治疗为主,包括使用维生素E(抗氧化剂)缓解NASH伴随的氧化应激[5]。NASH在西医治疗中尚存不足。
根据临床表型,NASH归属“肝癖”、“积聚”。2012年,中华中医药学会诊断专业委员会将其正式归属于“肝癖”的范畴[6]。中医凭借独特的整体观念治疗NASH,取得了较好的临床疗效。过食肥甘厚腻,耗伤脾胃,中焦运化失能,中气亏虚,肾虚气化不利,共致水湿内停,久而生痰,痰湿内蕴,生热化瘀,最终痰、热、瘀、湿纠结伤肝。益气补肾,活血化瘀被视为中医治疗NASH的基本法则。补益脾肾以补气行气、化湿逐痰;活血化瘀以通畅血脉、消散瘀滞。益气补肾调脂方(Yiqi-Bushen-Tiaozhi formula,YBTF)是课题组临床长期用于治疗NASH的经验方,由黄芪、淫羊藿、茯苓、白术、海藻、郁金、桃仁、山楂、何首乌9味中药组成。方中黄芪伍以茯苓、白术益气健脾,补而不腻;淫羊藿、何首乌补肾益精;郁金活血行气,兼以疏肝;海藻、桃仁辅以山楂共奏活血化瘀之功效;全方具有益气健脾、补肾益肝、活血化瘀的作用。课题组前期研究证实,YBTF能通过抗氧化应激,减轻肝组织氧化损伤,改善高脂高糖诱导的NASH小鼠肝脏脂肪变及炎症[7];能直接改善西式饮食造成的小鼠肝损伤:谷丙转氨酶(ALT)、谷草转氨酶(AST)升高及脂质代谢紊乱:血清总胆固醇(CHOL)升高,血清甘油三酯(TG)降低,但对血清TG水平无明显影响[8]。多年的临床应用也证明,YBTF具有极佳的改善NASH的疗效。但因复方多靶点、多途径治疗疾病的特点,尚不能明确YBTF治疗NASH的确切机制。
网络药理学利用网络数据库,结合多学科技术内容,探究复方各味药与疾病的关联,明确中药复方的有效成分及作用靶点,为研究中药复方的治疗机制提供新的角度。合理运用网络药理学有助于筛选复方治疗疾病的靶点与机制。本研究通过网络药理学对YBTF的作用靶点及治疗机制进行初步筛选,通过体内实验进行验证,试图明确YBTF治疗NASH的关键靶基因及信号通路,为YBTF的临床推广提供理论支持。
1 网络药理学分析及靶基因筛选 1.1 分析工具(Tab 1)| Public databases and software | Website |
| Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP) | http://lsp.nwu.edu.cn/tcmsp.php |
| Encyclopedia of Traditional Chinese Medicine(ETCM) | http://www.tcmip.cn/ETCM/ |
| Gene Expression Omnibus(GEO) | https://www.ncbi.nlm.nih.gov/geo/ |
| The Human Gene Database (GeneCards) | http://www.genecards.org/ |
| Disease related genes and Mutation sites Database(Disgenet) | http://www.disgenet.org/ |
| UniProt Knowledgebase(Uniprot) | https//www.uniprot.org/ |
| PubChem database(PubChem) | https://pubchem.ncbi.nlm.nih.gov/ |
| Protein Data Bank (PDB) | http://www.rcsb.org/ |
| Cytoscape 3.8.0 | https//cytoscape.org/ |
| CytoNCA | http://apps.cytoscape.org/apps/cytonca |
| BisoGenet | http://apps.cytoscape.org/apps/bisogenet |
| R software | https://www.r-project.org/ |
| Autodock Tools | http://autodock.scripps.edu/ |
通过TCMSP数据库以口服生物利用度(oral bioavailability,OB)≥30%及类药性(drug-like,DL)≥0.18为筛选阈值,结合课题组前期HPLC-MS检测的YBTF化学成分[8],筛选YBTF的活性成分及作用靶点。利用UniProt数据库进行作用靶点的名称转换。口服生物利用度反映药物进入循环系统的速度及程度,类药性则反应有效成分与已知药物的相似性,两者共为评价药物内在质量的重要指标。
1.2.2 筛选YBTF治疗NASH的靶基因通过GEO数据库下载GSE89632数据集,筛选正常组与NASH组间的差异基因。筛选阈值为p.adjust < 0.05,|logFC|>1。使用GeneCards、DisGeNET数据库以“nonalcoholic steatohepatitis”为关键词,检索NASH相关疾病基因。将YBTF的作用靶点与差异基因、疾病基因取交集,交集基因为YBTF治疗NASH的靶基因。
1.3 分析YBTF治疗NASH的靶基因并筛选关键治疗靶基因 1.3.1 GO、KEGG、DO富集分析使用R语言的R包org.Hs.eg.db将靶点基因的gene symbol转换为对应的EntrezID,接着使用R包clusterProfiler[9]进行基因本体论(Gene ontology, GO)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)、疾病本体论(Disease ontology, DO)富集分析。筛选条件为p.adjust < 0.05,q < 0.05。根据富集分析结果,明确YBTF治疗靶基因的基因功能及涉及的信号通路。
1.3.2 构建蛋白质互作网络及网络拓扑分析使用Cytoscape 3.8.0软件插件BisoGenet结合筛选到的YBTF治疗NASH的靶基因构建蛋白质互作网络。使用插件CytoNCA进行网络拓扑分析,依次根据条件度中心性(degree centrality,DC)≥30及中介中心性(betweenness centrality,BC)≥30构建子网络,筛选位于核心网络的关键靶基因。
1.3.3 筛选YBTF的关键治疗靶基因通过GO、KEGG富集分析结果明确YBTF靶基因的基因功能及涉及的通路。结合蛋白互作网络及网络拓扑分析筛选出的位于核心子网络以及在蛋白互作中发挥关键作用的靶基因。
2 靶基因筛选结果的验证 2.1 分子对接验证使用Autodock软件根据蛋白结构,将YBTF治疗NASH的关键靶基因与YBTF的关键活性成分进行分子对接,以判断两者能否顺利结合,发挥疗效。通过有机小分子生物活性数据库下载配体(YBTF关键活性成分)的3D结构;通过蛋白质结构数据库下载受体(YBTF关键靶基因)的蛋白结构。对受体蛋白进行加氢,去除水分子的处理,同时设置活性口袋,进行分子对接。
2.2 动物实验验证 2.2.1 实验主要试剂(Tab 2)| Reagent | Company | Lot |
| Cell senescence β-galactosidase staining kit | Beyotime Biotechnology | C0602 |
| Protein extraction kit | Applygen | P1250 |
| BCA protein assay kit | Multi Sciences Biotech | PQ0012 |
| 2×SDS-PAGE loading buffer | KeyGen Biotech | KGP1012 |
| Western blot marker(10-180 kDa) | Thermo Fisher Scientific | 26616 |
| LuminolPen | MineBio | LH03-50 |
| CDKN1A monoclonal antibody | HuaBio | ER1906-07 |
| GAPDH monoclonal antibody | Proteintech | 60004-1-Ig |
| Goat anti-rabbit IgG(H+L) HRP | Multi Sciences Biotech | 70-GAR0072 |
| Goat anti-mouse IgG(H+L) HRP | Multi Sciences Biotech | 70-GAM0072 |
| RNAiso plus | TaKaRa | 9109 |
| Evo M-MLV mix kit | Accurate Biology | AG11728 |
24只雄性C57BL/6小鼠(购自于上海西普尔-必凯实验物有限责任公司;许可证号:SCXK(沪)2013-0016;饲养于浙江中医药大学动物实验中心)适应性饲养1周后随机分成正常组(Normal diet,ND)、西式饮食组(Western diet,WD)、YBTF治疗组(YBTF treatment,YBTF),每组8只。ND组小鼠予以正常饲料(蛋白质占0.215,脂肪占0.123,碳水化合物占0.662),并自由饮水。WD、YBTF组小鼠予以高脂高糖的西式饮食(猪油占0.10,蛋黄粉占0.05,胆固醇占0.02,胆盐占0.005,基本饲料占0.825;基本饲料构成:蛋白质占0.216,脂肪占0.361,碳水化合物占0.423),并自由饮用质量分数为20%的果糖水。其中,第5周起,YBTF组小鼠每天予以22.80 g·kg-1的YBTF流浸膏(浙江中医药大学附属第一医院中药制剂中心制备)灌胃干预治疗, YBTF药物构成详见Fig 1。同时给予其他组小鼠相同体积的0.9% NaCl。第16周末处死所有小鼠,实验前小鼠禁食12 h(饮水不受限)。空腹麻醉下取血,分离血清待用;分离肝脏, 部分以4%多聚甲醛固定, 常规石蜡包埋待用。其余肝组织放入液氮2 h后冻存于-80 ℃冰箱中待用。本次动物实验得到浙江中医药大学伦理委员会的批准(决议号:ZSLL-2016-139)。
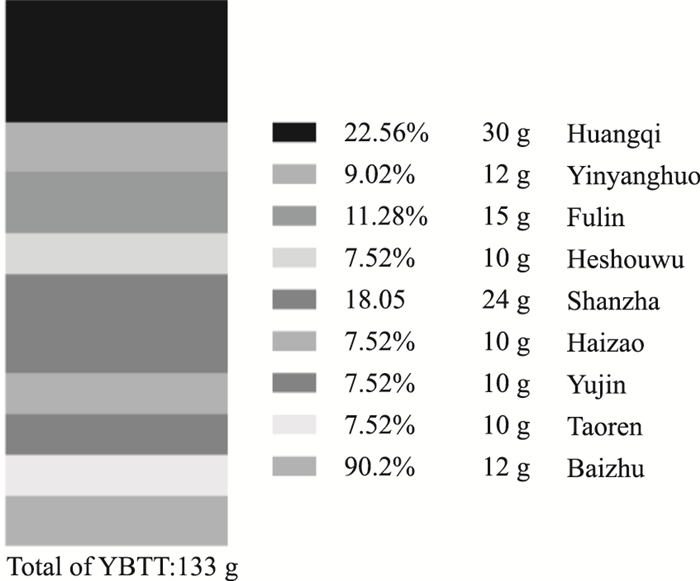
|
| Fig 1 Chinese herbs of Yiqi-Bushen-Tiaozhi formula |
油红O染色(Oil-red O staining)和苏木精-伊红染色(HE staining)检测小鼠肝组织病变。
2.2.4 β-半乳糖苷酶(SA-β-Gal)染色检测小鼠肝组织衰老小鼠肝组织石蜡切片按照常规方法进行脱蜡、水化。配置β-半乳糖苷酶染色液。肝组织切片加入适量染色液,无CO2的37 ℃培养箱中孵育14 h。光镜(200×)观察染色结果。
2.2.5 Western blot检测肝组织CDKN1A蛋白表达水平使用普利来全蛋白提取试剂盒提取小鼠肝组织的蛋白;使用BCA法进行蛋白定量, 结果为20 g·L-1。加2×SDS上样缓冲液并95 ℃变性后-80 ℃保存。使用10% SDS-PAGE胶,每孔80 μg上样,200 V恒压电泳40 min,恒流200 mA转膜90 min;发光笔涂抹marker,使用5%小牛血清室温封闭1 h后,加入相应一抗CDKN1A(1 ∶ 800),GAPDH(1 ∶ 5 000),4 ℃冰箱过夜;TBST洗膜后加入相应的抗兔或抗鼠二抗(1 ∶ 5 000),室温孵育1 h;TBST洗膜后以ECL在FCE型ProteinSimple化学发光成像系统进行曝光显影,AlphaView SA 3.3.0.0软件分析灰度值,采用目的蛋白灰度值/GAPDH灰度值代表目的蛋白的相对表达量。
2.2.6 qRT-PCR检测肝组织CDKN1A mRNA表达使用RNAiso Plus试剂盒提取肝组织总RNA;采用Evo M-MLV反转录预混型试剂盒以500 ng总RNA为模板合成cDNA,以下列反应体系进行PCR反应:2×SYBR 5 μL、10 μmol·L-1上下引物各0.4 μL、10 μg·L-1的cDNA模板2 μL、加双蒸水(double distilled H2O,ddH2O)补充体积至10 μL,PCR反应条件:95 ℃预性5 min,再95 ℃ 15 s,60 ℃ 45 s,循环扩增40次,溶解曲线分析:95 ℃×15 s,60 ℃×5 s,缓慢上升至95 ℃×15 s。以β-actin为内参,相对表达量(2-△△Ct)来表示目的基因CDKN1A的mRNA表达水平。基因引物由生工生物工程(上海)有限公司设计并合成(Tab 3)。
| Gene | Sequencing | Length (bp) |
| CDKN1A | Forward:5′-CCTGGTGATGTCCGACCTG-3′ | 103 |
| Reverse:5′-CCATGAGCGCATCGCAATC-3′ | ||
| β-actin | Forward:5′-TGTTGCCCTAGACTTCTTCGAGCA-3′ | 112 |
| Reverse:5′-CCATACCCAGGAAGGAAGGCT-3′ |
采用SPSS 22.0软件统计分析, 所有计量资料数据用x±s表示,根据数据类型选用单因素方差分析。
3 结果 3.1 YBTF活性成分及治疗靶基因的筛选TCMSP中无法检索到山楂、何首乌,因此使用中医百科全书数据库(ETCM)搜索山楂、何首乌的活性成分及作用靶点。结果显示YBTF共有223个作用靶点,105个活性成分。在105个活性成分中,只有75个活性成分具有对应得作用靶点,其中淫羊藿、桃仁、黄芪的活性成分数量位列前三(Fig 2A)。HPLC-MS检测结果则显示YBTF的主要化学成分包括有机氧化物、黄酮类及异黄酮类化合物。分析后发现槲皮素(quercetin)、常春藤皂苷元(hederagenin)等活性成分同时存在于多味中药中,是YBTF发挥疗效的重要活性成分(Tab 4)。GSE89632数据集中共有19个NASH样本,24个正常样本,筛选得到195个差异基因(Fig 2B)。GeneCards、DisGeNET数据库共筛选出NASH疾病基因748个(Fig 2Ca);三者的交集基因PTGS2、CDKN1A、IL6、IL1β被视作YBTF治疗NASH的治疗靶基因(Fig 2Cb)。
| ID | Ingredient | Classification | Attribution of TCM |
| MOL000098 | quercetin | Flavonoids | Haizao,Huangqi,Yinyanghuo,Shanzha |
| MOL000296 | hederagenin | Saponins | Fulin,Huangqi,Taoren |
| MOL000358 | beta-sitosterol | Phytosterol | Heshouwu,Taoren,Yujin |
| MOL000359 | sitosterol | Phytosterol | Yinyanghuo,Yujin |
| MOL000422 | kaempferol | Flavonoids | Huangqi,Yinyanghuo |
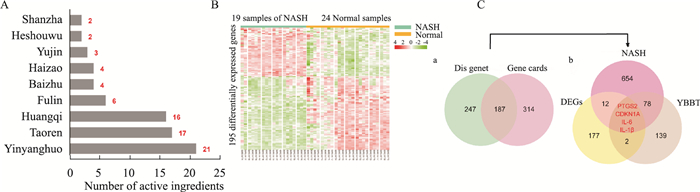
|
| Fig 2 Analysis of YBTF active ingredients and screening of target genes A. Screening results of YBTF active ingredients; B. Screening results of differentially expressed genes; C. Screening results of YBTF target genes |
GO富集分析主要包括细胞组分(cellular component, CC)、分子功能(molecular function, MF)、生物过程(biological process, BP)。共计富集到符合筛选条件的生物过程10条,分子功能10条与细胞组分6条(Fig 3A)。分析后发现YBTF治疗靶基因的基因功能多与细胞周期、细胞增殖、氧化应激以及炎症反应相关。KEGG富集分析共富集到93条通路,其中富集到多个基因(基因数量≥2)的通路共计49条,筛选可信度最高的前20条通路进行可视化(Fig 3B)。结果显示YBTF的治疗靶基因多涉及炎症、细胞周期相关通路。结合GO、KEGG富集分析的结果, 考虑YBTF的治疗靶基因多参与细胞周期、炎症的调控。DO富集分析共富集到505个与YBTF治疗靶基因相关的疾病,筛选与4个关键靶基因均密切相关的DO富集分析结果进行可视化(Fig 3C)。其中红色条柱是肝脏炎症相关疾病,结果显示与上述YBTF治疗靶基因关系最为密切的肝脏疾病包括肝炎、乙型肝炎、丙型肝炎,提示PTGS2、CDKN1A、IL6、IL1β可能是与肝组织炎症相关的疾病基因。
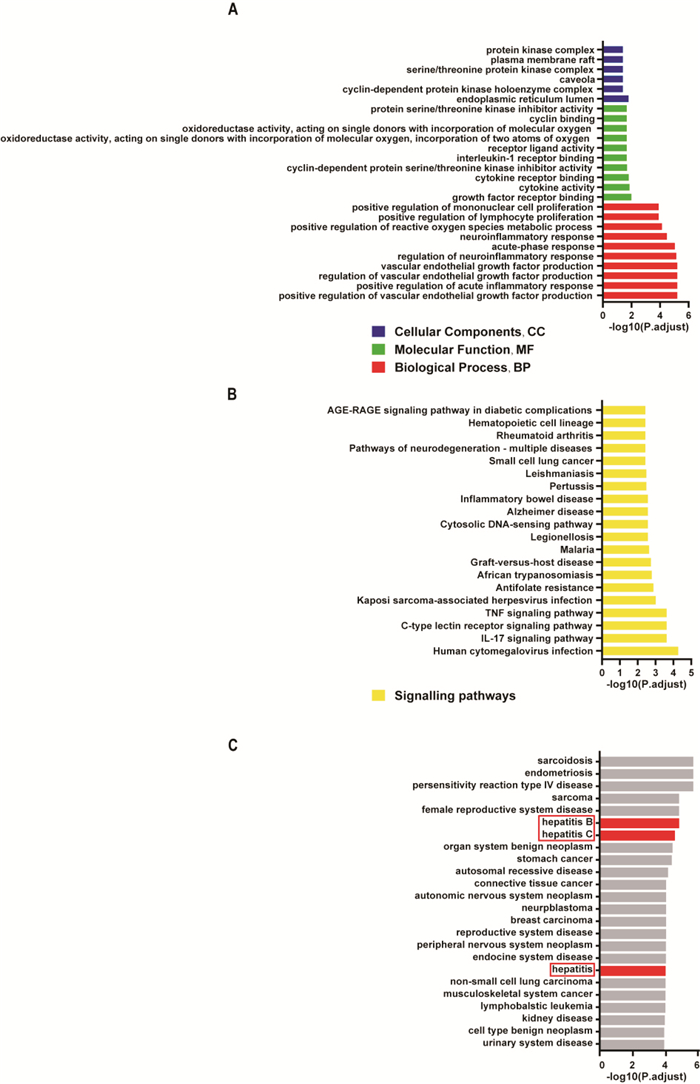
|
| Fig 3 Enrichment analysis results A. GO enrichment analysis results; B. KEGG enrichment analysis results; C. DO enrichment analysis results |
使用Cytoscape 3.8.0软件的插件BisoGenet、CytoNCA以YBTF治疗靶基因为基础构建蛋白质互作网络,通过节点度(Degree)≥30及介数中心度(Betweenness)≥30构建子网络,筛选出位于核心位置基因(Tab 5)。结果显示CDKN1A是YBTF所有治疗靶基因中唯一一个位于核心子网络中的基因,将其视为是YBTF治疗NASH的关键靶基因。
| Gene | Degree (DC) | Gene | Betweenness (BC) |
| CDKN1A | 278 | CDKN1A | 195.5 |
| TP53 | 111 | TP53 | 84.8 |
| CDK2 | 91 | CDK2 | 78.9 |
| ESR1 | 74 | COPS5 | 71.3 |
| HSP90AA1 | 73 | EP300 | 70.9 |
GO、KEGG富集分析结果显示,YBTF的治疗靶基因多参与细胞周期、炎症的调控。蛋白互作网络及网络拓扑分析显示在所有YBTF治疗NASH的治疗靶基因中,只有CDKN1A位于网络的核心位置,是关键靶基因。结合文献发现,CDKN1A可以调控细胞衰老,是直接反映细胞衰老的标志。基于此,提出假设YBTF通过靶向CDKN1A,改善肝细胞的细胞衰老,治疗NASH。
3.5 分子对接验证结果网络药理学分析结果显示CDKN1A是YBTF治疗NASH的关键靶基因,槲皮素、常春藤皂苷元、β-谷甾醇是YBTF发挥疗效的关键活性成分(筛选出现频率排名前三的活性成分视为关键成分)。因此,使用Autodock软件进行分子对接,Pymol、Discovery Studio 2016软件用于结果可视化,验证YBTF发挥疗效的关键有效成分能否与YBTF的关键靶基因CDKN1A实现对接。分别从PDB数据库下载CDKN1A的蛋白质结构(PDB ID:2ZVV);从PubChem数据库下载皮素、常春藤皂苷元、β-谷甾醇的3D结构。小分子配体能否与大分子蛋白结合主要通过结合能进行判断,结合能小于0,说明配体能自发和受体结合,结合能数值越小表示配体与受体的结合能力越强,提示活性成分越容易与靶基因结合,发挥疗效。CDKN1A与槲皮素、常春藤皂苷元、β-谷甾醇的最低自由结合均小于0(Tab 6)。槲皮素、常春藤皂苷元、β-谷甾醇均能与YBTF的治疗NASH的关键靶点CDKN1A实现对接,提示YBTF的重要活性成分槲皮素、常春藤皂苷元、β-谷甾醇可能可以作用于CDKN1A,改善细胞衰老(Fig 4)。
| YBTF crucial gene (PDB ID) | Ingredient | Minimum binding energy / kcal·mol-1 |
| CDKN1A(2ZVV) | quercetin | -7.6 |
| hederagenin | -7.9 | |
| beta-sitosterol | -8.1 |
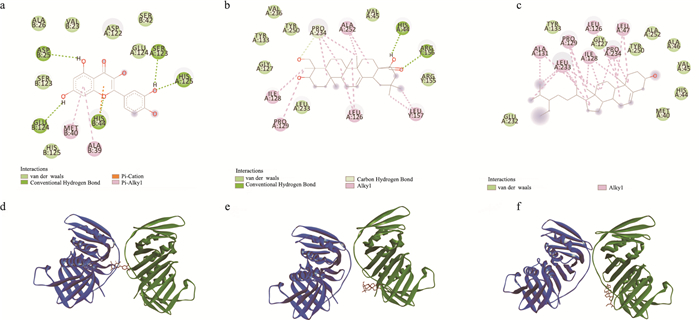
|
| Fig 4 The docking results of CDKN1A with quercetin, hederagenin, and β-sitosterol a. The chemical bond results of the docking of CDKN1A with quercetin (2D); b. The chemical bond results of the docking of CDKN1A with hederagenin (2D); c. The chemical bond results of the docking of CDKN1A with β-sitosterol (2D); d. Docking result of CDKN1A with quercetin (3D); e. Docking result of CDKN1A with hederagenin (3D); f. Docking result of CDKN1A with β-sitosterol (3D) |
油红O染色的结果表明,WD组小鼠的肝脏脂质堆积水平远高于ND组小鼠。相较于WD组小鼠,YBTF处理的小鼠肝脏异常脂质堆积明显改善。HE染色结果表明,WD组小鼠肝组织的炎症细胞浸润较ND组小鼠更严重。YBTF干预组小鼠肝脏炎性细胞浸润程度较WD组小鼠明显改善(Fig 5)。提示YBTF能显著改善NASH小鼠的炎症及脂肪变。
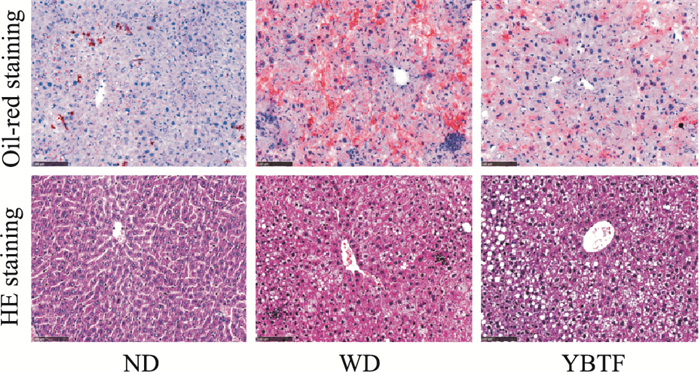
|
| Fig 5 Results of Oil-red O and HE staining (100×) |
观察染色结果表明,ND组未见明显β-半乳糖苷酶染色深蓝色产物,WD组小鼠肝组织深蓝色产物显著增多;YBTF干预组小鼠肝组织β-半乳糖苷酶染色阳性则较WD组小鼠明显改善(Fig 6)。结果提示NASH小鼠肝组织伴随细胞衰老,YBTF能明显改善细胞衰老。同时发现衰老细胞多集中于脂肪变细胞周边,提示脂肪变与细胞衰老之间可能存在密切关联。
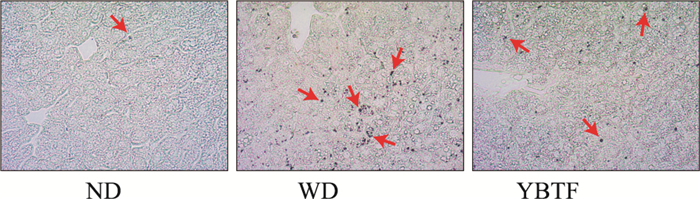
|
| Fig 6 Results of SA-β-Gal staining (200×) |
相较于予以正常饲料的ND组小鼠,给予西式饮食喂养的WD组小鼠CDKN1A表达量明显升高(P<0.05)。其中,从第5周起, 每天予以22.80 g·kg-1的益气补肾调脂方流浸膏治疗的YBTF组小鼠肝脏CDKN1A表达量较WD组明显降低(P<0.05)(Fig 7)。结果提示持续摄入高糖高脂的西式饮食在造成NASH小鼠模型的同时更会导致CDKN1A表达上调,YBTF干预治疗可逆转该过程。
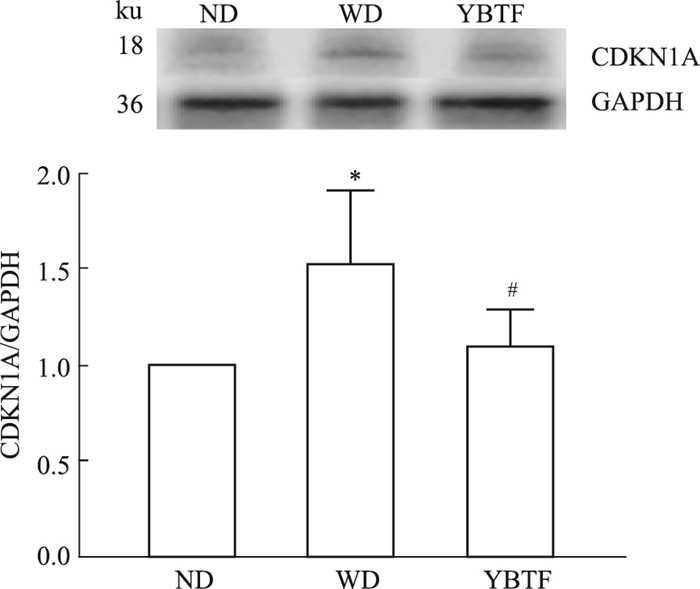
|
| Fig 7 Results of Western blot (x±s, n=8) *P < 0.05 vs ND; #P < 0.05 vs WD |
课题组前期分别各选取ND、WD、YBTF组3只小鼠的肝组织进行基因组测序[9]。分析发现WD组小鼠,CDKN1A表达量较ND组小鼠明显上升,YBTF干预治疗后表达量明显下降(P<0.01)(Fig 8A)。qRT-PCR实验结果也显示,在WD小鼠中CDKN1A mRNA表达量异常升高,YBTF干预治疗可以有效地降低CDKN1A mRNA表达量(P<0.05)(Fig 8B)。

|
| Fig 8 Results of sequencing and qRT-PCR (x±s, n=8) **P < 0.01 vs ND; #P < 0.05, ##P < 0.01 vs WD |
YBTF是课题组临床长期使用中药复方,具有极佳的改善NASH的疗效。课题组已通过miRNA测序结合实验明确YBTF可以通过改善炎症、免疫、氧化应激治疗NASH小鼠[8],但未明确YBTF发挥疗效的具体作用靶点。网络药理学从中药复方单位药的活性成分、作用靶点入手研究,通过构建网络的方式筛选复方治疗疾病的作用靶点,研究方式贴合中药复方多靶点、多途径的治疗原则。因此本研究通过网络药理学结合GO、KEGG富集分析筛选YBTF治疗NASH的作用机制及靶基因,伍以分子对接、WB、qRT-PCR对筛选结果进行验证。
结果显示YBTF可以治疗NASH,关键作用靶基因是CDKN1A,又名P21。诸多研究证实,当细胞端粒出现DNA损伤时,CDKN1A能够通过抑制细胞周期蛋白依赖性激酶的活性,引起细胞周期停滞,进行DNA修复, 使细胞恢复稳态[10]。但CDKN1A的过表达则会导致细胞周期阻滞,从而出现一系列细胞衰老的征象[11],通过靶向抑制CDKN1A的表达可显著改善细胞衰老[12]。CDKN1A与细胞衰老密切相关,是公认的细胞衰老标志。
细胞衰老是在各种应激因子诱导下出现的一种细胞周期停滞且不可逆的状态。常见的诱导因素包括端粒功能障碍,遗传毒性及氧化应激等。其中,细胞端粒缩短是细胞衰老的常见原因。数次分裂后,由于端粒缩短,细胞激活p53、p21、pRb等途径,从而导致生长停滞及细胞衰老。越来越多的证据表明,衰老是导致NASH恶化的重要危险因素[13]。实验证明细胞衰老可诱导线粒体功能障碍,破坏脂质代谢,导致脂质在肝细胞中过度堆积,造成脂肪变[14]。同时,线粒体功能障碍也会导致活性氧(reactive oxygen species,ROS)的生成[15]。过多的ROS会引起肝脏异常炎症以及NASH的恶化。动物实验发现,予以相同饮食的条件下,不同于抗肥胖组,易肥胖组小鼠肝组织脂肪变更严重,同时细胞衰老相关基因p16、p21 mRNA水平也明显高于抗肥胖组小鼠[16]。体外研究证实,抑制肝细胞中细胞衰老相关基因p53的表达可改善细胞凋亡和脂肪变[17]。临床实验也发现,NAFLD患者肝组织中p53的表达显著高于正常组[18]。上述实验均证明肝细胞衰老会促进肝细胞脂肪变及炎症,造成NASH的恶化,也进一步为YBTF以CDKN1A为关键靶基因,改善肝细胞衰老,治疗NASH的机制提供了理论支持。
YBTF是课题组长期用于治疗NASH的验方,临床疗效显著。但因YBTF多途径、多靶点治疗NASH的特点,YBTF的治疗机制尚不明确,阻碍了YBTF的临床推广。网络药理学是合适的用于筛选中药复方治疗疾病的靶点、机制的工具。本次研究通过网络药理学筛选YBTF治疗NASH的作用靶点,通过动物实验完成验证,流程完整;明确YBTF通过改善肝细胞衰老治疗NASH的机制及关键靶基因CDKN1A,筛选结果精准。为临床应用YBTF治疗NASH提供理论支撑。后续实验将进一步明确YBTF对CDKN1A上、下游基因的调控作用,筛选YBTF改善肝细胞衰老,治疗NASH的作用通路,研究肝细胞脂肪变与细胞衰老之间的关联。
| [1] |
Hsu C C, Ness E, Kowdley K V. Nutritional approaches to achieve weight loss in nonalcoholic fatty liver disease[J]. Adv Nutr (Bethesda), 2017, 8(2): 253-65. doi:10.3945/an.116.013730 |
| [2] |
Wong V W, Chitturi S, Wong G L, et al. Pathogenesis and novel treatment options for non-alcoholic steatohepatitis[J]. Lancet Gastroenterol Hepatol, 2016, 1(1): 56-67. doi:10.1016/S2468-1253(16)30011-5 |
| [3] |
Rinella M E. Nonalcoholic fatty liver disease: A systematic review[J]. JAMA, 2015, 313(22): 2263-73. doi:10.1001/jama.2015.5370 |
| [4] |
Greenhill C. NASH: Understanding how steatosis progresses to NASH[J]. Nat Rev Endocrinol, 2017, 13(1): 5. |
| [5] |
Bril F, Biernacki D M, Kalavalapalli S, et al. Role of vitamin E for nonalcoholic steatohepatitis in patients with type 2 diabetes: A randomized controlled trial[J]. Diabetes Care, 2019, 42(8): 1481-8. doi:10.2337/dc19-0167 |
| [6] |
我国16个重点病种的国家中医临床研究基地论文统计表(2008年~2013年)[J]. 世界科学技术-中医药现代化, 2013, 15(5): 1161-261. National TCM clinical research base of 16 crucial diseases in China (2008-2013)[J]. World Sci Technol Mod Tradit Chin Med, 2013, 15(5): 1161-261. |
| [7] |
杨晴柔, 严茂祥, 吴黎艳, 等. 益气补肾调脂方对非酒精性脂肪性肝炎小鼠氧化应激损伤的影响[J]. 浙江中医杂志, 2019, 54(12): 881-3. Yang Q R, Yan M X, Wu L Y, et al. Effects of tonifying qi, tonifying kidney and tiaozhi prescription on oxidative stress injury in mice with non-alcoholic steatohepatitis[J]. Zhejiang J Tradit Chin Med, 2019, 54(12): 881-3. doi:10.3969/j.issn.0411-8421.2019.12.011 |
| [8] |
Hong W, Li S, Cai Y, et al. The target microRNAs and potential underlying mechanisms of Yiqi-Bushen-Tiaozhi recipe against-non-alcoholic steatohepatitis[J]. Front Pharmacol, 2020, 11: 529553. doi:10.3389/fphar.2020.529553 |
| [9] |
Yu G, Wang L G, Han Y, et al. Cluster profiler: An R package for comparing biological themes among gene clusters[J]. OMICS, 2012, 16(5): 284-7. doi:10.1089/omi.2011.0118 |
| [10] |
Ou H L, Schumacher B. DNA damage responses and p53 in the aging process[J]. Blood, 2018, 131(5): 488-95. doi:10.1182/blood-2017-07-746396 |
| [11] |
Johnson A C, Zager R A. Plasma and urinary p21: Potential biomarkers of AKI and renal aging[J]. Am J Physiol Renal Physiol, 2018, 315(5): F1329-f35. doi:10.1152/ajprenal.00328.2018 |
| [12] |
Lee H C, Kang D, Han N, et al. A novel long noncoding RNA Linc-ASEN represses cellular senescence through multileveled reduction of p21 expression[J]. Cell Death Differ, 2020, 27(6): 1844-61. doi:10.1038/s41418-019-0467-6 |
| [13] |
向婷婷, 张长城, 刘朝奇, 等. 竹节参总皂苷干预自然衰老大鼠肝脏炎症的实验研究[J]. 中国药理学通报, 2017, 33(6): 848-53. Xiang T T, Zhang C C, Liu C Q, et al. Effects of total saponins of Panax japonicus on liver inflammation natural aging rats[J]. Chin Pharmacol Bull, 2017, 33(6): 848-53. doi:10.3969/j.issn.1001-1978.2017.06.020 |
| [14] |
Ogrodnik M, Miwa S, Tchkonia T, et al. Cellular senescence drives age-dependent hepatic steatosis[J]. Nat Commun, 2017, 8: 15691. doi:10.1038/ncomms15691 |
| [15] |
Miwa S, Jow H, Baty K, et al. Low abundance of the matrix arm of complex I in mitochondria predicts longevity in mice[J]. Nat Commun, 2014, 5: 3837. doi:10.1038/ncomms4837 |
| [16] |
Zhang X, Zhou D, Strakovsky R, et al. Hepatic cellular senescence pathway genes are induced through histone modifications in a diet-induced obese rat model[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(5): G558-64. doi:10.1152/ajpgi.00032.2011 |
| [17] |
Elston R, Inman G J. Crosstalk between p53 and TGF-β Signalling[J]. J Signal Transduct, 2012, 2012(11): 294097. |
| [18] |
Tomita K, Teratani T, Suzuki T, et al. p53/p66 Shc-mediated signaling contributes to the progression of non-alcoholic steatohepatitis in humans and mice[J]. J Hepatol, 2012, 57(4): 837-43. doi:10.1016/j.jhep.2012.05.013 |

