

2. 河北中医学院,河北 石家庄 050091
2. Hebei University of Chinese Medicine, Shijiazhuang 050091, China
梗阻性肾病占成人慢性肾病(chronic kidney disease, CKD)病因10%,也是儿童终末期肾病的首要病因[1]。炎性损伤和肾脏固有细胞损失是梗阻性肾病的重要原因。动物研究表明,凋亡、自噬、坏死或细胞转化可引起肾脏固有细胞急剧减少[2]。肾脏固有细胞损失可促进肾脏纤维化和肾功能恶化。焦亡,一种新的可调节性细胞死亡方式,不仅导致细胞减少而且带来严重炎症损伤,近来在心血管和肾脏领域颇受关注。有报道称梗阻性肾病时血浆醛固酮升高可导致肾脏巨噬细胞焦亡,而关于肾脏固有细胞焦亡少有研究。本实验采用醛固酮体外刺激人近端肾小管上皮细胞(HK2),观察补气活血解毒方含药血清及依普利酮对于DNA损伤、盐皮质激素受体NR3C2、血清和糖皮质激素诱导的蛋白激酶1 (serum and glucocorticoid-induced protein kinase 1,SGK-1)、核因子кB(nuclear factor кB,NF-κB)、焦亡信号通路相关蛋白NLRP3(nucleotide-binding oligomerization domain-like pyrin domain containing protein 3)、caspase-1和IL-1β的调控情况,研究补气活血解毒方含药血清及依普利酮抑制盐皮质激素受体活化导致的HK2细胞焦亡的作用机制。
1 材料与方法 1.1 药物依普利酮:购自美国Abcam公司(粉剂,批号APN12608-1-1),用DMSO配制成100 mmol·L-1的溶液。醛固酮:购自美国Cayman公司(粉剂,批号0487439-4),用无水乙醇配制成10 mmol·L-1溶液。补气活血解毒方含药血清:5只Wistar大鼠,清洁级,♂,购自河北省实验动物中心(合格证编号1605359)用于血清制备。补气活血解毒方采用一方制药公司(广东)的配方颗粒剂,药味包括金银花(批号6020961)、黄芩(批号6033511)、黄芪(批号403196T)、赤芍(批号311400T)、醋鳖甲(批号6013581)、地龙(批号6033291),质量配伍比例为20 ∶18 ∶40 ∶20 ∶7 ∶10。该组方颗粒按1.92 g·kg-1大鼠质量溶于3 mL蒸馏水,每日1次灌胃,共3日。末次给药后1 h股静脉取血分离血清并使用0.22 μm针孔过滤器过滤备用。
1.2 试剂与主要仪器TUNEL试剂盒(英国Eterlife公司,批号11422200),NR3C2抗体(美国Proteintech公司,批号21854-1-AP),SGK-1抗体(英国Abcam公司,批号GR197317-12),NF-кB(p65)抗体(武汉Servicebio公司,批号181905),IL-1β抗体(美国Novus公司,批号NB60-633),caspase-1抗体(美国Proteintech公司,批号00046167),NLRP3抗体(英国Eterlife公司,批号F1716),DMEM培养液(美国GIBCO公司,批号8118319)。全自动活细胞成像系统(美国Thermo Fisher scientific公司,型号EVOS FL Auto),近红外激光扫描成像仪(美国LI-COR公司,型号Odyssey),半干转膜仪(美国BIO-RAD公司,型号Semi-dry),激光扫描共聚焦显微镜(德国Leica公司,型号SP8)。
1.3 细胞培养采用人近端肾小管上皮细胞HK2为实验对象。细胞复苏后置于培养皿,在DMEM培养液(体积分数为1%青链霉素,8%牛血清)中培养(37 ℃、5% CO2)。待细胞增殖为培养面积的60%-70%时制备单细胞悬液,接种于培养瓶或细胞孔板继续培养。当处于对数生长期时改为去血清培养基培养24 h使细胞同步化,最后在相应药物干预24 h后收集细胞检测。干预药物的浓度依据MTT实验测试药物的细胞毒性及参考文献确定[3]。
1.4 实验分组对照组(Cont):仅采用DMEM培养基培养;醛固酮组(Ald):DMEM培养基加醛固酮(终浓度1 μmol·L-1);依普利酮干预组(EPL):DMEM培养基加醛固酮(终浓度1 μmol·L-1)和依普利酮(10 μmol·L-1);补气活血解毒方干预组(TCM):DMEM培养基加醛固酮(终浓度1 μmol·L-1)和体积分数10%中药血清。
1.5 指标检测 1.5.1 TUNEL检测细胞死亡4%多聚甲醛固定细胞后,滴加Triton-X 100冰浴2 min进行细胞破膜;滴加TUNEL试剂孵育1 h(37 ℃、避光);碘化丙啶复染细胞核,封片后使用全自动活细胞成像系统观察荧光(Ex:450-500 nm;Em:520-560 nm)。免疫荧光半定量分析:随机选取每组细胞标本TUNEL荧光图片3张,计算每张图片高倍镜视野中阳性细胞数量,取阳性细胞数量平均值作为统计结果。
1.5.2 蛋白免疫印迹检测SGK-1、NF-кB(p65)、IL-1β、caspase-1和NLRP3蛋白表达情况胰酶消化细胞后PBS洗涤、离心,留取细胞沉淀,加入含有PMSF的细胞裂解液,冰浴30 min,震荡吹打促进裂解,离心留取含蛋白上清液,加入上样缓冲液备用;制备SDS-聚丙烯酰胺凝胶,电泳分离蛋白;使用半干转膜仪使蛋白从凝胶转移到孔径为0.22 μm的醋酸纤维素(PVDF)膜上;PVDF膜放入5%脱脂牛奶中封闭2 h后孵育不同一抗和内参抗体GAPDH(稀释比例为1 ∶200-1 ∶2 000),4 ℃过夜;TBST清洗后滴加荧光标记二抗(IR 680或IR 780)避光孵育1 h;TBST和TBS清洗后使用近红外激光扫描成像仪观察拍照,ImageJ软件进行蛋白定量。
1.5.3 免疫荧光方法检测HK2细胞的NR3C2、NLRP3、caspase-1和IL-1β蛋白表达情况PBS洗涤细胞后4%多聚甲醛固定,Triton-X 100孵育20 min破膜,滴加山羊血清孵育30 min,分别滴加第一抗体(稀释比例为1 ∶50-1 ∶200),4 ℃过夜;PBS溶液洗涤后室温孵育荧光二抗(1 ∶200)1 h;DAPI复染、封片,采用活细胞成像系统观察。免疫荧光半定量分析同“1.5.1”。
1.6 统计分析使用GraphPad Prism 5.0软件分析数据,计量资料数据满足正态性分布且方差齐时采用单因素方差分析,SNK-q检验用于组间比较,实验结果以x±s表示。
2 结果 2.1 TUNEL染色检测HK2细胞死亡TUNEL阳性标记为绿色荧光细胞核,代表DNA断裂的死亡细胞。Ald组与Cont组比较,阳性细胞数量增多,差异具有统计学意义(P < 0.01),EPL和TCM组阳性细胞比Ald组明显减少,差异具有统计学意义(P < 0.01)。见Fig 1。

|
| Fig 1 DNA damage evaluated by TUNEL (×400)(x±s, n=3) **P < 0.01 vs Cont, ##P < 0.01 vs Ald. |
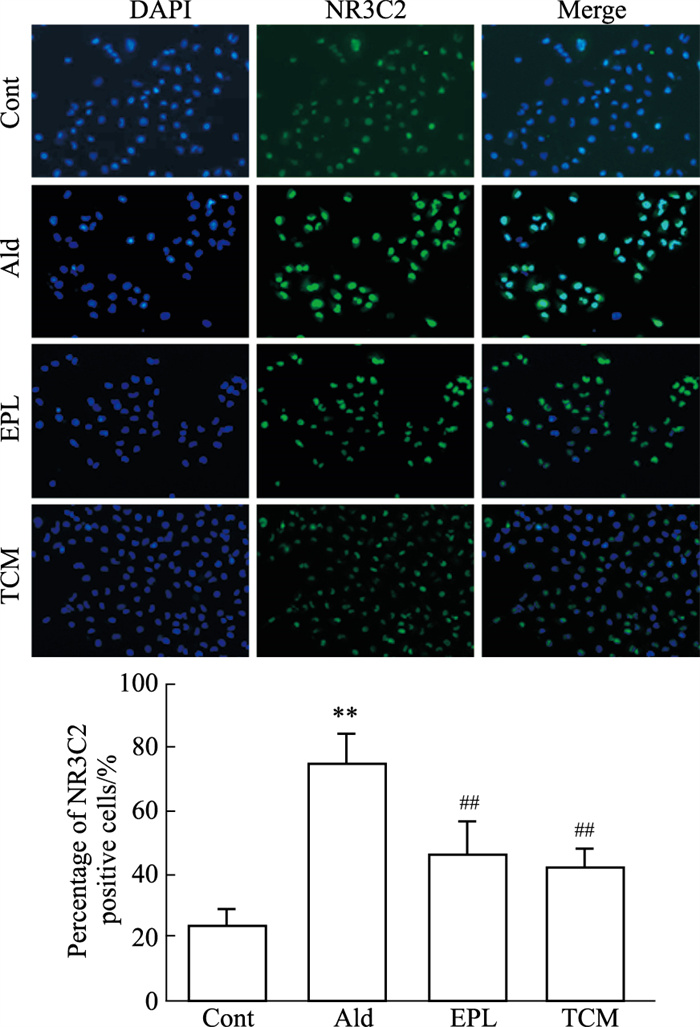
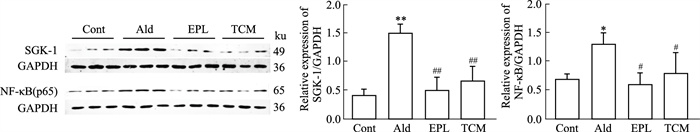
免疫荧光显示NR3C2表达:NR3C2被标记为绿色荧光,NR3C2活化后由胞质转入胞核。与对照组比较,醛固酮刺激后NR3C2的细胞核表达数量增多,差异具有统计学意义(P < 0.01);与醛固酮组相比,依普利酮或补气活血解毒方含药血清干预后NR3C2的细胞核表达数量下降,差异有统计学意义(P < 0.01), 见Fig 2。Western blot检测显示SGK-1、NF-кB(p65)表达:与Cont组比较,Ald组SGK-1、NF-кB(p65)蛋白表达明显上调(SGK-1:P < 0.01;NF-кB:P < 0.05);EPL组、TCM组与Ald组比较,SGK-1、NF-кB(p65)蛋白表达变弱, 见Fig 3。以上结果表明依普利酮或补气活血解毒方含药血清抑制了HK2细胞MR的活化。
|
| Fig 2 Protein expression of NR3C2 in HK2 cells by immunofluorescence (×400)(x±s, n=3) **P < 0.01 vs Cont, ##P < 0.01 vs Ald |
|
| Fig 3 Protein expression of SGK-1 and NF-κB in HK2 cells by Western blot(x±s, n=3) *P < 0.05, **P < 0.01 vs Cont, #P < 0.05, ##P < 0.01 vs Ald. |
免疫荧光显示:NLRP3、caspase-1和IL-1β均呈绿色荧光表达于胞质。Ald组与Cont组比较,三种蛋白表达增加,差异均具有统计学意义;依普利酮或补气活血解毒方含药血清干预后比Ald组表达减低,差异具有统计学意义。Western blot检测:以上三种蛋白定量结果与免疫荧光结果具有一致性。与Cont比较,Ald组三种蛋白表达明显上调(NLRP3、caspase-1:P < 0.01;IL-1β:P < 0.05);与Ald组比较,EPL组和TCM组中三种蛋白表达明显减低(NLRP3、caspase-1:P < 0.01;IL-1β:P < 0.05),见Fig 4。以上结果说明依普利酮或补气活血解毒方含药血清对于醛固酮诱导的HK2细胞焦亡具有抑制作用。

|
| Fig 4 Protein expression of NLRP3, caspase-1 and IL-1β in HK2 cells by Western blot or immunofluorescence (×400)(x±s, n=3) *P < 0.05, **P < 0.01 vs Cont; #P < 0.05, ##P < 0.01 vs Ald. |
焦亡属于基因可调控的细胞死亡方式之一,与凋亡最大不同在于产生强烈的炎症损伤。故近年来焦亡在各器官病理损伤中颇受重视。有报道称肾脏中巨噬细胞等免疫细胞可通过NLRP3炎症小体诱导焦亡,而固有细胞一般则不发生焦亡,于艳等[4]研究发现系膜细胞在高糖诱导下也可出现焦亡。炎症损伤贯穿梗阻性肾病始终,而焦亡能引起剧烈炎症反应,所以由梗阻因素备受累及的肾小管上皮细胞是否发生焦亡,进而促进梗阻性肾病的发生、发展值得关注。焦亡检测需要关注两方面:首先,TUNEL检测DNA损伤以证明细胞死亡,但不能分辨此种死亡属于焦亡还是凋亡;其次,检测焦亡依赖的信号通路,以鉴别凋亡。NLRP3炎症小体在CKD中关注度最高,也是触发焦亡的炎症体之一。NF-κB与相应基因结合后促进NLRP3、pro-caspase-1、pro-IL-1β等分子转录、翻译。随后,当NLRP3蛋白感知到体内存在损伤或病原相关分子模式时(DAMP、PAMP),迅速与接头蛋白(ASC)和pro-caspase-1组装,形成激活的NLRP3炎症体。接下来NLRP3炎症体级联水解pro-caspase-1和pro-IL-1β[5]。NLRP3/caspase-1/IL-1β为检测焦亡的经典信号通路。近几年研究发现Gasdermin家族中GSDMD蛋白被caspase激活后参与焦亡细胞膜孔的形成,炎症因子可通过细胞膜孔溢出诱发炎症反应[6]。此实验通过TUNEL和NLRP3/caspase-1/IL-1β信号通路联合检测发现醛固酮诱导的HK2出现细胞焦亡。加之前期实验观察到肾小球系膜细胞同样出现了焦亡[7],故推测醛固酮可以诱导肾脏固有细胞出现焦亡,给肾脏带来炎症损伤。
醛固酮及其盐皮质激素受体(mineralocoricoid receptor, MR)诱导的炎症损伤,参与梗阻性肾病的发生、发展。据报道高浓度血浆醛固酮可造成肾功能下降、蛋白尿,在UUO模型大鼠可导致肾小球硬化、足细胞损伤、肾组织中巨噬细胞增多,NLRP3、caspase-1、IL-18等炎症因子高表达[8],而盐皮质激素受体拮抗剂(MRB)可抑制肾组织炎性损伤。MR分布广泛,除肾小管外还分布于心血管内皮细胞等多个部位,是醛固酮诱导炎症损伤的关键受体。MR属于胞质受体,当与醛固酮结合后被激活进入细胞核,触发某些蛋白的基因转录[9]。SGK-1/NF-кB是醛固酮/MR下游的重要信号通路,MR活化促进SGK-1、NF-кB蛋白高表达,从而介导多种炎症分子产生,如NLRP3、pro-caspase-1、pro-IL-1β等[10-11]。本实验中TUNEL、NR3C2、SGK-1、NF-кB及焦亡相关蛋白检测结果表明:高选择性的MRB─依普利酮对醛固酮诱导的HK2细胞焦亡起到了明显抑制作用,结合之前研究发现MRB对于醛固酮介导的足细胞损伤及系膜细胞焦亡的抑制作用[12],可证明MRB是抑制醛固酮/MR诱导的肾脏固有细胞损伤的良好选择。
梗阻性肾病如早期无明显临床症状,加之肾脏本身代偿功能强大,早期发现困难。部分病人即使早期解除梗阻,肾脏损伤仍会持续进展甚至发展为肾衰竭[13]。中医治疗慢性肾病具有一定优势。慢性肾病以肾间质纤维化为特征,可归于中医的“关格”、“水肿”等病症范畴,其基本病机为脾肾亏虚、毒瘀互结、肾络瘀阻。虚为此病之本,以脾肾为主。脾虚无以运化水湿、化生气血,肾虚分清泌浊功能失常,致气血不足、水湿内停,体内病理产物郁积日久化毒,气虚、水停、毒邪均可致瘀,阻于肾络[14]。梗阻性肾病时肾脏血流瘀滞,多种炎症因子浸润,日久肾间质胶原沉积及纤维化,故补益脾肾、活血通络、化瘀解毒为其基本治法[15]。此实验以上述治法为指导确立“补气活血解毒方”,方药组成有黄芪、赤芍、地龙、醋鳖甲、黄芩、金银花,诸药配伍具有补气、活血化瘀、解毒通络之功效。临床应用显示此方有助于减轻尿蛋白、改善肾脏功能,但其分子蛋白水平的作用机制需要多方面研究。前期实验证实活血解毒中药可以下调8-OhdG表达抑制梗阻性肾病大鼠细胞凋亡[16],本次实验显示补气活血解毒方含药血清减轻醛固酮诱导的细胞焦亡,其作用机制与抑制NR3C2有关。
综上,该实验从醛固酮诱导的HK2细胞焦亡角度探讨了梗阻性肾病的发病机制,为补气活血解毒方通过减轻肾脏炎性损伤和肾脏固有细胞损失,治疗梗阻性肾病提供了实验支持。
( 致谢: 衷心感谢河北省中西医结合肝肾病证研究重点实验室提供科研平台! )
| [1] |
王秀丽, 吴玉斌. 先天性肾积水与肾间质纤维化研究进展[J]. 中国实用儿科杂志, 2018, 33(2): 105-9. Wang X L, Wu Y B. Research progress in congenital nephrosis and renal inter-stitial fibrosis[J]. Chin J Prac Pediatr, 2018, 33(2): 105-9. |
| [2] |
Wang Y, Jiang H, Pan J, et al. Macrophage-to-myofibroblast transition contributes to interstitial fibrosis in chronic renal allograft injury[J]. J Am Soc Nephrol, 2017, 28: 2053-67. doi:10.1681/ASN.2016050573 |
| [3] |
黄海燕, 魏佳莉. 醛固酮诱导人肾小管上皮细胞胶原Ⅰ、Ⅲ表达的研究[J]. 重庆医学, 2016, 45(21): 2900-2. Wang H Y, Wei J L. Study on expression of collagen Ⅰ and Ⅱ in aldosterone-induced human kidney tubular epithelial cells[J]. Chongqing Med, 2016, 45(21): 2900-2. doi:10.3969/j.issn.1671-8348.2016.21.006 |
| [4] |
于艳, 何丽洁, 王汉民. NLRP1炎性体促进高糖高胰岛素诱导的肾小球系膜细胞焦亡[J]. 细胞与分子免疫学杂志, 2018, 34(5): 442-7. Yu Y, He L J, Wang H M. NLRP1 inflammasome promotes hyperglycemic and hyperinsulin-induced pyroptosis of glomerular mesangial cells[J]. Chin J Cell Mol Immunol, 2018, 34(5): 442-7. |
| [5] |
Awada F, Assrawia E, Louvrier C, et al. Inflammasome biology, molecular pathology and therapeutic implications[J]. Pharmacol Ther, 2018, 187: 133-49. doi:10.1016/j.pharmthera.2018.02.011 |
| [6] |
Liu X, Zhang Z, Ruan J, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J]. Nature, 2016, 535: 153-8. doi:10.1038/nature18629 |
| [7] |
Zhang Y, Hao J, Ma X, et al. Huoxue Jiedu Huayu recipe ameliorates mesangial cell pyroptosis in contralateral kidney of UUO rats[J]. Evid Based Complement Alternat Med, 2020, e2530431. |
| [8] |
Bruder-nascimento T, Ferreira nathanne s., Zanotto C Z, et al. NLRP3 inflammasome mediates aldosterone-induced vascular damage[J]. Circulation, 2016, e024369. |
| [9] |
崔艳, 陈晓, 安惠霞, 等. 醛固酮与肾脏炎症的研究进展[J]. 中国中西医结合肾病杂志, 2012, 13(10): 932-4. Cui Y, Chen X, An H X, et al. Research progress of aldosterone and renal inflammation[J]. Chin J Integr Med Tradit West Nephrol, 2012, 13(10): 932-4. doi:10.3969/j.issn.1009-587X.2012.10.034 |
| [10] |
Terada Y, Ueda S, Hamada K, et al. Aldosterone stimulates nuclear factor-kappa B activity and transcription of intercellular adhesion molecule-1and connective tissue growth factor in rat mesangial cells via serum- and glucocorticoid-inducible protein kinase-1[J]. Clin Exp Nephrol, 2012, 16: 81-8. doi:10.1007/s10157-011-0498-x |
| [11] |
Doi T, Doi S, Nakashima A, et al. Mizoribine ameliorates renal injury and hypertension along with the attenuation of renal caspase-1 expression in aldosterone-salt-treated Rrats[J]. PLoS One, 2014, 9(4): e93513. doi:10.1371/journal.pone.0093513 |
| [12] |
Bai M, Chen Y, Zhao M, et al. NLRP3 inflammasome activation contributes to aldosterone-induced podocyte injury[J]. Am J Physiol Renal Physiol, 2017, 312: F556-64. |
| [13] |
杨芹, 么喜存. 梗阻性肾病影像学检查方法[J]. 实用医学影像杂志, 2014, 15(2): 137-8. Yang Q, Yao X C. Imaging examination method of obstructive nephropathy[J]. J Prac Med Imaging, 2014, 15(2): 137-8. |
| [14] |
许庆友, 韩琳, 秦建国, 等. 赵玉庸"肾络瘀阻"病机学说及临床应用[J]. 中华中医药杂志, 2015, 25(5): 702-4. Xu Q Y, Han L, Qin J G, et al. Theory of blood stagnation in kidney meridian raised by professor ZHAO Yu-yong and clinical practice[J]. Chin J Tradit Chin Med, 2015, 25(5): 702-4. |
| [15] |
余柯娜, 麻志恒, 陈建, 等. 浅谈中医药从炎症角度治疗肾纤维化的研究进展[J]. 中国中西医结合肾病杂志, 2015, 16(10): 938-40. Yu K N, Ma Z H, Chen J, et al. Research progress of traditional chinese medicine in the treatment of renal fibrosis from the perspective of inflammation[J]. Chin J Integr Med Tradit West Nephrol, 2015, 16(10): 938-40. |
| [16] |
王筝, 常奕, 熊云昭, 等. 活血解毒中药下调8-OhdG表达抑制梗阻性肾病大鼠细胞凋亡[J]. 中国药理学通报, 2017, 33(9): 1324-9. Wang Z, Chang Y, Xiong Y Z, et al. Inhibitory effects of Huoxue Jiedu decoction on cell apoptosis via downregulating 8-OhdG in obstructive nephropathy rats[J]. Chin Pharmacol Bull, 2017, 33(9): 1324-9. doi:10.3969/j.issn.1001-1978.2017.09.026 |

