

2. 上海中医药大学基础医学院,上海 201203
2. Basic Medical College, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
老年性聋(presbycusis)又称为年龄相关性听力损失(age-related hearing loss,ARHL),是指随着年龄的增长而引起听觉器官衰老和退变所造成的听力损失,是一种复杂的神经退行性疾病。老年性聋的发病机制复杂,目前仍然不十分清楚,研究认为,该病与氧化应激、细胞凋亡、线粒体功能障碍等有关[1]。近年来,微小RNA(microRNA,miRNA)与老年性聋的关系得到越来越多的关注[2]。miRNA是一类非蛋白质编码性RNA分子,可引起mRNA降解或抑制蛋白质翻译参与细胞的生理和病理过程。Zhang等[3]在C57BL/6J小鼠和CBA/J小鼠模型上检测参与老年性聋发病过程中耳蜗螺旋器退化的miRNA,发现促凋亡miRNA(miR-29和miR-34家族)的上调以及促增殖、分化miRNA(miR-181和miR-183家族)的下调。ROS引起的miRNA表达变化可能引起耳蜗螺旋器的退化,参与老年性聋的发病机制[4]。
沉默信息调节因子1(silent information regulator 1,SIRT1)是miR-34a的靶基因,参与调节氧化应激引起的细胞凋亡,又可以对自噬作用进行调控[5]。SIRT1可以介导自噬相关蛋白Atg9的乙酰化作用,调节内质网应激下的自噬。微管相关轻链蛋白3(microtubule-associated protein 1 light chain 3,LC3)是一种自噬标记物,其C端可被自噬相关蛋白Atg4分割成LC3-Ⅰ,分布于胞质。在自噬体形成之后,LC3-Ⅰ与磷脂酰乙醇胺结合,生成LC3-Ⅱ,并稳定的固定在自噬体内外膜,直到形成自噬溶酶体。因此,LC3-Ⅱ蛋白的表达可以在一定程度上反映自噬细胞内自噬体的多少。选择性自噬接头蛋白(p62/sequestosome 1,SQSTM1)是连接LC3-Ⅱ蛋白与待降解泛素化底物的重要桥梁。当某些Atg基因突变、缺失或者自噬溶酶体形成受阻时,p62蛋白会出现明显堆积[6]。
耳聋左慈丸(Erlong Zuoci Wan,ELZC)(《中国药典》2015版)为治疗耳聋、耳鸣的经典古方,由熟地黄、山茱萸、山药、茯苓、泽泻、丹皮、柴胡、磁石八味药组成,功效滋肾平肝,主治肝肾阴虚的耳鸣耳聋、头晕目眩。现代药理学研究发现,耳聋左慈丸对耳鸣、药物性聋和老年性聋均有一定的治疗作用[7]。课题组前期研究发现,耳聋左慈丸可以减轻C57BL/6J早发性老年性聋小鼠年龄相关的听力损失和耳蜗病理损伤[8]。耳蜗毛细胞暴露于过氧化氢(hydrogen peroxide,H2O2)会产生氧化损伤反应,并表现出衰老相关β-半乳糖苷酶活性增高的现象,常用于老年性聋离体培养模型的建立[9]。本研究拟在小鼠耳蜗基底膜离体培养模型上,进一步观察耳聋左慈丸对H2O2损伤后miR-34a及其下游蛋白的作用,探讨耳聋左慈丸防治老年性聋的分子机制。
1 材料与方法 1.1 动物SPF级C57BL/6J小鼠,购自上海斯莱克实验动物有限公司,生产许可证号SCXK(沪)2017-0005,4 d龄。
1.2 药物耳聋左慈丸由八味中药组成:熟地(批号:200307)、山茱萸(制)(批号:191231)、山药(批号:200218)、茯苓(批号:200121)、泽泻(批号:200120)、牡丹皮(批号:190810)、柴胡(批号:200205)、磁石(煅)(批号:190527),购于上海康桥中药饮片有限公司。按照前期研究[7],先将耳聋左慈丸各组分按照8 ∶4 ∶4 ∶3 ∶3 ∶3 ∶1 ∶1的比例配伍组成,称取相应中药,8倍量双蒸水浸泡2 h,武火煮沸后转文火煎煮30 min,取药液;再加双蒸水武火煮沸后转文火煎煮30 min,取药液。将两次药液合并,浓缩至所需生药浓度。按体积比2 ∶3加入无水乙醇,4 ℃静置24 h后,2000 rpm离心15 min取上清。蒸发浓缩,制备成0.3 kg·L-1(按生药浓度计算)的母液,经0.22 μm滤膜过滤除菌,4 ℃保存。使用时用培养液稀释至合适浓度。
1.3 试剂H2O2(美国Sigma公司);牛血清白蛋白(美国Sigma公司);BME培养基(美国Sigma公司);Hanks液(美国Thermo公司);miRNeasy mini kit试剂盒(德国QIAGEN公司);染料法Hairpin-it miRNAs定量和u6校准qRT-PCR试剂盒(上海吉玛制药技术有限公司);TUNEL检测试剂盒(美国Promega公司);phalloidin -TRITC(美国Sigma公司);抗体LC3-Ⅱ、p62、SIRT1和羊抗兔Alexa Fluor488,均购自美国Cell Signaling Technology公司。
1.4 仪器二氧化碳培养箱(美国Thermo公司);倒置荧光显微镜(德国ZEISS公司);LSM880共聚焦显微镜(德国ZEISS公司);LightCycler 96 SW荧光定量PCR仪(美国Roche公司);解剖显微镜(德国ZEISS公司)。
1.5 小鼠耳蜗组织取材及培养将出生4 d的C57BL/6J小鼠用75%酒精进行全身皮肤表面消毒,在解剖显微镜下取出耳蜗,放入盛有Hanks液的培养皿中,拨开耳蜗壳,将基底膜组织与蜗轴分离,去掉螺旋韧带、血管纹等其他结构,分离出整个基底膜,放入含无血清培养液的35 mm培养皿中,移到胶原凝胶滴的表面,铺放平整。在细胞培养箱(37 ℃,5%CO2)中培养,隔日更换无血清培养液。
1.6 实验分组和给药小鼠耳蜗基底膜离体培养24 h后,随机分为5组:对照组、H2O2模型组和耳聋左慈丸组(5 mg·L-1、10 mg·L-1和50 mg·L-1),每组14只。耳聋左慈丸组先以药物预处理24 h,对照组和模型组更换无血清培养液,24 h后模型组和耳聋左慈丸组加入0.3 mmol·L-1的H2O2继续置于细胞培养箱孵育4 h,终止培养。
1.7 Real-time qPCR法检测miR-34a表达终止培养后,收集基底膜组织,每组6只动物,设3个复孔。提取其miRNA(具体步骤参照说明书进行)。引物设计与合成由上海吉玛制药技术有限公司完成。mmu-mir-34a-5p基因引物序列:TCTGTCTCTCTTGGCAGTGTCTTA。miRNA逆转录和qPCR选用U6 snRNA作为内参。整个扩增反应体系参照试剂盒说明书进行。反应条件:95 ℃,3 min预变性;95 ℃,12 s变性;60 ℃,40 s,循环40次。实验结果采用公式2-△△Ct计算miR-34a的相对表达量。
1.8 免疫荧光组化法检测蛋白表达终止培养后,加入4% 多聚甲醛固定液固定1 h,用细镊刮脱带有基底膜的胶滴,0.01 mol·L-1 PBS清洗3次,10% 山羊血清封闭1 h,加入一抗,4 ℃孵育过夜;0.01 mol·L-1 PBS清洗3次,加入Alexa Fluor 488标记的羊抗兔二抗(1 ∶400),避光孵育1 h;0.01 M PBS清洗3次,加入phalloidin-TRITC(1 ∶200),避光孵育30 min,0.01 mol·L-1 PBS清洗3次。滴加50% 甘油PBS封固于玻片上,共聚焦显微镜下观察。免疫荧光图片采用ZEN 2.3 lite软件进行荧光半定量分析,每组4个耳蜗基底膜组织。
1.9 TUNEL法检测细胞凋亡终止培养后,加入4% 多聚甲醛固定液固定30 min,用细镊刮脱带有基底膜的胶滴,0.01 mol·L-1 PBS清洗3次,按照说明书,使用TUNEL检测试剂盒,注意避光。然后用0.01 mol·L-1 PBS清洗3次,加入phalloidin -TRITC(1 ∶200),避光孵育30 min,0.01 mol·L-1 PBS清洗3次。滴加50% 甘油PBS封固于玻片上,共聚焦显微镜下观察,每组4个耳蜗基底膜组织。
1.10 统计学分析所有实验数据以x±s表示,并用Graphpad prism7统计软件进行统计学分析,one-way ANOVA进行多组比较。
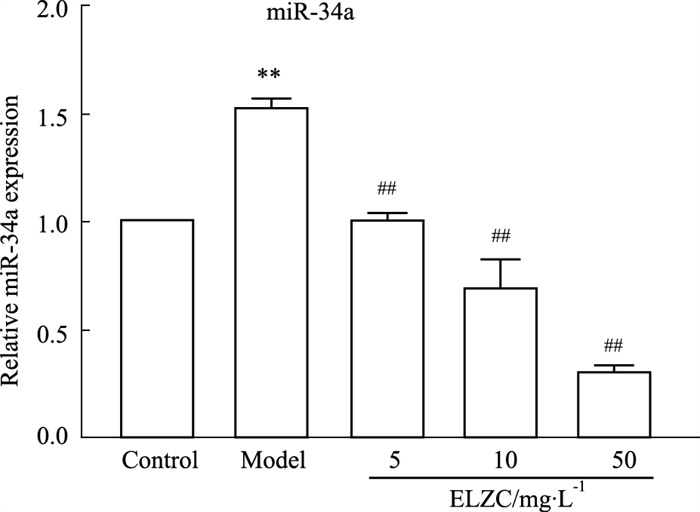
2 结果 2.1 耳聋左慈丸对H2O2损伤小鼠耳蜗基底膜miR-34a表达的影响Real-time qPCR结果显示,与对照组相比,H2O2模型组miR-34a表达明显升高(P < 0.01),耳聋左慈丸组miR-34a表达与模型组比较明显下降(P < 0.01)。提示耳聋左慈丸可以抑制H2O2致小鼠耳蜗基底膜损伤后miR-34a的表达增高(Fig 1)。
|
| Fig 1 Effect of ELZC on miR-34a expression in H2O2 damaged cochlear cultures (x±s, n=6) **P < 0.01 vs control group; ##P < 0.01 vs model group |
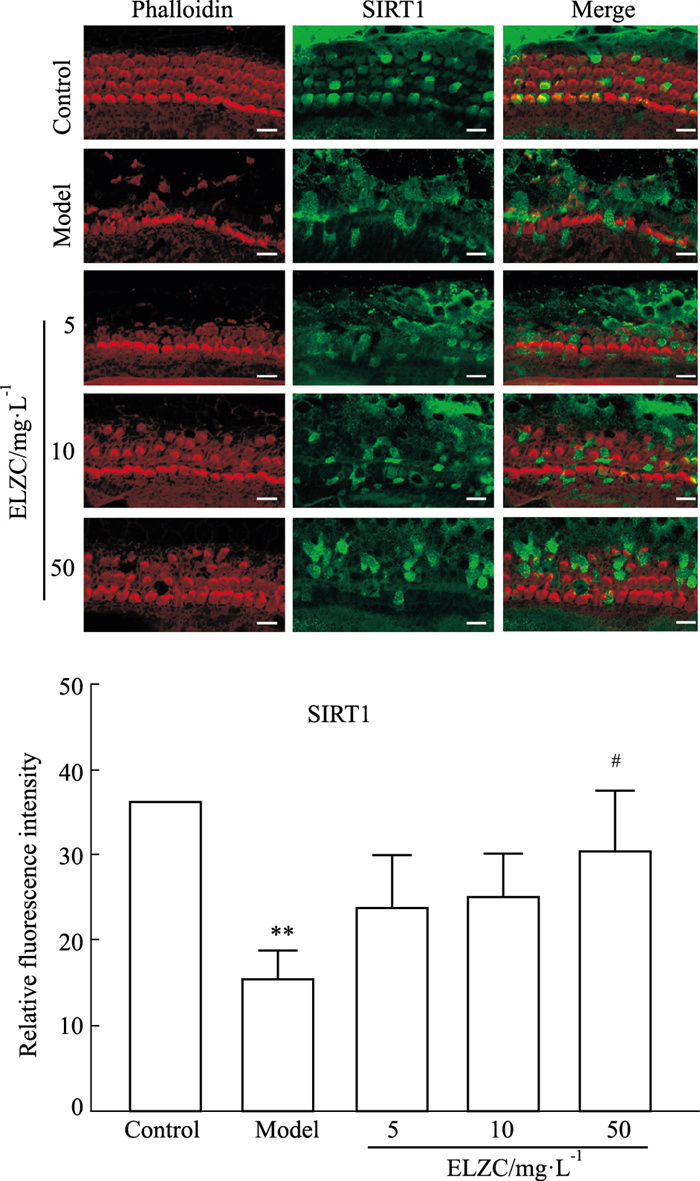
结果如Fig 2所示,对照组耳蜗毛细胞排列整齐,无缺失;0.3 mmol·L-1的H2O2作用4 h后外毛细胞大量缺失,内毛细胞损伤较小;耳聋左慈丸给药后,随着浓度的增加,毛细胞丢失和损伤明显减轻。与对照组相比,模型组耳蜗毛细胞SIRT1蛋白荧光强度明显降低(P < 0.01),耳聋左慈丸组SIRT1蛋白表达与模型组比较有增强趋势,50 mg·L-1耳聋左慈丸组SIRT1蛋白表达与模型组比较差异有统计学意义(P < 0.05)。
|
| Fig 2 Effect of ELZC on SIRT1 expression in H2O2 damaged cochlear cultures(x±s, n=4) A: Immunofluorescence staining of SIRT1, bar=10 μm; B: Densitometry analysis of SIRT1. **P < 0.01 vs control group; #P < 0.05 vs model group |
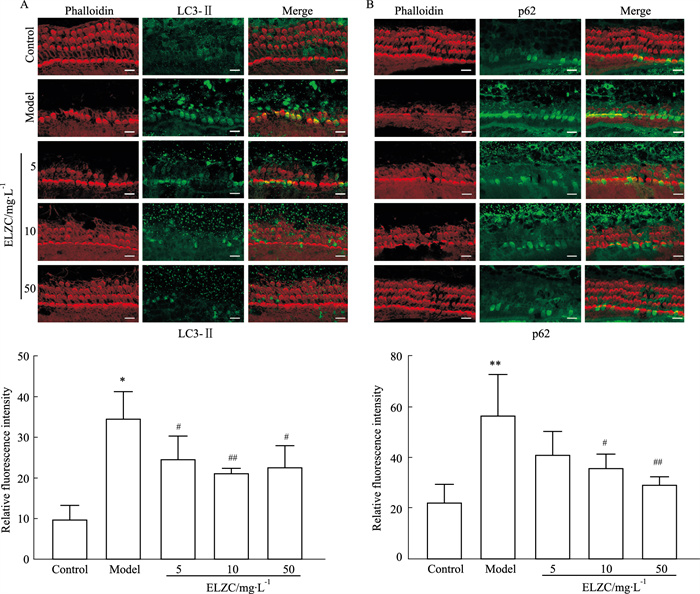
结果显示,与对照组相比,模型组毛细胞LC3-Ⅱ和p62蛋白表达明显升高(P<0.05,P<0.01);耳聋左慈丸组与模型组相比,LC3-Ⅱ和p62蛋白荧光表达明显降低(P<0.01,P<0.05)。以上结果提示,H2O2可以引起耳蜗基底膜毛细胞自噬体的堆积,损伤自噬流,而耳聋左慈丸有减少自噬体堆积,减轻自噬流损伤的作用(Fig 3)。
|
| Fig 3 Effects of ELZC on LC3-Ⅱ and p62 expression in H2O2 damaged cochlear cultures (x±s, n=4) A: Immunofluorescence staining and densitometry analysis of LC3-Ⅱ; B: Immunofluorescence staining and densitometry analysis of p62, bar=10 μm.*P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group |
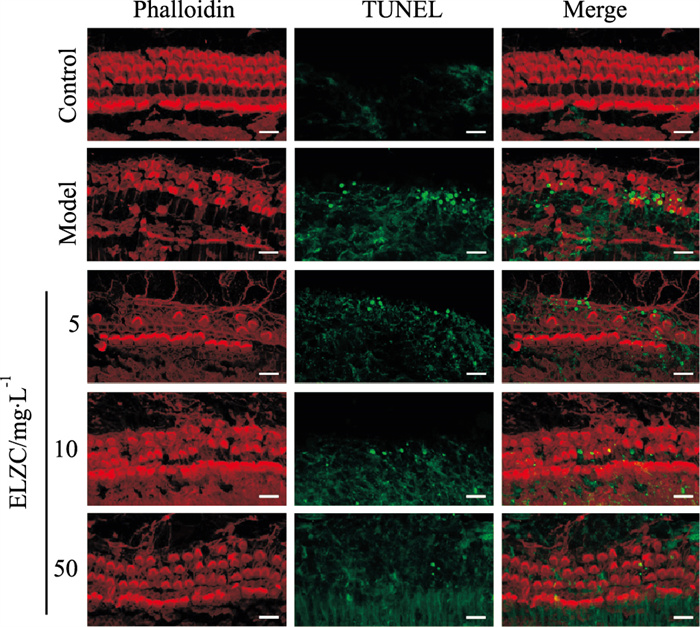
结果如Fig 4所示,对照组基底膜毛细胞几乎没有TUNEL阳性细胞出现,而H2O2模型组TUNEL阳性细胞数明显增多;耳聋左慈丸组TUNEL阳性细胞数与模型组相比明显降低。以上结果提示,H2O2可以诱导小鼠耳蜗基底膜毛细胞的凋亡,耳聋左慈丸具有抑制细胞凋亡的作用。
|
| Fig 4 Effect of ELZC on apoptosis in H2O2 damaged cochlear cultures (n=4). bar=10 μm |
miRNA是一类非编码微小RNA分子,通过特异性结合靶基因mRNA的3′端非翻译区,引起mRNA降解或蛋白质翻译抑制[10]。miRNA在老年性聋的发病机制中也可能具有重要作用。miR-34a是诱导衰老、细胞周期阻滞和凋亡的关键因子。在C57BL/6J早发性老年聋小鼠耳蜗中,miR-34a表达增加,抑制自噬相关蛋白ATG9A的表达,损伤自噬流,引起细胞死亡[11]。还有研究发现,老年性聋患者血浆中miR-34a水平明显增高,这些都提示,miR-34a在老年性聋的发病机制中有重要作用[12]。
SIRT1是一种NAD+ 依赖性去乙酰化酶,在代谢和衰老过程的调节中发挥重要作用。越来越多的研究将SIRT1作为治疗年龄相关性疾病的作用靶点。SIRT1是miR-34a的靶基因,miR-34a升高可以通过作用于NAMPT降低SIRT1的活性[13]。Xiong等[14]发现,调控miR-34a/SIRT1信号通路,可以协调线粒体自噬和线粒体生物合成,保护耳蜗毛细胞,延缓年龄相关性听力损失。本研究发现,耳聋左慈丸可以降低H2O2诱导的耳蜗基底膜miR-34a表达的升高,并上调SIRT1蛋白表达,提示耳聋左慈丸可能通过miR-34a/SIRT1通路抑制耳蜗基底膜的氧化损伤。
自噬和凋亡是调控细胞死亡的两个重要途径[15]。自噬是细胞在生理或病理因子作用下,通过溶酶体途径对错误折叠的蛋白质和功能受损的细胞器进行有效的识别和降解[16]。因此,自噬被认为是细胞除凋亡和坏死之外的第三种死亡方式。有研究发现,氧化应激和慢性炎症可以诱发线粒体受损和蛋白质表达异常,此时自噬水平的早期上调可以起到一定的清除作用,而自噬流一旦出现阻滞现象,就会加速聚集大量无功能的线粒体和蛋白分子,出现凋亡、自噬或两种细胞死亡途径共存的现象,引发耳蜗毛细胞毒性反应[17]。SIRT1可以与ATG5、ATG7和LC3作用,并去乙酰化这些蛋白,表明SIRT1也可以直接参与自噬调节[18]。本研究发现,H2O2可以引起耳蜗基底膜毛细胞LC3-Ⅱ和p62蛋白表达增高,提示自噬体堆积、自噬流阻滞,耳聋左慈丸可降低LC3-Ⅱ和p62蛋白表达,具有恢复自噬流的作用。
综上所述,耳聋左慈丸可能通过作用于miR-34a,调节SIRT1蛋白,进而影响自噬流,抑制细胞凋亡,对H2O2致小鼠耳蜗基底膜毛细胞损伤起到保护作用。
( 致谢: 本研究在上海中医药大学基础医学院听觉实验室完成,在此致以衷心的感谢!)
| [1] |
Wang J, Puel J L. Presbycusis: An update on cochlear mechanisms and therapies[J]. J Clin Med, 2020, 9(1): 218. doi:10.3390/jcm9010218 |
| [2] |
Hu W, Wu J, Jiang W, et al. MicroRNAs and presbycusis[J]. Aging Dis, 2018, 9(1): 133-42. doi:10.14336/AD.2017.0119 |
| [3] |
Zhang Q, Liu H, McGee J, et al. Identifying microRNAs involved in degeneration of the organ of corti during age-related hearing loss[J]. PLoS One, 2013, 8(4): e62786. doi:10.1371/journal.pone.0062786 |
| [4] |
Wang Z, Liu Y, Han N, et al. Profiles of oxidative stress-related microRNA and mRNA expression in auditory cells[J]. Brain Res, 2010, 1346: 14-25. doi:10.1016/j.brainres.2010.05.059 |
| [5] |
向菲, 李明航, 徐露, 等. 白藜芦醇通过促进线粒体自噬减轻小鼠脑缺血/再灌注损伤的实验研究[J]. 中国药理学通报, 2019, 6(35): 815-21. Xiang F, Li M H, Xu L, et al. Resveratrol alleviates cerebral ischemia /reperfusion injury in mice by promoting mitophagy[J]. Chin Pharmacol Bull, 2019, 6(35): 815-21. |
| [6] |
Catanese A, Olde Heuvel F, Mulaw M, et al. Retinoic acid worsens ATG10-dependent autophagy impairment in TBK1-mutant hiPSC-derived motoneurons through SQSTM1/p62 accumulation[J]. Autophagy, 2019, 15(10): 1719-37. doi:10.1080/15548627.2019.1589257 |
| [7] |
Dong Y, Cao B Y, Wang J, et al. Effects of Erlong Zuoci pill and its disassembled prescriptions on gentamicin-induced ototoxicity modelin vitro[J]. Chin J Integr Med, 2010, 16(3): 258-63. doi:10.1007/s11655-010-0258-x |
| [8] |
Dong Y, Guo C R, Ding Y, et al. Effects of Erlong Zuoci decoction on the age-related hearing loss in C57BL/6J mice[J]. J Ethnopharmacol, 2016, 181: 59-65. doi:10.1016/j.jep.2016.01.025 |
| [9] |
Benkafadar N, Francois F, Affortit C, et al. ROS-induced activation of DNA damage responses drives senescence-like state in postmitotic cochlear cells: Implication for hearing preservation[J]. Mol Neurobiol, 2019, 56(8): 5950-69. doi:10.1007/s12035-019-1493-6 |
| [10] |
Yang Y, Yu J W, Fang W, et al. The roles of miRNA, lncRNA and circRNA in the development of osteoporosis[J]. Biol Res, 2020, 53(1): 40. doi:10.1186/s40659-020-00309-z |
| [11] |
Pang J, Xiong H, Lin P, et al. Activation of miR-34a impairs autophagic flux and promotes cochlear cell death via repressing ATG9A: implications for age-related hearing loss[J]. Cell Death Dis, 2017, 8(10): e3079. doi:10.1038/cddis.2017.462 |
| [12] |
Pang J, Xiong H, Yang H, et al. Circulating miR-34a levels correlate with age-related hearing loss in mice and humans[J]. Exp Gerontol, 2016, 76: 58-67. doi:10.1016/j.exger.2016.01.009 |
| [13] |
Choi S E, Kemper J K. Regulation of SIRT1 by microRNAs[J]. Mol Cells, 2013, 36(5): 385-92. doi:10.1007/s10059-013-0297-1 |
| [14] |
Xiong H, Chen S, Lai L, et al. Modulation of miR-34a/SIRT1 signaling protects cochlear hair cells against oxidative stress and delays age-related hearing loss through coordinated regulation of mitophagy and mitochondrial biogenesis[J]. Neurobiol Aging, 2019, 79: 30-42. doi:10.1016/j.neurobiolaging.2019.03.013 |
| [15] |
Xie Q, Liu Y, Li X. The interaction mechanism between autophagy and apoptosis in colon cancer[J]. Transl Oncol, 2020, 13(12): 100871. doi:10.1016/j.tranon.2020.100871 |
| [16] |
楚敏, 施建蓉, 董杨. 自噬在感音神经性聋中的作用研究进展[J]. 中华耳鼻咽喉头颈外科杂志, 2020, 55(1): 68-72. Chu M, Shi J R, Dong Y. Research advances of autophagy in sensorineural hearing loss[J]. Chin J Otorhinolaryngol Head Neck Surg, 2020, 55(1): 68-72. |
| [17] |
Menardo J, Tang Y, Ladrech S, et al. Oxidative stress, inflammation, and autophagic stress as the key mechanisms of premature age-related hearing loss in SAMP8 mouse Cochlea[J]. Antioxid Redox Signal, 2012, 16(3): 263-74. doi:10.1089/ars.2011.4037 |
| [18] |
Li X, Wang Y, Xiong Y, et al. Galangin induces autophagy via deacetylation of LC3 by SIRT1 in HepG2 cells[J]. Sci Rep, 2016, 6: 30496. doi:10.1038/srep30496 |

