


2. 重庆医科大学药理学教研室,重庆 400016;
3. 武汉大学基础医学院药理学教研室,湖北 武汉 430072
2. Dept of Pharmacology, Pharmacy School, Chongqing Medical University, Chongqing 400016, China;
3. Dept of Pharmacology, School ofBasic Medical Sciences, Wuhan University, Wuhan 430072, China
迄今为止,结肠癌仍是消化系统的主要恶性肿瘤之一。随着技术和医学的发展,在过去的几十年中,结肠癌的早期筛查,诊断和治疗得到了极大的发展。但是,预后仍远未达到预期。因此,仍然迫切需要开发用于结肠癌的毒性较小且有效的药物。来自天然产物或其衍生物的具有抗癌活性的化合物已长期用于结肠癌治疗,例如长春新碱,紫杉醇,喜树碱等[1]。因此,天然产物可能是化学治疗剂的非常重要的来源。和厚朴酚(honokiol,HNK),一种双酚天然产物,从木兰属植物的树皮和叶片中分离出来。据报道,HNK对乳腺癌,肺癌,白血病和结肠癌等多种癌症具有抗癌活性。我们以前的研究表明,HNK还可以在HCT116结肠癌细胞中明显抑制增殖并诱导凋亡[2],这支持HNK可能是潜在的抗癌药物。然而,尚不清楚HNK的这种生物学功能的分子机制。前期研究发现,HNK能够抑制结肠癌细胞增殖并诱导其凋亡,这种作用可能与上调TGF-β1并通过p38 MAPK信号通路来促进YAP磷酸化有关,但具体的分子机制还需要进一步研究。
1 材料与方法 1.1 材料 1.1.1 细胞人结肠癌SW620细胞和HEK-293细胞从American Type Culture Collection(ATCC)购买。细胞在37 ℃,5% CO2的恒温培养箱中培养,培养基为含10%胎牛血清的DMEM高糖培养基。
1.1.2 试剂和厚朴酚购自西安昊轩生物科技有限公司(纯度为99.9%)。实验所用抗体TGF-β1(lot: 00082431)、BAD(lot: 00073982)、BCl-2(lot: 00078323) 和PCNA(lot: 00076208)购自Santa Cruz Biotechnology公司; 一抗YAP(lot: 00091404)、p-YAP(lot: #46g0742)购自Affinity公司,结晶紫购自北京索莱宝有限公司。
1.2 实验分组实验设计分为实验组与对照组,实验组加入不同浓度的HNK,对照组用相同体积的DMSO进行处理。
1.3 结晶紫染色检测细胞增殖将细胞铺于24孔板中,根据实验设计用不同浓度的药物(15、20、25、30、35 μmol·L-1)处理后,于24、48、72 h进行染色处理。具体步骤如下:弃去废液,用PBS润洗细胞两次,然后将200 μL结晶紫染色液加入孔中,室温下染色20 min,然后用清水洗尽染色液。将孔板晾干后进行扫描,将图像保存、分析。实验重复3次。
1.4 集落形成实验将细胞铺于24孔板中,加入不同浓度的药物(20、25、30 μmol·L-1)并作用48 h,将细胞消化后按500个/孔的细胞密度进行稀释,将细胞重铺于12孔板中,于37 ℃孵化箱中培养两周,之后用结晶紫染色液在室温下染色20 min,扫描并保存图像。实验重复3次。
1.5 流式细胞术检测细胞周期与凋亡将细胞铺于6孔板中,细胞密度为2×105个/孔,在用不同浓度的药物(20、25、30 μmol·L-1)处理后,于24 h收集细胞,弃去培养基,用PBS润洗细胞两次,用不含EDTA的胰蛋白酶消化细胞,再将细胞收集到1.5 mL EP管中,离心,条件为1 000 r·min-1,5 min,弃去废液,再用PBS重悬细胞后离心,条件为1 000 r·min-1,5 min,重复2次。用1 mL 75%冰乙醇溶液固定细胞并重悬分散,立即送检。每组实验重复3次。当检测凋亡时,在最后一步,用PBS离心2次之后,用1 mL PBS重悬再送检。实验重复3次。
1.6 Western blot实验将细胞接种在6孔板中,并根据实验设计用不同浓度的药物(20、25、30 μmol·L-1)处理。于24 h和48 h将所有细胞均用PBS(4 ℃)冲洗两次,然后裂解,收集并煮沸10 min使其变性。所有样品均用SDS-PAGE凝胶电泳,然后转到PVDF膜上。在用相应的一抗和二抗处理后,采用ECL试剂盒显影并保存图像。实验重复3次。
1.7 重组腺病毒构建TGF-β1重组腺病毒的构建采用AdEasy系统构建。从EST克隆中扩增了人TGF-β1的编码序列和绿色荧光蛋白(GFP),然后,将TGF-β1的PCR片段克隆到穿梭载体中,并用骨架质粒进行重组。将重组载体线性化并转染到HEK293细胞中,用于包装重组腺病毒,命名为TGF-β1。用绿色荧光蛋白(GFP)或红色荧光蛋白(RFP)标记重组腺病毒以追踪病毒,重组腺病毒仅表达GFP(AdGFP)作为载体对照。
1.8 统计学分析采用GraphPad Prism 9进行统计学分析,采用组间t检验比较两两差异,方差分析比较3组以上组间差异。结果以x±s表示。
2 结果 2.1 HNK对SW620细胞增殖的影响结晶紫染色法检测结果显示,HNK可以明显抑制结肠癌SW620细胞的增殖,并且抑制作用强弱与作用时间和药物浓度成正比(Fig 1A)。同时,Western blot结果表明,HNK能够上调SW620细胞中增殖细胞核抗原(PCNA)的表达水平(Fig 1C)。流式细胞术分析结果显示,HNK可将细胞周期阻滞在G1期(Fig 1E)。集落形成实验也证明HNK可以明显抑制集落的形成(Fig 1F)。以上结果提示,HNK能够抑制结肠癌SW620细胞增殖。

|
| Fig 1 1 Effects of HNK on proliferation in SW620 cells A: Crystal violet staining results showed the effect of HNK on proliferation in SW620 cells; C: Western blot assay results showed the effect of HNK on the level of PCNA in SW620 cells; E: Flow cytometric analysis results showed the effect of HNK on cell cycle arrest in SW620 cells; F: Cloning formation assay showed the effect of HNK on proliferation in SW620 cells. B, D: The quantitative diagram of A, C diagram respectively. *P<0.05, **P<0.01 vs control. |
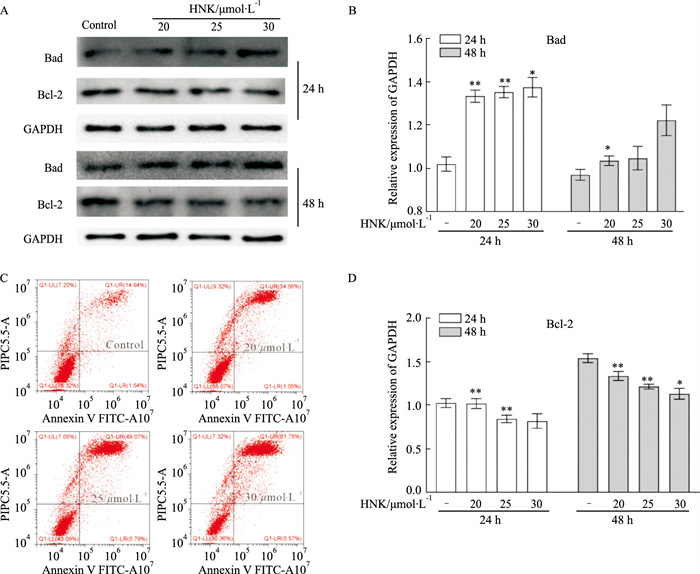
通过Western blot结果分析显示,HNK可以上调SW620细胞中Bad的蛋白水平,同时下调Bcl-2的蛋白水平(Fig 2A)。流式细胞术检测显示,HNK诱导细胞凋亡,其作用效果具有浓度和时间依赖性(Fig 2C)。结果提示,HNK能够促进SW620细胞凋亡。
|
| Fig 2 Effects of HNK on apoptosis in SW620 cells A: Western blot assay results showed the effect of HNK on the level of Bad and Bcl-2 in SW620 cells. C: Flow cytometric analysis results showed the effect of HNK on apoptosis in SW620 cells. B, D: The quantitative diagram of A diagram respectively. *P<0.05, **P<0.01 vs control. |
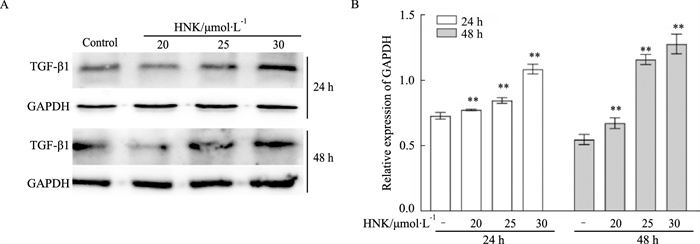
TGF-β1信号的异常与结肠癌的发生发展密切相关,因此我们接下来确定HNK是否可以调节结肠SW620细胞中TGF-β1的表达。Western blot实验表明,HNK可以明显地增加SW620细胞中TGF-β1的蛋白表达水平,使其浓度呈剂量依赖性上升(Fig 3A)。
|
| Fig 3 Effects of HNK on TGF-β1 in SW620 cells A: Western blot assay results showed the effect of HNK on the level of TGF-β1 in SW620 cells. B: The quantitative diagram of A diagram respectively. **P<0.01 vs control. |
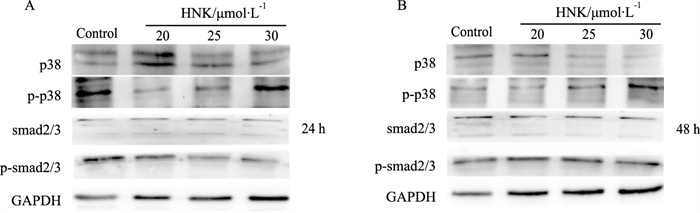
Western blot结果显示,HNK对smad2/3总蛋白以及磷酸化smad2/3水平无明显影响,但能明显增加磷酸化p38 MAPK的蛋白水平(Fig 4A,B)。结果提示,HNK抑制SW620细胞增殖可能与促进p38 MAPK磷酸化有关。
|
| Fig 4 Effects of HNK on p38 MAPK in SW620 cells A, B: Western blot assay results showed the effect of HNK on the level of phosphorylated p38 MAPK and smad2/3 in SW620 cells. |
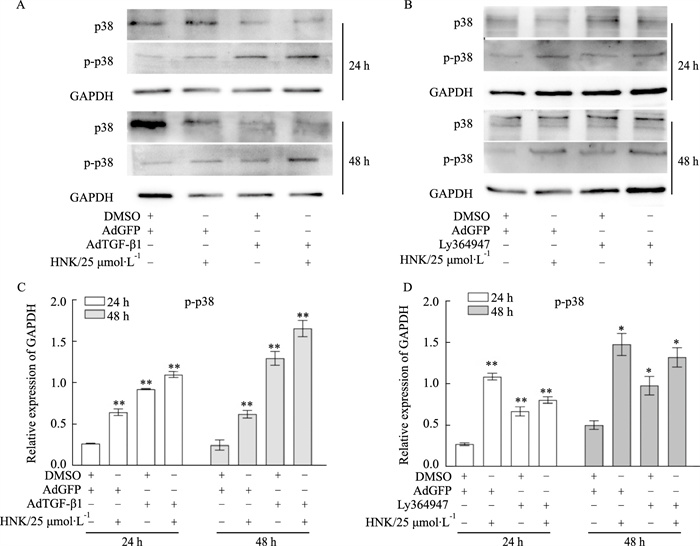
为了探究TGF-β1在对p38 MAPK信号的调控过程中的作用,通过Western blot结果表明,过表达TGF-β1腺病毒可以明显增强HNK上调SW620细胞中磷酸化p38的作用,相反,TGF-β1抑制剂则减弱HNK促进p38 MAPK磷酸化的作用(Fig 5A, B)。以上结果提示,TGF-β1对HNK的抗癌活性的作用至少可以通过p38 MAPK信号来传导。
|
| Fig 5 Effects of TGF-β1 mediated HNK on p38 MAPK phosphorylation in SW620 cells A: Western blot assay results showed the effect of TGF-β1 mediated HNK on the level of phosphorylated p38 MAPK in SW620 cells. B: Western blot assay results showed the effect of ly364947 (TGF-β1 inhibitor) and HNK on the level of phosphorylated p38 MAPK in SW620 cells. C, D : The quantitative diagram of A, B diagram respectively. *P<0.05, **P<0.01 vs control. |
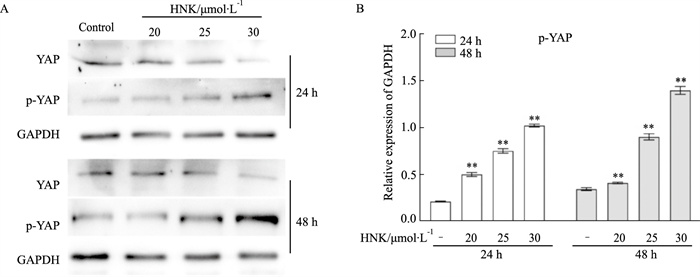
YAP是Hippo信号通路下游的转录共激活因子,通路中其他成员通过磷酸化负调控YAP,来实现该通路的生物学功能。Western blot结果表明,HNK促进了SW620细胞中YAP的磷酸化(Fig 6A)。
|
| Fig 6 Effects of HNK on YAP in SW620 cells A: Western blot assay results showed the effect of HNK on the level of phosphorylated YAP in SW620 cells. B: The quantitative diagram of A diagram respectively. **P<0.01 vs control. |
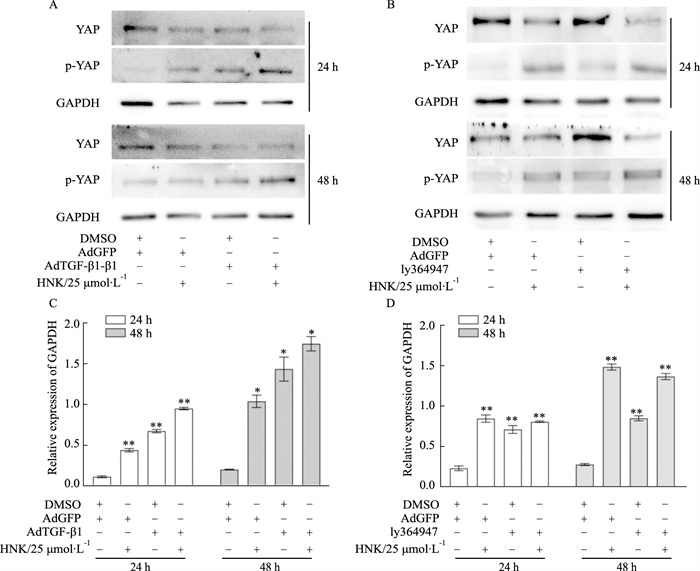
Western blot分析结果显示,TGF-β1的过表达可以增强HNK促进YAP磷酸化的作用,而TGF-β1抑制剂则部分逆转了这种作用(Fig 7A, B)。以上结果提示,TGF-β1可介导HNK促进YAP磷酸化。
|
| Fig 7 Effects of TGF-β1 mediated HNK on p-YAP in SW620 cells A: Western blot assay results showed the effect of TGF-β1 and HNK on the level of phosphorylated YAP in SW620 cells. B: Western blot assay results showed the effect of ly364947 (TGF-β1 inhibitor) and HNK on the level of phosphorylated YAP in SW620 cells. C, D : The quantitative diagram of A, B diagram respectively. *P<0.05, **P<0.01 vs control. |
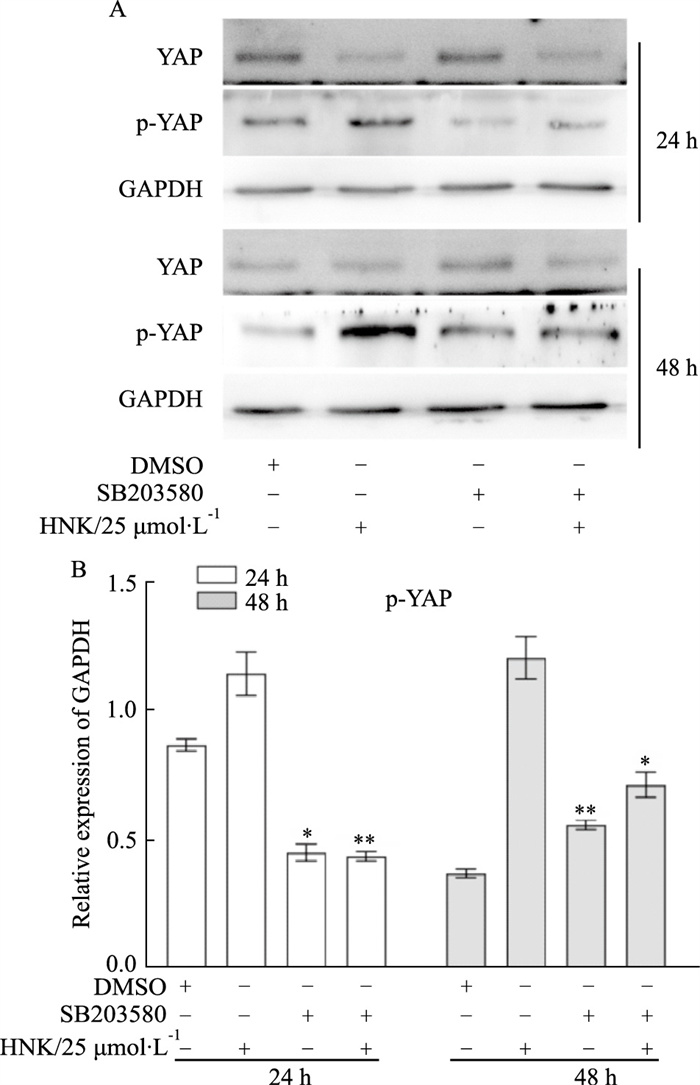
Western blot结果显示, 与对照组相比,p38 MAPK抑制剂能够明显抑制YAP磷酸化(Fig 8A),结果提示,HNK可能通过激活p38 MAPK来促进YAP磷酸化。
|
| Fig 8 Effects of p38 MAPK inhibitor and HNK on p-YAP in SW620 cells A: Western blot assay results showed the effect of SB203580 (p38 MAPK inhibitor) and HNK on the level of phosphorylated YAP in SW620 cells. B: The quantitative diagram of A diagram respectively. *P<0.05, **P<0.01 vs control. |
结肠癌是最常见的恶性肿瘤之一,目前是中国第五大高发癌症,预后远不如目前预期[3]。因此,仍然非常需要为其开发有效的药物。HNK是从木兰皮中提取的活性化合物,拥有多种药理活性,例如抗炎、抗癌等[4]。但是这些作用的分子机制尚不清楚。在这项研究中,我们验证了HNK在结肠癌细胞中的抗癌活性,并探讨了这种生物学功能的潜在机制。我们发现,HNK可以抑制结肠癌细胞的生长并促进其凋亡。HNK在结肠癌中的抗癌活性可以通过上调TGF-β1来介导,以激活p38 MAPK信号通路并促进YAP的磷酸化。
TGF-β是一个超家族,可调节胚胎的发育,细胞分化,凋亡和其他生物学过程。其中含量最高,表达最多的亚型是TGF-β1,而且TGF-β1是与肿瘤发生关系最密切的亚型[5]。我们之前的研究发现,汉防己甲素通过上调结肠癌中的TGF-β1表现出有效的抗癌活性[6]。因此,我们推测HNK在结肠癌中的抗癌活性也可能与TGF-β1有关。在这项研究中,我们发现HNK可以上调SW620细胞中TGF-β1的表达,这种作用与HNK的浓度成正比。
p38 MAPK通路是细胞增殖、应激、炎症、分化、转化、凋亡等信号转导通路的共同交汇通路之一,在肿瘤的发生发展过程中起到关键性的作用[7]。根据文献报道,在结肠癌细胞中活化p38 MAPK能抑制结肠癌细胞生长[8]。结果显示,HNK能够上调p38 MAPK的磷酸化水平,提示HNK抑制SW620细胞增殖的作用很可能与激活p38 MAPK通路有关。进一步的研究结果显示,过表达TGF-β1腺病毒能够增强HNK上调磷酸化p38 MAPK表达的作用,而TGF-β1抑制剂则作用相反,这提示我们HNK对p38 MAPK信号通路的调控作用可能是通过上调TGF-β1的表达来实现。
Hippo信号通路是一条通过调节细胞增殖、分化和凋亡而参与器官大小控制、组织再生、免疫应答、干细胞功能和肿瘤抑制的途径[9]。在许多癌症类型中都观察到高YAP和TAZ活性, 因为其调控细胞增殖和凋亡的作用,一旦功能失调就会导致恶性肿瘤。经实验结果证实,HNK能够上调磷酸化YAP蛋白的表达水平,减少YAP的入核转录,抑制SW620细胞的增殖,在过表达TGF-β1之后,磷酸化YAP水平明显增强,而TGF-β1抑制剂则减弱了HNK上调磷酸化YAP的作用。根据文献报道,YAP可能受p38 MAPK调控,在这两条信号通路之间可能存在一定的串扰[10-11],我们随后检测了p38 MAPK抑制剂对YAP水平的影响,发现p38 MAPK抑制剂减弱了HNK磷酸化YAP蛋白的作用,以上结果提示,HNK对SW620细胞的抑制增殖作用可能是通过激活p38 MAPK信号通路从而调控磷酸化YAP的表达水平实现的。
综上所述,HNK可能通过上调TGF-β1的功能来使激活p38 MAPK信号通路并上调磷酸化YAP来介导HNK的抗肿瘤作用。
| [1] |
Han Z M, Huang H M, Zhang T. Downregulation of DBN1 is related to vincristine resistance in colon cancer cells[J]. J Cancer Res Ther, 2019, 15(1): 38-41. |
| [2] |
刘荣兴, 胡培, 马妍, 等. 和厚朴酚抑制结肠癌细胞增殖与骨形态发生蛋白7关系的研究[J]. 中国药理学通报, 2018, 34(7): 1012-9. Liu R X, Hu P, Ma Y, et al. Inhibitory growth effect of honokiol and BMP7 in human colon cancer cells[J]. Chin Pharmacol Bull, 2018, 34(7): 1012-9. doi:10.3969/j.issn.1001-1978.2018.07.023 |
| [3] |
Marchiori C, Scarpa M, Kotsafti A, et al. Epithelial CD80 promotes immune surveillance of colonic preneoplastic lesions and its expression is increased by oxidative stress through STAT3 in colon cancer cells[J]. J Exp Clin Cancer Res, 2019, 38: 190. doi:10.1186/s13046-019-1205-0 |
| [4] |
Elfeky M G, Mantawy E M, Gad A M, et al. Mechanistic aspects of antifibrotic effects of honokiol in Con A-induced liver fibrosis in rats: Emphasis on TGF-β/SMAD/MAPK signaling pathways[J]. Life Sci, 2020, 240: 96-117. |
| [5] |
Duan D N, Derynck R. Transforming growth factor-β (TGF-β)-induced up-regulation of TGF-β receptors at the cell surface amplifies the TGF-β response[J]. J Biol Chem, 2019, 294: 8490-504. doi:10.1074/jbc.RA118.005763 |
| [6] |
任文艳, 陈前昭, 周林云, 等. 汉防已甲素抑制人结肠癌细胞增殖与TGF-β1的关联机制研究[J]. 中国药理学通报, 2017, 33(9): 1227-34. Ren W Y, Chen Q Z, Zhou L Y, et al. Relationship between anti-proliferation effect of tetrandrine and TGF-β1 in human colon cancer cells[J]. Chin Pharmacol Bull, 2017, 33(9): 1227-34. |
| [7] |
Wang X X, Qiao J H, Zou C Y, et al. Sesamin induces cell cycle arrest and apoptosis through p38/C-Jun N-terminal kinase mitogen-activated protein kinase pathways in human colorectal cancer cells[J]. Anticancer Drugs, 2021, 32: 248-56. doi:10.1097/CAD.0000000000001031 |
| [8] |
陈前昭, 曾于桦, 邵英, 等. 白藜芦醇抑制人结肠癌细胞增殖与p38 MAPK的关系研究[J]. 中国药理学通报, 2016, 32(8): 1110-4. Chen Q Z, Zeng Y H, Shao Y, et al. Anti-proliferation effect of resveratrol and p38 MAPK in human colon cancer cells[J]. Chin Pharmacol Bull, 2016, 32(8): 1110-4. |
| [9] |
Maugeri S M, De M R. The Hippo pathway in normal development and cancer[J]. Pharmacol Ther, 2018, 186: 60-72. |
| [10] |
Muranen T, Selfors L M, Hwang J, et al. ERK and p38 MAPK activities determine sensitivity to PI3K/mTOR inhibition via regulation of MYC and YAP[J]. Cancer Res, 2016, 76: 7168-80. |
| [11] |
Hu C, Yang J, Su H Y, et al. Yes-associated protein 1 plays major roles in pancreatic stellate cell activation and fibroinflammatory responses[J]. Front Physiol, 2019, 10: 1467. |

