

类风湿关节炎(rheumatoid arthritis,RA)是一种发病机制未知、对多个关节有影响的慢性、全身性自身免疫反应的疾病,主要病理表现为持续性的、慢性的滑膜炎性增生和形成的大量血管翳,导致关节损伤及不可逆性破坏,最终使得关节功能丧失[1]。在RA的发病过程中,涉及多种类型细胞之间的相互作用,其中成纤维样滑膜细胞起关键作用。该细胞可异常增殖、迁移、侵袭至血管及关节,也能在炎症环境下发生能量代谢异常,反过来促进其活化和滑膜炎症[2-3]。因此,抑制成纤维样滑膜细胞的活力,阻止其被活化,是治疗RA的关键,对RA药物的开发具有重要作用。
化合物Q-1来源于苗药铁筷子,是ACX库中未发现的全新化合物Q-1,课题组初步研究发现其具有抗炎、有效控制人RA成纤维滑膜细胞增殖的作用[4-5]。因此,本研究采用人RA成纤维样滑膜细胞株(MH7A)为研究对象,建立TNF-α引起的细胞炎症模型,基于NF-κB和MAPK信号通路来探索化合物Q-1的作用及机制,为化合物Q-1开发为RA的治疗药物提供理论支撑和实验依据。
1 材料 1.1 细胞人类风湿关节炎成纤维样滑膜细胞株(MH7A),购自吉妮欧生物公司。
1.2 药物、试剂与仪器化合物Q-1为实验室自制(纯度为98%以上),甲氨蝶呤(MTX)(Sigma公司,批号BCBN2516V);胎牛血清(FBS)(BI公司,批号2033119);DMEM高糖培养基(Gibico公司,批号8120500);二甲亚枫(DMSO)(Solarbio公司,批号1012D031);人TNF-α重组蛋白(Peprotech公司,批号041525E1319);CCK-8试剂盒(Bioss公司,批号AI04156754);TNF-α和IL-6 ELISA试剂盒、兔抗人p38蛋白抗体(Abcam公司,批号分别为GR3323551-1,GR3336678-1,GR3215674-8);兔抗人p-p38、IκBα、p-IκBα、NF-κB p65、p-NF-κB、ERK1/2、p-ERK1/2、JNK和p-JNK蛋白抗体(CST公司,批号分别为4511T,4812S,2859T,8242T,3033T,4695T,4370T,9252T,4668T);兔抗人GADPH蛋白抗体(杭州贤至公司,批号AB-P-R 001);山羊抗兔HRP二抗(Bioss公司,批号019116)。二氧化碳培养箱、1510全自动酶标仪(Thermo Fisher Scientic);SM-CJ-2F超净工作台(苏州安泰空气技术公司);TS-100倒置成像显微镜、BX53F电子显微镜(OLYMPUS);ST16R台式冷冻离心机(Thermo);CT100R离心机(天美科技有限公司);Western Blot装置(BIO-RAD);超灵敏多功能化学发光成像系统曝光机(Bio-Rad ChemiDocTMTouch)。
2 方法 2.1 细胞培养MH7A细胞在含10%胎牛血清的DMEM高糖培养基、37 ℃、5% CO2的培养箱里培养,湿度为100%。当细胞长到培养瓶80%以上时,常规传代,取5-10代细胞用于实验。
2.2 CCK-8法检测化合物Q-1对MH7A细胞增殖-毒性影响将MH7A细胞接种于96孔板,每孔10 000个,设空白孔(无细胞组)、对照孔(不加药物组)和药物组,37 ℃、5% CO2培养过夜后,每孔加入不同浓度化合物Q-1及MTX [6],每组设5个复孔。24 h后,每孔加入10 μL CCK-8溶液,放入培养箱继续孵育1 h。用酶标仪测定450 nm处的各孔吸光度(OD)值。计算MH7A细胞存活率和抑制率:细胞存活率/%=(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)× 100%,细胞抑制率/%=(OD对照孔-OD实验孔)/(OD对照孔-OD空白孔)× 100%。
2.3 Transwell迁移实验① 均匀接种MH7A细胞于T25培养瓶,随机分为5组,孵育过夜。给药干预24 h后,分别消化细胞,用无血清培养基调整细胞浓度为2×108 L-1。②在Transwell小室的下室加入20% FBS培养基800 μL,上室加入150 μL细胞悬液,继续培养24 h,每组设3个复孔。③取出Transwell小室,PBS洗净,甲醇固定15 min。④0.1%结晶紫染液染色30 min,清水反复清洗多次后,用湿棉签轻轻擦去上室底部膜表面上的细胞。⑤利用手术刀片摘取Transwell膜,将底部朝上瞭干。放于载玻片上,加入中性树胶封片,在高倍镜(100×)下选取中间和四周5个视野拍照。⑥采用ImageJ软件计数,计算穿过小室下室膜的细胞数,取平均值,计算迁移率,细胞迁移率/%=实验组迁移细胞数平均值/对照组迁移细胞数平均值× 100%。
2.4 酶联免疫吸附测定(ELISA)将MH7A细胞以5×107个·L-1密度均匀接种在24孔板,随机分为6组,放入37 ℃、5% CO2培养箱24 h,加入相应药物干预24 h,收集细胞上清液-20 ℃保存备用。按照试剂盒说明书进行测定。将相关样品加入酶板,贴上覆膜,室温避光振摇1 h。之后洗板3次,加入TMB显影液,避光摇10 min,加入终止液,酶标仪450 nm处测定。
2.5 蛋白质印迹检测① 细胞总蛋白提取:均匀接种MH7A细胞于T75培养瓶,随机分为6组。培养过夜,加入相应药物干预24 h,按照分组加或不加TNF-α溶液使终浓度为10 μg·L-1,刺激30 min。用预冷的PBS清洗细胞2次,消化,离心,得细胞沉淀,加入混合裂解液(2% Triton100 ∶PMSF ∶蛋白酶抑制剂∶磷酸酶抑制剂=99 ∶1 ∶1 ∶1),在冰上裂解30 min,4 ℃、12 000 r·min-1条件下离心25 min,所得上清即为蛋白原液。②BCA法测定蛋白浓度,稀释到同一浓度并分装,保存在-80 ℃冰箱。③凝胶电泳:使用BIO-RAD的免染胶,恒压100 V进行电泳。④转膜:半干转法。在25 V、2.5 A条件下转膜6 min。⑤封闭:5% BSA溶液室温下封闭1 h。⑥抗体孵育:加入相对应的一抗溶液,放在4 ℃冰箱孵育过夜,d 2回收一抗,1×TBST洗膜3次,每次10 min。加入二抗溶液室温下孵育1 h。同样方法洗膜洗3次。⑦ECL显影,得到蛋白条带。采用Bio-Rad ChemiDocTM Touch系统的Image Lab分析软件对蛋白条带进行灰度分析。以GADPH作为标准,将各组蛋白的灰度值均一化。使用均一化后的灰度值计算,得到蛋白相对表达水平,即蛋白相对表达水平=各组蛋白灰度值/正常组蛋白灰度值。
2.6 统计学分析所有数据分析均采用SPSS 17.0统计软件,采用单因素方差分析,组间差异使用多重比较,若方差齐性选用LSD,若方差不齐选用Tamhane,结果用x±s表示。
3 结果 3.1 CCK-8法检测化合物Q-1对MH7A细胞增殖-毒性影响结果如Tab 1所示,与空白组相比,MH7A细胞的存活率随着化合物Q-1浓度增加而明显降低,抑制率随着化合物Q-1浓度增加而明显升高(P < 0.05)。为确保化合物Q-1对细胞活力有抑制作用且无毒,选择100、50、25 mg·L-1浓度的化合物Q-1和5 μmol·L-1 MTX作为后续实验的浓度。
| Group | Cell viability/% | Cell inhibition/% | |
| Control | 100 | 0 | |
| Q-1 200 mg·L-1 | 65.73±3.95* | 52.56±9.29* | |
| Q-1 100 mg·L-1 | 73.28±6.31* | 37.28±11.93* | |
| Q-1 50 mg·L-1 | 81.84±7.09* | 22.91±11.07* | |
| Q-1 25 mg·L-1 | 88.02±3.84* | 13.75±4.85* | |
| MTX 5 μmol·L-1 | 82.07±7.81* | 22.72±11.46* | |
| *P < 0.05 vs control group | |||
如Tab 2、Fig 1所示,与空白组比较,各给药组的迁移细胞数明显减少,细胞迁移率明显下降(P < 0.01),提示化合物Q-1和MTX对MH7A的迁移能力有抑制作用。
| Group | Number of migration cells | Migration index/% |
| Control | 119±29.17 | 1.00 |
| MTX | 63±4.16* | 54.00±3.49*# |
| Q-1 100 mg·L-1 | 47±4.11* | 39.20±3.45* |
| Q-1 50 mg·L-1 | 64±25.39* | 53.67±21.29 |
| Q-1 25 mg·L-1 | 84±7.85*# | 70.02±6.56*# |
| *P < 0.05 vs control group; #P < 0.01 vs Q-1 100 mg·L-1 group | ||
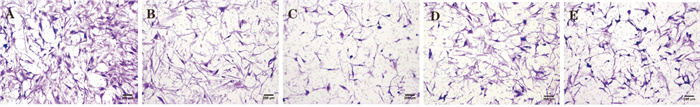
|
| Fig 1 Effect of compound Q-1 on migration of MH7A A. Control group B. MTX group C. Q-1 100 mg·L-1 group D. Q-1 50 mg·L-1 group E. Q-1 25 mg·L-1 group |
结果见Tab 3,与空白组相比,TNF-α组细胞上清液中的TNF-α、IL-6含量均升高(P < 0.01),说明炎症因子释放增加,造模成功;与TNF-α组相比,各给药组明显降低TNF-α、IL-6含量(P < 0.01),且呈浓度依赖性。
| Group | TNF-α /ng·L-1 | IL-6 /ng·L-1 |
| Control | 417.28±8.82 | 435.09±27.96 |
| TNF-α | 695.65±26.93* | 897.41±12.41* |
| TNF-α+MTX | 530.27±9.61*# | 340.97±5.50*# |
| TNF-α+Q-1/mg·L-1 | ||
| 100 | 467.49±2.10*#△ | 281.57±8.36*#△ |
| 50 | 470.69±22.54*#△ | 322.02±12.19*# |
| 25 | 537.59±19.26*# | 333.49±23.41*# |
| *P < 0.01 vs control group; #P < 0.01 vs TNF-α group; △P < 0.01 vs MTX group | ||
结果见Tab 4、Fig 2,经TNF-α诱导后,p65、p-p65、IκBα、p-IκBα蛋白表达均有所增加。给予药物干预后,以上蛋白表达均有所下降,其中MTX和25 mg·L-1的化合物Q-1可明显下调p-p65的表达(P < 0.05),100、50 mg·L-1的化合物Q-1可明显降低p65、p-p65、p-IκBα蛋白的表达(P < 0.05),但所有给药组对于IκBα蛋白的表达水平无明显影响(P > 0.05)。提示化合物Q-1主要通过抑制磷酸化后p65和IκBα蛋白表达,有效抑制NF-κB通路的异常激活,阻止炎症反应的发生。
| Group | p65 | p-p65 | IκBα | p-IκBα |
| Control | 1 | 1 | 1 | 1 |
| TNF-α | 1.40±0.27* | 1.21±0.21 | 1.40±0.16 | 1.20±0.06 |
| TNF-α+MTX | 1.11±0.14 | 0.73±0.11*# | 1.31±0.26 | 0.79±0.18 |
| TNF-α+Q-1/mg·L-1 | ||||
| 100 | 0.81±0.14# | 0.16±0.06*#△ | 0.85±0.50 | 0.59±0.13# |
| 50 | 0.97±0.34# | 0.40±0.18*#△ | 0.87±0.49 | 0.76±0.05*# |
| 25 | 1.04±0.22 | 0.48±0.20*#△ | 1.15±0.60 | 0.95±0.23 |
| *P < 0.05 vs control group; #P < 0.05 vs TNF-α group; △P < 0.05 vs MTX group | ||||
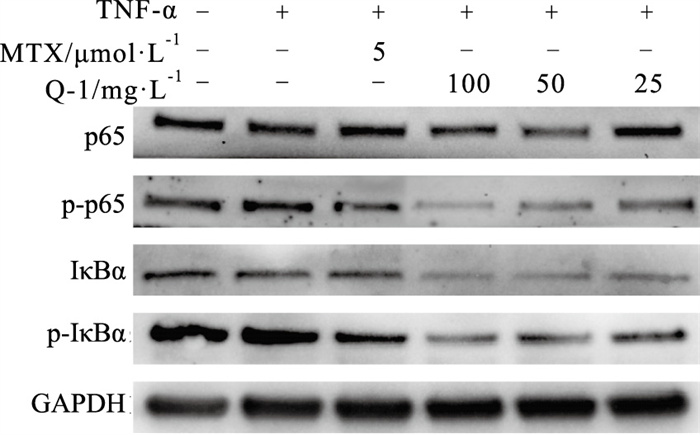
|
| Fig 2 Effect of compound Q-1 on protein expression levels of p65, p-p65, IκBα and p-IκBα in MH7A induced by TNF-α |
结果如Tab 5、Fig 3如示,在TNF-α的刺激下,p38、p-p38、ERK、p-ERK、JNK、p-JNK蛋白的表达均有所增加。各给药组可降低TNF-α诱导的MH7A细胞p38、p-p38蛋白表达水平(P < 0.05),对ERK、p-ERK、JNK、p-JNK蛋白表达水平影响不大(P > 0.05)。提示化合物Q-1可能主要对p38、p-p38蛋白表达起作用,从而抑制MAPK通路的激活,减轻MAPK通路介导的炎症反应。
| Group | p38 | p-p38 | ERK | p-ERK | JNK | p-JNK |
| Control | 1 | 1 | 1 | 1 | 1 | 1 |
| TNF-α | 1.18±0.12 | 1.40±0.31 | 2.14±0.52 | 1.25±0.28 | 2.12±0.99 | 1.08±0.14 |
| TNF-α+MTX | 0.67±0.11*# | 0.72±0.21 | 1.67±0.67 | 1.10±0.23 | 1.86±0.58 | 1.00±0.33 |
| TNF-α+Q-1/mg·L-1 | ||||||
| 100 | 0.50±0.21*# | 0.26±0.09*# | 1.48±1.26 | 0.81±0.36 | 1.68±0.79 | 0.99±0.19 |
| 50 | 0.74±0.18*# | 0.37±0.07*# | 1.56±0.64 | 1.17±0.29 | 1.90±0.63 | 1.14±0.24 |
| 25 | 0.92±0.12# | 0.56±0.23# | 1.67±1.00 | 1.24±0.18 | 1.91±1.28 | 1.01±0.28 |
| *P < 0.05 vs control group; #P < 0.05 vs TNF-α group | ||||||
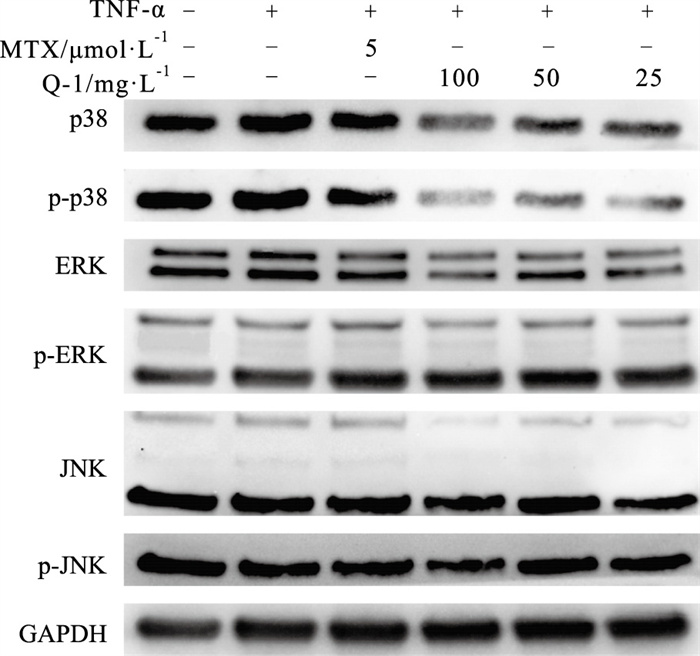
|
| Fig 3 Effect of compound Q-1 on protein expression levels of p38, p-p38, ERK, p-ERK, JNK, p-JNK in MH7A induced by TNF-α |
RA发病机制复杂,成纤维样滑膜细胞以及促炎细胞因子(TNF-α、IL-6等)在疾病进展中起着非常重要的作用,主要体现为促进RA免疫系统激活、滑膜炎和关节破坏。在促炎细胞因子刺激下,滑膜细胞异常增殖活化,并表现出肿瘤样行为,包括迁移、侵袭,是造成RA患者滑膜组织增生和关节被破坏的主要原因[7]。与此同时,成纤维样滑膜细胞可以分泌各种促炎细胞因子,反过来促进其增殖和释放炎症因子,让更多的免疫细胞进入炎症微环境,这样就会形成一种恶性循环,持续促进RA滑膜炎的发展进程,从而导致软骨损伤和关节破坏[8]。本研究表明,化合物Q-1可明显抑制MH7A细胞的增殖和迁移,减少TNF-α、IL-6的表达,控制RA滑膜炎症,减缓RA病程进展。
NF-κB信号通路炎症研究的经典通路之一,在RA病理过程中发挥重要作用,早已被大家重视并得到公认。NF-κB信号通路可以调控炎性细胞因子的表达,并在炎性细胞因子刺激下持续激活,从而介导炎症反应[3]。在正常情况下,NF-κB受到IκB家族蛋白的抑制,在受到细胞外信号刺激如TNF-α等刺激后,导致IκBα上游激酶如IKK的活化,激活的IKK可磷酸化IκBα,使其被泛素化降解,释放NF-κB进入细胞核启动转录,诱导促炎细胞因子的产生[9]。抑制NF-κB途径的主要效应单位NF-κB p65和IκBα可以减轻炎症反应,改善RA进程[10-11]。Western blot结果显示,化合物Q-1可显著下调由TNF-α引起的NF-κB p65、IκBα以及磷酸化的NF-κB p65、IκBα表达水平,表明化合物Q-1可能通过调控NF-κB信号通路的激活而阻止炎症介质的转录启动,从而发挥抗RA作用。
MAPK信号通路也是炎症信号转导通路之一,其中的经典三条途径是p38、JNK、ERK,可以调节成纤维样滑膜细胞的生长、凋亡和分化,在RA滑膜炎症和关节破坏至关重要[12-13]。MAPK途径经TNF-α刺激活化,引起通路上相关蛋白磷酸化而介导炎症反应[14]。本研究结果显示,化合物Q-1可下调由TNF-α引起的p38及其磷酸化p38的蛋白表达水平,但对JNK和ERK以及磷酸化的JNK和ERK的表达蛋白无明显影响,提示化合物Q-1主要通过调控p38、p-p38蛋白的表达而抑制MAPK信号通路激活,从而减少炎症的发生起到抗RA作用。
综上所述,化合物Q-1可能通过调控p65、IκBα介导的NF-κB信号通路和p38介导的MAPK信号通路,抑制MH7A细胞增殖、迁移,减少炎症因子TNF-α、IL-6的分泌从而减少炎症的发生,减轻RA的症状改善RA进程。
| [1] |
Alam J, Jantan I, Bukhari SNA. Rheumatoid arthritis: Recent advances on its etiology, role of cytokines and pharmacotherapy[J]. Biomed Pharmacother, 2017, 92: 615-33. |
| [2] |
O'Neil L J, Kaplan M J. Neutrophils in rheumatoid arthritis: Breaking immune tolerance and fueling disease[J]. Trends Mol Med, 2019, 25(3): 215-27. doi:10.1016/j.molmed.2018.12.008 |
| [3] |
贾成艳, 常艳, 魏伟. 成纤维样滑膜细胞能量代谢异常关键分子在类风湿关节炎中的研究进展[J]. 中国药理学通报, 2021, 37(1): 17-21. Jia C Y, Chang Y, Wei W. Study on energy metabolism of fibroblastoid synovial cells in rheumatoid arthritis[J]. Chin Pharm Bull, 2021, 37(1): 17-21. doi:10.3969/j.issn.1001-1978.2021.01.004 |
| [4] |
钱海兵, 李姝臻, 王祥培, 李媛. 一种具有抗炎作用的化合物及其制备方法和用途: 中国, 201410776865.7[P]. 2015-04-08. Qian H B, Li S Z, Wang X P, Li Y The invention relates to a compound with anti-inflammatory effect, a preparation method and application thereof : China, 201410776865.7[P]. 2015-04-08. |
| [5] |
李姝臻. 苗药铁筷子抗炎活性物质的筛选[D]. 贵阳: 贵阳中医学院, 2014. Li S Z. Screening of anti-inflammatory active substances of Miao medicine of iron chopsticks [D]. Guiyang: Guiyang College of Tradit Chin Med, 2014. |
| [6] |
李楠. 益母草碱对类风湿关节炎成纤维样滑膜细胞活化、迁移和侵袭的调控及其机制研究[D]. 广州: 广州中医药大学, 2017. Li N. Effects of mothermotherine on the activation, migration and invasion of fibroblast synovial cells in rheumatoid arthritis [D]. Guangzhou: Guangzhou Univ Chin Med, 2017. |
| [7] |
Ganesan R, Rasool M. Fibroblast-like synoviocytes-dependent effector molecules as a critical mediator for rheumatoid arthritis: Current status and future directions[J]. Int Rev Immunol, 2017, 36(1): 20-30. doi:10.1080/08830185.2016.1269175 |
| [8] |
Nygaard G, Firestein G S. Restoring synovial homeostasis in rheumatoid arthritis by targeting fibroblast-like synoviocytes[J]. Nat Rev Rheumatol, 2020, 16(6): 316-33. |
| [9] |
Lawrence T. The nuclear factor NF-kappaB pathway in inflammation[J]. Cold Spring Harb Perspect Biol, 2009, 1(6): a001651. |
| [10] |
Sun C L, Wei J, Bi L Q. Rutin attenuates oxidative stress and proinflammatory cytokine level in adjuvant induced rheumatoid arthritis via inhibition of NF-κB[J]. Pharmacology, 2017, 100(1-2): 40-9. doi:10.1159/000451027 |
| [11] |
Peng S, Hu C, Liu X, et al. Rhoifolin regulates oxidative stress and proinflammatory cytokine levels in Freund's adjuvant-induced rheumatoid arthritis via inhibition of NF-κB[J]. Braz J Med Biol Res, 2020, 53(6): e9489. |
| [12] |
de Launay D, van de Sande M G, de Hair M J, et al. Selective involvement of ERK and JNK mitogen-activated protein kinases in early rheumatoid arthritis (1987 ACR criteria compared to 2010 ACR/EULAR criteria): A prospective study aimed at identification of diagnostic and prognostic biomarkers as well as therapeutic targets[J]. Ann Rheum Dis, 2012, 71(3): 415-23. |
| [13] |
Luan L, Ma Y, Zhang L. HOXD10 silencing suppresses human fibroblast-like synoviocyte migration in rheumatoid arthritis via downregulation of the p38/JNK pathway[J]. Exp Ther Med, 2018, 16(3): 1621-8. |
| [14] |
Li Z Z, Tan J P, Wang L L, et al. Andrographolide benefits rheumatoid arthritis via inhibiting MAPK pathways[J]. Inflammation, 2017, 40(5): 1599-605. |

