


2. 广东药科大学中医药研究院,广东 广州 510006;
3. 广东药科大学新药开发中心,广东 广州 510006
 ,
HUANG Juan1,
ZOU Guo-fa1,
LI Kun-ping2,
FENG Yi-fan3,
MING Lu1,
GAO Zhen-hu1,
CHEN Yan-fen1
,
HUANG Juan1,
ZOU Guo-fa1,
LI Kun-ping2,
FENG Yi-fan3,
MING Lu1,
GAO Zhen-hu1,
CHEN Yan-fen1

2. Institute of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China;
3. The Center for Drug Research and Development, Guangdong Pharmaceutical University, Guangzhou 510006, China
高良姜是姜科植物高良姜(Alpinia officinarum Hance)的干燥根茎,产于中国东南部(广东、广西、海南),性热、味辛,温胃止呕、散寒止痛,临床常用于治疗脘腹冷痛、嗳气吞酸、胃寒呕吐等消化系统疾病。研究表明,高良姜具有明显的镇痛作用,除了胃痛腹痛,对原发性痛经等疼痛也具有显著疗效[1-2]。尽管在体内研究中已经证实了高良姜的镇痛作用,但其潜在的镇痛作用的分子机制仍不清楚。瞬时受体电位通道蛋白1(TRPA1)是瞬时受体电位(transient receptor potential,TRP)超家族的一员,是一种对钙离子具有高通透性的非选择性阳离子通道,通常在小直径的初级传入神经纤维中表达,与感知外界伤害性刺激相关,可被各种外源性刺激物激活,如有害的低温、芥子油中的异硫氰酸烯丙酯、过氧化氢和不饱和醛等内源性反应物质[3]。研究表明[4],TRPA1通过感觉神经激活参与痛觉和炎性疼痛的感知,TRPA1通道的激活可增加细胞内Ca2+浓度,最终导致伤害性或伤害性反应。因此,以TRPA1为目标蛋白成为开发新型镇痛药的研究热点。在前期研究中,我们采用脂质体转染法构建了稳定表达TRPA1通道的HEK-293T细胞系[5]。本研究采用TRPA1-HEK293T细胞模型,体外研究高良姜是否对TRPA1表达具有调节作用,以期阐述中药高良姜温中止痛的作用机制。
1 材料与方法 1.1 材料与试剂 1.1.1 细胞株人胚肾(HEK-293T)细胞,采用脂质体转染法将TRPA1真核表达质粒转入HEK-293T细胞中,构建稳定表达TRPA1通道的TRPA1-HEK293T细胞株。由本实验室传代培养保存。
1.1.2 实验动物SPF级SD大鼠,♀♂各半,体质量(200 ± 20)g,合格证号SCXK(粤):2013-0034,购自广东省医学实验动物中心,饲养于广东药科大学动物房,饲养条件为恒温(24 ± 2)℃,相对湿度50%-70%。
1.1.3 药物与试剂高良姜饮片(康美药业股份有限公司,批号:160202851);高良姜黄酮部位、二苯基庚烷部位、挥发油部位由本实验室自制[6];DMEM培养基(美国Hyclon公司);总RNA提取试剂TRIzol(Invitrogen公司);GoScriptTM Reverse Transcription试剂盒(Invitrogen公司);兔多克隆抗体TRPA1(Abcam公司);二抗(羊抗兔)HRP标记(JACKSOM);兔多克隆抗体β-actin(万类生物科技有限公司);cAMP ELISA试剂盒(美国R & D公司);EnlightTM Western特异发光检测试剂盒(北京英格恩生物科技有限公司);色谱甲醇(瑞典欧普森公司);色谱乙腈(瑞典欧普森公司);高良姜素(成都曼思特生物科技有限公司);高良姜二芳基庚烷A参照化合物由广东药科大学新药开发中心自制,化学结构式为1-苯基-7- (3′-甲氧基-4′-羟基) 苯基-5-醇-3-庚酮,按HPLC面积归一化法计,质量分数不低于98.0%[7]。
1.1.4 主要仪器T100TM PCR仪(伯乐生命医学产品新加坡有限公司);TOCAN领成全自动凝胶成像系统(上海领成生物技术有限公司);ELX800全自动酶标仪(Biotek Instruments公司);激光扫描共聚焦显微镜(日本Olympus公司);LC-20AT高效液相色谱仪(日本岛津)。
1.2 实验方法 1.2.1 细胞培养TRPA1-HEK293T细胞经复苏后,使用10%胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素的高糖DMEM培养基,在含有95%湿度和5% CO2细胞培养箱中以37 ℃恒温培养,取处于对数生长期细胞用于实验。
1.2.2 含药血清的制备称取高良姜500 g,加水淹没中药浸泡30 min;煎煮至水沸改用温火,30 min后倾出药液,双层纱布滤过,重复共煎煮两次,合并两次滤液。水浴90 ℃,浓缩至500 mL,得生药含量为1 mg·L-1高良姜水煎液。SD大鼠随机分为高良姜给药组和空白对照组,禁食12 h,给药组以10 mL·kg-1灌胃体积给药,空白组给予同等剂量的蒸馏水,每日1次,连续7 d。末次给药1 h后,乙醚麻醉,眼眶采血,4 ℃离心,得空白血清和高良姜含药血清,56 ℃水浴30 min灭活,微孔滤膜过滤,保存于-20 ℃冰箱备用。
1.2.3 MTT法检测高良姜含药血清对TRPA1-HEK293T细胞增殖的影响待细胞长至对数生长期时,0.25%胰酶-EDTA常规消化,1 000 r·min-1离心5 min,收集细胞,细胞计数,完全培养基调整细胞密度为7.5×108个·L-1,96孔培养板内每孔加入180 μL细胞悬液。于37 ℃、5% CO2饱和湿度培养箱中培养12 h-18 h,待细胞贴壁后,将平板中培养液吸去,每孔加入空白血清或各浓度(20%、15%、10%、5%、2.5%)含药血清,每个浓度设置4个平行孔,继续培养36 h。每孔加入20 μL 5 g·L-1 MTT液,继续培养4 h后,终止培养,将孔内的液体小心吸走,每孔加入150 μL DMSO,振荡10 min,至结晶全部溶解,酶标仪于波长490 nm测定每孔的OD值,计算各给药浓度下细胞的相对活性。计算公式:细胞的相对活性/%=(各浓度实验组平均OD值/各浓度对照组平均OD值)×100%。
1.2.4 RT-PCR法检测TRPA1 mRNA的表达6孔培养板内培养细胞,分组给予不同处理,继续培养36 h后收集细胞。使用TRIzol试剂提取细胞总RNA后,按逆转录PCR(RT-PCR)试剂盒说明书扩增目的基因,PCR扩增条件为:94 ℃预变性3 min,98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸5 min,共循环35次。以β-actin为内参,引物如下:TRPA1,F: 5′-AACCGCTAGAGCTCCTCAA-3′,R: 5′-GAGGAATAAGGGCAACACGA-3′,399 bp;β-actin,F: 5′-GACCCAGATCATGTTTGGACAC-3′,R: 5′-GCAGTAATCTCCTTCTGCATCC-3′,600 bp。将DNA样品8 μL与样品缓冲液2 μL混合,加入凝胶点样孔,120 V下1 %琼脂糖凝胶电泳30 min,凝胶成像分析系统拍照分析,测定电泳条带光密度值,计算TRPA1和β-actin光密度比值相对值作为半定量指标。
1.2.5 Western blot法检测TRPA1蛋白的表达6孔培养板内培养细胞,分组给予不同处理,继续培养36 h后收集细胞。提取各组细胞总蛋白,用BCA蛋白检测试剂盒定量,进行SDS-PAGE电泳,电转到NC膜上,剪取目的蛋白条带,并在室温下用含有5%脱脂乳的封闭缓冲液封闭2 h。用抗TRPA1(1:250)和兔抗人β-actin(1 ∶1 000)的一抗在4 ℃孵育过夜,然后用HRP连接的山羊抗兔IgG和山羊抗鼠IgG二抗在室温下孵育1 h。用化学发光Ecl法检测目的蛋白,并用Image J进行图像分析。
1.2.6 ELISA法检测细胞cAMP浓度分别为用5%、10%、15% 3个浓度的高良姜含药血清和空白血清组,每孔设3个复孔,继续培养36 h。弃培养基,常规消化,收集细胞沉淀,重悬,破碎细胞,4 ℃ 600×g离心10 min,吸取上清。根据cAMP ELISA试剂盒说明,检测HEK293T-TRPA1细胞cAMP水平,检测波长为450 nm。
1.2.7 激光共聚焦显微镜检测细胞内Ca2+浓度实验分为空白含药血清组、15%高良姜含药血清组、10%高良姜含药血清组和5%高良姜含药血清组,每组细胞培养于激光共聚焦显微镜专用培养皿中,细胞贴壁后,每组分别给药处理36 h,D-Hanks溶液冲洗3次,终浓度10 μmol·L-1的Fluo-3/AM、0.1% F-127的D-Hanks溶液37 ℃避光负载30 min,D-Hanks溶液冲洗3次,洗去多余的染料。直接取各组细胞皿置激光共聚焦显微镜的载物台上,以488 nm的氩激光激发Fluo-3产生绿色荧光,观察各皿中细胞的形态、细胞中Ca2+的荧光强度及分布变化。采集图像,并采用FV10-ASW1.7图像分析软件分析计算平均荧光强度。
1.2.8 HPLC法分析高良姜含药血清成分 1.2.8.1 对照品溶液的制备精密称量高良姜素对照品和二芳基庚烷A对照品10 mg,分别置于25 mL棕色量瓶中,色谱甲醇溶解稀释至刻度,摇匀,即得标准品溶液(含高良姜素0.4 g·L-1,含二芳基庚烷A 0.4 g·L-1)。
1.2.8.2 血清样品的处理将空白组和高良姜给药组的大鼠血清分别混合,混匀后各精密吸取0.5 mL,加入0.75 mL色谱纯乙腈,在涡旋混合器上振荡2 min使充分混合,10 000 r·min-1的速度离心15 min,取上清液置于2 mL EP管中,用氮气浓缩吹干后加入120 μL色谱甲醇充分溶解,10 000 r·min-1的速度离心5 min,吸取上清液0.45 μm微孔滤膜过滤,待测。
1.2.8.3 色谱条件色谱柱:Inertsil® ODS-3柱(250 mm × 4.6 mm,5 μm),柱温为30 ℃,流动相:A液为乙腈,B液为0.2%磷酸水溶液。等度洗脱程序: 0-20 min,50% 乙腈,体积流量:1 mL·min-1。检测波长为220 nm,进样量为10 μL。
1.3 统计学分析采用SPSS 13.0软件包进行统计分析,所有数据采用平均值±标准差(x±s)表示,统计方法主要采用单因素方差分析(ANOVA)。
2 结果 2.1 高良姜含药血清对TRPA1-HEK293T细胞增殖的影响MTT结果显示高良姜各浓度含药血清(20%,15%,10%,5%,2.5%)的OD值和同浓度的空白血清组比较均无明显差异,计算细胞相对活性百分率分别为0.987,1.038,1.071,1.161,1.111。显微镜下观察各组细胞状态良好,细胞贴壁生长,细胞形态成梭形,排列紧密,细胞透明,折光性好,界限清晰(Fig 1)。参考实验室既往研究经验,后续选择15%、10%、5% 3种血清浓度作为受试含药血清浓度。见Fig 1。

|
| Fig 1 Effect of A. officinarum medicated serum on growth of TRPA1-HEK293T cells in vitro A: OD value(x±s, n=4); B: Morphological changes (400×). |
RT-PCR结果显示(Fig 2A),与空白血清组比较,15%高良姜组、10%高良姜组、5%高良姜组TRPA1 mRNA表达均下降,其中10%高良姜组、15%高良姜组TRPA1 mRNA表达差异有显著性(P<0.05),5%高良姜组差异不明显。结果提示高良姜能够在体外下调TRPA1-HEK293T细胞的TRPA1 mRNA的表达。
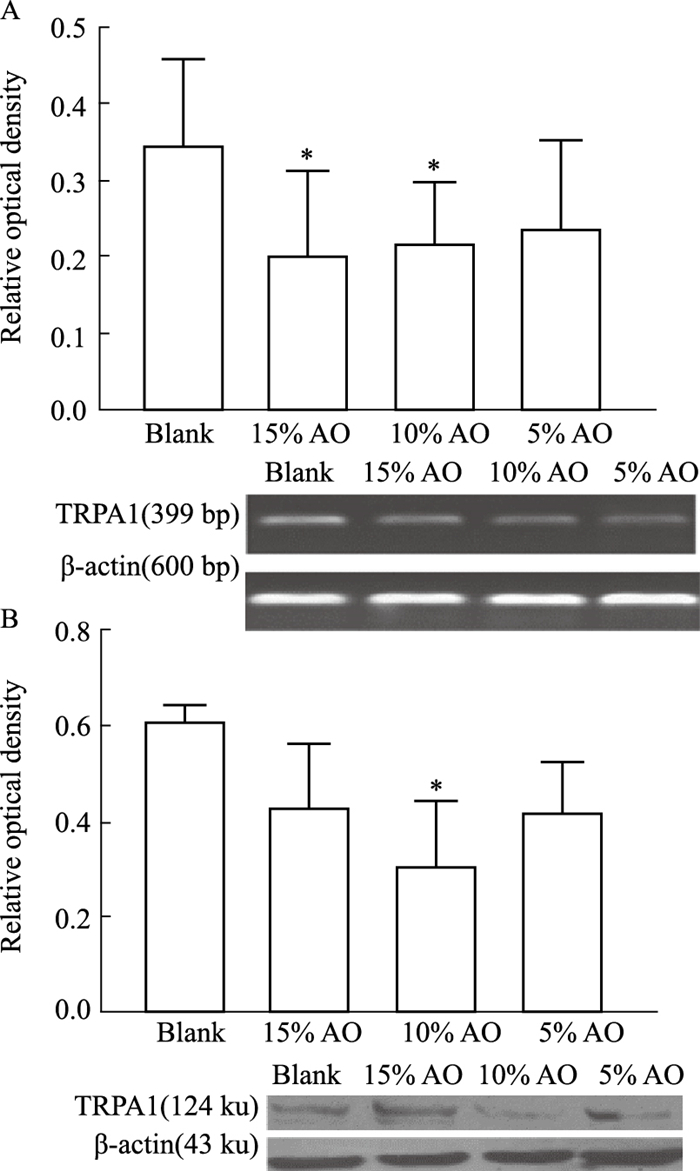
|
| Fig 2 Effect of A. officinarum serum on expression of TRPA1 mRNA and protein(x±s, n=3) A: The expression of TRPA1 mRNA; B: The expression of TRPA1 protein. *P < 0.05 vs the blank serum group |
如Fig 2B所示,与空白血清组比较,15%高良姜组、10%高良姜组、5%高良姜组TRPA1蛋白表达下降,尤其以10%高良姜组TRPA1蛋白表达下降明显(P<0.05),5%、15%高良姜组则差异不明显。
2.4 高良姜含药血清对cAMP含量的影响根据标准品测定结果绘制标准曲线图,曲线方程为Y = 1/(0.0824X+3.596),R2=0.9944,将受试样品的OD值代入标准曲线方程式计算出各样品的cAMP浓度(Fig 3A)。结果显示,与空白血清组比较,15%高良姜组、10%高良姜组、5%高良姜组细胞内cAMP含量均有增高,其中15%高良姜组和10 %高良姜组差异有显著性(P<0.05),5%高良姜组差异不明显。结果表明,高良姜能够提高HEK293T-TRPA1细胞内cAMP浓度。
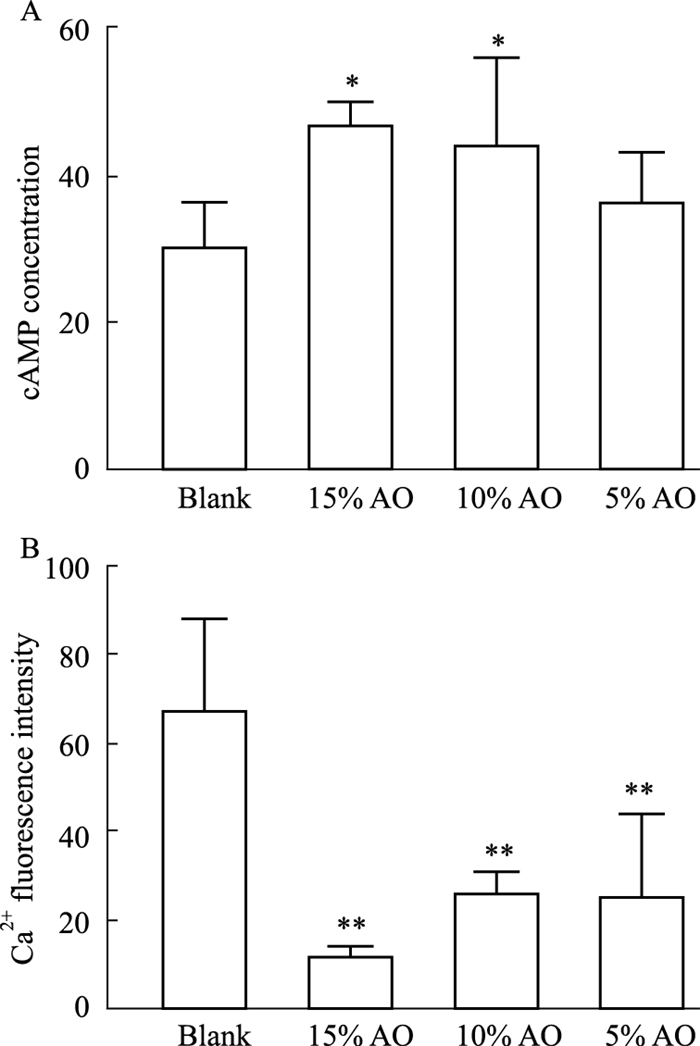
|
| Fig 3 Effect of A. officinarum serum on concentration of cAMP (A) and Ca2+ (B) (x±s, n=3) **P < 0.01 vs blank group |
Fluo-3/AM进入细胞后,酯基被水解掉,Fluo-3与细胞内Ca2+的结合,在特定激发波长的作用下发出绿色荧光,其荧光强度反映细胞内Ca2+浓度。与空白血清组相比较,15%、10%、5%高良姜组均明显降低细胞内Ca2+浓度(P<0.01),提示高良姜可能通过调控TRPA1通道,从而阻断Ca2+的内流(Fig 3B)。
2.6 高良姜有效部位对TRPA1 mRNA表达的影响以2%乙醇作为有效部位的溶剂,故对照组为2%乙醇。分别以2%乙醇、高良姜黄酮部位组(20、10、5 mg·L-1)和二芳基庚烷部位(40、20、10 mg·L-1)给药处理HEK293T-TRPA1细胞36 h。RT-PCR结果表明,与对照组相比,黄酮类和二芳基庚烷类呈现抑制TRPA1 mRNA表达的趋势,其中黄酮类20 mg·L-1和二芳基庚烷类40 mg·L-1具有显著的抑制作用(Fig 4),提示高良姜调节TRPA1信号通路的主要物质基础可能是黄酮类和二芳基庚烷类成分。
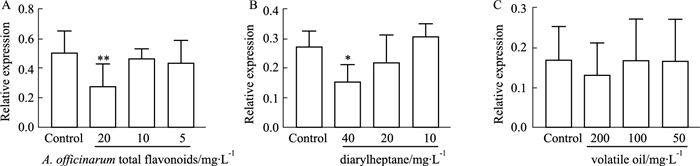
|
| Fig 4 The inhibitory effect of A. officinarum total flavonoids (A), diarylheptane (B) and volatile oil (C) on expression of TRPAl mRNA (x±s, n=3) *P < 0.05, **P < 0.01 vs control group |
精密吸取高良姜素和二芳基庚烷A对照品溶液及空白组和高良姜给药组血清供试液10 μL,注入液相色谱仪,进行HPLC分析。高良姜素和二芳基庚烷A、高良姜提取液、空白血清、含药血清、含药血清加标准品HPLC图谱见Fig 5。高良姜二芳基庚烷A和高良姜素分别在11.053 min和15.052 min出峰。对比Fig 5B和Fig 5C,空白血清在11.053 min和15.052 min两处基线较为平稳,无色谱峰出现,高良姜含药血清则在两处均有色谱峰出现。此情况下,在高良姜含药血清中加入适量高良姜素和高良姜二芳基庚烷A标准品溶液进样得到Fig 5E,相较于高良姜含药血清图谱,11.053 min和15.052 min两处色谱峰峰高均有增长,可推断高良姜素和二芳基庚烷A为高良姜药材的入血成分。
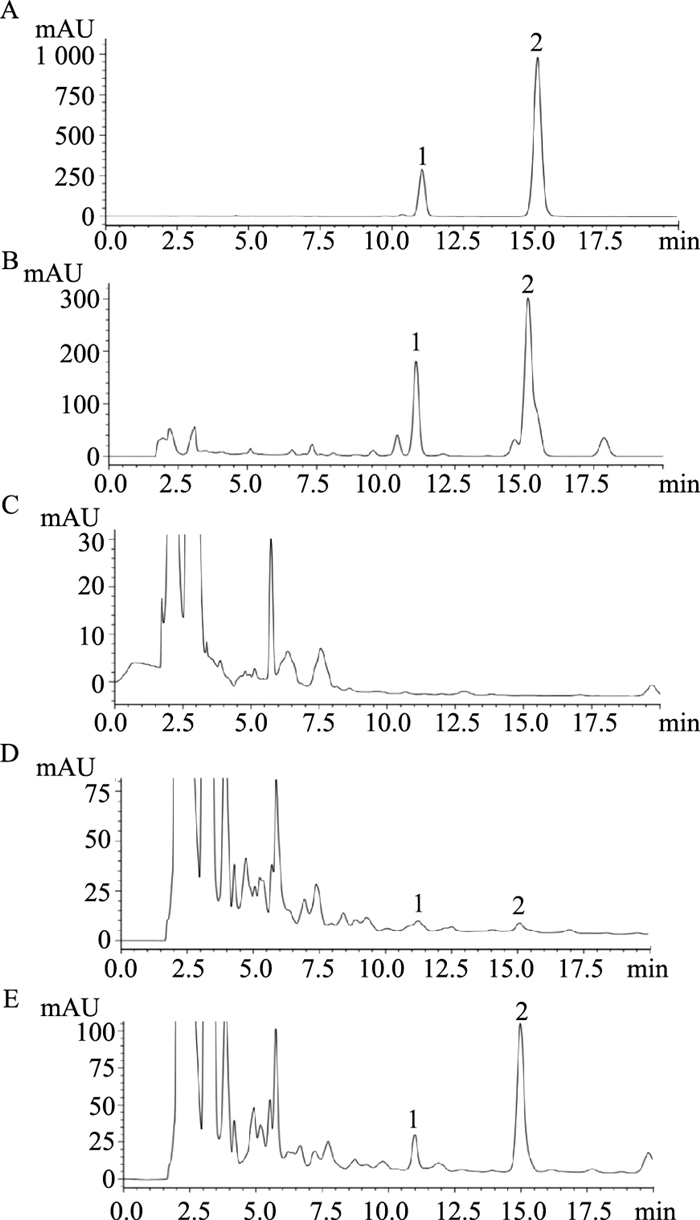
|
| Fig 5 Representative chromatogram by HPLC A: Diarylheptane A and galangin standard; B: Alpinia officinarum extract; C: Blank serum; D: A. officinarum medicated serum; E: A. officinalis serum add double standard. Retention time of diarylheptane A and galangin was 11.053 min (1) and 15.052 min (2) respectively |
血清药理学最初由Tashino于1984年命名[8],是指给动物口服药物或药物的混合物,在一定时间后采集血液分离血清,然后使用含药血清进行药物或药物复方作用的体外实验研究[9]。该方法更适合中药的体外研究,首先,避免了原料药所含杂质对结果的干扰[10];其次,药物通过口服途径进入动物体内,经过吸收和代谢等一系列生物转化过程,机体血清中所含的药物成分可能为体内直接作用物质[11]。近年研究表明,在中药药理体外实验中,含药血清模拟了体内的药物状态,通过高效液相色谱法指认含药血清中的药源性成分[12-14],血清药理学与血清药化学研究相结合,对于研究中药药效物质基础具有重要意义,为阐明中药药理作用机制提供实验基础[15]。
TRPA1是瞬时受体电位离子通道家族中的一员,被认为是一种冷刺激的感受器,可被各种外源性刺激物,特别是有害的低温激活。同时,TRPA1在痛觉产生及痛觉敏感性增强的病理过程中也发挥重要作用,目前是抗炎和镇痛治疗的主要靶点[16]。“寒者热之,热者寒之”,中药高良姜作为一种常用的温里药,临床主要用于脘腹冷痛、嗳气吞酸、呕吐泄泻等里寒证的治疗,课题组的动物实验也表明高良姜具有明显的温中止痛作用。为了体外研究高良姜对TRPA1信号通路的影响,本实验室在前期构建了稳定表达TRPA1通道的HEK-293T细胞模型[5]。因此,本研究主要基于冷觉和痛觉感受器TRPA1与中药寒热药性理论的联系,探究高良姜体外对TRPA1信号通路的影响,揭示高良姜温中止痛的分子作用机制。
首先,高良姜含药血清的RT-PCR结果表明,与空白血清组相比,15%高良姜含药血清组、10%高良姜含药血清组TRPA1 mRNA表达明显下降(P<0.05);蛋白表达结果表明,与空白血清组比较,10%高良姜含药血清组的TRPA1蛋白表达明显下降(P<0.05),提示温里药高良姜可能通过下调冷觉感受蛋白TRPA1的表达而发挥温中散寒作用。其次,我们探讨了高良姜对细胞内Ca2+浓度及cAMP浓度的影响。Ca2+作为机体内的第二信使,参与神经递质释放、肌肉(包括骨骼肌、平滑肌)收缩、激素分泌、以及细胞的分化、凋亡和死亡等过程。研究显示,TRPA1通道可以被伤害性冷刺激(< 17 ℃)激活,激活后以Ca2+进入的方式将冷觉信息传入中枢或引起外周肌肉痉挛收缩疼痛。本研究结果显示,与空白血清组相比较,15%高良姜组、10%高良姜组、5%高良姜组均能明显降低细胞内Ca2+浓度(P<0.01),提示高良姜可能通过调控TRPA1通道而阻断Ca2+内流。环磷酸腺苷(cAMP)是机体内另一个重要的第二信使,参与和调节机体神经递质传递、基因表达、激素调节、免疫反应以及细胞增殖和分化等生理及病理作用[17]。同时,cAMP被认为是与中医的阴阳(寒热)密切相关的细胞内第二信使,在虚寒状态下,cAMP含量降低,虚热状态下,cAMP含量升高,常常以cAMP作为阐释温里药温热药性本质的重要指标之一。高良姜含药血清的ELISA结果表明,与空白血清组比较,15%高良姜组、10%高良姜组、5%高良姜组细胞内cAMP含量均增高,其中15%高良姜组和10%高良姜组差异有显著性(P<0.05),提示高良姜的温中散寒作用也与调控细胞内cAMP浓度有关。
化学研究表明,高良姜的主要化学成分是黄酮类、二芳基庚烷类、挥发油类等[18]。本研究还初步探讨了高良姜3类主要成分对TRPA1 mRNA表达的影响,结果发现黄酮类和二芳基庚烷类对高良姜TRPA1 mRNA表达具有抑制趋势。在本实验室的前期研究中发现,高良姜黄酮部位和二芳基庚烷部位是高良姜治疗脾胃寒证相关疾病的主要有效部位,其中胃肠解痉作用以黄酮类较强,镇痛作用以二芳基庚烷部位更强[6]。为了进一步确定高良姜调节TRPA1信号通路的物质基础,采用高效液相色谱法对高良姜的入血成分进行了化学分析。结果表明,高良姜素和二芳基庚烷A是高良姜的主要入血成分。
综上所述,高良姜作为一种温里药,温中散寒止痛是其最重要的功效之一,体外实验表明其温中止痛作用机制可能与调控TRPA1信号通路,从而阻断Ca2+内流,调节细胞内cAMP浓度等有关,其对TRPA1离子通道的具体调控机制及物质基础值得进一步探讨。
| [1] |
Verma R K, Mishra G, Singh P, et al. Anti-diabetic activity of methanolic extract of Alpinia galanga Linn. aerial parts in streptozotocin induced diabetic rats[J]. Ayu, 2015, 36(1): 91-5. doi:10.4103/0974-8520.169006 |
| [2] |
Huang L, Zhang J Q, Li Y B, et al. Effect of Alpinia officinarum Hance alcohol extracts on primary dysmenorrheal[J]. Asian Pac J Trop Med, 2016, 9(9): 882. doi:10.1016/j.apjtm.2016.07.012 |
| [3] |
Pinheiro Fde V, Villarinho J G, Silva C R, et al. The involvement of the TRPA1 receptor in a mouse model of sympathetically maintained neuropathic pain[J]. Eur J Pharmacol, 2015, 747: 105-13. doi:10.1016/j.ejphar.2014.11.039 |
| [4] |
Nalli M, Ortar G, Moriello A S, et al. TRPA1 channels as targets for resveratrol and related stilbenoids[J]. Bioorg Med Chem Lett, 2016, 26(3): 899-902. doi:10.1016/j.bmcl.2015.12.065 |
| [5] |
黄娟, 明露, 陈艳芬, 等. 稳定表达TRPA1通道的HEK-293T细胞模型的建立[J]. 中国药理学通报, 2019, 35(3): 440-3. Huang J, Ming L, Chen Y F, et al. Establishment of HEK-293T cell model stably expressing TRPA1 channel[J]. Chin Pharmacol Bull, 2019, 35(3): 440-3. doi:10.3969/j.issn.1001-1978.2019.03.028 |
| [6] |
桂蓓, 高振虎, 贾真, 等. 高良姜不同部位胃肠解痉及镇痛作用的比较研究[J]. 中药新药与临床药理, 2021, 32(2): 158-64. Gui B, Gao Z H, Jia Z, et al. Comparative study on gastrointestinal spasmolysis and analgesic effects of different extracts from Alpinia officinarum[J]. Tradit Chin Drug Res Clin Pharmacol, 2021, 32(2): 158-64. |
| [7] |
崔维利, 冯毅凡, 郭晓玲, 孟青. 高良姜中二苯基庚烷A的含量测定及指纹图谱研究[J]. 广东药学院学报, 2007, 23(6): 635-7, 60. Cui W L, Feng Y F, Guo X L, Meng Q. Contents and fingerprints of diphenylheptane A in Rhizoma Alpiniae Officinarum[J]. J Guangdong Coll Pharm, 2007, 23(6): 635-7, 60. |
| [8] |
Jia D, Chen X, Cao Y, et al. On-line comprehensive two-dimensional HepG2 cell membrane chromatographic analysis system for charactering anti-hepatoma components from rat serum after oral administration of Radix scutellariae: A strategy for rapid screening active compounds in vivo[J]. J Pharm Biomed Anal, 2016, 118: 27-33. doi:10.1016/j.jpba.2015.10.013 |
| [9] |
Zhang Y H, Liu J T, Wen B Y, Liu N. Mechanisms of inhibiting proliferation of vascular smooth muscle cells by serum of rats treated with Dahuang Zhechong pill[J]. J Ethnopharmacol, 2009, 124(1): 125-9. doi:10.1016/j.jep.2009.04.012 |
| [10] |
Sun J, Bi Y, Guo L, et al. Buyang Huanwu Decoction promotes growth and differentiation of neural progenitor cells: Using a serum pharmacological method[J]. J Ethnopharmacol, 2007, 113(2): 199-203. doi:10.1016/j.jep.2007.05.018 |
| [11] |
朱春胜, 姜卓希, 李佳静, 张冰. 中药血清谱效学研究现状概述[J]. 中草药, 2020, 51(13): 3569-74. Zhu C S, Jiang Z X, Li J J, Zhang B. Overview research status in serum spectrum-effect of Chinese materia medica[J]. Chin Tradit Herb Drugs, 2020, 51(13): 3569-74. doi:10.7501/j.issn.0253-2670.2020.13.027 |
| [12] |
窦志华, 许波, 施忠, 等. 大黄蒽醌类成分肝肾毒性和效应物质研究[J]. 中国临床药理学杂志, 2018, 34(10): 1214-7. Dou Z H, Xu B, Shi Z, et al. Study on the liver and kidney toxicity and effective substances of rhubarb anthraquinone[J]. Chin J Clin Pharmacol, 2018, 34(10): 1214-7. |
| [13] |
Yin Y, Feng L, Wang L, Ding L. The role of curcumae rhizoma-sparganii rhizoma medicated serum in epithelial-mesenchymal transition in the triple negative breast cancer : Pharmacological role of CR-SR in the TBNC[J]. Biomed Pharmacother, 2018, 99: 340-5. doi:10.1016/j.biopha.2017.11.139 |
| [14] |
Yin D, Liu Z, Peng D, et al. Serum containing Tao-Hong-Si-Wu decoction induces human endothelial cell VEGF production via PI3K/Akt-eNOS signaling[J]. Evid Based Complement Alternat Med, 2013, 2013: 195158. |
| [15] |
国锦, 高燕, 赵渤年. 中药复方血清药理学研究方法进展[J]. 中华中医药杂志, 2017, 32(4): 1656-8. Guo J, Gao Y, Zhao B N. Progress of research methods of traditional Chinese medicine compound serum pharmacology[J]. Chin J Tradit Chin Med Pharm, 2017, 32(4): 1656-8. |
| [16] |
Meents J E, Ciotu C I, Fischer M J M. TRPA1: A molecular view[J]. J Neurophysiol, 2019, 121(2): 427-43. doi:10.1152/jn.00524.2018 |
| [17] |
Omori K, Kotera J. Overview of PDEs and their regulation[J]. Circ Res, 2007, 100(3): 309-27. doi:10.1161/01.RES.0000256354.95791.f1 |
| [18] |
魏晴, 魏娜. 高良姜的化学成分及细胞毒活性研究[J]. 安徽农业科学, 2020, 48(21): 179-82. Wei Q, Wei N. Study on the chemical constituents and cytotoxic activity of Alpinia officinarum Hance[J]. J Anhui Agric Sci, 2020, 48(21): 179-82. doi:10.3969/j.issn.0517-6611.2020.21.049 |