


2. 延边大学附属医院耳鼻喉科,吉林 延吉 133002;
3. 延边大学医学院解剖教研室,吉林 延吉 133002
金永德(1964-),男,博士,博士生导师,研究方向:过敏性鼻炎,通信作者,E-mail: jyd0091@126.com
 ,
YU Yang1,2,
JIN Hai-nan1,2,
SONG Yi-lan1,3,
LIU Si-qi1,2,
ZHANG Ya-lin1,2,
YAN Guang-hai1,3
,
YU Yang1,2,
JIN Hai-nan1,2,
SONG Yi-lan1,3,
LIU Si-qi1,2,
ZHANG Ya-lin1,2,
YAN Guang-hai1,3
 ,
JIN Yong-de1,2
,
JIN Yong-de1,2

2. Department of Otolaryngology, Affiliated Hospital of Yanbian University, Yanji Jilin 133002;
3. Department of Anatomy, Yanbian University School of Medicine; Yanji Jilin 133002
慢性鼻窦炎(Chronic rhinosinusitis,CRS)是一种鼻窦部常见的慢性炎症性疾病,其全球患病率逐年增高约为5%-16%[1]。CRS目前根据不同的组织重塑模式分为带鼻息肉的CRSwNP(CRS with nasal polyps)和没有鼻息肉的CRSsNP(CRS without nasal polyps)[2]。CRSwNP的典型特征是细胞外基质(ECM)过度降解,存在白蛋白形成和水肿形成,而CRSsNP的定义为过度的胞外基质沉积和纤维化形成。除此之外,CRswNP和CRSsNP还具有明显的免疫病理学特征差异。有研究表明,来自欧洲的CRSwNP患者的病理学特征是Th2偏斜型嗜酸性炎症模式。而Zhang等[3]研究发现,来自中国南方的CRSwNP患者表现出Th1/Th17细胞型并伴轻度嗜酸性炎症模式。Cao等[4]也同样对中国嗜酸性CRswNPs的患者进行研究,发现其表现出Th2/Th17细胞型炎症反应。因此,进一步了解IL-17在CRS中的作用将对探讨该疾病的发病机制具有重要意义。
IL-17A,通常被称为IL-17,是IL-17家族成员中首个被发现且为目前最为广泛研究的。它与许多自身免疫及炎性疾病相关,如类风湿性关节炎、过敏性鼻炎、急性肝损伤、牙周炎等[5-6]。IL-17A被报道刺激人腹膜间皮细胞上调α-SMA的表达,参与胃癌腹膜播散过程中的肿瘤纤维化[7]。有研究表明IL-17A能够通过激活NF-κB信号通路上调MMP-9的表达[8]。另有报道指出IL-17参与自身免疫性脱髓鞘病中Act1介导的炎症基因表达,从而促进Th17细胞介导的发病机制[9]。NF-κB激活蛋白1(Act1)是一种E3泛素连接酶,其下游有许多底物,肿瘤坏死因子受体相关因子6(Traf6)为其中之一。Feng等[10]研究发现抑制Traf6能够调控NF-κB信号缓解广州管圆线虫引起的嗜酸性脑膜炎。以上表明Act1与Traf6结合后可能参与对NF-κB信号通路的调控。尽管已有研究表明IL-17A在CRS中高度表达[8],但IL-17A在CRSwNP的重塑中发挥着怎样作用及其机制尚不清楚。本研究的目的是探讨IL-17A在CRSwNP中的临床意义,并确定其在调节组织重塑中可能发挥的分子机制。
1 材料与方法 1.1 动物模型的制备所有动物实验均经我校动物保健与使用委员会批准,实验动物使用许可证号SYXK(吉)2020-0009。SPF级7周龄BALB/c♂小鼠32只,每组8只共4组:分别为对照组(Control)、C+anti-IL-17A组(IL-17A中和抗体0.05 mg·kg-1)、HDM组(模型组)、H+anti-IL-17A组(HDM+IL-17A中和抗体0.05 mg·kg-1)。HDM组和H+anti-IL-17A组小鼠于d 1、d 5皮下注射1 g·L-1 HDM 100 μL致敏,于d 12开始连续7 d以0.5 g·L-1 HDM 40 μL滴鼻操作,此后每周3次连续3个月滴鼻操作,于第2个月每周附加3次金黄色葡萄球菌肠毒素B(SEB)10 ng滴鼻操作,对照组均予以等量PBS代替。而C+anti-IL-17A组和H+anti-IL-17A组从第5周开始每周3次额外予以IL-17A中和抗体0.05 mg·kg-1。d 104处死小鼠,提取出小鼠鼻息肉及下鼻甲黏膜组织备用。
1.2 人鼻粘膜上皮细胞的培养人鼻粘膜上皮细胞(HNEpCs)购自于丰晖生物(湖南),置于盛有1640(Thermo)和10%FBS(Biowest)的培养皿、37℃ 5%二氧化碳培养箱中培养。
1.3 ELISA根据ELISA试剂盒说明书的步骤,依次检测小鼠鼻粘膜组织中IL-4、IL-17A的含量,并通过标准曲线计算其浓度。
1.4 组织化学染色对烤好的片子进行脱蜡、脱水,再予以抗体修复液中修复半小时,然后用IL-17A一抗和相对应的二抗进行孵育。DAB显色、苏木精复染并封片。并于显微镜下观察,Cytantion5微孔成像仪进行拍片。
1.5 HE染色取出的小鼠鼻腔黏膜组织固定好,包埋后进行贴片、烤片、脱蜡、水洗、脱水后予以苏木精和伊红染色,再次脱水后封片,并于显微镜下观察,Cytantion5微孔成像仪进行拍片。
1.6 Western blot将组织蛋白裂解或细胞蛋白收集后测定其样品蛋白浓度。配好的电泳胶上每个泳道加等量的蛋白开始电泳。将分离后的蛋白转到pvdf膜上,封闭后加入稀释的一抗(MMP-9、VEGF、Act1、Traf6、p65、p-IκBα、IκBα、β-actin) 4 ℃过夜。洗膜,相应二抗再孵育2 h。再次洗膜后加入发光剂,利用AI 600凝胶成像仪采集图像。
1.7 统计学分析使用GraphPad Prism 9.1.2进行数据分析与作图,所有数据均采用x±s表示,组间对比使用t检验。
2 结果 2.1 CRSwNP小鼠Th2/Th17表达变化为证明CRSwNP小鼠中Th2/Th17的平衡关系,我们通过ELISA法检测不同分组小鼠对应组织中IL-4和IL-17A的表达。结果表明,与对照组相比,单纯予以IL-17中和抗体组的IL-4和IL-17A表达没有明显统计学差异(P>0.05),单纯予以HDM组的IL-4和IL-17A表达明显上调(P < 0.01),予以HDM和IL-17中和抗体组的IL-4和IL-17A表达则显著低于单纯予以HDM组(P < 0.01;Fig 1A、B)。同时,我们在小鼠的鼻息肉及下鼻甲粘膜的组织化学染色中也同样发现予以IL-17中和抗体后可以明显降低HDM引起的IL-17A表达(Fig 1C)。
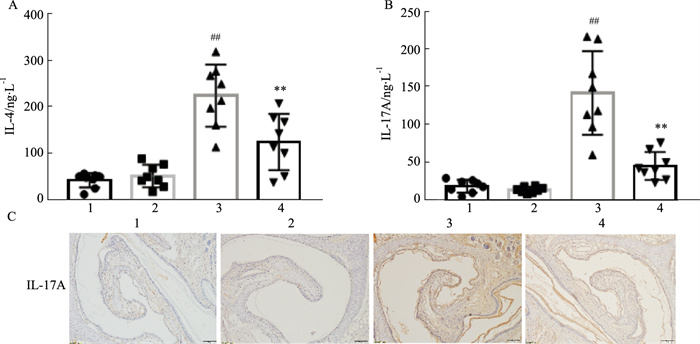
|
| Fig 1 Expression of Th2 and Th17 cytokines in mice (x±s, n=8) A, B: The expressions of IL-4 and IL-17A in the supernatant of mouse nasal polyps and inferior turbinate mucosa were determined by ELISA; C. The expression of IL-17A in mice was observed by immunohistochemical staining; 1:control; 2:C+anti-17A;3:HDM; 4:H+anti-IL-17A; ##P<0.01 vs control; **P<0.01 vs HDM |
Western blot结果表明,小鼠予以IL-17A中和抗体后与未处理小鼠的MMP-9和VEGF蛋白表达没有明显差异(P>0.05),而HDM处理后的小鼠MMP-9和VEGF蛋白表达明显升高(P < 0.05),HDM小鼠再予以IL-17A中和抗体治疗后MMP-9和VEGF蛋白表达显著降低(P < 0.05)。而且,我们在小鼠鼻息肉和下鼻甲粘膜HE染色中发现正常组和单纯予以IL-17中和抗体组的组织中炎症细胞较少,而HDM组较正常组炎症细胞明显增多,且粘膜显著增厚。而IL-17中和抗体可以缓解HDM引起的炎症,逆转粘膜的增生。见Fig 2。
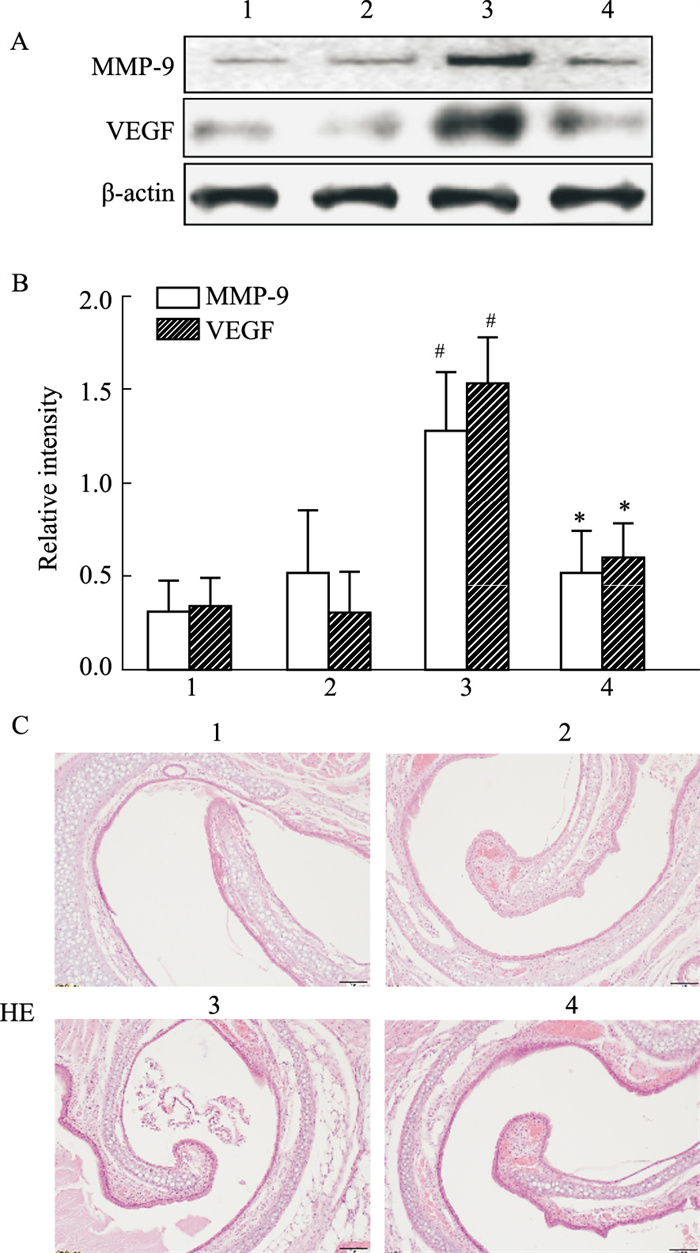
|
| Fig 2 Expression of MMP-9 and VEGF protein and histopathological changes in mice (x±s, n=8) A, B: Western blot was used to detect the expression of MMP-9 and VEGF in nasal polyps and inferior turbinate mucosa of mice (n=8); C: HE staining was used to observe the expression of inflammatory cells in different groups of mice; 1:control; 2:C+anti-17A;3:HDM; 4:H+anti-IL-17A; #P<0.05 vs control; *P<0.05 vs HDM |
Western blot结果如Fig 3可见,与对照组相比,予以IL-17A中和抗体的小鼠Act1、Traf6、p65蛋白表达及IκBα磷酸化表达均无明显变化(P>0.05),HDM模型组小鼠Act1、Traf6、p65蛋白表达及IκBα磷酸化表达均升高(P < 0.05)。然而H+IL-17A中和抗体组较HDM组降低了以上蛋白的磷酸化和表达(P < 0.05)。
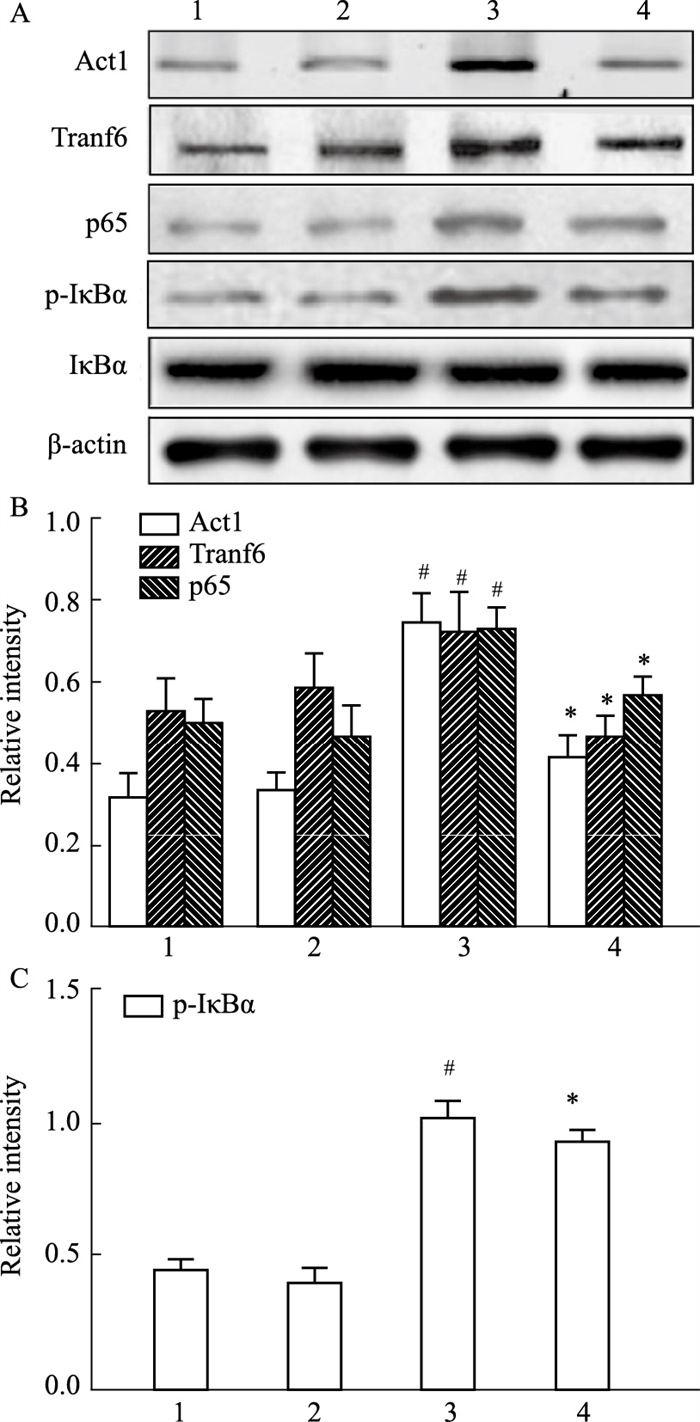
|
| Fig 3 Detection levels of Traf6 and NF-κB pathway proteins in different groups of mice (x±s, n=8) A, B, C: Protein expression levels of Act1, Traf6, p65 and phosphorylation of IκBα in nasal polyps and inferior turbinate mucosa tissues of mice were determined by Western blot; 1:control; 2:C+anti-17A;3:HDM; 4:H+anti-IL-17A; #P<0.05 vs control; *P<0.05 vs HDM |
为了证实IL-17A通过IL-17AR信号诱导Traf6及NF-κB信号通路蛋白的表达,HNEpCs在IL-17A刺激前用anti-IL-17RA预处理1 h。如预期一样,与仅IL-17A治疗刺激相比,anti-IL-17RA处理后Act1、Traf6、p65的蛋白表达显著下降,IκBα的磷酸化水平也明显降低(P < 0.05)。见Fig 4。
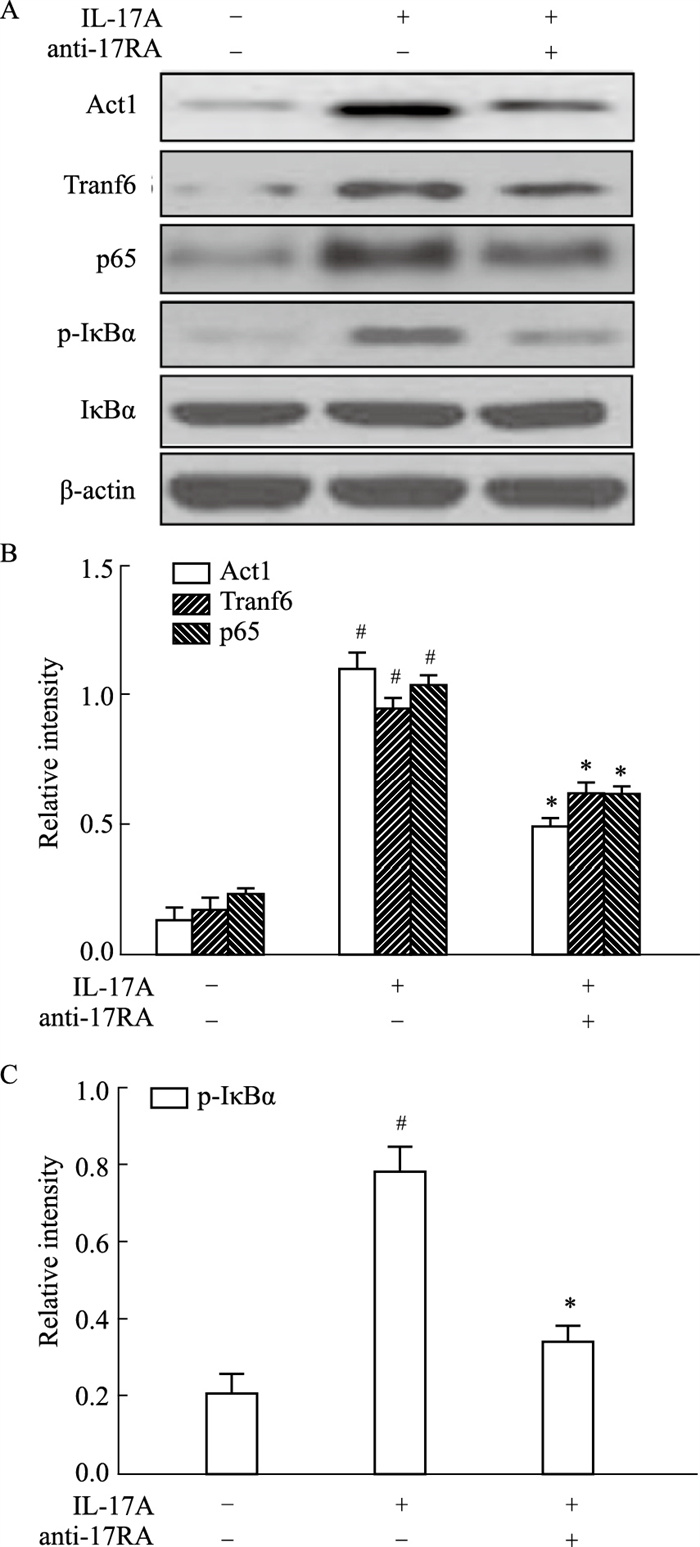
|
| Fig 4 Expression of Traf6 and NF-κB Signaling Pathway Proteins in HNEpCs Treated with anti-IL-17RA (x±s, n=3) A, B, C: Protein expression levels of Act1, Traf6, p65 and phosphorylation of IκBα in HNEpCs treated with IL-17A or a combination of IL-17A and anti-IL-17RA were determined by Western blot; #P<0.05 vs untreated group, *P<0.05 vs treated with IL-17A group |
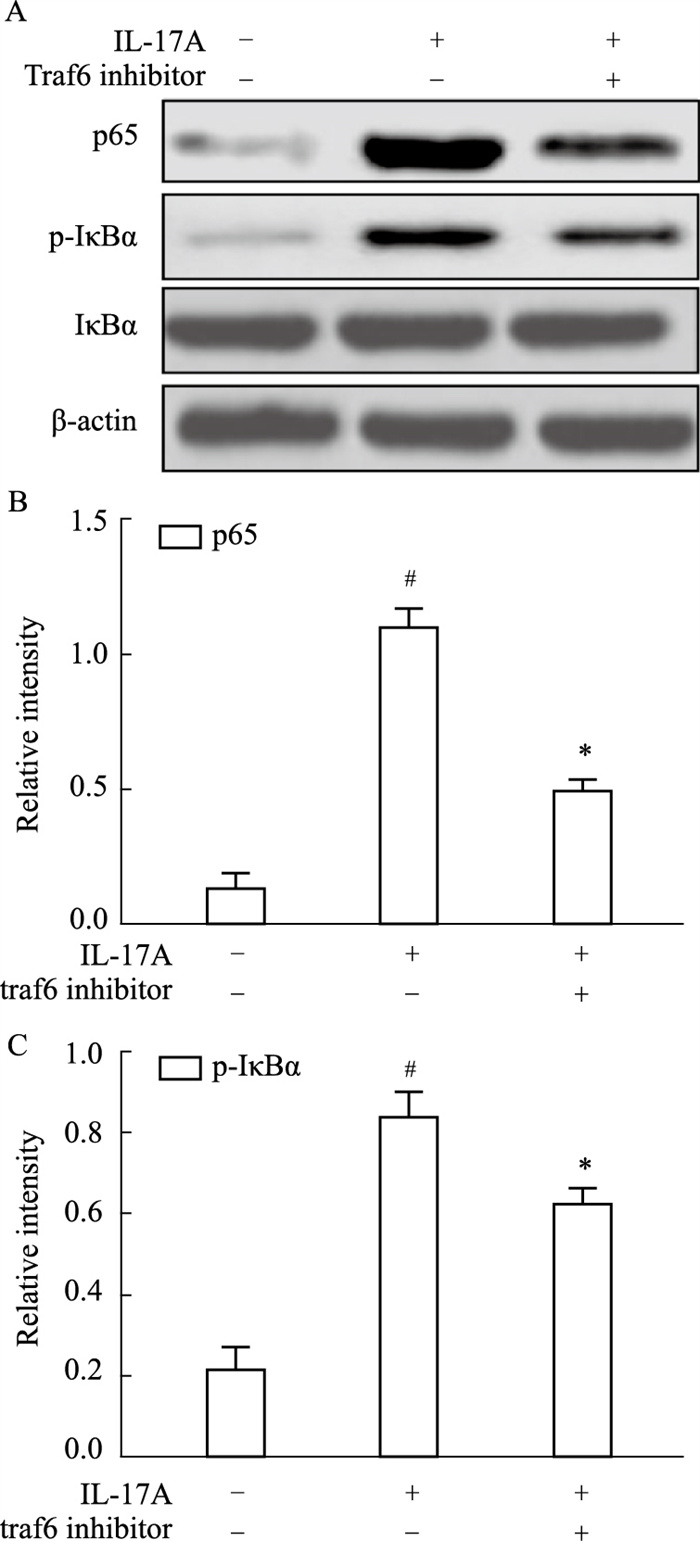
Traf6信号可以被IL-17A激活,为证实其在NF-κB信号通路活化中的作用。在IL-17A处理HNEpCs前,用Traf6的抑制剂Traf6 inhibitor预处理HNEpCs 1 h,最后Western blot结果表明,Traf6 inhibitor预处后p65蛋白表达以及IκBα的磷酸化均显著减弱(P < 0.05)。见Fig 5。
|
| Fig 5 Expression of NF-κB pathway proteins in HNEpCs treated with Traf6 inhibitor (x±s, n=3) A, B, C: Protein expression levels of Act1, Traf6, p65 and phosphorylation of IκBα in HNEpCs treated with IL-17A or a combination of IL-17A and Traf6 inhibitor were determined by Western blot; #P<0.05 vs untreated group, *P<0.05 vs treated with IL-17A group |
慢性鼻窦炎(CRS)是一种复杂的上气道疾病,与各种细胞、炎症介质和细胞因子有关。CRS的发生率可高达人均10%左右,根据其性质又可分为无鼻息肉的CRS (CRSsNP)和带有鼻息肉的CRS(CRSwNP)[2]。这两种表型的特点是疾病所造成的经济负担高和临床症状的重叠,主要以面部疼痛和嗅觉丧失最为显著。近年来,我国对CRS病理生理学的认识方面取得了很大的进展:从上皮和上皮间充质过渡到先天和适应性免疫途径,然而,针对CRSwNP中息肉的发生机制仍存在多种假设。为此,本研究以寻找CRSwNP发病机制为重点,制备CRSwNP小鼠模型。IL-17A具有广泛的功能,已知它参与各种炎症反应。有研究报告证实,IL-17A在急性肺曲霉病和过敏性哮喘中起着重要作用[11-12]。我们的结果表明,与正常组相比,IL-17A蛋白在CRSwNP小鼠的鼻组织中高度表达。同时,我们还发现,予以IL-17A中和抗体后,CRSwNP小鼠的Th2、Th17型炎症因子表达及炎症细胞浸润明显减轻。总之,我们的研究结果证实并扩展了其他人的发现,即增加IL-17A的表达在CRSwNP致病中起着关键作用。虽然CRSwNP在炎症模式中表现出显著的异质性,但鼻息肉水肿的形成是CRSwNP的一个共同特征。因此,识别调节鼻息肉水肿形成的因素对该疾病的治疗干预至关重要。有研究表明,蛋白酶及其抑制剂之间的不平衡可能在细胞外基质的降解和水肿的形成中发挥关键作用[13]。MMPs是一个锌和钙依赖性内肽酶家族,可以降解几乎所有的细胞外基质成分[14]。VEGF是一种二聚体肝素结合糖蛋白,具有促水肿和血管生成特性[15]。而我们的研究发现,通过IL-17A中和抗体将CRSwNP模型中IL-17A降解后可以减少MMP-9和VEGF的表达。
此外,我们还发现CRSwNP中Act1和Traf6水平升高。为探究CRSwNP中Act1和Traf6的蛋白水平变化是否与IL-17A有关,我们用IL-17A刺激人鼻粘膜上皮细胞(HNEpCs),在IL-17A刺激后,ACT1通过E3连接酶招募并促进TRAF6泛素化,从而传递下游信号。有报道表明,Act1可能在IL-17A诱导的星形胶质细胞脱髓鞘过程中起主导作用[16]。然而,在我们用IL-17A和anti-IL-17RA对细胞进行预处理后,发现anti-IL-17RA预处理可以消除Act1和Traf6水平的上调。这表明IL-17A通过与IL-17AR结合来诱导Traf6的产生,从而激活下游信号。我们的研究提示IL-17A/IL-17RA/Traf6参与了CRSwNP的炎症反应。
IL-17A可以激活多种下游信号通路,包括NF-κB、MAPK等在不同疾病中表达[17]。在本研究中,我们发现NF-κB在CRSwNP小鼠中被激活。NF-κB转录因子家族作为五个不同亚单位的二聚体,即p65或RelA,p50(NF-κB1)、RelB、p52(NF-κB2)和cRel。在没有刺激的情况下,NF-κB在细胞质中与IκBα、IκBβ、IκBε的相互作用不活跃。而炎症等刺激NF-κB活化后,IκB降解,使核转位和NF-κB与κB共有DNA序列结合,调节靶基因转录[18]。在本研究中,我们发现CRSwNP小鼠和IL-17A刺激的HNEpCs中NF-κB信号通路表达上调,提示它被IL-17信号激活。有研究表明,NF-κB是Traf6的一个下游基因。因此,我们怀疑Traf6可能参与了IL-17A调节NF-κB的机制。在本研究中,我们证实了IL-17A可以激活Traf6途径。此外,用Traf6 inhibitor(Traf6抑制剂)对HNEpCs进行预处理。研究证实,IL-17A诱导的NF-κB表达上调可以通过Traf6抑制来消除,这表明IL-17A可以通过激活Traf6途径诱导鼻上皮细胞中NF-κB的产生。
总之,本研究的结果表明,CRSwNP中的局部炎症环境可能会诱导IL-17A的表达。IL-17A通过鼻上皮细胞中的Traf6通路上调NF-κB的表达,这表明IL-17A可能在CRSwNP的组织重塑中发挥至关重要的作用。阻滞IL-17RA/Traf6/NF-κB信号通路可以缓解鼻窦炎伴鼻息肉组织重塑。
| [1] |
Takabayashi T, Schleimer R P. Formation of nasal polyps: The roles of innate type 2 inflammation and deposition of fibrin[J]. J Allergy Clin Immunol, 2020, 145(3): 740-50. doi:10.1016/j.jaci.2020.01.027 |
| [2] |
Van Crombruggen K, Taveirne S, Holtappels G, et al. Innate lymphoid cells in the upper airways: importance of CD117 and IL-1RI expression[J]. Eur Respir J, 2018, 52(6): 1800742. doi:10.1183/13993003.00742-2018 |
| [3] |
Zhang N, Van Zele T, Perez-Novo C, et al. Different types of T-effector cells orchestrate mucosal inflammation in chronic sinus disease[J]. J Allergy Clin Immunol, 2008, 122(5): 961-8. doi:10.1016/j.jaci.2008.07.008 |
| [4] |
Cao P P, Li H B, Wang B F, et al. Distinct immunopathologic characteristics of various types of chronic rhinosinusitis in adult Chinese[J]. J Allergy Clin Immunol, 2009, 124(3): 478-84. doi:10.1016/j.jaci.2009.05.017 |
| [5] |
McGeachy M J, Cua D J, Gaffen S L. The IL-17 Family of Cytokines in Health and Disease[J]. Immunity, 2019, 50(4): 892-906. doi:10.1016/j.immuni.2019.03.021 |
| [6] |
Bunte K, Beikler T. Th17 Cells and the IL-23/IL-17 Axis in the Pathogenesis of Periodontitis and Immune-Mediated Inflammatory Diseases[J]. Int J Mol Sci, 2019, 20(14): 3394. doi:10.3390/ijms20143394 |
| [7] |
Gunjigake K, Kinoshita J, Yamaguchi T, et al. Interleukin-17A derived from mast cells contributes to fibrosis in gastric cancer with peritoneal dissemination[J]. Gastric Cancer, 2021, 24(1): p.31-44. doi:10.1007/s10120-020-01092-2 |
| [8] |
Chen X H, Chang L H, Li X, et al. Tc17/IL-17A Up-Regulated the Expression of MMP-9 via NF-kappaB Pathway in Nasal Epithelial Cells of Patients With Chronic Rhinosinusitis[J]. Front Immunol, 2018, 9: 2121. doi:10.3389/fimmu.2018.02121 |
| [9] |
Zepp J, Wu L, Li X. IL-17 receptor signaling and T helper 17-mediated autoimmune demyelinating disease[J]. Trends Immunol, 2011, 32(5): 232-9. doi:10.1016/j.it.2011.02.007 |
| [10] |
Feng Y, Zheng C J, Zhou Z P, et al. IL-17A neutralizing antibody attenuates eosinophilic meningitis caused by Angiostrongylus cantonensis by involving IL-17RA/Traf6/NF-kappaB signaling[J]. Exp Cell Res, 2019, 384(1): 111554. doi:10.1016/j.yexcr.2019.111554 |
| [11] |
Garth J M, Mackel J J, Reeder K M, et al. Acidic Mammalian Chitinase Negatively Affects Immune Responses during Acute and Chronic Aspergillus fumigatus Exposure[J]. Infect Immun, 2018, 86(7): e00944-17. |
| [12] |
李承德, 周文宾, 孙艳, 等. 黄芪多糖对哮喘大鼠Th17/Treg细胞因子及肺部炎症的影响[J]. 中国药理学通报, 2013, 29(9): 1275-8. Li C D, Zhou W B, Sun Y. Effects of astragalus polysaccharide on Th17 /Treg associated cytokines and airway inflammation in OVA-induced asthmatic rats[J]. Chin Pharmacol Bull, 2013, 29(9): 1275-8. doi:10.3969/j.issn.1001-1978.2013.09.022 |
| [13] |
范凯健, 吴菁, 李钦, 等. 基质金属蛋白酶13在软骨重塑和关节炎中的研究进展[J]. 中国药理学通报, 2018, 34(5): 607-11. Fan K J, Wu J, Li Q., et al. Advances in matrix metalloproteinase 13 in cartilage remodeling and arthritis[J]. Chin Pharmacol Bull, 2018, 34(5): 607-11. doi:10.3969/j.issn.1001-1978.2018.05.005 |
| [14] |
Huang C C, Wang C H, Wu P W, et al. Increased nasal matrix metalloproteinase-1 and -9 expression in smokers with chronic rhinosinusitis and asthma[J]. Sci Rep, 2019, 9(1): 15357. doi:10.1038/s41598-019-51813-6 |
| [15] |
Sodhi A, Ma T, Menon D, et al. Angiopoietin-like 4 binds neuropilins and cooperates with VEGF to induce diabetic macular edema[J]. J Clin Invest, 2019, 129(11): 4593-608. doi:10.1172/JCI120879 |
| [16] |
Wang C, Zhang C J, Martin B N, et al. IL-17 induced NOTCH1 activation in oligodendrocyte progenitor cells enhances proliferation and inflammatory gene expression[J]. Nat Commun, 2017, 8: 15508. doi:10.1038/ncomms15508 |
| [17] |
Yoshida T, Das N A, Carpenter A J, et al. Minocycline reverses IL-17A/TRAF3IP2-mediated p38 MAPK/NF-kappaB/iNOS/NO-dependent cardiomyocyte contractile depression and death[J]. Cell Signal, 2020, 73: 109690. doi:10.1016/j.cellsig.2020.109690 |
| [18] |
Lan X, Han X N, Li Q, et al. Modulators of microglial activation and polarization after intracerebral haemorrhage[J]. Nat Rev Neurol, 2017, 13(7): 420-33. doi:10.1038/nrneurol.2017.69 |