

糖尿病及其并发症发病率逐年升高,是全球关注的重大健康问题。糖尿病成因复杂,能量代谢失衡、炎症、氧化应激等不良生理病理状况均可诱导机体胰岛素抵抗和胰岛β细胞损伤,促进糖尿病的发生发展。目前,临床上广泛应用的糖尿病药物仍存在一定副作用和长期服药产生耐药性等问题,糖尿病特效药物的开发还存在诸多困难和挑战。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是机体维持细胞内能量平衡、调控全身能量代谢的一种关键能量调节元件。大量研究表明,AMPK在调节糖脂代谢、促进白色脂肪棕色化、抗炎、抗氧化应激等多方面发挥重要作用,有利于改善机体胰岛素抵抗和胰岛β细胞损伤,被认为是糖尿病防控的重要靶点[1-2]。在中西医中均能找到通过干预AMPK信号通路发挥抗糖尿病作用的药理学依据。除二甲双胍、吡格列酮等常用的抗糖尿病药物以外,小檗碱、白藜芦醇、苦参碱、紫檀芪、虫草素、龙胆苦苷等多种传统中药提取成分均被发现可以通过激活AMPK在糖尿病的防控中发挥正向作用。本文通过中国知网、PubMed、Web of Science等数据库, 分别以中英文形式的AMPK、diabetes、glucose and lipid metabolism、browning of white adipose、inflammation、oxidative stress等为关键词,主要对近5年高影响因子的相关文献进行检索和阅读,并结合本团队的科研成果,对AMPK阻止糖尿病发生发展的相关机制展开综述,旨在为安全高效的AMPK靶向抗糖尿病药物的开发提供科学指导。
1 AMPK概述 1.1 AMPK的结构AMPK由α、β、γ 3种亚基组成,是一种在真核细胞生物体内广泛存在,并在机体能量代谢的调节中扮演关键角色的异源三聚体复合物。α亚基的α1、α2两种亚型在机体多种组织中发挥催化活性。上游相关激酶可以通过磷酸化α亚基的Thr172位点实现对AMPK的激活。不同基因编码的两种β亚基(β1、β2亚型)协同或独立参与各种生理活动的调节。β亚基上具有一段在AMPK三聚体的形成和定位中发挥重要作用的结构域——C端结构域(β-C-terminal domain,β-CTD)。α亚基和γ亚基通过与β亚基的β-CTD结合,共同组成完整的AMPK复合物。而β亚基的碳水化合物结合模块(β-carbohydrate-binding module,β-CBM)可以与糖原以及糖原代谢相关酶结合,参与糖原合成的调节。γ亚基具有γ1、γ2、γ3三种亚型。γ亚基包含四个具有胱硫氨酸-β-合成酶(cysteionine-β-synthetase,CBS)结构域的串联重复序列,参与AMPK与腺嘌呤核苷酸的结合[3]。
1.2 AMPK的激活AMPK可以灵敏的感知机体能量状况变化,并通过激活或抑制多种下游因子参与能量代谢的调节。传统的能量感应机制认为:当细胞内ADP/ATP和/或AMP/ATP的比例升高时,ADP和/或AMP与AMPK的γ亚基结合,引起AMPK发生构象改变,抑制其α亚基Thr172位点的去磷酸化,并促进上游钙/钙调蛋白依赖性蛋白激酶激酶β、转化生长因子-β激活激酶和肝激酶B1磷酸化Thr172位点,协同作用激活AMPK[1]。近年来,有研究提出可能存在一种新的AMPK激活途径:葡萄糖传感机制。相关研究显示:当机体能量缺乏时,即使细胞内腺嘌呤核苷酸的比例未发生改变,AMPK也可以通过感知葡萄糖浓度的改变而激活。当葡萄糖浓度较低时,糖酵解中间产物果糖-1,6-二磷酸与醛缩酶的结合受到抑制,进而引起醛缩酶和溶酶体表面的v-ATP酶之间的相互作用发生改变,促进AMPK复合物的形成[4]。激活后的AMPK可通过多种机制减少葡萄糖、脂肪酸、胆固醇的生物合成,增加葡萄糖的摄取利用和脂肪酸的β氧化,进而提高机体内ATP的含量水平[5]。
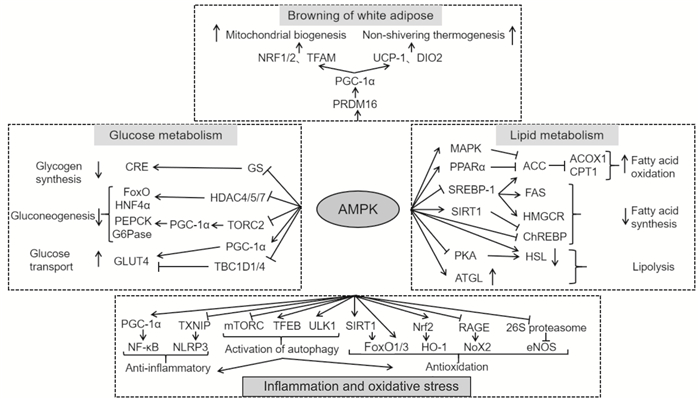
2 AMPK阻止糖尿病发生发展的相关机制糖脂代谢紊乱、炎症反应和氧化应激会引起外周组织器官产生胰岛素抵抗,导致肝脏、肌肉和脂肪组织等胰岛素敏感组织无法发挥正常的生理功能,增加糖尿病发病风险。AMPK可以通过调节糖脂代谢、促进白色脂肪棕色化、抗炎、抗氧化应激等途径,阻止糖尿病的发生发展。
2.1 AMPK与糖代谢肝脏和骨骼肌作为机体内葡萄糖生成和利用的主要的场所,在机体糖代谢稳态的调节中至关重要。AMPK对肝脏生成葡萄糖和骨骼肌摄取利用葡萄糖的调控,有助于维持机体糖代谢稳态,进而达到防治糖尿病的目的。
肝脏糖异生的异常增加,会引起机体糖代谢紊乱,是糖尿病的重要危险因素。大量研究表明,AMPK的激活可以有效抑制肝脏糖异生,使机体血糖浓度维持在适宜范围内,降低糖尿病发病风险。AMPK可以通过直接促进哺乳动物雷帕霉素靶蛋白2(mammalian target of rapamycin complex 2,mTORC2)磷酸化或者抑制环磷酸腺苷(cAMP)刺激的mTORC2去磷酸化,阻止mTORC2与环磷酸腺苷效应元件结合蛋白(cAMP response element binding protein,CREB)结合,进而抑制过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC -1α)转录磷酸烯醇式丙酮酸羧化激酶(phosphoenolpyruvate carboxykinase,PEPCK)和葡萄糖-6 -磷酸酶(glucose-6-phosphatase,G6Pase),减少肝糖的生成和输出[6]。在对人参皂苷Rg2、辣椒素酯等植物化学物质降糖机制的研究中发现,AMPK可以通过促进糖原合成酶(glycogen synthase,GS)磷酸化,抑制环磷酸腺苷效应元件(cAMP response element,CRE)的转录活性,下调PEPCK水平,从而减少肝脏糖异生[7, 8]。除此以外,AMPK还通过磷酸化组蛋白去乙酰化酶(histone deacetylase 4/5/7,HDAC4、HDAC5、HDAC7),使之与14-3-3蛋白结合,抑制肝细胞核因子4α(hepatic nuclear factor 4 alpha,HNF4α)和叉头转录因子1(forkhead transcription factor 1,FoxO1)的转录活性,进而减少糖异生相关基因的转录和表达[9]。
骨骼肌对葡萄糖的摄取利用在糖代谢稳态的维持和调节中发挥着不可忽视的作用。体内外实验显示,AMPK可以通过增加PGC -1α的表达,促进db/db小鼠骨骼肌(L6肌管)中葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的合成和易位,表现出对骨骼肌摄取利用葡萄糖的显著增强效果[2, 10]。另有实验研究表明,AMPK可通过磷酸化RabGAP蛋白(Tre-2/BUB2/cdc1 domain family member 1/4,TBC1D1、TBC1D4),促使GLUT4易位至细胞质膜,进而上调骨骼肌对葡萄糖的摄取利用,改善机体的胰岛素抵抗[11]。
上述众多研究表明,AMPK可以通过多种途径抑制肝脏糖异生、促进骨骼肌对葡萄糖的摄取利用,从而有效缓解机体的糖代谢紊乱,降低糖尿病及其并发症的发病风险。
2.2 AMPK与脂代谢机体脂代谢紊乱与糖尿病的发生发展密切相关。研究发现血清中游离脂肪酸、胆固醇、甘油三酯、低密度脂蛋白等脂质水平与糖尿病的患病风险存在明显的剂量反应关系[12]。因此,可从增加脂肪酸β氧化、减少脂质合成、调控脂肪水解等方面寻找改善糖尿病患者脂代谢紊乱的方法。
Sayeed等[10]发现,AMPK可提高p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸化水平,并活化过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPAR-α),诱导乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)磷酸化,进而增加脂肪酸β氧化[10]。Zhu等研究表明,AMPK可以上调肉毒碱棕榈酰转移酶(carnitine palmitoyltransferase 1,CPT1)、酰基辅酶A氧化酶1(acyl coenzyme A oxidase 1,ACOX1)等脂肪酸β氧化相关蛋白的表达,并通过抑制固醇调节元件结合转录因子(sterol regulatory element binding protein -1c,SREBP -1c)的转录和核易位,促进胆固醇合成限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A Reductase,HMGCR)磷酸化、降低脂肪酸合成酶(fatty acid synthase,FAS)、ACC1等脂质合成相关蛋白含量[13]。有研究显示,AMPK可通过直接磷酸化碳水化合物应答元件结合蛋白(carbohydrate response element binding protein,ChREBP),阻止其与DNA结合,降低丙酮酸激酶肝异构体基因的表达水平,或通过活化沉默信息调节因子1(sirtuin 1,SIRT1)下调ChREBP的转录活性,从而抑制糖类向脂质的转化,减少脂质的生成[6, 8, 14]。
肝脏过量摄取脂肪酸,会增加肝脏脂肪变性和胰岛素抵抗的发病风险,进而推动糖尿病及其相关疾病的发病进程。AMPK可以通过磷酸化激素敏感脂肪水解酶(hormone-sensitive lipase,HSL)的S565位点,拮抗环磷酸腺苷依赖蛋白激酶A(cAMP-dependent protein kinase A,PKA)对HSL的激活作用,降低脂肪水解速度[15]。另有研究发现,AMPK可以诱导脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)的S406位点磷酸化,促进脂肪组织甘油三酯的水解[16]。上述研究提示,AMPK对脂解作用可能存在双向调控,通过与机体其他机制有机结合,合理控制脂解速度,维持脂代谢稳态。
以上研究表明,AMPK可以通过多种机制增加脂肪酸的β氧化、减少脂质的生成和积累、双向调控脂肪的水解,进而维持机体脂代谢稳态、阻止糖尿病发生发展。
2.3 AMPK与白色脂肪组织棕色化白色脂肪组织可在内、外界因素刺激作用下发生棕色化反应,转化为米色脂肪组织。米色脂肪组织中含有丰富的线粒体,其线粒体膜上存在大量的解偶联蛋白(uncoupling protein 1,UCP -1),可以增加机体非战栗性产热,促进能量消耗,减少脂肪积累,进而降低糖尿病及其他肥胖相关疾病的发病风险[17]。而诸多研究表明,AMPK可以通过调控多种白色脂肪组织棕色化相关靶点,促进米色脂肪组织的生成,在糖尿病的防治中发挥正向调节作用。
AMPK增加脂肪组织生热的作用与其维持脂肪组织中的线粒体质量相关。AMPK可以通过调节PGC-1α及其下游因子核呼吸因子(nuclear respiratory factors 1/2,NRF1、NRF2)和线粒体转录因子A(mitochondrial transcription factor A,TFAM),促进线粒体的生物合成和氧化代谢,进而推动白色脂肪棕色化的进程[18]。研究发现,UCP -1的合成、易位和激活是白色脂肪棕色化进程中不可缺少的一环。AMPK通过上调白色脂肪组织中PGC-1α的活性,提高UCP -1的表达水平,进而促进米色脂肪组织的生成[19-20]。对白色脂肪组织棕色化相关机制展开进一步研究发现,增加AMPKα基因的表达,可抑制转化生长因子β1识别和激活受体结合型Smad3蛋白,进而阻止Smad3与PR结构域蛋白16(PR domain containing 16,PRDM16)启动子结合,促进PRDM16启动子的PR结构域去甲基化,进而增加PGC -1α,UCP-1、2型脱碘酶(deiodinase type 2,Dio2)的转录和表达,诱导白色脂肪棕色化[21]。
以上论述表明,AMPK通过调控PRDM16、UCP-1、PGC-1α等下游因子,促进白色脂肪棕色化,显著增加非战栗性产热,通过增加机体的能量消耗,减少脂肪的异常堆积,改善脂诱导性胰岛素抵抗,进而降低糖尿病的发病风险。
2.4 AMPK与炎症反应当机体出现炎症反应时,炎性因子的过量表达,会损伤胰岛β细胞,并降低全身各细胞的胰岛素敏感性,进而导致机体胰岛素分泌缺乏和胰岛素抵抗[22],导致糖尿病的发生发展。大量研究表明,AMPK可显著减弱机体的炎症反应,进而起到防治糖尿病的作用。

|
| Fig 1 The domain map of AMPK |
|
| Fig 2 Mechanisms of AMPK in diabetes prevention and control AMPK activates or inhibits multiple downstream effectors, thereby regulating glucose and lipid metabolism, promoting browning of white adipose, anti-inflammatory, antioxidant stress, thus having significance in the prevention and treatment of diabetes. NRF1/2: Nuclear respiratory factors 1/2. TFAM: Mitochondrial transcription factor A. UCP-1: Uncoupling protein 1. DIO2: Deiodinase type 2. PGC-1α: Peroxisome proliferator-activated receptor γ coactivator-1α. PRDM16: PR domain containing 16. CRE: cAMP response element. GS: Glycogen synthase. FoxO: Forkhead transcription factor 1. HNF4α: Hepatic nuclear factor 4 alpha. HDAC4/5/7: Histone deacetylase 4/5/7. PEPCK: Phosphoenolpyruvate carboxykinase. TORC2: Mammalian target of rapamycin complex 2. GLUT4: Glucose transporter 4. TBC1D1/4: Tre-2/BUB2/cdc1 domain family member 1/4. MAPK: Mitogen-activated protein kinase. PPARα: Peroxisome proliferator-activated receptor α. ACC: Acetyl CoA carboxylase. ACOX1: Acyl coenzyme A oxidase 1. CPT1: Carnitine palmitoyltransferase 1. SREBP-1: Sterol regulatory element binding protein-1c. FAS: Fatty acid synthase. HMGCR: 3-hydroxy-3-methylglutaryl coenzyme A Reductase. SIRT1: Sirtuin 1. ChREBP: Carbohydrate response element binding protein. PKA: cAMP-dependent protein kinase A. HSL: Hormone-sensitive lipase. ATGL: Adipose triglyceride lipase. NF-κB: Nuclear factor-κB. TXNIP: Thioredoxin-interacting protein. NLRP3: Nucleotide-binding oligomerization domain-like receptor protein 3. TFEB: Transcription factor EB. ULK1: Unc-51 like kinase 1. Nrf2: Nuclear factor E2-related factor 2. HO-1: Heme-oxygenase-1. RAGE: Receptor for advanced glycation endproducts. NoX2: Nicotinamide adenine dinucleotide phosphate oxidase 2. eNOS: Endothelial nitric oxide synthase. |
AMPK可通过上调PGC-1α的浓度,抑制核因子κB(nuclear factor-κB,NF-κB)的表达,或通过促进硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)变性失活,减少炎性小体核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)的生成,进而抑制白介素-1β(interleukin -1β,IL-1β)、IL-6、IL-18、单核细胞趋化蛋白-1、肿瘤坏死因子等炎性因子的生成和释放[23-24]。另有研究表明,AMPK可以促进自噬激酶(unc -51 like kinase 1,ULK1)和mTORC1磷酸化,上调自噬相关蛋白活性,或通过对FoxO3、转录因子EB(transcription factor EB,TFEB)等转录因子的调控,提高自噬相关基因的表达水平,进而缓解机体的炎症反应[25]。
以上研究结果显示,AMPK可以通过调控炎症以及自噬相关基因的转录和表达,调节炎性反应和自噬反应相关蛋白活性,阻碍炎性小体的形成,促进炎性小体的清除,抑制炎性因子的成熟和释放,进而缓解机体炎症反应、阻止糖尿病的发生发展。
2.5 AMPK与氧化应激机体发生氧化应激时,活性氧(reactive oxygen species,ROS)过量生成和积累,会引起包括胰岛在内的全身各组织氧化损伤,进而导致胰岛素分泌不足和胰岛素敏感性降低。而AMPK可以通过多种途径减少体内ROS的堆积,进而减缓机体的氧化损伤,在糖尿病的预防和控制发挥积极作用。
AMPK可通过磷酸化Fox3、mTORC1、TFEB等靶点,激活并调控自噬反应选择性的清除受损线粒体,抑制线粒体功能障碍所导致的ROS生成增多[5]。上文提及,激活AMPK可以增加线粒体内膜上解偶联蛋白UCP-1的表达。Demine等[26]研究发现,线粒体解偶联可以激活自噬反应并减少ROS的生成。因此,AMPK可以通过增加UCP-1的表达,调控线粒体解偶联,进而减少活性氧的生成,发挥抗氧化应激作用。同时大量研究表明,AMPK可调控氧化还原相关酶活性,减少活性氧和过氧化物的积累,缓解糖尿病患者的氧化应激损害。吕丽娟等[27]的实验数据显示,激活AMPK可以下调糖基化终产物受体(receptor for advanced glycation endproducts,RAGE)的表达,降低还原型辅酶Ⅱ氧化酶2(nicotinamide adenine dinucleotide phosphate oxidase 2,NoX2)的活性,减少ROS和超氧化物阴离子的生成,并通过抑制26S蛋白酶体对三磷酸鸟苷环化水解酶1的降解,促进内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)聚合物的生成,从而发挥抗氧化作用。部分研究发现,AMPK可以直接激活FoxO1或通过活化SIRT1促进FoxO1和FoxO3去乙酰化,增加其在细胞核中的稳定性,促进抗氧化酶的转录表达,抑制活性氧的生成[28-29]。AMPK还可以通过活化核因子E2相关因子(nuclear factor E2-related factor 2,Nrf2)上调其下游血红素氧合酶1(heme-oxygenase-1,HO -1)的表达,促进过氧化物的还原,减少体内ROS的堆积[30]。
以上论述表明,AMPK可以通过调控自噬以及氧化还原反应相关蛋白和基因的表达,减少过氧化物的生成和积累,进而发挥抗氧化应激功能,降低糖尿病的发病风险。
3 小结糖尿病是一种对公共健康造成沉重负担的代谢紊乱性疾病。AMPK作为机体重要的能量稳态调节器,被认为是糖尿病防治的重要靶点。AMPK通过调控PGC-1α、UCP-1、SIRT1等多种下游效应因子,参与糖脂代谢、白色脂肪棕色化、炎症、氧化应激等多种生理病理过程的调节,从而阻止糖尿病的发生发展。目前,对于AMPK发挥上述生理调节功能的相关机制研究已取得巨大进展,但部分机制仍未被完全阐明,且现阶段已知的多种AMPK激活剂在临床应用上仍具有一定的局限性,还需展开进一步的探索研究,为安全有效的糖尿病防治药物的开发提供科学依据。
| [1] |
Li J, Zhong L P, Wang F Z, et al. Dissecting the role of AMP-activated protein kinase in human diseases[J]. Acta Pharm Sin B, 2017, 7(3): 249-59. doi:10.1016/j.apsb.2016.12.003 |
| [2] |
Meng Q H, Qi X, Fu Y, et al. Flavonoids extracted from mulberry (Morus alba L.) leaf improve skeletal muscle mitochondrial function by activating AMPK in type 2 diabetes[J]. J Ethnopharmacol, 2020, 248: 112326-38. doi:10.1016/j.jep.2019.112326 |
| [3] |
Hardie D G, Ross F A, Hawley S A. AMP-activated protein kinase: A target for drugs both ancient and modern[J]. Chem Biol, 2012, 19(10): 1222-36. doi:10.1016/j.chembiol.2012.08.019 |
| [4] |
Lin S C, Hardie D G. AMPK: Sensing glucose as well as cellular energy status[J]. Cell Metab, 2018, 27(2): 299-313. doi:10.1016/j.cmet.2017.10.009 |
| [5] |
Herzig S, Shaw R J. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol, 2018, 19(2): 121-35. doi:10.1038/nrm.2017.95 |
| [6] |
刘凡铭, 王琪, 钱昱臻, 等. 腺苷酸活化蛋白激酶在糖脂代谢调控中的研究进展[J]. 生物工程学报, 2019, 35(6): 1021-8. Liu M F, Chen D, Qian Y Z, et al. Research progress of Adenosine 5'-monophosphate-activated protein kinase in the regulation of glycolipid metabolism[J]. Chin J Biotech, 2019, 35(6): 121-35. |
| [7] |
Yuan H D, Kim D Y, Quan H Y, et al. Ginsenoside Rg2 induces orphan nuclear receptor SHP gene expression and inactivates GSK3β via AMP-activated protein kinase to inhibit hepatic glucose production in HepG2 cells[J]. Chem Biol Interact, 2012, 195(1): 35-42. doi:10.1016/j.cbi.2011.10.006 |
| [8] |
Zang Y F, Fan L, Chen J H, et al. Improvement of lipid and glucose metabolism by capsiate in palmitic acid-treated HepG2 cells via activation of the AMPK/SIRT1 signaling pathway[J]. J Agric Food Chem, 2018, 66(26): 6772-81. doi:10.1021/acs.jafc.8b01831 |
| [9] |
Mihaylova M M, Vasquez D S, Ravnskjaer K, et al. Class Ⅱa histone deacetylases are hormone-activated regulators of FOXO and mammalian glucose homeostasis[J]. Cell, 2011, 145(4): 607-21. doi:10.1016/j.cell.2011.03.043 |
| [10] |
Sayeed M, Gautam S, Verma D P, et al. A collagen domain-derived short adiponectin peptide activates APPL1 and AMPK signaling pathways and improves glucose and fatty acid metabolisms[J]. J Biol Chem, 2018, 293(35): 13509-23. doi:10.1074/jbc.RA118.001801 |
| [11] |
Espelage L, Al-Hasani H, Chadt A. RabGAPs in skeletal muscle function and exercise[J]. J Mol Endocrinol, 2020, 64(1): 1-19. doi:10.1530/JME-19-0159 |
| [12] |
刘少博, 从祥丰, 徐婷玲, 等. 中国8省市成人血脂与糖尿病前期及糖尿病发病关系的前瞻性队列研究[J]. 中国健康教育, 2020, 36(5): 392-6. Liu S B, Cong X F, Xu T L, et al. A prospective cohort study on the relationship between serum lipids and prediabetes and diabetes[J]. Chin J Health Education, 2020, 36(5): 392-6. |
| [13] |
Zhu X P, Bian H, Wang L, et al. Berberine attenuates nonalcoholic hepatic steatosis through the AMPK-SREBP-1c-SCD1 pathway[J]. Free Radic Biol Med, 2019, 141: 192-204. doi:10.1016/j.freeradbiomed.2019.06.019 |
| [14] |
Zhang N, Hu Y, Ding C C, et al. Salvianolic acid B protects against chronic alcoholic liver injury via SIRT1-mediated inhibition of CRP and ChREBP in rats[J]. Toxicol Lett, 2017, 267: 1-10. doi:10.1016/j.toxlet.2016.12.010 |
| [15] |
Lee Y G, Sue Y M, Lee C K, et al. Synergistic effects of cAMP-dependent protein kinase A and AMP-activated protein kinase on lipolysis in kinsenoside-treated C3H10T1/2 adipocytes[J]. Phytomedicine, 2019, 55: 255-63. doi:10.1016/j.phymed.2018.06.043 |
| [16] |
Lo M C, Chen J Y, Kuo Y T, et al. Camptothecin activates SIRT1 to promote lipid catabolism through AMPK/FoxO1/ATGL pathway in C(2)C(12) myogenic cells[J]. Arch Pharm Res, 2019, 42(8): 672-83. doi:10.1007/s12272-019-01155-8 |
| [17] |
范礼, 秦虹. 米色脂肪生成的研究进展[J]. 卫生研究, 2018, 47(4): 676-80. Fan L, Qin H. Research progress on the formation of beige adipocytes[J]. J. Hyg. Res, 2018, 47(4): 676-80. |
| [18] |
林翠, 秦虹. 线粒体质量控制与米色脂肪之间的关系[J]. 中国生物化学与分子生物学报, 2021, 37(3): 316-20. Lin C, Qin H. The relationship between mitochondrial quality control and beige adipocytes[J]. Chin J Biochem Mol Biol, 2021, 37(3): 316-20. |
| [19] |
Kim H L, Park J, Jung Y, et al. Platycodin D, a novel activator of AMP-activated protein kinase, attenuates obesity in db/db mice via regulation of adipogenesis and thermogenesis[J]. Phytomedicine, 2019, 52: 254-63. doi:10.1016/j.phymed.2018.09.227 |
| [20] |
吕慧婕, 罗金定, 伍迪, 等. 二氢杨梅素经激活AMPK-PGC1α-Sirt1信号通路促进高脂饮食诱导的肥胖小鼠肩胛下脂肪组织棕色化[J]. 中国药理学通报, 2019, 35(12): 1687-92. Lv H J, Luo J D, Wu D, et al. Dihydromyricetin promoted browning of subscapular adipose tissues in obese mice fed with high-fat diet via activating AMPK-PGC1α-Sirt1 signaling pathway[J]. Chin Pharmacol Bull, 2019, 35(12): 1687-92. doi:10.3969/j.issn.1001-1978.2019.12.013 |
| [21] |
Seale P, Kajimura S, Yang W, et al. Transcriptional control of brown fat determination by PRDM16[J]. Cell Metab, 2007, 6(1): 38-54. doi:10.1016/j.cmet.2007.06.001 |
| [22] |
Saltiel A R, Olefsky J M. Inflammatory mechanisms linking obesity and metabolic disease[J]. J Clin Invest, 2017, 127(1): 1-4. doi:10.1172/JCI92035 |
| [23] |
Jung T W, Lee S H, Kim H C, et al. METRNL attenuates lipid-induced inflammation and insulin resistance via AMPK or PPARδ-dependent pathways in skeletal muscle of mice[J]. Exp Mol Med, 2018, 50(9): 122-32. |
| [24] |
Wei H, Bu R, Yang Q, et al. Exendin-4 protects against hyperglycemia-induced cardiomyocyte pyroptosis via the AMPK-TXNIP pathway[J]. J Diabetes Res, 2019, 2019: 8905917-29. |
| [25] |
Li Y, Chen Y. AMPK and autophagy[J]. Adv Exp Med Biol, 2019, 1206: 85-108. |
| [26] |
Demine S, Renard P, Arnould T. Mitochondrial uncoupling: A key controller of biological processes in physiology and diseases[J]. Cells, 2019, 8(8): 795-834. doi:10.3390/cells8080795 |
| [27] |
吕丽娟, 叶山东. 二甲双胍通过AMPK信号通路对糖尿病肾脏疾病的保护作用[J]. 中国糖尿病杂志, 2019, 27(5): 393-6. Lv L J, Ye S D. Metformin protects diabetic kidney disease through AMPK signal pathway[J]. Chin J Diabetes, 2019, 27(5): 393-6. doi:10.3969/j.issn.1006-6187.2019.05.014 |
| [28] |
Samanta J, Mondal A, Saha S, et al. Oleic acid protects from arsenic-induced cardiac hypertrophy via AMPK/FoxO/NFATc3 pathway[J]. Cardiovasc Toxicol, 2020, 20(3): 261-80. doi:10.1007/s12012-019-09550-9 |
| [29] |
Cantó C, Gerhart-Hines Z, Feige J N, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity[J]. Nature, 2009, 458(7241): 1056-60. doi:10.1038/nature07813 |
| [30] |
Kosuru R, Kandula V, Rai U, et al. Pterostilbene decreases cardiac oxidative stress and inflammation via activation of AMPK/Nrf2/HO-1 pathway in fructose-fed diabetic rats[J]. Cardiovasc Drugs Ther, 2018, 32(2): 147-63. doi:10.1007/s10557-018-6780-3 |

