

恶性肿瘤是对人类危害最大、最为重要的致死性疾病,其发病率和死亡率均位于各类疾病前列[1]。针对恶性肿瘤的药物治疗策略也较多,如有各种特异性靶向关键受体和关键激酶等的抑制剂,它们可抑制诱发肿瘤发生发展关键信号通路的活化。其中Ras-MAPK (mitogen-activated protein kinase,MAPK) 信号通路和PI3K (phosphatidylinositol 3-kinase,PI3K)-Akt信号通路在肿瘤发生发展中的作用被研究的最为透彻,针对这两条信号通路的抗肿瘤靶向药物在临床上也被应用的最多[2]。
自上个世纪60年代Ras原癌基因被发现以来,众多的研究表明,Ras蛋白与肿瘤的发生发展密切相关,大约有1/3的人类肿瘤是因Ras基因突变而导致的[3]。但因Ras蛋白结构的独特性,致使其缺乏药物分子结合口袋,并使之难以成为小分子化合物作用的靶点,所以学界普遍认为Ras蛋白是“无药可靶向的” (undruggable)[4]。所以,对Ras蛋白功能具有重要调控作用的FTase逐渐成为抗肿瘤药物研发的焦点[5]。
FTase是一种膜结合蛋白,研究表明,其在肿瘤细胞的增殖、侵袭和代谢等过程中发挥着重要作用。FTase最主要的功能是其可通过催化作用,将一个含有15个碳原子的法尼基脂共价连接到靶蛋白羧基端四肽基序中的半胱氨酸巯基上,实现对靶蛋白的法尼基化和功能调控[6]。其中Ras是FTase最为重要的底物蛋白之一,只有当Ras蛋白被法尼基化后,其才能通过法尼基脂结合于细胞膜而被激活[7-8]。
1 Ras蛋白概述Ras蛋白是一种细胞膜结合蛋白,它属于GTPase家族成员,是一种小G蛋白。Ras蛋白家族含有H-Ras、N-Ras、K-Ras 4A和K-Ras 4B等4个成员,它们分别由H-Ras、N-Ras和K-Ras基因编码生成,其中K-Ras 4A和K-Ras 4B是K-Ras基因的不同剪接体[9]。如前文所述,Ras基因突变是诱发大约1/3人类肿瘤的主要因素,而排在前三位致死率最高的肿瘤(肺腺癌、结直肠癌和胰腺癌)中,K-Ras的突变最为常见,分别在86%的胰腺癌组织、41%的结直肠癌组织和32%的肺腺癌组织中均检测到K-Ras基因突变。K-Ras基因突变主要发生在第12位密码子,该密码子编码甘氨酸(G)。在肺癌组织中,第12位甘氨酸常常突变成半胱氨酸(G12C),而在结直肠癌和胰腺癌组织中,甘氨酸常常突变成天冬氨酸(G12D)[3, 10]。
在正常细胞中,位于细胞膜的Ras蛋白可被表皮生长因子受体(epidermal growth factor receptor,EGFR)等受体及鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF)所激活。GEF可实现Ras蛋白由非活化状态GDP-Ras向活化状态GTP-Ras转变,从而激活Ras蛋白及其下游MAPK和PI3K-Akt这两条细胞主干信号通路,以维持细胞的正常增殖和分化等生理功能。GTP酶活化蛋白(GTPase-activating protein,GAP)可催化GTP-Ras中GTP的水解,使Ras蛋白转变成GDP-Ras状态,反馈性地抑制Ras活性,防止Ras下游信号通路的持续激活[11]。而当Ras基因发生致癌突变时,GAP将无法水解GTP-Ras中的GTP,致使Ras一直处于激活状态,从而导致Ras下游信号通路的持续异常活化及细胞的癌性转变[11]。
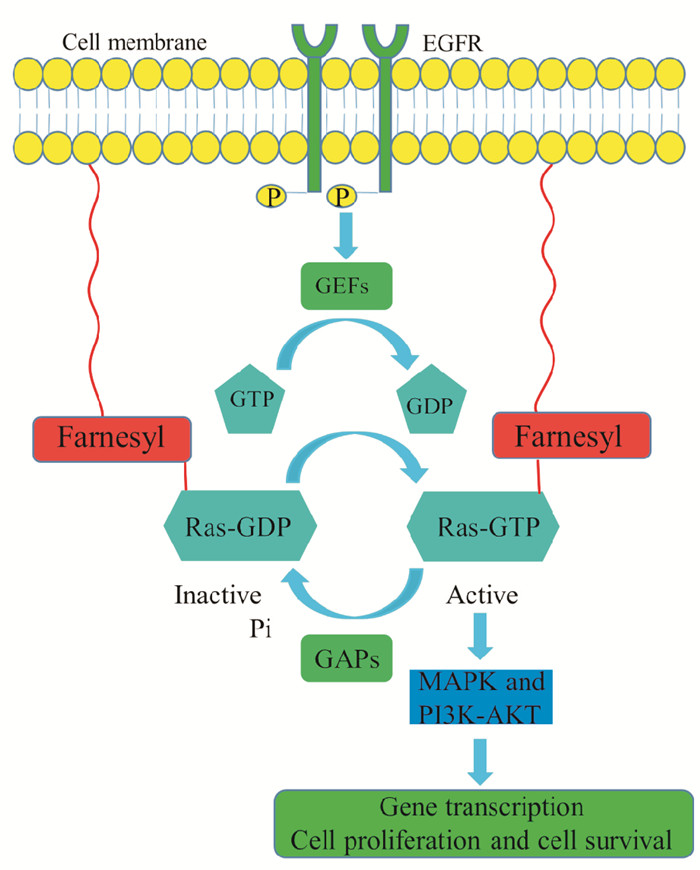
|
| Fig 1 Schematic diagram of activation of Ras protein and its downstream MAPK and PI3K-Akt signaling pathways |
作为一种在胞质中刚被表达的Ras前体蛋白是没有活性的,它需要经历诸多翻译后修饰包括聚异戊二烯化(3个异戊二烯即可形成法尼基)、蛋白水解和羧基甲基化等才能转变成有活性的Ras蛋白[12]。Ras蛋白的法尼基化是其翻译后修饰的第一步。在FTase催化作用下,其可将一个含有15个碳原子的法尼基异戊二烯脂连接到Ras蛋白羧基端CAAX四肽基序的半胱氨酸巯基上,其中C是半胱氨酸,A是一种脂肪族氨基酸,X是丝氨酸或甲硫氨酸。Ras蛋白被法尼基化后,法尼基异戊二烯可以将Ras固定在内质网上。位于内质网上的Ras蛋白羧基端CAAX四肽基序中的AAX进而被RCE1(Ras-converting CAAX endopeptidase 1,RCE1)所酶切水解。之后在ICMT (isoprenylcysteine carboxyl methyltransferase)酶的作用下,一个羧甲基被连接到羧基末端的半胱氨酸上。最后,在棕榈酰转移酶(palmitoyltransferase) 的作用下,两个棕榈酰长链脂肪酸基团被分别连接到羧甲基化半胱氨酸上游的两个半胱氨酸上。此时,棕榈酰化的Ras蛋白拥有一个较强的疏水性尾巴,该尾巴使Ras蛋白对细胞膜具有较高的亲和力,并可将Ras蛋白固定于细胞膜,从而有利于Ras蛋白的激活[7]。
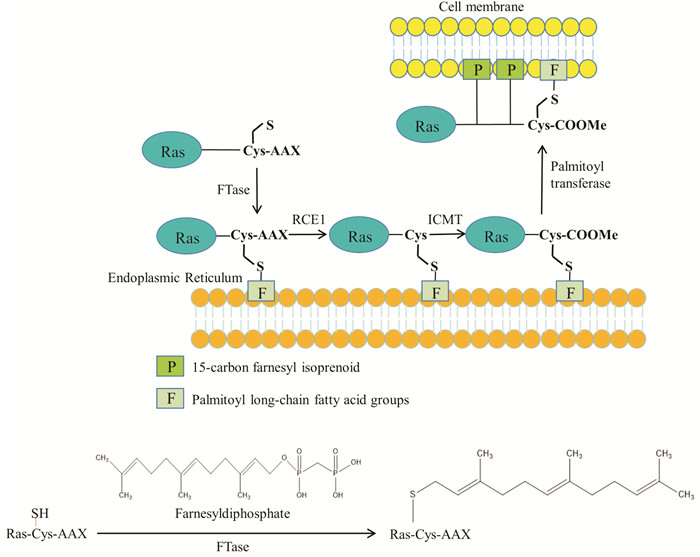
|
| Fig 2 The farnesylation and palmitoylation modification of Ras protein |
研究表明,FTase在肝癌、肺癌、卵巢癌和食管癌等癌组织中呈高表达态势,其可通过促进肿瘤细胞增殖、侵袭、转移、肿瘤血管生成和抑制肿瘤细胞凋亡而促进肿瘤的发生发展[6, 13-14]。FTase可以使Ras、CENP-E (centromere-associated protein E,CENP-E)、CENP-F和spindly等蛋白法尼基化,上述蛋白又是细胞增殖和细胞周期进程的重要调控分子。FTase促进肿瘤发生发展的分子机制主要与Ras蛋白有关,因Ras-MAPK和Ras-PI3K-Akt信号通路异常活化在肿瘤细胞增殖、侵袭、转移和血管生成过程中发挥着重要作用[14-15]。
3 FTase抑制剂自从发现Ras蛋白的法尼基化对其功能至关重要以来,FTase抑制剂(FTIs) 逐渐成了抗肿瘤药物研究热点。根据FTIs结构及其抑制FTase的作用机制,可将FTIs分为4类:(1)CAAX四肽基序及其模拟物,(2)法尼基焦磷酸(Farnesyl pyrophosphate,FPP,它是法尼基的活化形式)模拟物,(3)过渡态模拟物,(4)其它化合物[16]。
最初的FTIs即为野生型K-Ras羧基端CVIM四肽,后续研究工作对该四肽化合物进行了改造,主要目的是为了减少该类FTIs骨架中的酰胺键,降低FTIs在体内被蛋白酶水解的风险,提高FTIs的半衰期。此外,还可通过替换CAAX四肽中的氨基酸A,以提高其活性。如将CVIM四肽化合物中异亮氨酸(I)替换成疏水性更强的苯丙氨酸(F),则CVFM四肽化合物的FTIs活性明显增强[17](Fig 3)。
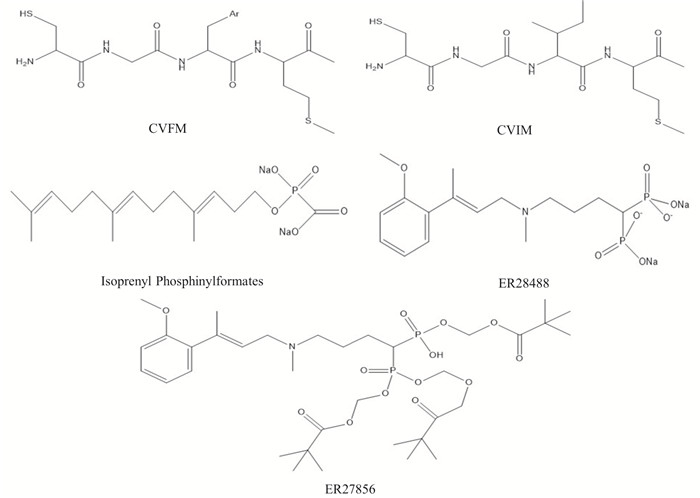
|
| Fig 3 The chemical structures of CVFM, CVIM, isoprenyl phosphinylformates, ER28488 and ER27856 |
目前已有100多种各类FTIs被发现[8, 18],其中5种化合物替吡法尼、洛那法尼、安卓奎诺尔、BMS-214662和L778123已进入临床实验研究阶段或已完成临床实验。近期,替吡法尼和洛那法尼已被美国食品药品监督管理局(Food and Drug Administration,FDA)批准分别用于T细胞淋巴瘤和早衰症的治疗。
3.1 FTase的底物模拟物底物蛋白羧基端的CAAX四肽基序及法尼基焦磷酸(FPP,法尼基的活化形式)是FTase最直接的底物。在FTase的催化作用下,其可将法尼基共价连接到CAAX四肽基序中半胱氨酸巯基上。基于这一机制,当前已合成或发现诸多底物模拟物,这些模拟物可以与CAAX四肽基序或法尼基焦磷酸竞争结合FTase的活性中心,从而抑制FTase对底物的催化作用。
除了上文所述的CVIM和CVFM外,其它FTIs活性较好的底物模拟物还包括isoprenyl phosphinylformates、ER-28488和ER-27856等,其中后3种化合物属于FPP的类似物。ER-28488及其前体ER-27856对FTase的半抑制浓度(IC50)分别为3.6 nmol·L-1和39 μmol·L-1[6]。
3.2 过渡态模拟物在FTase催化法尼基连接至半胱氨酸巯基上时,半胱氨酸会形成一个碳正离子中间体,一些能够很好模拟碳正离子中间体的化合物如铵类似物(ammonium analogues)、N-芳烷基-法尼胺衍生物(N-arylalky-farnesylamine derivative)和RPR 101821(一个质子化的环已胺衍生物),它们能够与碳正离子中间体竞争结合FTase的酶活性中心,进而抑制FTase活性[6, 19]。
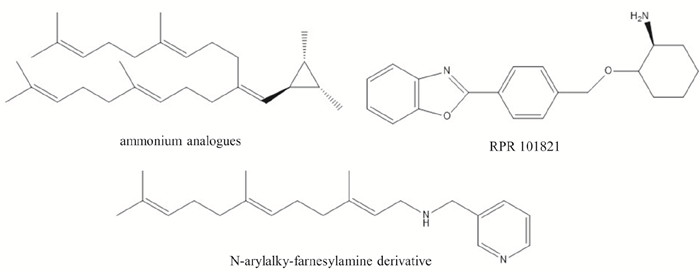
|
| Fig 4 The chemical structures of ammonium analogues, RPR 101821 and N-arylalky-farnesylamine derivative |
|
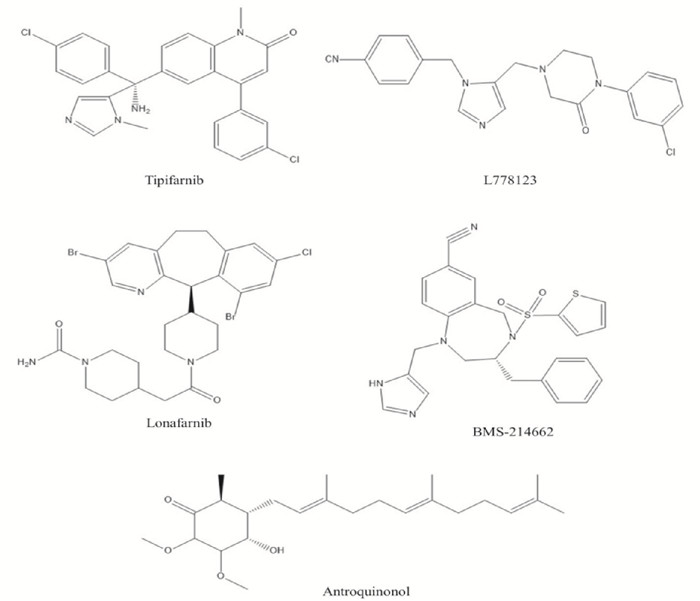
| Fig 5 The chemical structures of tipifarnib, L778123, lonafarnib, BMS-214662 and antroquinonol |
除了底物模拟物和过渡态模拟物,还有许多不能归属于上述两类模拟物的化合物也表现出较强的FTIs活性,这些化合物包括替吡法尼、洛那法尼、安卓奎诺尔、BMS-214662、L778123、L744832、TAK-475、Manumycin-A、FTI-276、FTI-277、FTI-2153、LB-42708、Moverastin和ABT-100等,其中前5个化合物已进入临床实验研究阶段或已完成临床实验。值得注意的是,替吡法尼和洛那法尼已于2020年被FDA批准分别用于T细胞淋巴瘤和早衰症的临床治疗。
3.3.1 替吡法尼替吡法尼是一种强效的FTase特异性抑制剂,其对FTase的IC50值可低达7.9 nmol·L-1。有研究检测替吡法尼对53种常见人类肿瘤细胞系增殖的抑制效果,发现75%的肿瘤细胞系均对替吡法尼敏感,而且绝大多数对替吡法尼敏感的肿瘤细胞系均发生了H-Ras或N-Ras突变[20]。临床研究结果显示,在已接受替吡法尼单药疗法的重度预防治疗的T细胞淋巴瘤患者中,客观缓解率(objective response rate,ORR)约为50%。而在携带杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)突变体的患者中,替吡法尼的抗肿瘤活性明显增强,这些患者的ORR可达70%,完全缓解率(complete remission,CR) 达40%[21]。于2020年,替吡法尼已被FDA批准用于T细胞淋巴瘤的临床治疗。
|
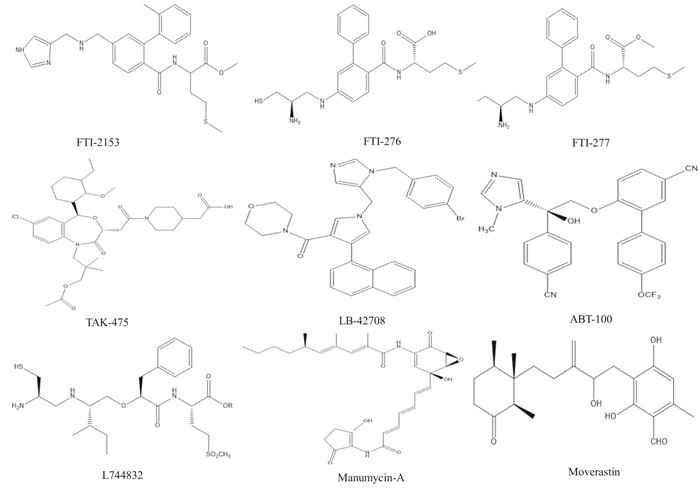
| Fig 6 The chemical structures of FTI-2153, FTI-276, FTI-277, TAK-475, LB-42708, ABT-100, L744832, Manumycin-A and Moverastin |
此外,应用替吡法尼治疗膀胱癌[22]、唾液腺癌[23]、慢性粒细胞白血病、甲状腺癌[24]、乳腺癌、胶质母细胞瘤和肺癌等肿瘤正处于各期临床实验阶段。
3.3.2 洛那法尼洛那法尼也是一种特异性FTase抑制剂,有研究表明,其对7种常见肿瘤细胞的72 h平均IC50值约为8 μmol·L-1[25]。于2020年洛那法尼被FDA批准用于早衰症的治疗。因洛那法尼可以有效抑制FTase对早衰素(presenilin) 的法尼基化,从而降低早衰素在细胞核中的积累[26]。此外, 2018年FDA还授予洛那法尼用于治疗丁型肝炎病毒(HDV) 感染的突破性药物资格(breakthrough therapy designation,BTD)[27]。
3.3.3 安卓奎诺尔安卓奎诺尔是一种萃取自台湾特有珍稀物种牛樟芝(Antrodia camphorata)的天然小分子化合物,它也是一种强效的FTase抑制剂[28]。有许多研究从不同角度探讨了安卓奎诺尔抑制肺癌、乳腺癌、肝癌、结直肠癌和胰腺癌生长的分子机制[28]。机制研究发现,安卓奎诺尔的环状结构可以直接结合于FTase活性中心的Ras-CAAX四肽基序结合位点,从而竞争性抑制Ras蛋白的法尼基化及其功能[28]。安卓奎诺尔对非小细胞肺癌(non-small cell lung cancer,NSCLC)的Ⅱ期临床研究结果显示,单独使用安卓奎诺尔可提高肺癌的控制率,延长无进展生存期(progress free survival,PFS) 和总生存期(overall survival,OS)。虽然安卓奎诺尔对K-Ras突变阴性肺癌患者的治疗效果明显优于对K-Ras突变阳性肺癌患者的治疗效果,但目前安卓奎诺尔仍然是治疗K-Ras突变阳性肺癌患者唯一有效药物[29]。此外,评价安卓奎诺尔的抗乙肝病毒(HBV)活性,探讨安卓奎诺尔在慢性乙肝中的治疗作用机制的Ⅱ期临床实验也正在进行中(Clinical Trials编号: NCT04112147和NCT036 25102)。其它曾经进入Ⅰ期临床抗肿瘤研究的FTIs还包括BMS-214662和L778123,但由于存在较大的毒副作用,它们未能进一步进入更大规模的临床研究。
3.3.4 TAK-475等TAK-475又名拉帕司他(lapaquistat),一度进入Ⅱ期和Ⅲ期临床研究,但由于其较强的肝脏毒性,在临床实验过程中被FDA叫停。此外,化合物L744834、Manumycin-A、FTI-276、FTI-277、FTI-2153、LB-42708、Moverastin和ABT-100等也具有较强的FTIs活性,目前它们正处于临床前抗肿瘤活性评估和抗肿瘤作用机制研究阶段[30]。
4 总结与展望诸多研究表明,Ras蛋白在众多肿瘤的病理进程中发挥着重要作用,而FTase通过法尼基化将Ras蛋白固定于细胞膜是Ras蛋白活化所必需的。因此,FTase可在Ras介导下促进肿瘤的发生发展。因Ras蛋白结构的特殊性,致使其缺乏合适的小分子作用位点,所以很长时间以来Ras蛋白一直被认为是“无药可靶向的”。为了能够找到用于治疗Ras突变所诱发肿瘤的药物,FTase及其抑制剂逐渐成了研究的焦点。在过去20多年,共有100多种各型FTIs被发现,其中5种FTIs包括替吡法尼、洛那法尼、安卓奎诺尔、BMS-214662和L778123已进入或已完成临床实验,替吡法尼和洛那法尼已于2020年被FDA批准分别用于T细胞淋巴瘤和早衰症的临床治疗。
然而,还有很多FTIs止步于Ⅱ期临床研究或未进入临床研究,主要是因为这些FTIs表现出较强的毒副作用,包括严重的对正常细胞的毒性、肝脏毒性、胃肠不适和神经毒性等。基于对这些FTIs结构及其抑制FTase作用机制的认识,当前许多工作正在开展对这些FTIs进行结构改造或联合用药等方面的研究,以期提高这些FTIs的药效及降低其毒副作用。同时,随着新的化合物被合成、新的天然化合物被不断发现及高通量筛选技术的日趋完善,许多新的FTIs先导或候选化合物将会被识别鉴定,这将会为Ras突变所诱发肿瘤等疾病的治疗提供更多选择。
| [1] |
Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2020, 70: 313. |
| [2] |
An S, Yang Y, Ward R, et al. A-Raf: A new star of the family of raf kinases[J]. Crit Rev Biochem Mol Biol, 2015, 50: 520-31. doi:10.3109/10409238.2015.1102858 |
| [3] |
Dunnett-Kane V, Nicola P, Blackhall F, et al. Mechanisms of resistance to KRAS(G12C) inhibitors[J]. Cancers (Basel), 2021, 13. |
| [4] |
Moore A R, Rosenberg S C, McCormick F, et al. RAS-targeted therapies: Is the undruggable drugged[J]. Nat Rev Drug Discov, 2020, 19: 533-52. doi:10.1038/s41573-020-0068-6 |
| [5] |
Klochkov S G, Neganova M E, Yarla N S, et al. Implications of farnesyltransferase and its inhibitors as a promising strategy for cancer therapy[J]. Semin Cancer Biol, 2019, 56: 128-34. doi:10.1016/j.semcancer.2017.10.010 |
| [6] |
Ha N T, Lee C H. Roles of farnesyl-diphosphate farnesyltransferase 1 in tumour and tumour microenvironments[J]. Cells, 2020, 9(11): 2352. doi:10.3390/cells9112352 |
| [7] |
Wang J, Yao X, Huang J. New tricks for human farnesyltransferase inhibitor: Cancer and beyond[J]. Medchemcomm, 2017, 8: 841-54. doi:10.1039/C7MD00030H |
| [8] |
Dai X, Sun Y, Zhang T, et al. An overview on natural farnesyltransferase inhibitors for efficient cancer therapy[J]. J Enzyme Inhib Med Chem, 2020, 35: 1027-44. doi:10.1080/14756366.2020.1732366 |
| [9] |
Tisi R, Gaponenko V, Vanoni M, et al. Natural products attenuating biosynthesis, rrocessing, and activity of ras oncoproteins: State of the art and future perspectives[J]. Biomolecules, 2020, 10: 1535. doi:10.3390/biom10111535 |
| [10] |
Goebel L, Muller M P, Goody R S, et al. KRasG12C inhibitors in clinical trials: A short historical perspective[J]. RSC Med Chem, 2020, 11: 760-70. doi:10.1039/D0MD00096E |
| [11] |
Abankwa D, Gorfe A A. Mechanisms of ras membrane organization and signaling: Ras rocks again[J]. Biomolecules, 2020, 10: 1522. doi:10.3390/biom10111522 |
| [12] |
姜壮壮, 徐婷婷, 陶丽, 等. 肿瘤KRAS基因突变靶向治疗研究进展[J]. 中国药理学通报, 2019, 35(10): 1346-9. Jiang Z Z, Xu T T, Tao L, et al. Progress in targeted therapy of tumor KRAS gene mutation[J]. Chin Pharmacol Bull, 2019, 35(10): 1346-9. doi:10.3969/j.issn.1001-1978.2019.10.004 |
| [13] |
Yang Y F, Jan Y H, Liu Y P, et al. Squalene synthase induces tumor necrosis factor receptor 1 enrichment in lipid rafts to promote lung cancer metastasis[J]. Am J Respir Crit Care Med, 2014, 190: 675-87. doi:10.1164/rccm.201404-0714OC |
| [14] |
Tuzmen S, Hostetter G, Watanabe A, et al. Characterization of farnesyl diphosphate farnesyl transferase 1 (FDFT1) expression in cancer[J]. Per Med, 2019, 16: 51-65. doi:10.2217/pme-2016-0058 |
| [15] |
丁萌, 廖海秀, 周楠楠, 等. 吉非替尼耐药肺癌细胞株建立及其EGFR信号通路改变[J]. 中国药理学通报, 2020, 36(5): 634-39. Ding M, Liao H X, Zhou N N, et al. Establishment of gefitinib resistant lung cancer cell line and changes of EGFR signaling pathway[J]. Chin Pharmacol Bull, 2020, 36(5): 634-39. doi:10.3969/j.issn.1001-1978.2020.05.009 |
| [16] |
Shen M, Pan P, Li Y, et al. Farnesyltransferase and geranylgeranyltransferase I: Structures, mechanism, inhibitors and molecular modeling[J]. Drug Discov Today, 2015, 20: 267-76. doi:10.1016/j.drudis.2014.10.002 |
| [17] |
Sousa S F, Fernandes P A, Ramos M J. Theoretical studies on farnesyltransferase: The distances paradox explained[J]. Proteins, 2007, 66: 205-18. |
| [18] |
张明, 李诗良, 朱丽丽, 等. 新型法尼基转移酶抑制剂的发现及构效关系分析[J]. 药学学报, 2019, 54(1): 111-6. Zhang M, Li S L, Zhu L L, et al. Structure-activity relationship analysis of novel farnesyl transferase inhibitors[J]. Acta Pharm Sin, 2019, 54(1): 111-6. |
| [19] |
Koohang A, Bailey J L, Coates R M, et al. Enantioselective inhibition of squalene synthase by aziridine analogues of presqualene diphosphate[J]. J Org Chem, 2010, 75: 4769-77. doi:10.1021/jo100718z |
| [20] |
Epling-Burnette P K, Loughran T P. Suppression of farnesyltransferase activity in acute myeloid leukemia and myelodysplastic syndrome: Current understanding and recommended use of tipifarnib[J]. Expert Opin Investig Drugs, 2010, 19: 689-98. doi:10.1517/13543781003801076 |
| [21] |
Witzig T E, Tang H, Micallef IN, et al. Multi-institutional phase 2 study of the farnesyltransferase inhibitor tipifarnib (R115777) in patients with relapsed and refractory lymphomas[J]. Blood, 2011, 118: 4882-9. |
| [22] |
Lee H W, Sa J K, Gualberto A, et al. A phase Ⅱ trial of tipifarnib for patients with previously treated, metastatic urothelial carcinoma harboring HRAS mutations[J]. Clin Cancer Res, 2020, 26: 5113-9. doi:10.1158/1078-0432.CCR-20-1246 |
| [23] |
Hanna G J, Guenette J P, Chau N G, et al. Tipifarnib in recurrent, metastatic HRAS-mutant salivary gland cancer[J]. Cancer, 2020, 126: 3972-81. doi:10.1002/cncr.33036 |
| [24] |
Untch B R, Dos A V, Garcia-Rendueles MER, et al. Tipifarnib inhibits HRAS-driven dedifferentiated thyroid cancers[J]. Cancer Res, 2018, 78: 4642-57. doi:10.1158/0008-5472.CAN-17-1925 |
| [25] |
Marcus A I, Zhou J, O'Brate A, et al. The synergistic combination of the farnesyl transferase inhibitor lonafarnib and paclitaxel enhances tubulin acetylation and requires a functional tubulin deacetylase[J]. Cancer Res, 2005, 65: 3883-93. doi:10.1158/0008-5472.CAN-04-3757 |
| [26] |
Mullard A. The FDA approves a first farnesyltransferase inhibitor[J]. Nat Rev Drug Discov, 2021, 20: 8. |
| [27] |
Caviglia G P, Rizzetto M. Treatment of hepatitis D: An unmet medical need[J]. Clin Microbiol Infect, 2020, 26: 824-7. doi:10.1016/j.cmi.2020.02.031 |
| [28] |
Angamuthu V, Shanmugavadivu M, Nagarajan G, et al. Pharmacological activities of antroquinonol-mini review[J]. Chem Biol Interact, 2019, 297: 8-15. doi:10.1016/j.cbi.2018.10.009 |
| [29] |
Villaume M T, Sella E, Saul G, et al. Antroquinonol A: Scalable synthesis and preclinical biology of a phase 2 drug candidate[J]. ACS Cent Sci, 2016, 2: 27-31. doi:10.1021/acscentsci.5b00345 |
| [30] |
Wang J Y, Yao X, Huang J. New tricks for human farnesyltransferase inhibitor: Cancer and beyond[J]. Medchemcomm, 2017, 8: 841-54. doi:10.1039/C7MD00030H |

