

2. 广东省心血管病研究所心血管内科,广东 广州 510080;
3. 广东省人民医院(广东省医学科学院)医学研究部临床药理重点实验室,广东 广州 510080
张斌(1965-),男,博士生,研究方向:心血管内科学,通讯作者,E-mail:drbinzhang@163.com
 ,
WU Qing-rui1,3,
LI Qian1,2,
RAO Fang1,3,
KUANG Su-juan3,
YANG Hui3,
ZHANG Qian-huan2
,
WU Qing-rui1,3,
LI Qian1,2,
RAO Fang1,3,
KUANG Su-juan3,
YANG Hui3,
ZHANG Qian-huan2
 ,
ZHANG Bin1,2
,
ZHANG Bin1,2

2. Dept of Cardiology, Guangdong Institute of Cardiovascular Diseases, Guangzhou 510080, China;
3. Key Laboratory of Clinical Pharmacology, Medical Research Dept, Guangdong People's Hospital (Guangdong Academy of Medical Sciences), Guangzhou 510080, China
心脏压力负荷增高是多种心脏疾病共同存在的现象,这类心脏疾病常见包括原发/继发性高血压、心脏瓣膜疾病、原发/继发性心肌病以及肺动脉高压等,长时间的心脏压力负荷增高会引发心肌纤维化,造成心脏不可逆的损害,最终危害生命健康[1]。心肌纤维化是一种心脏受到异常刺激后不断发生损伤与修复的病理改变,主要是由于心肌成纤维细胞(CFs)增殖转化成肌成纤维细胞并大量分泌细胞外基质(ECM),最终ECM过度沉积所导致的[2]。ECM的主要成分为胶原蛋白,其中I型与Ⅲ型胶原蛋白(COL-1、COL-3)在心肌组织中占总胶原蛋白含量的90%以上,COL-1和COL-3比例异常升高会使得心肌变硬,最终出现收缩与舒张功能障碍[3]。
目前研究表明,转化生长因子β(transforming growth factor beta,TGF-β)参与纤维化的发生发展,是治疗纤维化的重要靶点。此外,TGF-β可以促进CFs分泌胶原蛋白,引起心肌纤维化[4],且在压力负荷诱导的心肌纤维化中也发挥着重要的作用[5]。
DNA加双氧酶TET (Ten-eleven translocation) 家族是一种去甲基化相关的DNA加双氧酶,它可以通过将5-甲基胞嘧啶(5-mC)氧化成5-羟甲基胞嘧啶(5-hmC)、5-胞嘧啶甲酰(5-fc)和5-胞嘧啶羧基(5-cac),5-fc与5-cac最终被胸腺嘧啶DNA糖基化酶(TDG)识别并消化,实现DNA去甲基化[6]。目前认为,DNA去甲基化与基因激活有关,研究发现TET2可以通过调控TGF-β调节区域的去甲基化实现TGF-β的激活,进而影响糖尿病肾病的发生发展[7]。另外也有研究报道DNA去甲基化参与主动脉缩窄小鼠心肌纤维化的发生发展[8];但在高压负荷下TET家族参与心肌纤维化的病理机制尚未明确。因此,本研究将Wistar及自发性高血压大鼠(spontaneous hypertension rat,SHR)作为动物模型、以高压诱导的原代SD乳大鼠心肌成纤维细胞(NRCFs)作为细胞模型,探讨高压负荷下心肌纤维化的发生机制是否与TET家族对TGF-β的甲基化修饰相关,旨在为高压负荷下防控心肌纤维化的发生提供新的治疗靶点,并为改善心肌纤维化患者的心功能提供新的治疗方案。
1 材料 1.1 实验动物出生7周的♂ SHR和Wistar大鼠,购自北京维通利华实验动物技术有限公司,生产许可证为SCXK(京)2016-0006。出生0-3d的SD乳大鼠,不限雌雄,购自南方医科大学实验动物中心,生产许可证号为SCXK(粤)2016-0041。动物质量检测单位为广东省实验动物检测所。动物实验获广东省人民医院(广东省医学科学院)伦理委员会批准,批准号No. GDREC2014095A。
1.2 主要试剂TET1(ab191698)、TET2(ab94580)、TET3 (ab139311),COL-1(ab34710)、COL-3(ab7778)和5-hmC(ab214728)抗体,均购自Abcam公司;TGF-β(3711)抗体购自CST公司;GAPDH(60004-1)抗体购自Proteintech公司;Loding Buffer(9173)和TB GreenⓇ Premix Ex TaqTM Ⅱ(RR820A)购自TaKaRa公司;蛋白酶抑制剂(539131)和RIPA裂解液(20-188)购自Millipore公司;Lipo3000转染试剂盒(L3000-015)购自Thermo公司;DMEM/F12培养基(C11330500BT)购自Gibco公司;BCA试剂盒(P0009)和DNA提取试剂盒(D0063)购自碧云天公司;TBS(AR0031)和PBS(AR0030)购自BOSTER公司;EpiMarkⓇ 5-hmC和5-mC分析试剂盒(E3317)购自NEB公司;Triton X-100(X100-100ML)购自Sigma公司;sh-RNA-TET1购自吉凯基因。
2 方法 2.1 动物实验 2.1.1 动物造模及心脏标本采集SHR是自发性高血压大鼠,其血压随鼠龄增高而不断增高,并在12周左右确立高血压,本研究将出生7周的雄性Wistar大鼠(n=6)作为正常血压对照组,性别周龄匹配的SHR(n=6)作为高血压组,饲养于恒定的标准室温、湿度和光照周期下,自由进食标准鼠食及自来水,饲养8周后,根据SHR与Wistar大鼠的血压明确SHR造模是否成功。血压的测量采用无创血压计测定大鼠尾部动脉血压,测量3次并取其均值为1次血压。
将造模成功的SHR与Wistar大鼠称重,腹腔注射戊巴比妥钠(30 mg·kg-1)麻醉,待麻醉后颈椎脱臼法处死大鼠,快速取出整颗心脏标本,冰上快速分离出大鼠左心室组织,并剪取绿豆大小的左心室组织置入预冷的多聚甲醛(40 g·L-1)中4 ℃保存,用于后续的HE及Masson染色,剩余一部分心肌组织置于-80 ℃保存备用。
2.1.2 Western blot心脏组织总蛋白提取:剪取适量组织块,PBS清洗后加入RIPA裂解液(含10 g·L-1的蛋白酶抑制剂),冰上破碎裂解20-30 min,12 000 r·min-1 4 ℃离心15 min,取上清为组织总蛋白。采用BCA法测蛋白浓度,按照20 μg蛋白上样量配置上样缓冲液,经变性、电泳、电转,封闭后用相应的一抗(1 ∶1 000稀释)4 ℃孵育过夜,用与一抗相同来源的二抗(1 ∶5 000稀释)室温孵育1 h,最后使用ECL法显影目的条带,Image J软件测定条带灰度值,并计算目的条带与内参GAPDH灰度值的比值。
2.1.3 HE和Masson染色将Wistar大鼠和SHR的左心室心肌组织在多聚甲醛(40 g·L-1)中固定48 h后,进行石蜡包埋,切片,HE和Masson染色,光学显微镜下观察心肌形态及心肌纤维胶原的改变。
2.2 细胞实验 2.2.1 原代NRCFs分离及造模快速取出0-3 d的SD乳大鼠心脏,用酶解法将心肌组织消化成单个细胞,再利用心肌细胞与NRCFs贴壁时间的差异分离出NRCFs,使用的酶液为含有胰酶(0.8 g·L-1, 溶剂为PBS溶液)和胶原酶(0.8 g·L-1, 溶剂为PBS溶液)的混合酶。用含10% 胎牛血清的DMEM/F12培养基培养NRCFs,并将细胞置于37 ℃、5% CO2培养箱中培养,待细胞密度达到80%-90% 时进行细胞传代。选取P2-P5代NRCFs进行干预。使用我们自行研制的高压装置,可提供并维持一定的压力(专利号201420109263.1,中国),根据大鼠正常左心室的压力负荷为90 mmHg-120 mmHg,设置0 mmHg为对照组、120 mmHg为正常压力组、180 mmHg为高压力组,处理24 h,并以NRCFs的纤维化相关蛋白(COL-1和COL-3)表达的增加来判断心肌纤维化模型是否建立成功。
2.2.2 原代NRCFs质粒转染采用Lipofectamine 3000试剂对NRCFs进行质粒转染,分别设置Control+Neg组、180 mmHg+Neg组和180 mmHg+sh-TET1组。在细胞成长至80%-90% 的密度时,按125 μL ∶7.5 μL比例加入Opti-MEMTM培养基与Lipofectamine 3000试剂,混匀;按125 μL ∶2.5 μg比例加入Opti-MEMTM培养基稀释DNA,然后添加5 μL的P3000试剂;按1 ∶1的比例在每管已稀释的LipofectamineTM 3000试剂中加入稀释的DNA,室温孵育15 min,将DNA-脂质复合物加入到细胞中,转染24 h换液,继续转染24 h,显微镜观察细胞转染效率。
2.2.3 Western blot细胞总蛋白提取:将处理好的细胞用PBS清洗残留培养液,加入RIPA裂解液(含10 g·L-1的蛋白酶抑制剂),冰上静置裂解20-30 min,收集裂解液,12 000 r·min-1 4 ℃离心15 min,取上清为细胞总蛋白。其余步骤同“2.1.2”。
2.2.4 细胞免疫荧光在贴壁的NRCFs中加入多聚甲醛(40 g·L-1)固定细胞15 min,PBS洗净;加入Triton X-100(2 g·L-1)通透细胞20 min,PBS洗净;加入HCl(2 mol·L-1)变性细胞30 min,PBS洗净;加入BSA(50 g·L-1)封闭细胞30 min,去除BSA,加入一抗(5-hmC, 1 ∶500),置于避光湿盒中4 ℃孵育过夜,加入适量的荧光二抗(1:200)室温孵育1 h;最后加入DAPI染细胞核,激光共聚焦显微镜观察染色结果,Image J软件测定目的细胞5-hmC的平均荧光强度。
2.2.5 5-mC与5-hmC的水平检测使用碧云天公司的DNA提取试剂盒提取NRCFs的DNA,将提取好的DNA使用NEB公司的EpiMark试剂盒来分析5-mC与5-hmC的水平。这种方法是利用了同分异构体Mspl和Hpall对不同修饰的DNA甲基化敏感性来区分5-mC和5-hmC。将目的基因组DNA用T4-BGT处理,将所有的5-hmC葡萄糖化(5-ghmC),但是未修饰或含有5-mC的DNA不受影响。糖基化后使用Mspl和Hpall限制性内切酶消化相同的目的序列(CCGG),Hpall只裂解一个完全未修饰的位点,任何修饰(5-mC、5-hmC或5-ghmC)在任何一个胞嘧啶都将阻断裂解;而Mspl识别和切割5-mC和5-hmC,但不识别和切割5-ghmC。
将不同限制性内切酶裂解的DNA样品用荧光定量PCR来分析DNA片段的5-mC与5-hmC的变化。将目的DNA配置成10 μL的PCR反应体系,内含:5 μL TB GreenⓇ Premix Ex Taq,3.2 μL超纯水,0.4 μL PCR正义引物,0.4 μL PCR反义引物,1 μL DNA模板。反应条件如下:95 ℃ 2 min,PCR反应40个循环(95 ℃ 25 s,58 ℃ 25 s,72 ℃ 25 s),72 ℃ 5 min,60 ℃ 25 s,95 ℃ 15 s。通过2-ΔΔCT法计算基因的相对表达水平,β-actin作为内参对照。TGF-β引物序列:Forward 5′-GCCGCGGATCCTCCAGAC A-3′, Reverse 5′-CAGACTCTGGGGCCTCGGA-3′,β-actin引物序列:Forward 5′-TGTCCCTGTATGCCTC TGGT-3′, Reverse 5′-GATGTCACGCACGATTTCC-3′。
2.3 统计学处理用SPSS 20.0统计软件进行统计学分析,用GraphPad Prism 6.01将统计结果绘制成柱形图,计量资料以x±s方式表示,两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA)。
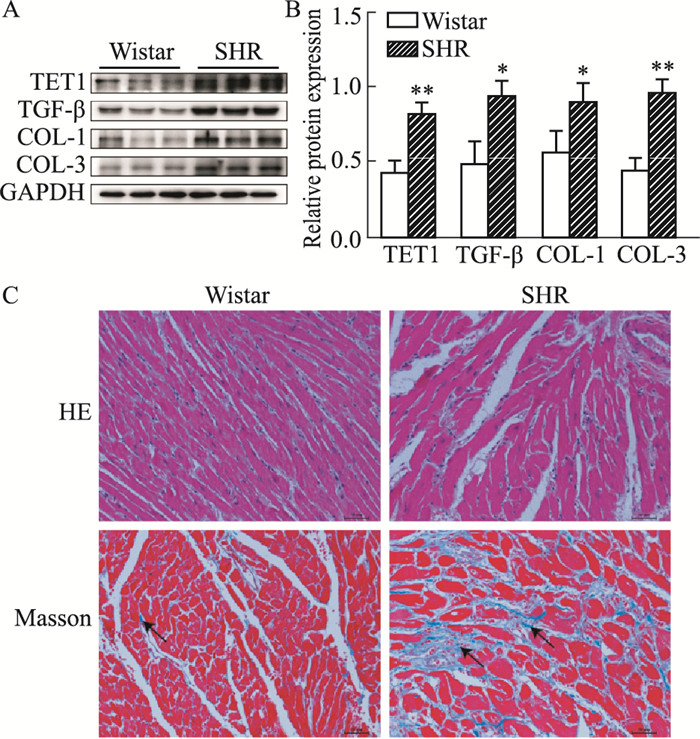
3 结果 3.1 SHR心肌纤维化改变及TET1和TGF-β蛋白表达水平变化为了探索在体TET与TGF-β以及心肌纤维化的关系,选取Wistar与SHR大鼠心室肌组织来检测心肌纤维化以及TET、TGF-β蛋白表达水平的改变。结果显示:与Wistar大鼠相比,SHR大鼠血压明显升高(P<0.01,Tab 1),心室组织中的TET1、TGF-β、COL-1和COL-3的蛋白表达均增加(P<0.05, Fig 1A)。HE染色显示心肌细胞间质增加、排列紊乱,心肌细胞呈现肥大状态。Masson染色可见心肌组织间胶原纤维增多(Fig 1C)。
| Group | Wistar | SHR | t-test |
| Studied animals(n) | 6 | 6 | |
| SBP/mmHg | 130.83±3.01 | 188.67±7.11 | P<0.01 |
| DBP/mmHg | 99.22±10.49 | 141.33±7.38 | P<0.01 |
| MAP/mmHg | 109.76±7.67 | 157.11±6.66 | P<0.01 |
| SBP: systolic blood pressure; DBP: diastolic blood pressure; MBP: mean arterial pressure. Data are presented as x±s. n=6. | |||
|
| Fig 1 Expressions of TET1, TGF-β and fibrosis related protein in myocardium of Wistar rats and SHR A-B: Representative blots and densitometry analysis of TET1, TGF-β, COL-1 and COL-3 in the myocardium of Wistar rats and SHR. GAPDH was used as an internal control. Data are presented as x±s (n=3). *P < 0.05, **P < 0.01 vs Wistar rats. C: HE and Masson staining. Scale bar: 50 μm. |
将P2-P5代心肌成纤维细胞置于不同的压力(0、120、180 mmHg)中培养24 h,使用Western blot检测不同压力梯度下COL-1和COL-3的表达,以及检测促纤维化因子TGF-β的表达。结果显示:与对照组相比,随着120 mmHg与180 mmHg压力梯度的增高,TGF-β蛋白表达水平以及COL-1和COL-3蛋白均逐渐升高,在180 mmHg压力下达最高水平(P<0.01, Fig 2A);而与120 mmHg压力组相比,180 mmHg压力组的上述蛋白表达水平均有增加,但差异无统计学意义(P>0.05,Fig 2A)。

|
| Fig 2 High pressure affected expression of fibrosis-related proteins and TGF-β in NRCFs A-B: Representative blots and densitometry analysis of TGF-β, COL-1 and COL-3 in the NRCFs under different pressure. GAPDH was used as an internal control, 1 mmHg=0.133 kPa. Data are presented as x±s (n=3). *P < 0.05, **P < 0.01 vs Control groups. |
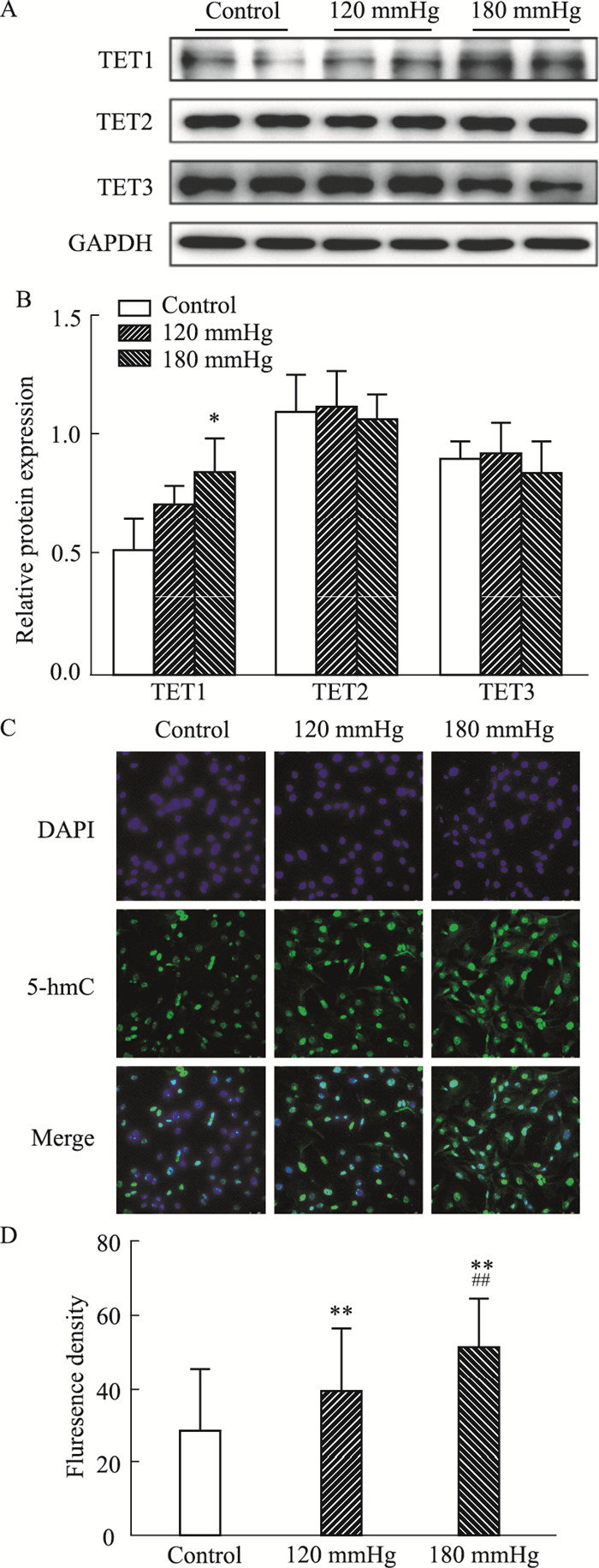
在高压诱导NRCFs中纤维化相关蛋白高表达的基础上,使用Western blot检测TET1、TET2和TET3的蛋白表达,以及使用免疫荧光检测5-hmC的荧光强度。结果显示:与对照组相比,压力负荷组5-hmC的荧光强度明显增加,并呈压力依赖性(P<0.01, Fig 3C);去甲基化相关酶TET1蛋白表达随着压力梯度的升高而升高,但仅在180 mmHg组差异有统计学意义(P<0.05, Fig 3A),而TET2和TET3无明显的变化(P>0.05, Fig 3A)。以上结果显示,在高压诱导心肌纤维化模型中,细胞呈现了去甲基化的趋势,且这种改变与TET1表达升高相关,提示TET1在高压诱导的心肌纤维化中可能发挥着重要的作用。
|
| Fig 3 High pressure affected TET1 expression and 5-hmC level in NRCFs A-B: Representative blots and densitometry analysis of TET1, TET2 and TET3 in the NRCFs under different pressure. GAPDH was used as an internal control. Data are presented as x±s. n=3. C-D: Representative fluorescence images and intensity analysis of 5-hmC in the NRCFs under different pressure. Scale bar: 100 μm. 1 mmHg=0.133 kPa. Data are presented as x±s. n=50 cells was quantified. *P < 0.05, **P < 0.01 vs Control groups; ##P < 0.01 vs 120 mmHg groups. |
为了进一步明确高压状态下5-hmC的水平增加与TET1的高表达相关,我们对180 mmHg压力下的NRCFs予以TET1 shRNA质粒转染敲低TET1(转染效率见补充Fig 1),观察5-hmC水平的变化。结果发现,TET1 shRNA质粒转染后TET1表达水平降低(P<0.01, Fig 4A)并伴随着5-hmC水平的降低(P<0.01, Fig 4C),说明TET1参与调控高压状态下5-hmC水平的变化。

|
| 图 4 Knockdown of TET1 affected 5-hmC level under high pressure A-B: Representative blots and densitometry analysis of TET1 in the NRCFs after treated with TET1 shRNA. GAPDH was used as an internal control. Data are presented as x±s. n=3. C-D: Representative fluorescence images and intensity analysis of 5-hmC in the NRCFs after treated with TET1 shRNA. Scale bar: 100 μm. Data are presented as x±s. n=50 cells was quantified. 1:Control+Neg; 2:180 mmHg+Neg; 3:180 mmHg+sh-TET1;**P < 0.01 vs Control+Neg groups; ##P < 0.01 vs 180 mmHg+sh-TET1. |
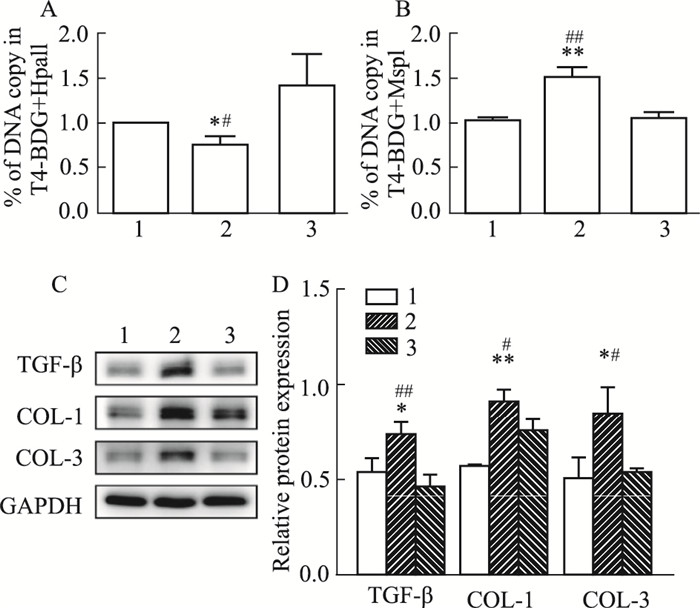
为了确定TET1在高压相关的心肌纤维化中发挥关键作用,在高压下敲低TET1的NRCFs中进一步检测纤维化相关蛋白和TGF-β的表达,以及TGF-β启动子区域5-hmC的水平。结果显示,敲低TET1之后,TGF-β表达水平下降(P<0.01,Fig 5C),并伴随着纤维化相关蛋白COL-1和COL-3表达降低(P<0.05,Fig 5C);此外,TGF-β启动子区域5-hmC在敲低TET1后水平明显降低(P<0.01,Fig 5B),而5-mC和5-hmC的总水平升高(P<0.05,Fig 5A),提示敲低TET1促使TGF-β启动子区域甲基化。此部分研究显示,高压状态下敲低TET1可以通过促进TGF-β启动子区域甲基化从而降低TGF-β表达以及降低纤维化相关蛋白的表达。
|
| Fig 5 Knockdown of TET1 affected 5-hmC level in TGF-β promoter region, TGF-β expression and fibrosis related proteins induced by high pressure A: RT-PCR analysis of DNA copy in TGF-β promoter region in the NRCFs after treated with Hpall, Hpall digestion identifies 5-hmC and 5-mc levels. Data are presented as x±s (n=3). B: RT-PCR analysis of DNA copy in TGF-β promoter region in the NRCFs after treated with Mspl, Mspl digestion identifies 5-hmC levels. Data are presented as x±s (n=3). C-D: Representative blots and densitometry analysis of TGF-β, COL-1 and COL-3 in the NRCFs after treated with TET1 shRNA. GAPDH was used as an internal control. Data are presented as x±s (n=3).1:Control+Neg; 2:180 mmHg+Neg; 3:180 mmHg+sh-TET1. *P < 0.05, **P < 0.01 vs Control groups; #P < 0.05, ##P < 0.01 vs 180 mmHg+sh-TET1 groups. |
本研究结果表明,压力负荷增高,DNA加双氧酶TET1、5-hmC、TGF-β以及纤维化相关蛋白增加;高压下敲低TET1可以降低TGF-β启动子区5-hmC水平、增加5-mC和5-hmC总水平,以及降低TGF-β表达,抑制纤维化相关蛋白表达。提示TET1可能通过调控TGF-β启动子区域去甲基化进而激活TGF-β表达,参与高压负荷诱导的心肌纤维化。
心脏高压负荷会通过持续的机械应力诱发心脏的一系列自我保护作用,包括心肌肥大以及心肌纤维化等,其中心肌纤维化以胶原沉积为主要特征,最终会导致心脏顺应性下降,收缩与舒张功能障碍,心力衰竭。已有研究表明,机体内心血管系统承受的三种不同的力学刺激,剪切应力、牵张力和静水压[9];剪切应力是指血流对细胞表面产生的摩擦力[10]。牵张力是指血流导致血管扩张和回缩产生的力[11];静水压是指血流对单位面积血管壁的压力(即血压)[9]。我们认为高压负荷所导致心脏的一系列病理改变,其主要的力学改变是高静水压。静水压升高进而导致心脏扩大,发生牵拉,导致牵张力的增加。因此,本研究使用自行研制的高静水压装置,在体外给予一定的压力负荷,以观察高压负荷导致心肌纤维化的病理机制。在本课题组已报道研究中,通过体外高压装置给与心房肌成纤维细胞20 mmHg及40 mmHg压力梯度来模仿心房高压状态,并发现心肌纤维化相关因子水平随压力梯度升高,成功构建心房肌成纤维细胞心肌纤维化模型[12]。在本研究中,通过体外给与NRCFs 120 mmHg及180 mmHg的压力来模仿心室的正常压力和高压状态,发现NRCFs在120 mmHg及180 mmHg压力处理24 h后,促纤维化因子TGF-β以及心肌纤维化相关蛋白COL-1和COL-3呈现稳定的梯度增加,以高压180 mmHg更为明显。
TGF-β作为已知的心肌纤维化发病重要靶点,主流研究聚焦于TGF-β与Smad家族蛋白之间的关系,认为TGF-β可以通过结合于细胞膜TGF-β的I型和Ⅱ型受体形成复合体,然后作用于胞质中的Smad家族蛋白并使其磷酸化活化,进而启动纤维化的发生[13-14]。但是在心肌纤维化中何种机制能够调控TGF-β还未得到很好阐明。本研究中,不论是细胞高压模型还是SHR动物模型中,TGF-β表达均明显升高,与目前主流研究一致,因此需进一步探索调控TGF-β的作用机制。
TET家族蛋白是DNA去甲基化最主要的因子,通过将5-mC氧化成5-hmC启动去甲基化过程进而调控基因的表达[15]。研究表明,DNA去甲基化与心肌纤维化存在密切关系。如在升主动脉缩窄模型小鼠中,骨形成蛋白7通过促进RASAL1启动子去甲基化,促进RASAL1表达增加,进而减少了心肌纤维化[8];在SHR心脏中,也发现抑制DNA甲基化可以显著减少心肌胶原蛋白沉积以及心肌细胞的大小[16]。虽然直接关注TET家族蛋白在器官纤维化中作用的研究不多,但在硬皮病患者的成纤维细胞中,TET1的mRNA水平明显高于正常成纤维细胞,5-hmC水平明显升高,总体甲基化水平降低[17],提示TET1与硬皮病患者的纤维化有着密切关系。本研究中,在120 mmHg与180 mmHg压力造模成功的基础上,发现5-hmC的水平梯度上升,TET1蛋白表达梯度升高,而TET2和TET3并无明显改变,并在SHR中也发现了TET1表达升高,提示TET1可能通过调控DNA去甲基化参与高压诱导的心肌纤维化。进一步在180 mmHg压力状态下敲低NRCFs的TET1,发现5-hmC水平和TGF-β蛋白表达均下降,且伴随着COL-1和COL-3蛋白表达下降,说明TET1在高压诱导的TGF-β参与的心肌纤维化中发挥着重要作用。有研究发现,在糖尿病肾病中,TET2可以通过调节TGF-β调节区域的去甲基化进而激活TGF-β的表达来调控糖尿病肾病的发病。本研究中,在敲低TET1的基础上,发现TGF-β启动子区域5-hmC水平降低,而5-mC及5-hmC总水平升高,说明敲低TET1后TGF-β启动子区域中甲基化水平增高,抑制了高压状态下被激活的TGF-β,进一步说明在高压诱导的心肌纤维化模型中,TET1可以调控TGF-β启动子区域的去甲基化进而调控TGF-β的表达。
综上所述,本研究初步证实TET1可能通过调控TGF-β启动子区域的去甲基化来激活TGF-β参与高压诱导的心肌纤维化。本研究的创新点在于将DNA去甲基化相关酶TET1与TGF-β参与的高压诱导的心肌纤维化关联起来,旨在探索高压诱导的心肌纤维化的发生机制,寻找高压诱导心肌纤维化的潜在药物治疗靶点。
| [1] |
Moore-Morris T, Camboa N, Banerjee I, et al. Resident fibroblast lineages mediate pressure overload-induced cardiac fibrosis[J]. J Clin Invest, 2014, 124(7): 2921-34. doi:10.1172/JCI74783 |
| [2] |
Ma Z G, Yuan Y P, Wu H M, et al. Cardiac fibrosis: new insights into the pathogenesis[J]. Int J Biol Sci, 2018, 14(12): 1645-57. doi:10.7150/ijbs.28103 |
| [3] |
Venero J V, Doyle M, Shah M, et al. Mid wall fibrosis on CMR with late gadolinium enhancement may predict prognosis for LVAD and transplantation risk in patients with newly diagnosed dilated cardiomyopathy-preliminary observations from a high-volume transplant centre[J]. ESC Heart Fail, 2015, 2(4): 150-9. doi:10.1002/ehf2.12041 |
| [4] |
谭嘉安, 刘英华, 张根水, 宜全. 和厚朴酚对TGF-β1诱导的心肌成纤维细胞迁移的影响[J]. 中国药理学通报, 2020, 36(11): 1536-41. Tan J A, Liu Y H, Zhang G S, Yi Q. Effect of honokiol on TGF-β1-induced migration in cardiac fibroblasts[J]. Chin Pharmacol Bull, 2020, 36(11): 1536-41. doi:10.3969/j.issn.1001-1978.2020.11.011 |
| [5] |
Zhang C L, Zhao Q, Liang H, et al. Cartilage intermediate layer protein-1 alleviates pressure overload-induced cardiac fibrosis via interfering TGF-β1 signaling[J]. J Mol Cell Cardiol, 2018, 116: 135-44. doi:10.1016/j.yjmcc.2018.02.006 |
| [6] |
Yin X, Xu Y. Structure and function of TET Enzymes[J]. Adv Exp Med Biol, 2016, 945: 275-302. |
| [7] |
Yang L, Zhang Q, Wu Q, et al. Effect of TET2 on the pathogenesis of diabetic nephropathy through activation of transforming growth factor β1 expression via DNA demethylation[J]. Life Sci, 2018, 207: 127-37. doi:10.1016/j.lfs.2018.04.044 |
| [8] |
Xu X, Tan X, Tampe B, et al. Epigenetic balance of aberrant Rasal1 promoter methylation and hydroxymethylation regulates cardiac fibrosis[J]. Cardiovasc Res, 2015, 105(3): 279-91. doi:10.1093/cvr/cvv015 |
| [9] |
Sumpio B E, Widmann M D, RICOTTA J, et al. Increased ambient pressure stimulates proliferation and morphologic changes in cultured endothelial cells[J]. J Cell Physiol, 1994, 158(1): 133-9. doi:10.1002/jcp.1041580117 |
| [10] |
Albuquerque M L, Waters C M, Savla U, et al. Shear stress enhances human endothelial cell wound closure in vitro[J]. Am J Physiol Heart Circ Physiol, 2000, 279(1): H293-302. doi:10.1152/ajpheart.2000.279.1.H293 |
| [11] |
Iba T, Sumpio B E. Morphological response of human endothelial cells subjected to cyclic strain in vitro[J]. Microvasc Res, 1991, 42(3): 245-54. doi:10.1016/0026-2862(91)90059-K |
| [12] |
Wei W, Rao F, Liu F, et al. Involvement of Smad3 pathway in atrial fibrosis induced by elevated hydrostatic pressure[J]. J Cell Physiol, 2018, 233(6): 4981-9. doi:10.1002/jcp.26337 |
| [13] |
Wu J, Jackson-Weaver O, Xu J. The TGFβ superfamily in cardiac dysfunction[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(4): 323-35. doi:10.1093/abbs/gmy007 |
| [14] |
Bujak M, Ren G, Kweon H J, et al. Essential role of Smad3 in infarct healing and in the pathogenesis of cardiac remodeling[J]. Circulation, 2007, 116(19): 2127-38. doi:10.1161/CIRCULATIONAHA.107.704197 |
| [15] |
Wu X, Zhang Y. TET-mediated active DNA demethylation: Mechanism, function and beyond[J]. Nat Rev Genet, 2017, 18(9): 517-34. |
| [16] |
Watson C J, Horgan S, Neary R, et al. Epigenetic therapy for the treatment of hypertension-induced cardiac hypertrophy and fibrosis[J]. J Cardiovasc Pharmacol Ther, 2016, 21(1): 127-37. doi:10.1177/1074248415591698 |
| [17] |
Hattori M, Yokoyama Y, Hattori T, et al. Global DNA hypomethylation and hypoxia-induced expression of the ten eleven translocation (TET) family, TET1, in scleroderma fibroblasts[J]. Exp Dermatol, 2015, 24(11): 841-6. doi:10.1111/exd.12767 |