

我国每年乳腺癌新发病24.9万,居女性恶性肿瘤第1位,病死率居第5位,且其发病率呈逐年上升趋势,严重危害了广大妇女的健康。研究显示,25%-30%的乳腺癌患者存在HER2(人表皮生长因子受体-2)蛋白的过量表达[1]。HER2表达量越高,肿瘤的恶性程度也越高,患者预后越差[2]。
HER2靶向治疗的推出大大提高了HER2+乳腺癌患者的长期存活率,并为各个阶段都提供了多种治疗选择。其中被临床应用并证明有效的抗体是人表皮生长因子受体2抗体(Anti-her2)[3]。单抗Anti-her2可与HER2受体胞外区特异性结合,从而抑制肿瘤细胞生长,并使过量表达HER2受体的肿瘤细胞对细胞毒性因子更加敏感[4]。HER2单抗的出现,很大程度上改善了HER2阳性乳腺癌患者的治疗及预后。
重组单抗具有高特异性、高活性和低毒性等特点,从而使其在医药领域备受关注,并逐渐成为国内外药物研发企业的研究热点。目前,重组抗体的生产主要依赖哺乳动物表达系统。该表达系统的优势在于可进行包括糖基化修饰在内的各种翻译后修饰,从而使获得的重组蛋白具有与人体来源相似的糖蛋白结构[5]。本实验中,我们利用构建的HER2人源化单克隆抗体重链及轻链表达载体转化中国仓鼠卵巢细胞(CHO),筛选获得稳定表达重组HER2人源化单克隆抗体的细胞株,并小规模发酵生产重组抗体,为后续深入研究HER2过表达与乳腺癌的关系及其基因治疗奠定基础。
1 材料与方法 1.1 质粒及细胞Anti-her2重链、轻链模板:pMC-her2 HC、pMC-her2 LC由西湖大学金炜元副研究员馈赠;中国仓鼠卵巢细胞系CHO(CHO-K1细胞系经过悬浮驯化)为本实验室保存。
1.2 主要实验仪器Protein A柱、Q-Sepharose离子交换柱(美国GE公司);电转化仪(美国Bio-rad MicroPulser);CO2培养箱(美国Thermo HERAcell 150i),高效液相色谱仪(美国Agilent 1200)。
1.3 主要实验试剂DMEM/F12培养基(Hyclone,批号:AE24921272),胎牛血清(Gibco,批号:42F3495K),G418(Gibco,批号:1833291),CD CHO(Gibco,批号:2202258),FC抗体(CST,批号:12),其他实验试剂为国产分析纯。
1.4 重组抗HER2人源化单克隆抗体制备方法学的建立 1.4.1 细胞电击转化CHO细胞接种于T75培养瓶中,加入DMEM/F12+10% FBS,37 ℃,5% CO2下贴壁培养。待细胞贴满80%底面积后,胰酶消化,取细胞约5×106 cells重悬于200 μL PBS中,并加入30 μg载体DNA(pMC-her2 LC:20 μg,pMC-her2 HC:10 μg)及10 μg鲑鱼精DNA混匀(保护目标DNA),950 μF、250 V电击转化2次,冰浴1 min后铺于100 mm培养皿,加入DMEM/F12+20% FBS,37 ℃,5% CO2下贴壁培养。
1.4.2 克隆筛选约1~2 d待细胞贴壁伸展,抗性基因充分表达后,加入含1.5 g·L-1 G418的DMEM/F12+10% FBS进行抗性筛选。约3-4 d后,用PBS轻轻淋洗去除死细胞,降低G418浓度至600 mg·L-1维持2-3 d,单克隆形成。尽量选取单独的克隆转移至96孔板,37 ℃,5% CO2培养5-7 d。
1.4.3 克隆表达待细胞在96孔板中汇合度达到80%左右,换液成无血清的DMEM/F12,37 ℃,5% CO2下表达1 d,取样进行Dot blot检测。
1.4.4 免疫斑点杂交检测取5 μL上清样品点于硝酸纤维膜(NC膜),室温干燥,加入5%牛奶/TBST封闭30 min,弃溶液,加入1%牛奶稀释的抗FC(1 ∶ 15 000)抗体,37 ℃ 30 min后弃去溶液,用TBST漂洗3次,每次10 min。底物曝光(ECL Western blot detection reagents)[6]。
1.4.5 克隆放大培养挑选Dot blot检测表达量最高的5个克隆株进行再次克隆操作,挑选稳定表达的其中1个二次克隆株,加入DMEM/F12+10% FBS,37 ℃,5% CO2传代扩种,扩到3个T75培养瓶后胰酶消化,用细胞悬浮培养摇瓶悬浮扩增,接种密度2×109 cells·L-1,体积30 mL。培养基采用CD CHO。待细胞密度扩增至6×109 cells·L-1左右,接种至1 L摇瓶培养,接种密度2×109 cells·L-1。d2开始取样,并每天添加5 mL CD CHO及1.5 g·L-1葡萄糖,最终样品收液纯化。
1.4.6 蛋白纯化细胞培养液离心后去沉淀,上清液经0.8 μm和0.45 μm滤膜过滤后,以20 mL·min-1的流速上样于Protein A柱,10 mmol·L-1柠檬酸,0.2 mol·L-1 NaCl缓冲液洗脱;再经Q-Sepharose离子交换柱分离,上样缓冲液为10 mmol·L-1 PB,0.2 mol·L-1 NaCl,随后用Sephacryal-200凝胶层析柱纯化,10 mmol·L-1 PB,0.15 mol·L-1 NaCl洗脱, 洗脱液HPLC分析。
1.4.7 还原型及非还原型SDS-PAGE检测取表达后的纯化蛋白5 μL,分别进行还原型及非还原型SDS-PAGE检测,其中,还原型电泳上样缓冲液含β-巯基乙醇,非还原型电泳上样缓冲液不含β-巯基乙醇,加入等体积上样缓冲液后沸水浴10 min,12 000 r·min-1离心5 min后取上清电泳,至溴酚蓝的带近底端1 cm时,停止电泳。考马斯亮蓝染色3 h。脱色液脱色至能清晰显示出蛋白条带止[7]。
1.4.8 Western blot检测应用Western blot检测表达蛋白的特异性:样品经SDS-PAGE后,电转移至PVDF膜,5%的脱脂奶粉封闭60 min,弃溶液,加入一抗,37 ℃ 30 min后弃去溶液,用TBST漂洗3次,每次5 min。然后加入二抗,室温孵育1.5 h,再次TBST洗膜4次,底物曝光[8]。
1.5 重组抗HER2人源化单克隆抗体体外活性检测 1.5.1 体外生物学活性测定完全培养基(M-Hybricare)培养BT474细胞,将细胞稀释至0.25×104 cells/well后在96孔板上按每孔100 μL接种细胞。将重组抗HER2人源化单克隆抗体和市售品“赫赛汀”分别稀释到1 mg·L-1初始浓度,倍比稀释不同梯度后为试验组,不加药为对照组。孵育48 h,每孔加入100 μL CCK-8和RPMI 1640混合培养基(1 ∶ 10,V/V),37℃孵育1 h,450 nm读数。利用GraphPad 7.0计算Anti-her2的IC50,了解其体外生物学活性。
1.5.2 Anti-her2对细胞的增殖抑制检测采用CCK-8法检测不同浓度Anti-her2及“赫赛汀”对BT474细胞增殖抑制的影响。取对数生长期BT474细胞悬液,96孔板每孔接种5 000个细胞,并加100 μL的RPMI 1640培养基,CO2培养箱培养24 h后,按照空白组(单纯培养液)、对照组(细胞悬液+DMSO)和试验组(Anti-her2及“赫赛汀”浓度梯度分别为0、0.004、0.008、0.016、0.03 mg·L-1、0.06、0.125、0.25、0.5)加入各试剂。48 h后每孔加入10 μL CCK-8试剂,置于培养箱中继续培养1 h,酶标仪450 nm处测定各孔的吸光值。细胞存活率/% =[(OD试验孔-OD空白孔)/(OD对照孔-OD空白孔)]×100%。
1.6 统计学方法采用SPSS 17.0统计软件进行数据分析,计量数据以x±s表示,两两比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 重组抗HER2人源化单克隆抗体的制备 2.1.1 克隆筛选检测电击转化后共铺2个100 mm培养皿,经G418筛选后,挑取2块96孔板。表达后Dot blot检测表明,最高表达克隆表达量在30 mg·L-1左右。其余均在2.5-10 mg·L-1,见Fig 1。

|
| Fig 1 Dot blot of recombinant humanized Anti-her2 monoclonal antibody Left side of A, B shows the standard; the sample was diluted to 30 mg·L-1, 20 mg·L-1, 10 mg·L-1, 5 mg·L-1, 2.5 mg·L-1, 1.25 mg·L-1 |
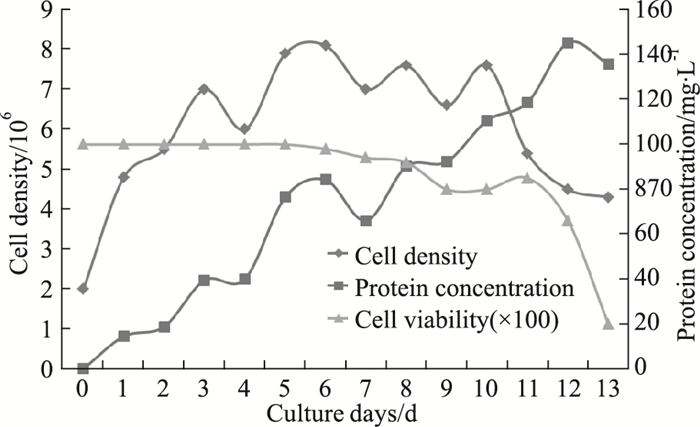
取Dot blot检测表达量最高的一次克隆进行二次克隆,表达稳定的二次克隆进行放大培养,种子扩增后接种至1 L摇瓶流加培养,共培养13 d,细胞活率从d 11起下降。培养最高细胞密度为8.1×109 cells·L-1,最高表达量145.3 mg·L-1。最终收液1.2 L,蛋白BCA定量结果135.9 mg·L-1, 见Fig 2。
|
| Fig 2 Small scaling-up of recombinant humanized Anti-her2 monoclonal antibody |
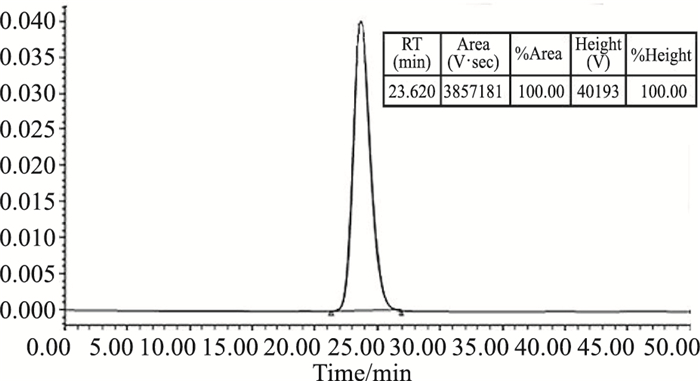
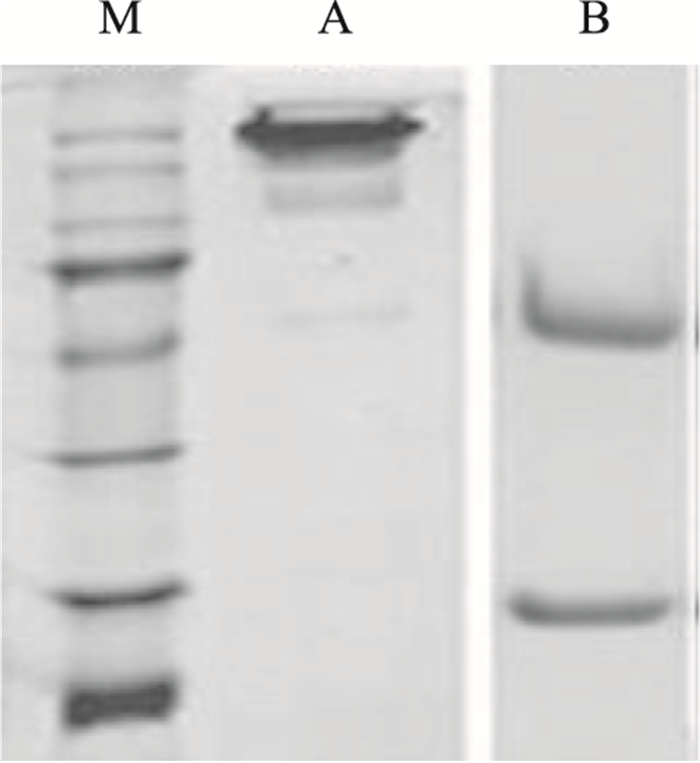
蛋白原液经Protein A亲和纯化,对纯化后的Anti-her2进行HPLC检测,结果表明,目的蛋白纯度大于99%,见Fig 3。非还原SDS-PAGE检测显示在185 kD附近出现了与目标蛋白理论大小相同的条带,样品中含有完整的抗体分子,见Fig 4A。还原的纯化样品中分别含有抗体的轻重链,轻重链结构完整,大小与理论值一致, 见Fig 4B。
|
| Fig 3 HPLC analysis of purified recombinant humanized Anti-her2 monoclonal antibody |
|
| Fig 4 SDS-PAGE analysis of purified recombinant humanized Anti-her2 monoclonal antibody M: protein marker, From top to bottom: 180, 135, 100, 75, 63, 48, 35, 25 kD respectively; A: Anti-her2 non-reduction SDS-PAGE detection; B: Anti-her2 reduction SDS-PAGE detection |
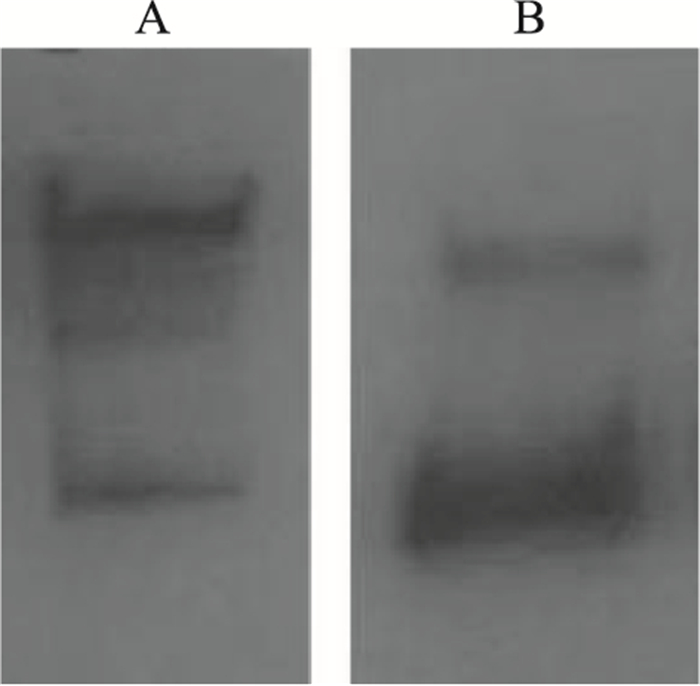
纯化蛋白经SDS-PAGE后,转膜并Western blot免疫分析,还原与非还原电泳后转膜均与FC单克隆抗体发生了特异性免疫反应,非还原电泳膜上出现与目标蛋白理论大小相同的条带,并带有部分小片段非主带,这与SDS-PAGE结果吻合,说明纯化蛋白可能存在部分重轻链装配不完全,见Fig 5A,还原电泳膜上出现两条干净的重链、轻链,且浓度比例基本为1 ∶ 2,结合SDS-PAGE结果,说明表达产物是重组HER2人源化单克隆抗体,且重氢链装配基本准确,见Fig 5B。
|
| Fig 5 Western blotting of purified recombinant humanized Anti-her2 monoclonal antibody A: Anti-her2 non-reduction Western blot detection; B: Anti-her2 reduction Western blot detection |
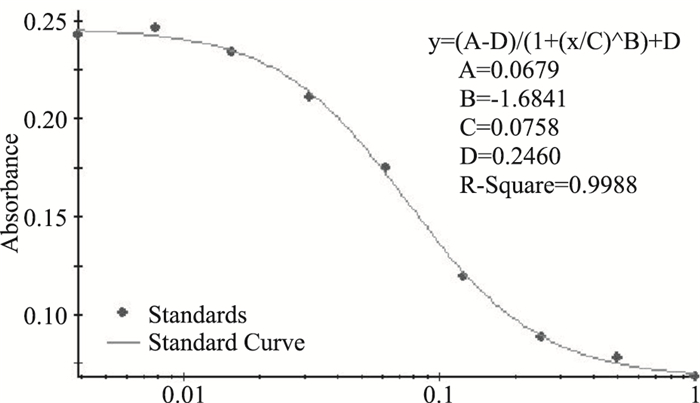
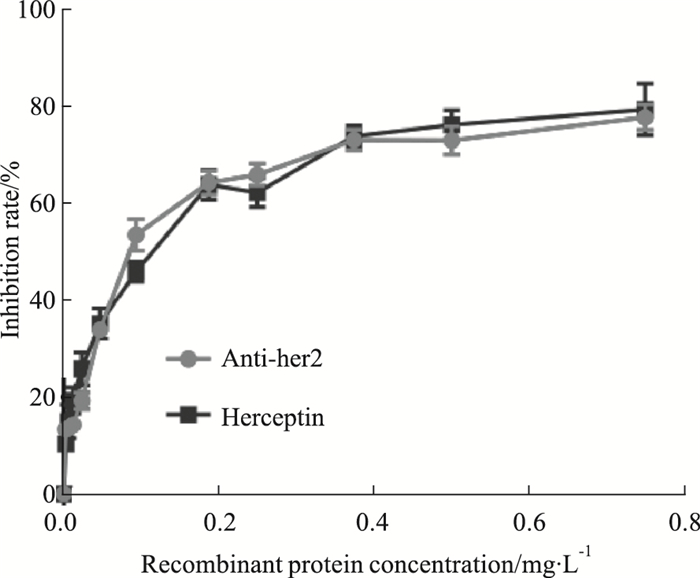
利用赫塞汀标准品配制的9个稀释度(0、0.006、0.012、0.023、0.047、0.188、0.375、0.75、1 mg·L-1),测定拟合优度,相关系数r>0.95,符合检测要求,检测范围为0.031-0.375 mg·L-1,见Fig 6。体外活性检测结果表明,表达抗体能够有效的对BT-474细胞生长产生抑制活性,其抑制率基本与赫塞汀相近,见Fig 7,经GraphPad Prism7.0计算得其IC50值为0.103,实验结果证明了两者在生物学活性方面的相似性。
|
| Fig 6 Goodness-of-fit testing of Anti-her2 |
|
| Fig 7 Comparison of bioactivity of Anti-her2 and Herceptin on BT-474 (x±s, n=3) |
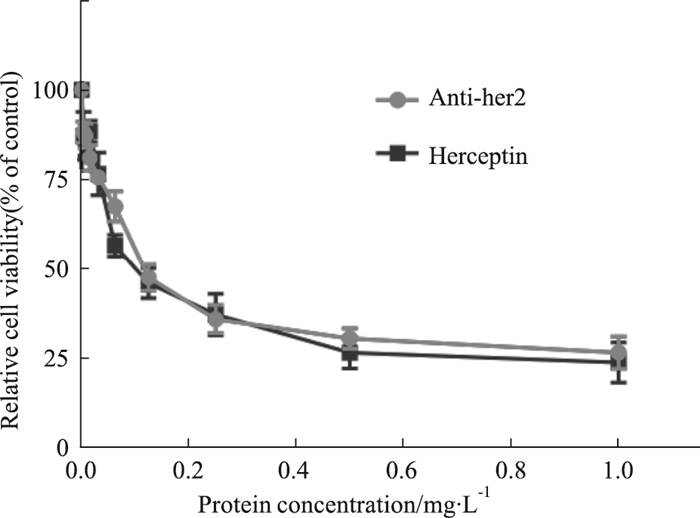
体外增殖实验表明,Anti-her2和“赫赛汀”对BT-474细胞的增殖抑制呈剂量依赖关系,在低浓度区间0.06-0.2 mg·L-1,就表现出极高的抑制效率,随着剂量的增加,抑制效果并无低浓度区间增加明显,见Fig 8,在药物浓度达到1.0 mg·L-1时,两者对BT-474细胞的抑制达到最大值。
|
| Fig 8 Comparison of inhibitory effect of Anti-her2 and Herceptin on BT-474 (x±s, n=3) |
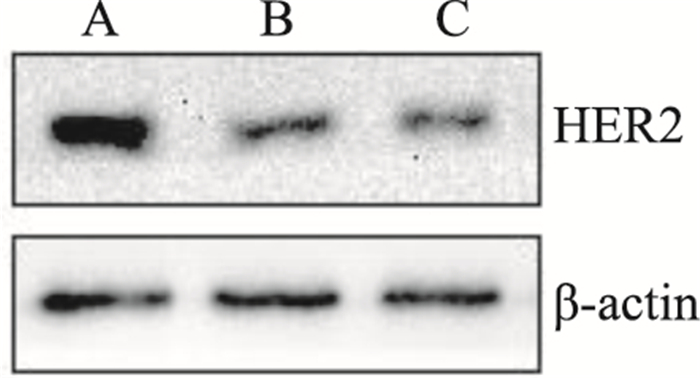
Western blot结果显示,与未加抗体对照组相比,“赫赛汀”与Anti-her2处理组HER2蛋白的表达均有所降低,这提示“赫赛汀”与Anti-her2均可明显抑制BT-474中HER2蛋白的表达。见Fig 9。
|
| Fig 9 Comparison of HER2 expression of Anti-her2 and Herceptin on BT-474 A: control; B: herceptin (0.06 mg·L-1) treatment; C: Anti-her2 (0.06 mg·L-1) treatment |
HER2蛋白的过量表达与多种肿瘤的发生、发展及预后密切相关, 其中以乳腺癌最为密切[9]。研究显示,HER2蛋白的过量表达往往能破坏机体组织的抗侵袭屏障,导致肿瘤细胞的侵袭力增加。HER2蛋白能显著增加血管内皮生长因子的表达,从而促进肿瘤新生血管形成,并促进癌细胞的扩散和转移。这些特殊的生物功能揭示HER2可作为乳腺癌生物治疗的靶点[10]。
HER2人源化单克隆抗体是一个针对HER2蛋白过量表达的人源单抗,其在临床试验和后续应用中均取得了确切疗效[11]。在疾病治疗中,人源化单抗能有效降低机体的免疫排斥反应,同时其Fc段能募集效应因子或效应细胞, 对靶细胞产生杀伤。人源化抗体中Fc段也可特异地结合人血管内皮细胞上的Fc受体而不被很快降解,从而延长其在体内的半衰期。但不同方法制备单抗的抗肿瘤活性可能有非常显著的差异,研究HER2人源化单抗生产工艺,并建立稳定的重组蛋白表达体系,对于人源化抗体技术的进一步应用具有非常重要的意义[12]。
我们利用Anti-her2重链、轻链真核表达载体质粒,共同转化中国仓鼠卵巢细胞,经二次克隆及G418筛选、免疫组化鉴定, 获得了能够稳定表达HER2人源化单克隆抗体的CHO细胞株。同时采用摇瓶悬浮流加培养,进行小规模放大生产重组目的蛋白,摇瓶悬浮流加可通过更为精确有效的工艺控制,在获得表达蛋白高产的同时稳步提高产品质量。本次流加培养的表达量达到135.9 mg·L-1,经纯化后检测分析,其在纯度及生物学活性方面、对乳腺癌细胞的增殖抑制方面,基本与商业化“赫赛汀”标准品保持一致。
稳定高效表达重组蛋白主要依靠克隆的筛选及后期培养工艺参数的优化,本研究建立了HER2人源化单克隆抗体的规模化稳定表达方法,为进一步大规模培养放大和工业化生产奠定了基础。
| [1] |
陈万青, 李贺, 孙可欣, 等. 2014年中国恶性肿瘤发病与死亡分析[J]. 中华肿瘤杂志, 2018, 40(1): 5-13. Chen W Q, Li H, Sun K X, et al. Report of cancer incidence and mortality in China, 2014[J]. Chin J Oncol, 2018, 40(1): 5-13. |
| [2] |
Loibl S, Gianni L. HER2-positive breast cancer[J]. Lancet, 2017, 10 087(389): 2415-29. doi:10.1016/S0140-6736(16)32417-5 |
| [3] |
Nuciforo P, Thyparambil S, Aura C, et al. High HER2 protein levels correlate with increased survival in breast cancer patients treated with anti-HER2 therapy[J]. Mol Oncol, 2016, 10(1): 138-47. doi:10.1016/j.molonc.2015.09.002 |
| [4] |
Brandao M, Ponde N F, Poggio F, et al. Combination therapies for the treatment of HER2-positive breast cancer: Current and future prospects[J]. Expert Rev Anticancer Ther, 2018, 18(7): 629-49. doi:10.1080/14737140.2018.1477596 |
| [5] |
Aricescu A R, Owens R J. Expression of recombinant glycoproteins in mammalian cells: Towards an integrative approach to structural biology[J]. Curr Opin Struct Biol, 2013, 23(3): 345-56. doi:10.1016/j.sbi.2013.04.003 |
| [6] |
Heinicke E, Kumar U, Munoz D G. Quantitative dot-blot assay for proteins using enhanced chemiluminescence[J]. J Immunol Methods, 1992, 152(2): 227-36. doi:10.1016/0022-1759(92)90144-I |
| [7] |
Rath A, Glibowicka M, Nadeau V G, et al. Detergent binding explains anomalous SDS-PAGE migration of membrane proteins[J]. Proc Natl Acad Sci USA, 2009, 106(6): 1760-5. doi:10.1073/pnas.0813167106 |
| [8] |
Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications[J]. Proc Natl Acad Sci USA, 1979, 76(9): 4350-4. doi:10.1073/pnas.76.9.4350 |
| [9] |
Cornejo K M, Kandil D, Khan A, et al. Theranostic and molecular classification of breast cancer[J]. Arch Pathol Lab Med, 2014, 138(1): 44-56. doi:10.5858/arpa.2012-0442-RA |
| [10] |
Yan M, Parker B A, Schwab R, et al. HER2 aberrations in cancer: Implications for therapy[J]. Cancer Treat Rev, 2014, 40(6): 770-80. doi:10.1016/j.ctrv.2014.02.008 |
| [11] |
Bianchini G, Gianni L. The immune system and response to HER2-targeted treatment in breast cancer[J]. Lancet Oncol, 2014, 15(2): 58-68. doi:10.1016/S1470-2045(13)70477-7 |
| [12] |
Hughes C, Nissim A. Progress and clinical potential of antibody-targeted therapy for arthritic damage[J]. Expert Rev Proteomics, 2016, 13(6): 539-43. doi:10.1080/14789450.2016.1188008 |

