

吴艳玲(1977-),女,教授,博士生导师,研究方向:中药抗纤维化,通讯作者,E-mail: ylwu@ybu.edu.cn
肝纤维化是一种可逆病变,主要表征为细胞外基质(extracellular matrix,ECM)的过度沉积,肝星状细胞(hepatic stellate cells,HSCs)受病毒性肝炎、酒精等因素刺激,由贮存视黄醇的静息态变为激活态,其活化与增殖是肝纤维化形成的主要标志[1]。因此,抑制HSCs活化是逆转肝纤维化的有效途径之一。信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是STAT家族主要成员之一,作为应答IL-6等炎性因子的主要转录因子被首次发现,现被视为慢性炎症形成中不可或缺的关键分子[2]。受异常激活时,STAT3由细胞质转移至细胞核,进而参与细胞增殖、分化、免疫和炎症反应等[3]。白桦酯酸(betulinic acid,BA),是由白桦树皮中分离获得一种五环三萜类物质,前期研究初步发现,BA可以改善由硫代乙酰胺诱导肝纤维化,但具体作用机制尚不明确[4]。基于STAT3生物学调控作用,本研究探讨BA介导STAT3信号通路改善肝纤维化的影响。
1 材料与方法 1.1 细胞系肝星状细胞系HSCs和巨噬细胞系Raw264.7为韩国生命工学研究院(韩国大田)Jung-Joon Lee博士慷慨相赠。
1.2 药品与试剂白桦酯酸(Skyherb Technologies,98%);小鼠IL-6 ELISA试剂盒(Neobio Science,42SH01);ALT(A001)、AST(A002)试剂盒(长春汇力);苏木精染液(Solarbio,517-28-2);伊红染色液(BA4024)、Masson(BA4079B)试剂盒(Baso);DMEM(C11965500BT)、FBS(900-108)、0.25% Try(15090046)购自Gibco BRL;DMSO(D2650)、青霉素/链霉素(I9532、V900929)、LPS(L2880)购自Sigma;Anti-α-SMA(ab5694)、Anti-collagen-1(ab34710)、Anti-MMP-13(ab75606)、Anti-TIMP-1(ab61224)、β-actin(ab8226)购自Abcam;Anti-TLR4(sc-293072)、Anti-p-STAT3(sc-8059)、Anti-STAT3(sc-8019)、Anti-p-LKB1(sc-271924)、Anti-LKB1(sc-374300)、Anti-AMPK(sc-398861)购自Santa Cruz;Anti-p-AMPK(CS-2531)购自Cell Signaling。
1.3 仪器化学成像发光显色仪(Tanon);共聚焦扫描显微镜(Olympus);数码倒置显微镜(Nikon);全自动倒置电泳仪、转印电泳槽、电泳仪、转印电泳槽(Bio-Rad);水平摇床、低温超速离心机、CO2培养箱(Thermo);酶标仪(Bio Tek);净化工作台(上海新范医疗器械有限公司)。
1.4 细胞培养HSCs和Raw264.7细胞分别用含有10% FBS和100 U·L-1的青霉素/链霉素的DMEM培养,在37 ℃、5%的CO2培养箱中进行传代培养。
1.5 ELISA检测上清液IL-6含量Raw264.7细胞接种于6孔板,培养24 h后,给予LPS(1 mg·L-1)孵育细胞不同时间(0、1、3、6、12 h),收集上清液备用。采用小鼠IL-6 ELISA试剂盒检测上清液中IL-6含量,酶标仪测定波长600 nm处的吸光度值,计算出上述上清液中IL-6含量。
1.6 细胞实验方案Raw264.7细胞接种于6孔板,培养24 h后,给予LPS(1 mg·L-1)孵育12 h,收集上清液备用。为探讨BA对活化HSCs抑制作用的时间和剂量关系,HSCs接种于6孔板,培养24 h后,BA(25 μmol·L-1)预处理HSCs 2h后,给予上述上清液孵育0-6 h;BA(0-25 μmol·L-1)预处理HSCs 2 h后,给予上述上清液孵育1 h,收集各分组细胞,提取蛋白,-80 ℃备用。
1.7 Western blot实验取-80 ℃中提取的蛋白,并用BCA法测定细胞蛋白浓度,取适量进行Western blot检测,以β-actin为内参,测定蛋白相对表达量。
1.8 动物实验方案C57BL/6雄性小鼠(购于长春亿斯实验动物科技有限公司),平均体质量(20±2)g。采用标准化饲料喂养小鼠,待小鼠适应喂养1周后,随机分为3组,即:正常组、模型组、BA给药组,每组6只。BA(50 mg·kg-1)灌胃给药4 d后,除正常组外,每组小鼠腹腔注射10% CCl4(2 mL·kg-1),24 h后,对小鼠进行安乐死,收集血清和肝脏,部分肝脏浸泡于10%福尔马林中,部分冻存于-80 ℃备用。
1.9 ALT、AST指标的测定根据试剂盒说明书检测血清中ALT、AST的水平。
1.10 小鼠肝脏组织病理学观察取固定于10%福尔马林溶液的小鼠肝脏,梯度乙醇脱水,石蜡包埋。将蜡块厚5 μm切片,经HE、Masson染色和STAT3免疫组织荧光染色后,用共聚焦扫描显微镜进行肝脏组织病理学观察。
1.11 统计分析用Quantityone(Bio-Rad公司)分析X-光片中各条带灰度值进行比较。实验数据用GraphPad Prism 5.0进行统计分析。
2 结果 2.1 LPS对Raw264.7细胞上清液中IL-6含量的影响本研究为模拟体外HSCs所处肝脏炎症微环境,采用LPS刺激Raw264.7细胞获取上清液,再孵育HSCs。由Fig 1可见,随着时间的延长,上清液中IL-6含量逐渐升高,3 h升高具有统计学意义,12 h时达最高值。

|
| Fig 1 IL-6 contents in medium of Raw 264.7 *P < 0.05 vs 0 h; ns, no significance. |
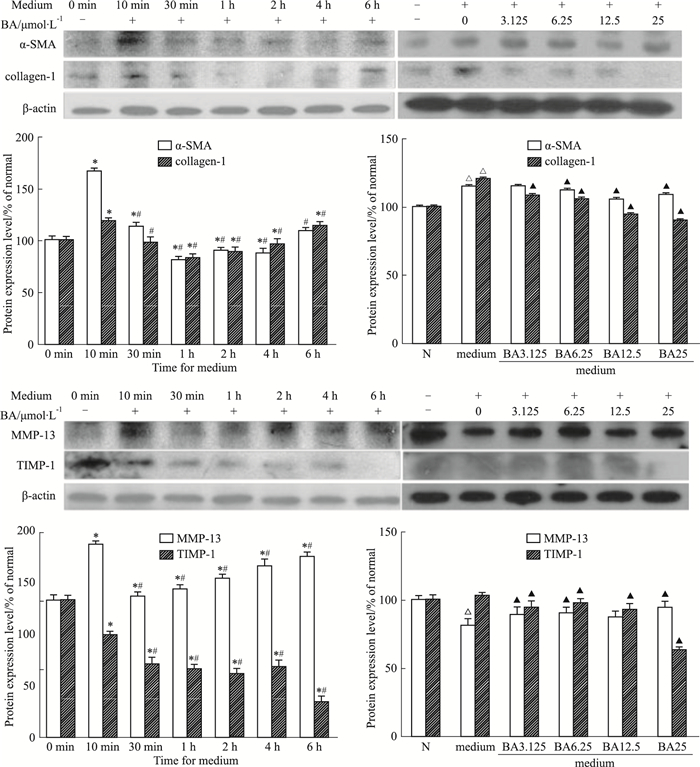
由Fig 2可见,BA(25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育不同时间,BA可以明显抑制活化HSCs中α-SMA和collagen-I蛋白表达以及TIMP-1/MMP-13比值,呈现时间依赖性。不同浓度BA(0-25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育1 h,BA可以明显抑制活化HSCs中α-SMA和collagen-I蛋白表达以及TIMP-1/MMP-13比值,呈现剂量依赖性。
|
| Fig 2 Effect of BA on hepatic fibrosis makers in activated HSCs *P < 0.05 vs 0 min, #P < 0.05 vs 10 min; △P < 0.05 vs normal, ▲P < 0.05 vs medium |
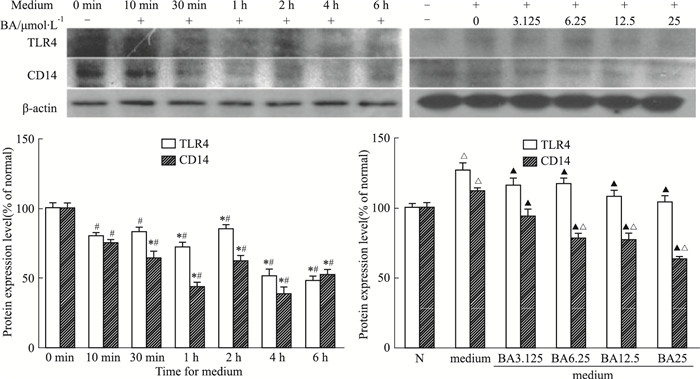
由Fig 3可见,BA(25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育不同时间,BA可以明显抑制活化HSCs中TLR4和CD14蛋白表达,呈时间依赖性。不同浓度BA(0-25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育1 h,BA可以明显抑制活化HSCs中TLR4和CD14蛋白表达,呈剂量依赖性。
|
| Fig 3 Effect of BA on TLR4 in activated HSCs #P < 0.05 vs 0 min, *P < 0.05 vs 10 min; △P < 0.05 vs normal, ▲P < 0.05 vs medium |
由Fig 4可见,BA(25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育不同时间,BA可以明显增强活化HSCs中STAT3磷酸化蛋白表达。不同浓度BA(0-25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育1 h,BA可以明显增强活化HSCs中STAT3磷酸化蛋白表达。

|
| Fig 4 Effect of BA on STAT3 in activated HSCs #P < 0.05 vs 0 min, *P < 0.05 vs 10 min; △P < 0.05 vs normal, ▲P < 0.05 vs medium |
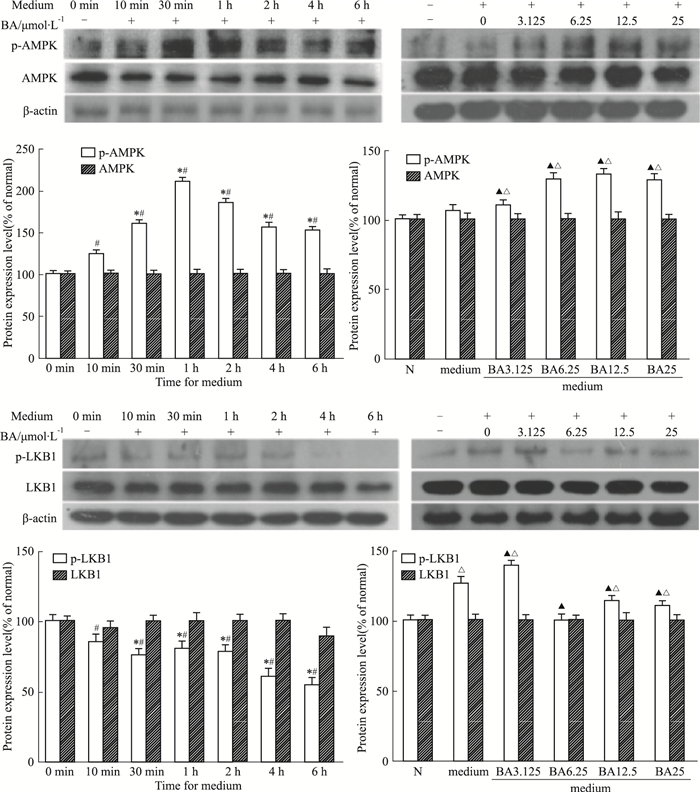
由Fig 5可见,BA(25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育不同时间,BA可以明显增强活化HSCs中AMPK磷酸化蛋白表达并且明显抑制LKB1磷酸化蛋白表达。不同浓度BA(0-25 μmol·L-1)预处理HSCs 2 h后,给予上清液孵育1 h,BA可以明显增强活化HSCs中AMPK磷酸化蛋白表达并且明显抑制LKB1磷酸化蛋白表达。
|
| Fig 5 Effect of BA on AMPK-LKB1 in activated HSCs #P < 0.05 vs 0 min, *P < 0.05 vs 10 min; △P < 0.05 vs normal, ▲P < 0.05 vs medium |
由Fig 6A可见,造模后,模型组小鼠血清中的ALT、AST水平明显高于正常组。给予BA后,给药组小鼠血清中的ALT、AST水平明显降低;由Fig 6B可见,与正常组相比,HE染色显示,模型组有大量炎性细胞浸润到汇管区,Masson染色显示,模型组有大量的胶原纤维增生、交联,形成纤维间隔,STAT3免疫组织荧光染色显示,模型组明显抑制STAT3的阳性表达,给予BA后,给药组小鼠均有明显改善。

|
| Fig 6 Effects of BA on related indexes and liver pathological changes in CCl4 induced hepatic fibrosis in mice A: Serum ALT and AST levels, #P < 0.05 vs normal; *P < 0.05 vs CCl4; B: HE, Masson, IHC of STAT3 staining |
肝纤维化发生于各种慢性肝脏疾病中,若治疗不及时可进展为肝硬化甚至肝癌。肝纤维化发生发展中,炎症的控制对疾病的治疗与转归具有关键作用。本研究着眼于调控炎症,结合体内外模拟肝纤维化微环境,研究发现,BA介导STAT3信号通路抑制炎症因子分泌,进而改善肝纤维化。
非特异性免疫和特异性免疫细胞对肝星状细胞产生调控作用。IL-6是非特异性免疫调节作用的细胞因子,在肝脏炎症及肝纤维化中扮演关键作用[5]。本研究利用LPS刺激小鼠巨噬细胞Raw264.7产生相关细胞因子IL-6进行后续实验研究。研究发现,STAT3在肝病的早期阶段表现活跃,该信号通路被IL-6激活后,进而磷酸化的STAT3转移到细胞核,然后激活许多靶基因的转录过程,这些基因在诱导和改善肝纤维化方面非常重要[6]。肝纤维化中STAT3表现出“双刃剑”。有研究发现[7],STAT3活化能抑制肝纤维化发生,肝细胞特异性STAT3敲除小鼠α-SMA表达明显高于野生型,表明STAT3敲除促进肝纤维化,且STAT3磷酸化上调依赖于Kupffer细胞分泌IL-6。另有研究表明,STAT3抑制剂STX-0119可阻止HSCs活化来抑制肝纤维化的发展[8]。为了进一步探讨STAT3在肝纤维化的作用,研究发现,给予上述上清液后,STAT3磷酸化的表达明显升高,说明BA可能介导STAT3活化来调控肝纤维化。TLR4是巨噬细胞表面的模式识别受体位于HSCs膜上,能促进肝纤维化和炎症的发生。LPS在细胞表面由CD14至TLR4呈递,激活TLR4信号,所以在活化细胞中,TLR4效应蛋白凭借着特异性识别功能,与LPS结合而发生活化[9]。STAT3信号通路能够被TLR4信号通路信号传导产物lL-6激活,具有调节细胞增殖、凋亡以及调控炎性反应等多种过程中,发挥关键作用[10]。在活化的HSCs中,抑制TLR4-STAT3信号,可调控炎症反应,参与肝纤维化调控。AMPK是细胞蛋白质合成的能量调节器,多条信号通路调控其磷酸化,AMPK对调节氧化应激及改善炎症有重要意义,LKB1主要通过调节能量代谢,细胞炎症来抑制癌症发生发展,而LKB1-AMPK信号调控可能是肝损伤改善关键环节之一[11-12]。BA可明显改善CCl4升高的血清转氨酶、组织病理改变,以及STAT3免疫荧光表达。本研究还以LPS刺激Raw264.7细胞,并收集上清液孵育HSCs,模拟体外HSCs所处肝脏炎症微环境。实验结果表明,BA可以抑制活化HSCs中ECM以及炎症因子的表达,从而逆转肝纤维化。BA介导STAT3信号通路,并阻断TLR4信号转导,调控AMPK/LKB1磷酸化,是其改善肝纤维化的潜在机制。
目前临床上肝纤维化治疗以去除病因治疗为主,尚缺乏特异性治疗药物及方法。研发作用靶点明确、安全效优的药物具有重要的临床价值。本研究结果表明,BA介导STAT3信号通路调控TLR4和AMPK/LKB1磷酸化,进而抑制细胞外基质过度沉积和炎症因子分泌,为BA基于STAT3改善肝纤维化提供了新的思路和理论支撑。考虑机体内信号通路庞杂及多样性,仍需要进行更为深入的机制研究。
| [1] |
王莉莉, 赵永忠. 肝星状细胞与肝纤维化的关系[J]. 世界最新医学信息文摘, 2020, 20(10): 40-1. Wang L L, Zhao Y Z. The relationship of hepatic stellate cells and hepatic fibrosis[J]. World Latest Med Inform, 2020, 20(10): 40-1. |
| [2] |
音金萍, 岳紫晨, 卓少元. STAT3:慢性炎症介导肝癌进程的关键分子[J]. 临床肝胆病杂志, 2020, 36(4): 948-52. Yin J P, Yue Z C, Zhuo S Y. STAT3: A key molecule in the progression of liver cancer mediated by chronic inflammation[J]. J Clin Hepatol, 2020, 36(4): 948-52. doi:10.3969/j.issn.1001-5256.2020.04.054 |
| [3] |
Liu Z, Wang H, Guan L, et al. LL1, a novel and highly selective STAT3 inhibitor, displays anti-colorectal cancer activities in vitro and in vivo[J]. Br J Pharmacol, 2020, 177(2): 298-313. doi:10.1111/bph.14863 |
| [4] |
Wan Y, Wu Y L, Lian L H, et al. The anti-fibrotic effect of betulinic acid is mediated through the inhibition of NF-κB nuclear protein translocation[J]. Chem-Biol Interact, 2012, 195(3): 215-23. doi:10.1016/j.cbi.2012.01.002 |
| [5] |
Shahkar L, Keshtkar A, Mirfazeli A, et al. The role of IL-6 for predicting neonatal sepsis: A systematic review and meta-analysis[J]. Iran J Pediatr, 2011, 21(4): 411-7. |
| [6] |
Xiang D M, Sun W, Ning B F, et al. The HLF/IL-6/STAT3 feedforward circuit drives hepatic stellate cell activation to promote liver fibrosis[J]. Gut, 2018, 67(9): 1704-15. doi:10.1136/gutjnl-2016-313392 |
| [7] |
Deng Y R, Ma H D, Tsuneyama K, et al. STAT3-mediated attenuation of CCl4-induced mouse liver fibrosis by the protein kinase inhibitor sorafenib[J]. J Autoimmun, 2013, 46: 25-34. doi:10.1016/j.jaut.2013.07.008 |
| [8] |
Choi S, Jung H J, Kim M W, et al. A novel STAT3 inhibitor, STX-0119, attenuates liver fibrosis by inactivating hepatic stellate cells in mice[J]. Biochem Biophys Res Commun, 2019, 513(1): 49-55. doi:10.1016/j.bbrc.2019.03.156 |
| [9] |
Ichise Y, Saegusa J, Tanaka-Natsui S, et al. Soluble CD14 induces pro-inflammatory cytokines in rheumatoid arthritis fibroblast-like synovial cells via toll-like receptor 4[J]. Cells, 2020, 9(7): 1689. doi:10.3390/cells9071689 |
| [10] |
Yao R R, Li J H, Zhang R, et al. M2-polarized tumor-associated macrophages facilitated migration and epithelial-mesenchymal transition of HCC cells via the TLR4/STAT3 signaling pathway[J]. World J Surg Oncol, 2018, 16(1): 9. doi:10.1186/s12957-018-1312-y |
| [11] |
Johnson J, Chow Z, Napier D, et al. Targeting PI3K and AMPKα signaling alone or in combination to enhance radiosensitivity of triple negative breast cancer[J]. Cells, 2020, 9(5): 1253. doi:10.3390/cells9051253 |
| [12] |
姚友丽. 刺五加酸及葫芦素E调控LKB1-AMPK信号通路改善肝损伤的机制研究[D]. 吉林延吉: 延边大学, 2018: 4-11. Yao Y L. Acanthoic acid and cucurbitacin E ameliorates hepatic injury in vivo and in vitro through regulation of LKB 1-AMPK signaling pathway[D]. Jilin Yanji: Yanbian Univ, 2018: 4-11. |

