


2. 宁夏医科大学国家卫生健康委代谢性心血管疾病研究重点实验室,宁夏回族自治区,宁夏 银川 750004;
3. 宁夏医科大学宁夏血管损伤与修复研究重点实验室,宁夏回族自治区,宁夏 银川 750004;
4. 宁夏医科大学总医院感染科,宁夏回族自治区,宁夏 银川 750004;
5. 宁夏医科大学药学院,宁夏回族自治区,宁夏 银川 750004
 ,
JIAO Yun4,
WANG Qing-qing1,2,3,
XU Long1,2,3,
ZHANG Hui1,2,3,
GUO Wei1,2,3,
YANG An-ning,
HAO Yin-ju5,
JIANG Yi-deng1,2,3
,
JIAO Yun4,
WANG Qing-qing1,2,3,
XU Long1,2,3,
ZHANG Hui1,2,3,
GUO Wei1,2,3,
YANG An-ning,
HAO Yin-ju5,
JIANG Yi-deng1,2,3

2. School of Basic Medicine, Key Lab of Metabolic Cardiovascular Disease Research, National Health Commission, Ningxia Medical University, Ningxia Hui Autonomous Region, Yinchuan 750004, China;
3. School of Basic Medicine, Ningxia Key Lab of Vascular Injury and Repair Research, Ningxia Medical University, Ningxia Hui Autonomous Region, Yinchuan 750004, China;
4. School of Basic Medicine, Dept of Infection, Ningxia Medical University, Ningxia Hui Autonomous Region, Yinchuan 750004, China;
5. School of Basic Medicine, School of Pharmacy, Ningxia Medical University, Ningxia Hui Autonomous Region, Yinchuan 750004, China
同型半胱氨酸(homocysteine,Hcy)是甲硫氨酸代谢过程中的产物,血浆中Hcy的浓度超过15μmol/L定义为高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)[1]。肝脏作为Hcy代谢的重要脏器,Hcy的水平增加与肝脏损伤密切相关[2]。课题组前期研究发现Hcy水平增加能够通过促进肝细胞大量凋亡引起肝脏损伤[3-6]。目前认为,自噬是一种至关重要的溶酶体降解途径,主要通过细胞器或蛋白质的降解来保证细胞功能,其特征是通过细胞的降解和循环形成新的细胞,病理状态下,细胞内过度自噬对细胞的损伤起着关键作用[7], 因此,探讨HHcy通过自噬引起肝损伤的发生机制至关重要。大量研究表明,26S蛋白酶体非ATP酶调节亚基10(proteasome 26S subunit, non-ATPase, 10,PSMD10)在肝细胞增殖、侵袭和凋亡中起着重要的调控作用[8]。Sun等[9]研究发现PSMD10的过度表达减弱原代肝细胞的增殖,促进肝细胞凋亡,说明PSMD10在肝脏中过表达与肝脏的损伤密切相关。但是,在HHcy中,PSMD10是否通过调控肝细胞自噬引起肝损伤是未知的。因此探讨PSMD10在HHcy致肝损伤过程中的作用及其与肝细胞自噬的调控关系将为肝脏损伤的防护提供新的实验依据。
1 材料与方法 1.1 材料BS110S型精密天平(Sartorius);超净工作台(安泰技术有限公司);电泳仪和凝胶成像仪(Bio-Rad);普通PCR仪和qRT-PCR仪(德国耶拿);总RNA提取试剂盒(DP419, 北京天根生物技术有限公司);逆转录试剂盒(RR037A,日本Takara);酶标仪(美国Bio-TEK);Anti-PSMD10、Anti-LC3B和Anti-p62(ab182576,ab192890,ab56416美国Abcam);PSMD10引物(上海生工);ALT和AST ELISA试剂盒(JL45794,JL12187,上海信裕生物),全自动生化分析仪(美国强生)。
1.2 方法 1.2.1 动物分组及饲养实验动物购于美国Jackson实验室。随机选取野生型小鼠(cbs+/+,n=8)及cbs基因敲除小鼠(cbs+/-,n=8)均给予高蛋氨酸(2%高蛋氨酸)饮食,2组小鼠饲养在屏障环境中,自由摄食饮水,12周后处理取材用于后续实验。
1.2.2 细胞培养及分组用含10%胎牛血清及1%双抗的RPMI1640培养液,于37 ℃、含5% CO2的培养箱中培养正常人源肝细胞(HL-7702),用含终浓度100μmol·L-1 Hcy培养液干预细胞48 h,用于后续实验。
1.2.3 细胞转染PSMD10 siRNA在1.5 mL EP管中加入250 μL的1640纯培养基(不含血清,不含抗生素),随后加入0.5OD 6.25 μL的PSMD10 siRNA,混匀。在另一个1.5 mL EP管中加入250 μL纯培养基和5 μL的Lipofectamine 2000,混匀静置5 min。之后混匀两管液体,静置20 min。将六孔板中培养基弃掉,加入1.5 mL的纯培养基,20 min过后,将混合的液体500 μL液体全部加入到六孔板中。6 h后,换做正常的培养基,并加入Hcy药物干预,48 h后进行后续其他实验。
1.2.4 细胞转染PSMD10过表达腺病毒将10 μL的腺病毒加入25 cm2的培养瓶中,加入4 mL正常培养基,6 h后换培养基,48 h后荧光显微镜观察转染效率。
1.2.5 ELISA检测肝细胞培养液上清中的AST和ALT按照试剂盒说明收集样本,制备标准品;加样:分别设标准品孔,空白孔和样本孔各加不同浓度的标准品50 μL,样本孔中加待测样本50 μL,空白孔加样本稀释液50 μL。用封板膜封板后置37 ℃温育30 min。将30倍浓缩洗涤液用蒸馏水30倍稀释后进行洗涤,随后每孔加入酶标试剂50 μL,空白孔除外,再次进行温育和洗涤,加入显色剂A 50 μL,再加入显色剂B 50 μL,混匀后孵育15 min,每孔加终止液50 μL,终止反应,450 nm波长处检测吸光度值。
1.2.6 qRT-PCR检测肝脏和肝细胞中PSMD10的表达按RNA提取试剂盒说明书提取小鼠肝脏和肝细胞中的总RNA,逆转录合成cDNA。引物交由上海生工设计,PSMD10(人源)Forward:GTGCCAGTGAATGATAAAGACG,Reverse:TGTAAGGGAGTACAGCCATTTT;PSMD10(鼠源)Forward:GAGGGGTGTGTGTCTAACATAA,Reverse:GTCCTGATCAGTTCTAGTAGCC。PCR扩增条件为: 95 ℃预变性5 min;95 ℃变性10 s、59 ℃退火30 s、72 ℃延长30 s,45个循环。反应结束后,根据扩增曲线数据,按照计算公式: 2-ΔΔCt (ΔCt=Ct目的-Ct内参,ΔΔCt=ΔCt-10)分析PSMD10的表达量。实验重复3次。
1.2.7 Western blot法检测PSMD10、LC3B、P62的蛋白表达将干预好的细胞裂解变性,取30 μg总蛋白上样,经SDS/PAGE凝胶电泳,电转至PVDF膜,封闭后,与1 ∶1 000稀释的一抗4 ℃孵育过夜,再与1 ∶5 000稀释的二抗室温孵育2 h,PBST清洗3次,每次10 min,曝光。用凝胶图像分析成像系统进行扫描分析,结果以目的条带面积灰度值做半定量检测。
1.2.8 数据处理数据均采用Prism 6.0软件进行统计学处理。数据均为计量资料,用±s表示,两样本均数间比较采用Student’s t检验,多样本均数间比较采用One-way ANOVA检验,各组结果之间的两两比较用Student-Newman-Keuls检验。
2 结果 2.1 测定小鼠血清和肝细胞培养液上清中AST和ALT为了验证Hcy引起肝脏损伤,使用全自动生化分析仪检测小鼠血清中AST和ALT;100 μmol·L-1 Hcy干预肝细胞48 h,ELISA检测肝细胞培养液上清的中AST和ALT水平,检测结果显示,cbs+/-小鼠血清中AST和ALT的水平高于cbs+/+小鼠(P<0.01,Fig 1A,B),Hcy组肝细胞培养液上清中AST和ALT的水平的高于control组(P<0.01,Fig 1C,D),表明Hcy能够的引起肝脏的损伤。
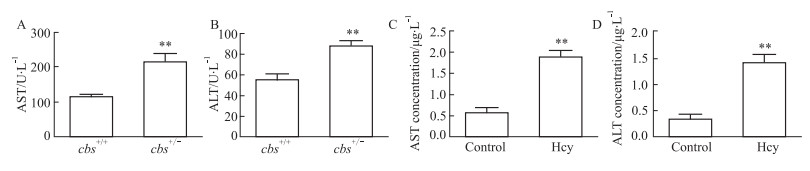
|
| Fig 1 Changes of AST and ALT levels in mouse serum and hepatocyte culture supernatant A and B: Contents of ALT and AST in serum of mice were analyzed using automatic biochemical analyzer (±s, n=8); C and D: The levels of AST and ALT in the supernatant of hepatocytes were detected by ELISA (±s, n=3). **P<0.01 vs cbs+/+ or control group. |
为了验证自噬在Hcy致肝损伤过程中的变化,使用Western blot检测肝脏和肝细胞中自噬相关蛋白LC3B与p62的表达改变,检测结果显示cbs+/-小鼠较cbs+/+小鼠肝脏相比,LC3Ⅱ/Ⅰ的比值增加,p62的表达降低(P<0.01,Fig 2A);Hcy干预肝细胞后,与control组相比,LC3Ⅱ/Ⅰ的比值增加,p62的表达降低(P<0.01,Fig 2B)。细胞水平与动物水平变化一致,表明Hcy促进肝细胞自噬水平增加。
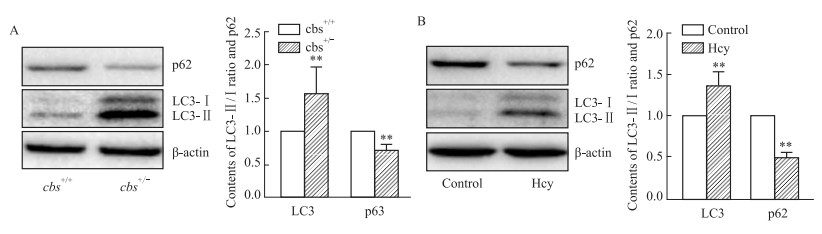
|
| Fig 2 The protein expression of LC3B and p62 in liver and hepatocytes detected by Western blot A: The protein expression of LC3B and p62 in the liver tissues of cbs+/+ and cbs+/- mice was detected by Western blot (±s, n=8); B: The protein expression of LC3B and p62 in hepatocytes was detected by Western blot (±s, n=3). **P<0.01 vs cbs+/+or control group. |
为了明确PSMD10在Hcy引起肝损伤过程中的作用,使用qRT-PCR和Western blot检测肝脏和肝细胞中PSMD10 mRNA和蛋白的表达改变。检测结果显示,cbs+/-小鼠肝脏中PSMD10 mRNA和蛋白的表达水平均高于cbs+/+小鼠肝脏(P<0.05,P<0.01,Fig 3A);Hcy干预肝细胞后,与control组相比,Hcy组肝细胞中PSMD10 mRNA和蛋白的表达增加(P<0.01,Fig 3B)。以上结果说明,Hcy能够促进PSMD10在肝细胞中表达增加。
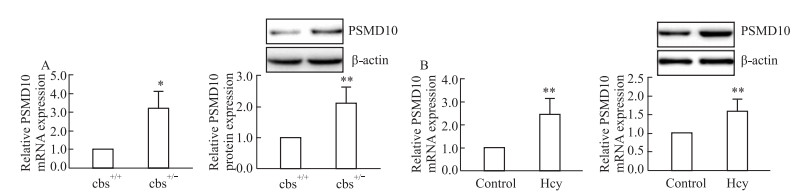
|
| Fig 3 Expression of PSMD10 in liver and hepatocytes detected by Western blot and qPT-RCR A: The expression of PSMD10 mRNA and protein in liver tissues were detected by qRT-PCR and Western blot(±s, n=8); B: The expression of PSMD10 mRNA and protein in hepatocytes were detected by qRT-PCR and Western blot (±s, n=3). *P<0.05, **P<0.01 vs cbs+/+ or control group. |
为进一步验证PSMD10是否调控Hcy诱导的肝细胞自噬,肝细胞转染PSMD10 siRNA并用Hcy干预48 h后,Western blot检测PSMD10蛋白表达改变,结果显示PSMD10敲低成功如Fig 4A所示,通过Western blot检测肝细胞中自噬相关蛋白LC3B与p62的表达改变,结果显示,与Hcy+siNC组相比,Hcy+siPSMD10组LC3Ⅱ/Ⅰ的比值降低,p62的表达增加(P<0.05,P<0.01,Fig 4B);为进一步验证PSMD10调控肝细胞自噬的功能,感染PSMD10过表达腺病毒(ad-PSMD10),荧光显微镜观察感染效率,qRT-PCR和Western blot检测肝细胞过表达PSMD10后自身表达改变,如Fig 4C,D所示,肝细胞PSMD10过表达腺病毒感染成功;进一步使用Western blot检测LC3B和p62的表达改变,结果表明,与ad-GFP组相比,ad-PSMD10组LC3Ⅱ/Ⅰ的比值增加,p62的表达降低(P<0.01,Fig 4E)。该结果表明,PSMD10增加引起肝细胞自噬,敲低PSMD10后能够缓解Hcy诱导的肝细胞自噬。
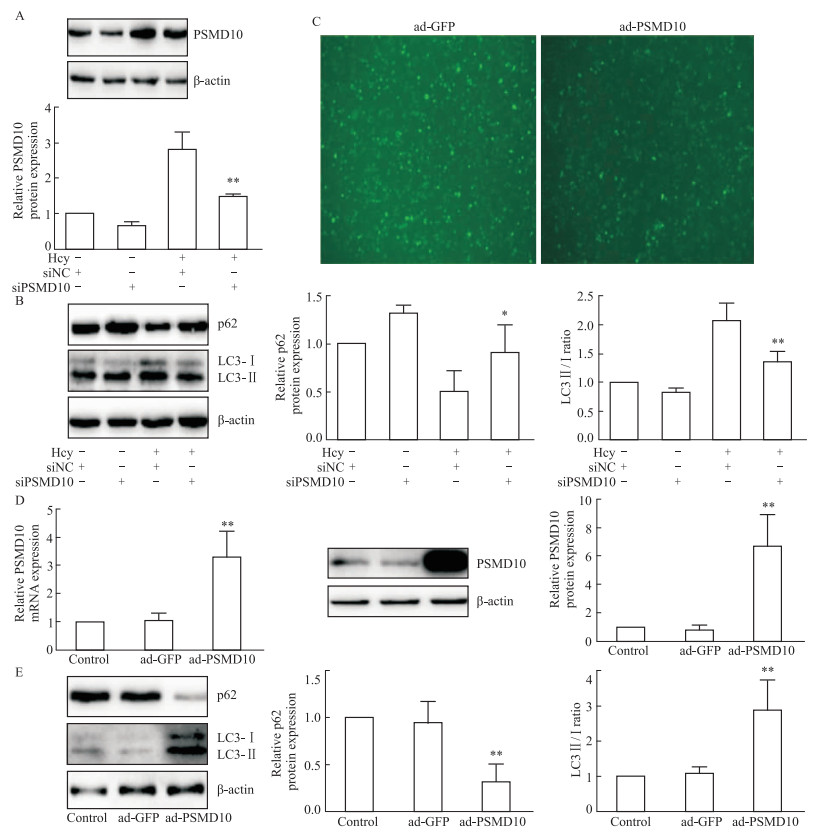
|
| Fig 4 Changes of autophagy levels in hepatocytes after knockdown or overexpression of PSMD10 A: Hepatocytes were transfected with PSMD10 siRNA, and the expression of PSMD10 was detected by Western blot (±s, n=3); B: Hepatocytes were transfected with PSMD10 siRNA, and the expression of LC3B and p62 were detected by Western blot (±s, n=3); C: Hepatocytes were infected with PSMD10 overexpressing adenovirus, and infection efficiency was observed by fluorescence microscope; D: Hepatocytes were infected with PSMD10 overexpressing adenovirus, and the expression of PSMD10 was detected by qRT-PCR and Western blot (±s, n=3); E: Hepatocytes were infected with PSMD10 overexpressing adenovirus, and the expression ofLC3B and p62 were detected by Western blot (±s, n=3). *P<0.05, **P<0.01 vs Hcy+siNC or ad-GFP group. |
为进一步验证PSMD10通过自噬途径调控Hcy诱导的肝损伤,肝细胞转染PSMD10 siRNA,Hcy干预肝细胞48h后,使用ELISA检测肝细胞培养液上清中AST和ALT水平,检测结果显示,与Hcy+siNC组相比,Hcy+siPSMD10组肝细胞培养液上清中AST和ALT水平降低(Fig 5A和B,P<0.01),为进一步验证PSMD10对肝细胞损伤的调控,肝细胞感染PSMD10过表达腺病毒,使用ELISA检测肝细胞培养液上清中AST和ALT水平,检测结果显示,与ad-GFP组相比,ad-PSMD10组AST和ALT水平增加(Fig 5C,P<0.01)。该结果表明敲低PSMD10后能够抑制Hcy引起的肝细胞损伤,过表达PSMD10,肝细胞损伤明显增加。以上结果说明PSMD10经自噬途径调控Hcy引起的肝损伤。
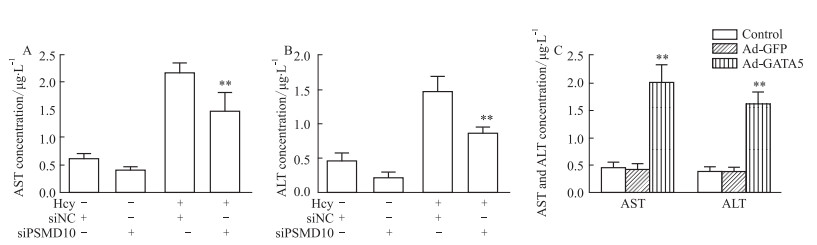
|
| 图 5 Changes of hepatocyte injury after knocking down or overexpressing PSMD10 A and B: Knock down the expression of PSMD10 in hepatocytes, expression levels of AST and ALT in the supernatant of hepatocyte culture medium were detected by ELISA (±s, n=3); C: Overexpression the PSMD10 in hepatocytes, expression levels of AST and ALT in the supernatant of hepatocytes culture medium were detected by ELISA (±s, n=3); **P<0.01 vs Hcy+siNC or ad-GFP group. |
同型半胱氨酸(Hcy)浓度升高是心血管疾病如冠心病、高血压和中风等的独立危险因素,Hcy在体内主要通过再甲基化和转硫这两种重要方式代谢,Hcy的转硫途径在肝脏中发挥至关重要的作用,主要受到胱硫酶醚合成酶(CBS)的调节,当CBS的活性降低,Hcy不能够充分的通过转硫途径转换为胱硫醚,从而在体内蓄积引起肝脏损伤[10-12]。大量的研究显示,高水平的Hcy与酒精性肝硬化、慢性肝病、肝炎等疾病密切相关[13],肝脏功能障碍导致蛋氨酸代谢异常,出现Hcy升高,当Hcy水平增加又会进一步的损害肝脏的功能,本实验结果显示,使用cbs+/-小鼠高蛋氨酸饮食后,cbs+/-小鼠血清中AST与ALT水平明显上升,在细胞水平也进一步证明了在Hcy刺激肝细胞后,肝细胞上清中的AST和ALT显著增加,说明,Hcy显著引起肝脏损伤,肝细胞受损。课题组前期的大量工作也证明HHcy小鼠出现显著的肝脏损伤,Hcy能够通过促进肝细胞大量凋亡和异常的自噬等途径造成肝脏的损伤[3-6]。
自噬是一种自我保护机制,维持细胞稳态和细胞器的完整性[14]。自噬在调节肝脏生理和平衡肝脏代谢中起着至关重要的作用[15];课题组前期研究发现CFTR能够通过调控肝细胞自噬调控肝脏的损伤[6],本实验研究结果也表明,cbs+/-小鼠肝脏和Hcy组肝细胞中,LC3Ⅱ/Ⅰ的比值增加,p62的表达明显降低,进一步的验证Hcy能够促进肝细胞大量自噬造成肝脏损伤。
有研究表明,在饥饿或压力的条件下,PSMD10能够通过与细胞质中的ATG7以及核热激转录因子1(HSF1)协同结合作用促进肝细胞癌(HCC)中的自噬[16]。本研究结果显示,在cbs+/-小鼠肝脏和Hcy组肝细胞中,PSMD10的mRNA和蛋白的表达均明显增加,说明PSMD10可能与Hcy引起的肝脏损伤密切相关。Zhao等[17]研究发现,当构建肝脏特异性PSMD10过表达小鼠,肝脏出现损伤,这进一步的证明在PSMD10与肝脏损伤过程中表达增加。本实验发现当肝细胞中敲低PSMD10的表达后,Hcy诱导的肝细胞自噬和肝损伤降低,PSMD10过表达后,肝细胞自噬水平增加,肝细胞损伤加重,说明PSMD10通过调控肝细胞自噬进而调控Hcy所引起的肝损伤。有研究报道显示,Linc-GALH可以通过调节DNMT1的泛素化调控PSMD10的甲基化状态,从而调节PSMD10的表达,调控肝癌细胞的增殖和转移[18]。课题组前期也证明,Hcy上调肝细胞中DNMT1的表达,通过DNA甲基化和组蛋白甲基化调控肝细胞损伤[6],这进一步的证明Hcy通过调控PSMD10激活肝细胞自噬造成肝脏损伤。
综上所述,Hcy诱导的肝细胞过度自噬促进PSMD10表达增加,进而导致肝损伤。这为临床治疗Hcy所引起的肝损伤提供了新的治疗思路。
| [1] |
Kaye A D, Jeha G M, Pham A D, et al. Folic acid supplementation in patients with elevated homocysteine levels[J]. Adv Ther, 2020, 37(10): 4149-64. doi:10.1007/s12325-020-01474-z |
| [2] |
Al-Bayyari N, Hailat R, Subih H, et al. Vitamin D reduces risk of cardiovascular and liver diseases by lowering homocysteine levels: double-blinded, randomised, placebo-controlled trial[J]. BrJNutr, 2020, 1: 1-8. |
| [3] |
谢琳, 丁宁, 徐灵博, 等. FoxO1 DNA甲基化在同型半胱氨酸致肝细胞凋亡中的作用[J]. 实用医学杂志, 2018, 34(16): 2659-62, 69. Xie L, Ding N, Xu L B, et al. The role of FoxO1 DNA methylation in hepatocyte apoptosis induced by homocysteine[J]. The J Pract Med, 2018, 34(16): 2659-62, 69. doi:10.3969/j.issn.1006-5725.2018.16.007 |
| [4] |
马芳, 张辉, 李桂忠, 等. miR-148a-5p参与了高蛋氨酸饮食诱导ApoE(-/-)小鼠的肝细胞凋亡[J]. 中国组织工程研究, 2020, 24(35): 5632-7. Ma F, Zhang H, Li G Z, et al. Involvement of miR-148a-5p in ApoE-/-mouse hepatocyte apoptosis induced by high methionine diet[J]. CRTER, 2020, 24(35): 5632-7. |
| [5] |
孙磊, 郭伟, 马鹏俊, 等. miR-30a-5p启动子区DNA甲基化在同型半胱氨酸致肝损伤中的作用[J]. 中国病理生理杂志, 2020, 36(1): 119-26. Sun L, Guo W, Ma P J, et al. Effect of DNA methylation of miR-30a-5p promoter region on hepatic injury induced by homocysteine[J]. Chin J Pathophysiol, 2020, 36(1): 119-26. doi:10.3969/j.issn.1000-4718.2020.01.017 |
| [6] |
Yang A, Jiao Y, Yang S, et al. Homocysteine activates autophagy by inhibition of CFTR expression via interaction between DNA methylation and H3K27me3 in mouse liver[J]. Cell Death Dis, 2018, 9(2): 169. doi:10.1038/s41419-017-0216-z |
| [7] |
李帅, 鲍翠玉, 李晶. 自噬相关通路在糖尿病心肌病中的研究进展[J]. 中国药理学通报, 2019, 35(6): 753-6. Li S, Bao C Y, Li J. Research progress of autophagy-related pathways in diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2019, 35(6): 753-6. |
| [8] |
Han J, Wang F, Lan Y, et al. KIFC1 regulated by miR-532-3p promotes epithelial-to-mesenchymal transition and metastasis of hepatocellular carcinoma via gankyrin/AKT signaling[J]. Oncogene, 2019, 38(3): 406-20. doi:10.1038/s41388-018-0440-8 |
| [9] |
Sun W, Ding J, Wu K, et al. Gankyrin-mediated dedifferentiation facilitates the tumorigenicity of rat hepatocytes and hepatoma cells[J]. Hepatology, 2011, 54(4): 1259-72. doi:10.1002/hep.24530 |
| [10] |
Lee H O, Wang L, Kuo Y M, et al. S-adenosylhomocysteine hydrolase over-expression does not alter S-adenosylmethionine or S-adenosylhomocysteine levels in CBS deficient mice[J]. Mol Genet Metab Rep, 2018, 15: 15-21. doi:10.1016/j.ymgmr.2018.01.002 |
| [11] |
Riberio D F, Cella P S, da Silva LECM, et al. Acute exercise alters homocysteine plasma concentration in an intensity-dependent manner due increased methyl flux in liver of rats[J]. Life Sci, 2018, 196: 63-8. doi:10.1016/j.lfs.2018.01.003 |
| [12] |
Shimada R, Ebihara K. Soybean amplifies the hypohomocysteinemic effect of betaine and improves its hypercholesterolemic effect. Biosci. Biotechnol[J]. Biosci Biotechnol Biochem, 2018, 82(4): 669-76. doi:10.1080/09168451.2017.1403886 |
| [13] |
Shabangu C S, Huang J F, Hsiao H H, et al. Liquid biopsy for the diagnosis of viral hepatitis, fatty liver steatosis, and alcoholic liver diseases[J]. Int J Mol Sci, 2020, 21(10): 3732. doi:10.3390/ijms21103732 |
| [14] |
Li D, Yang S G, He C W, et al. Excess diacylglycerol at the endoplasmic reticulumdisrupts endomembrane homeostasis and autophagy[J]. BMC Biol, 2020, 18(1): 107. doi:10.1186/s12915-020-00837-w |
| [15] |
Brecklinghaus T. Role of autophagy in drug induced liver injury[J]. Arch Toxicol, 2020, 94(10): 3599-600. doi:10.1007/s00204-020-02887-z |
| [16] |
Luo T, Fu J, Xu A, et al. PSMD10/gankyrin induces autophagy to promote tumor progression through cytoplasmic interaction with ATG7 and nuclear transactivation of ATG7 expression[J]. Autophagy, 2016, 12(8): 1355-71. doi:10.1080/15548627.2015.1034405 |
| [17] |
Zhao X, Fu J, Xu A, et al. Gankyrin drives malignant transformation of chronic liver damage-mediated fibrosis via the Rac1/JNK pathway[J]. Cell Death Dis, 2015, 6(5): 1751. doi:10.1038/cddis.2015.120 |
| [18] |
Xu X, Lou Y, Tang J, et al. The long non-coding RNA Linc-GALH promotes hepatocellular carcinoma metastasis via epigenetically regulating Gankyrin[J]. Cell Death Dis, 2019, 10(2): 86. doi:10.1038/s41419-019-1348-0 |