


急性肝损伤是由各种原因引起的肝脏短时间内功能异常,严重者甚至导致肝衰竭,进而危及生命[1]。急性肝损伤可由肝脏长时间缺血、药物、乙醇、毒素或毒物暴露、代谢紊乱、感染及免疫过程等引起。由于病因多样且发病较急,目前对其治疗仍是一个挑战[1]。急性肝损伤发病机制复杂,涉及氧化应激、炎症反应、NF-κB活化、细胞凋亡等[2]。肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)作为一种多效性细胞因子,在各种肝病中大多可见含量升高,其诱导的细胞凋亡是肝损伤的一种典型的病理机制[3]。TNF-α联合应用肝脏特异性致敏剂D-半乳糖胺(D-galactosamine,D-GalN)可诱导肝细胞凋亡和肝组织损伤,目前已在多种体内外模型中证明了其诱发急性肝损伤的作用[4-6]。
双环醇(Bicyclol)是由我国自主研发的I类抗炎保肝药物[7]。在刀豆蛋白A、顺铂、四环素、酒精及肝脏缺血/再灌注等引起的小鼠或大鼠肝损伤模型中已证实具有明显的肝保护作用[7-8]。其中,双环醇对化学性肝损伤的作用与保护线粒体功能,清除自由基,调节脂质代谢等有关[7-8];而对刀豆蛋白A等引起的免疫性肝损伤的保护作用与调节炎症/抗炎因子的体内平衡、调节内质网功能及促进热休克蛋白的表达,从而抑制肝细胞凋亡有关[7-8]。另外,双环醇对脂多糖(lipopolysaccharide,LPS)/D-GalN及聚肌胞苷酸(polyinosinic-polycytidylic acid,Poly(I: C))/D-GalN引起的肝损伤同样具有明显缓解作用,其机制则涉及抗炎、抗氧化应激作用[9-11]。鉴于TNF-α/D-GalN诱导的细胞凋亡在肝损伤中的关键作用,双环醇对TNF-α/D-GalN诱导的凋亡性肝损伤是否同样具有保护作用,目前尚未可知。本研究拟通过TNF-α联合D-GalN(TNF-α/D-GalN)诱导的小鼠急性凋亡性肝损伤模型,评价双环醇对肝损伤的保护作用及相关机制。
1 材料与方法 1.1 药物与试剂双环醇(北京协和药厂,纯度> 99%),小鼠TNF-α重组蛋白(R&D Systems),D-GalN(Sigma)。TUNEL细胞凋亡检测试剂盒(Roche),线粒体提取试剂盒(索莱宝)。含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,caspase-3)、caspase-9活性检测试剂盒及Bradford蛋白定量试剂盒(碧云天)。纯化线粒体膜通道孔(mPTP)光度法检测试剂盒(美国GENMED公司)。细胞色素C(Cytochrome c, Cyt c)及Actin抗体(Cell Signaling公司)。激活型caspase-3及caspase-9、Bax、Bcl-2、COX IV抗体(沈阳万类生物公司)。
1.2 模型及处理SPF级♂ C57BL/6N小鼠(22.0 g±2.0 g)购于斯贝福(北京)生物技术有限公司,许可证号SCXK(京)-2019-0010。小鼠适应3 d后按体质量随机分成6组:对照组、双环醇高剂量(200 mg·kg-1·d-1)单独处理组、模型组、模型+双环醇低/中/高剂量(50/100/200 mg·kg-1·d-1)组,每组6只。采用不同剂量双环醇或对照溶剂(5 g·L-1的羧甲基纤维素钠)灌胃5 d,每天2次。于末次给药后2 h腹腔注射700 mg·kg-1的D-GalN,30 min后腹腔注射10 μg·kg-1的TNF-α,正常及双环醇单独给药组给予溶剂PBS腹腔注射。4 h后取血并分离血清,生化仪检测ALT和AST,收集肝组织标本用于后续检测。实验按照国家实验室动物饲养管理规范进行,并经中国医学科学院医药生物技术研究所伦理委员会审核批准。
1.3 生存率分析将60只SPF级♂ C57BL/6N小鼠(22.0 g±2.0 g)按体质量随机分成对照组、模型组、模型+双环醇低剂量组、模型+双环醇高剂量组,每组15只。给药及诱导过程同上,于TNF-α注射后观察并记录各组小鼠24 h生存情况并绘制生存率曲线。
1.4 组织病理及TUNEL细胞凋亡检测采集小鼠肝右叶相同部位肝组织,10%中性福尔马林固定24 h后,常规程序制作苏木精-伊红(hematoxylin-eosin,HE)染色玻片,显微镜下观察各组肝组织病理学改变。TUNEL细胞凋亡检测采用肝组织经4%多聚甲醛固定后制作石蜡切片,常规脱蜡、蒸馏水洗。加入蛋白酶K 37℃孵育30 min,PBS洗3次。吸干周围水分,加入TUNEL反应混合液37 ℃孵育2 h,PBS洗3次。用新配制的3%过氧化氢溶液室温避光孵育15 min,PBS洗3次。加入适量converter-POD覆盖组织,37 ℃孵育30 min,PBS洗3次。DAB显色,苏木精复染、脱水、封片后显微镜观察,阳性细胞的胞核呈棕黄色。
1.5 caspase活性检测按照说明书方法研磨各组小鼠肝组织,Bradford法测定肝匀浆蛋白含量,调整蛋白浓度一致。取96孔板,设立空白对照孔、样品孔及不同浓度标准品孔,配制反应体系及加样。405 nm波长下测定OD值,以对照组caspase活性为1,计算各组caspase-3及-9相对活性。
1.6 纯化线粒体膜通透性转换孔(membrane permeability transition pore, mPTP)开放状态测定用线粒体提取试剂盒提取肝组织线粒体并定量。根据说明书,取200 μg纯化线粒体加入到96孔板对应孔中,然后加入170 μL室温预热的缓冲液,混匀后即刻放入酶标仪测定540 nm波长下初始读数(OD0 min)。室温静置1 min,加入10 μL诱导液,混匀后测定10 min吸光度值OD10 min,计算吸光值降低相对大小Relative△A540=(OD0 min-OD10 min)/ OD0 min。吸光值降低越大(比值越大),表明线粒体mPTP开放程度越大。
1.7 Western blot取肝组织按质量比例加入裂解液,匀浆器研磨后12 000×g,4 ℃离心10 min。取上清进行蛋白定量,调整浓度一致,加入上样缓冲液并煮沸后用于Western blot检测。常规上样、电泳、转膜、封闭后于4 ℃孵育一抗Cleaved caspase-3、Cleaved caspase-9、Bax、Bcl-2、Cyt c过夜(1:500)。次日,TBST洗3次,室温孵育相应二抗(1 ∶ 5 000)1 h,使用Bio-Rad凝胶成像系统检测蛋白条带,采用Gel-Pro analyzer进行定量分析。Cyt c及内参COX Ⅳ蛋白检测采用线粒体提取试剂盒提取线粒体并裂解、煮沸后上样检测。
1.8 统计分析将所得数据用GraphPad Prism 8.0作图及分析,结果以x±s表示,每组小鼠数目以n表示,多组间均数比较采用单因素方差分析,mantel-cox方法检验生存率差异。
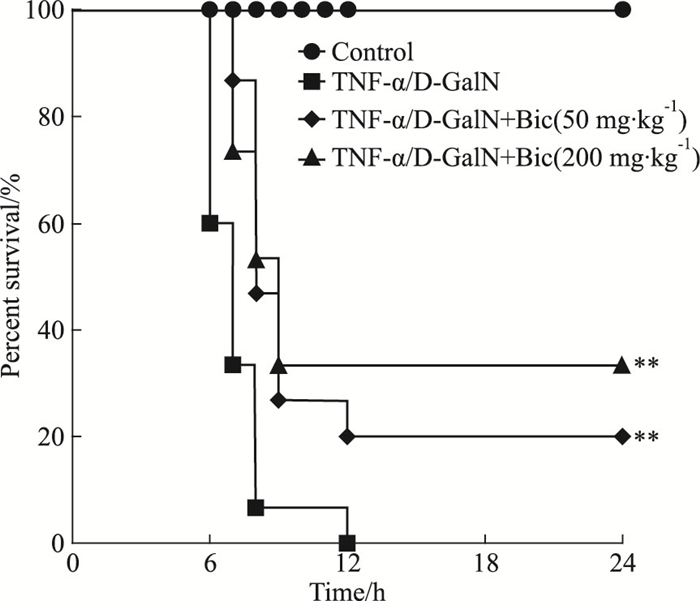
2 结果 2.1 双环醇提高TNF-α/D-GalN诱导肝损伤小鼠的生存率如Fig 1所示,TNF-α/D-GalN处理后小鼠陆续死亡。6 h时,模型组生存率为60%,双环醇低、高剂量组均为100%;8 h时,模型组生存率为6.67%,双环醇低、高剂量组均分别为46.67%及53.33%;12 h及24 h时,模型组生存率为0%,双环醇低、高剂量组均分别为20%及33.33%。因此,双环醇低、高剂量干预后小鼠生存率较模型组有明显提升,两组生存率的提高均有统计学意义(P < 0.01)。
|
| Fig 1 Effect of bicyclol on mouse survival rate of TNF-α/D-GalN-induced fulminant hepatitis (x±s, n=15) **P < 0.01 vs TNF-α/D-GalN-induced model group |
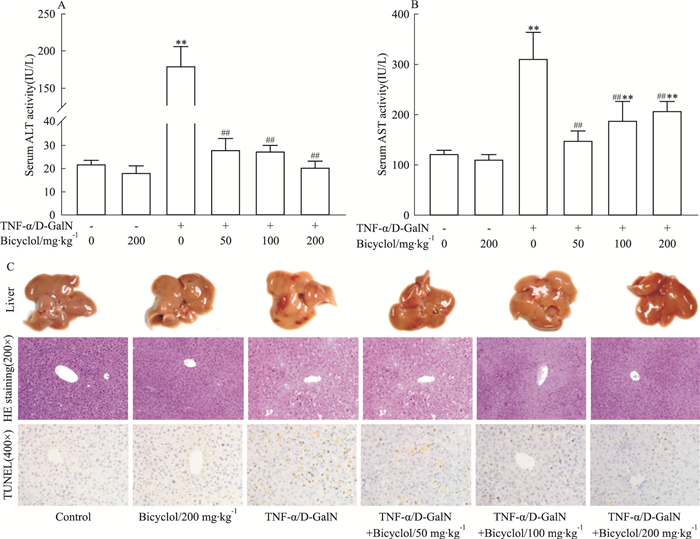
转氨酶是反映肝脏功能的常用指标。本研究中,双环醇单独处理对转氨酶水平无影响,而双环醇干预能明显抑制TNF-α/D-GalN诱导的ALT及AST升高(Fig 2A和2B)。肝脏大体观察可见模型组肝脏出血灶明显,给药后明显好转(Fig 2C)。病理结果与以往TNF-α/D-GalN诱导肝损伤病理损伤相似[6],模型组可见大量肝细胞死亡并伴有出血淤积、大片肝索结构破坏,而不同剂量双环醇干预后,肝小叶内结构破坏及红细胞淤积情况均明显减轻(Fig 2C)。TUNEL法肝组织内细胞凋亡检测结果显示:肝脏凋亡细胞核染成棕黄色,模型组凋亡细胞数目较多,双环醇干预后肝细胞凋亡明显减少(Fig 2C)。因此,双环醇能够减轻TNF-α/D-GalN诱导的肝组织损伤及肝细胞凋亡,且对细胞凋亡的抑制具有一定的剂量依赖性。
|
| Fig 2 Effect of bicyclol on TNF-α/D-GalN-induced apoptotic liver injury in mice (x±s, n=6) **P < 0.01 vs control group; ##P < 0.01 vs TNF-α/D-GalN-induced model group |
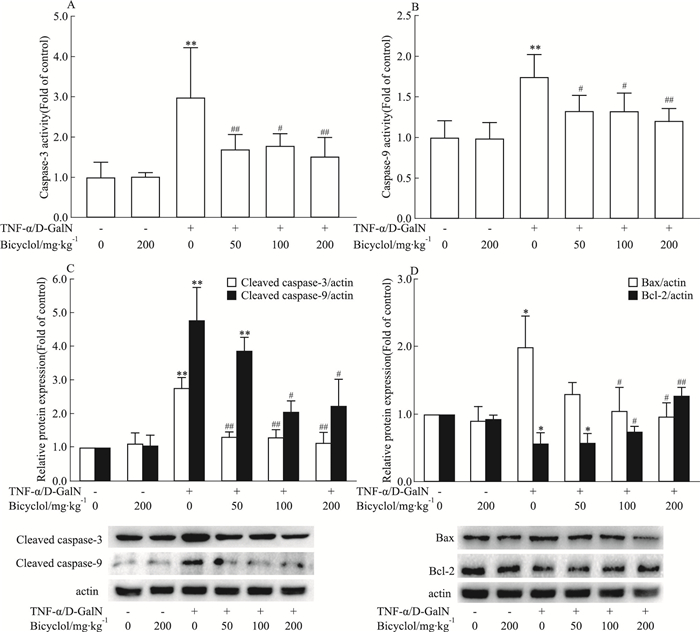
caspase家族属于半胱氨酸蛋白酶,介导细胞凋亡的级联反应,是细胞凋亡的中心调节分子。各组小鼠在PBS或TNF-α/D-GalN腹腔注射后4 h取肝组织,匀浆后检测肝内caspase-3和caspase-9(caspase-3/-9)活性。结果显示:双环醇单独给药组与正常对照组相比较,caspase-3/-9活性无显著变化,而模型组两者活性明显高于对照组。与模型组相比较,不同剂量双环醇干预后caspase-3/-9的活性显著降低(Fig 3A和3B)。与此一致,Western blot结果也证实模型组小鼠肝内激活型caspase-3/-9蛋白水平较正常对照组明显升高,而双环醇干预后肝内激活型caspase-3/-9蛋白水平明显下调(Fig 3C)。同时,不同剂量双环醇可降低TNF-α/D-GalN引起的Bax升高,并一定程度逆转TNF-α/D-GalN引起的抗凋亡蛋白Bcl-2下调。因此,TNF-α可引起D-GalN致敏的小鼠线粒体凋亡途径激活,而双环醇可明显抑制该过程,从而发挥抗肝损伤作用。
|
| Fig 3 Effect of bicyclol on mitochondrial apoptosis pathway of TNF-α/D-GalN-induced fulminant hepatitis in mice (x±s, n=6) *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TNF-α/D-GalN-induced model group |
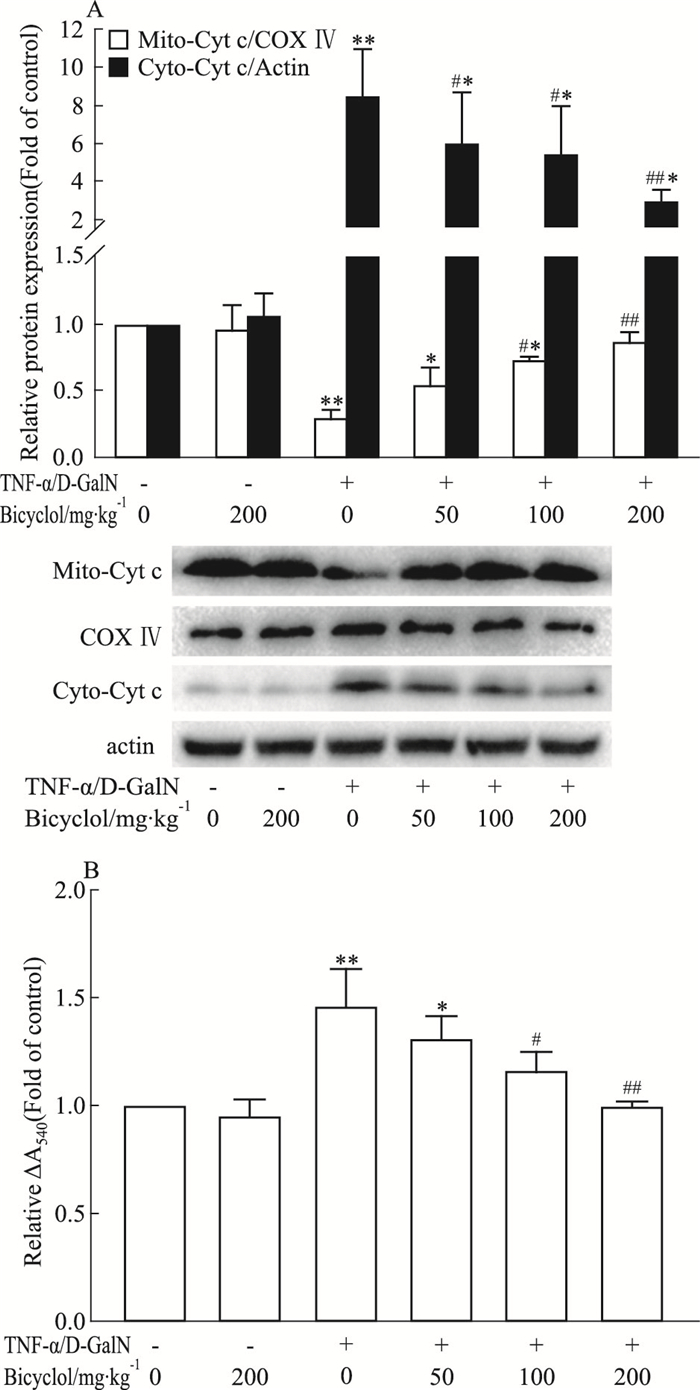
线粒体为TNF-α/D-GalN诱导肝细胞凋亡机制的核心环节,线粒体细胞色素C的胞质释放引起下游caspase的激活。因此,我们检测了双环醇在该模型中是否对线粒体起到保护作用。结果显示,双环醇单独给药对线粒体及胞质细胞色素C含量无影响,但可降低TNF-α/D-GalN诱导的胞质细胞色素C含量增加,抑制线粒体内细胞色素C含量的减少,即双环醇抑制了TNF-α/D-GalN引起的线粒体内细胞色素C的胞质释放,且该效应具有一定的浓度依赖性(Fig 4A)。肝损伤过程中线粒体mPTP的开放引起细胞色素C的胞质释放,mPTP开放程度检测结果显示:双环醇处理后吸光度降低较模型组小,说明其可抑制TNF-α/D-GalN诱导的mPTP开放增强(Fig 4B)。因此,双环醇在TNF-α/D-GalN诱导的肝损伤模型中的抗凋亡效应与其保护线粒体膜通透性,进而抑制线粒体内细胞色素C的胞质释放有关。
|
| Fig 4 Effect of bicyclol on cytochrome c level and opening of membrane permeability transition pore in mouse liver mitochondria (x±s, n=6) *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TNF-α/D-GalN-induced model group |
腹腔联合注射TNF-α和特异性肝脏致敏剂D-GalN可诱导肝细胞凋亡。目前,多种体内外模型已证实其在诱导急性肝细胞凋亡性肝损伤中的作用[4-6, 12]。细胞凋亡是TNF-α/D-GalN诱导重型肝炎的主要机制,抑制凋亡过程有望使肝损伤得到较好的治疗。双环醇作为我国临床推荐的常用保肝抗炎药物,在化学性、免疫性、脂肪性、肝部分切除与缺血再灌注等肝功能损伤模型中具有良好的抗炎保肝作用[8, 13]。前期我们在Poly(I: C)/D-GalN诱导的肝炎中证明了双环醇对氧化应激及炎症通路的抑制与其对线粒体的保护作用有关,但该机制并未涉及细胞凋亡过程[11]。因此,我们进一步提出假设:双环醇或可通过对线粒体的保护抑制TNF-α/D-GalN诱导的凋亡性肝损伤。本研究中我们证实了双环醇通过抑制经典的线粒体凋亡途径,缓解TNF-α/D-GalN诱导的肝损伤。
爆发性肝损伤病情进展迅速,往往对生命造成重大威胁。本研究中TNF-α/D-GalN诱导小鼠后6 h即可引起小鼠死亡,至12 h时模型组死亡率为100%,而双环醇处理可延缓小鼠死亡,明显提高生存率。TNF-α可通过两条途径诱导细胞凋亡[14],一种是内源性凋亡信号途径,即线粒体损伤引起细胞色素C的胞质释放及caspase-3和caspase-9激活,进而诱导下游凋亡级联反应。该过程中,mPTP作为跨越线粒体内外膜的由多种蛋白质组成的复合蛋白通道,其开放程度决定了凋亡因子细胞色素C等的胞质释放程度,基质中的促凋亡蛋白Bax、Bak等可增加其通透性,而抗凋亡的Bcl-2、Bcl-xL等蛋白则抑制这一过程[15-16]。本研究中我们发现,双环醇可抑制线粒体凋亡途径中caspase-3和caspase-9的激活。进一步研究显示,双环醇抑制了促凋亡蛋白Bax并提高抗凋亡蛋白Bcl-2的水平,进而降低了TNF-α/D-GalN诱导的mPTP开放程度,最终抑制了线粒体细胞色素C的胞质释放。双环醇在该模型中对线粒体膜通透性的保护与以往研究中其诱导热休克蛋白进而维持细胞氧化还原稳态及线粒体稳定性的作用一致[7-8]。细胞凋亡的另一条途径是外源性途径:TNF-α与细胞表面TNF-α受体1(TNFR1)结合,进而通过接头蛋白招募并激活caspase-8。激活的caspase-8不仅可以直接剪切并激活caspase-3,还可以通过剪切促凋亡蛋白Bid,促进其转位到线粒体中激活Bax及Bak,从而进一步激活内源性凋亡途径[17]。外源和内源途径介导的细胞凋亡交织在一起,双环醇抑制caspase-3的激活,这提示外源性凋亡途径可能也被双环醇所抑制。细胞凋亡通路失调与肝细胞癌、病毒性肝炎、自身免疫性肝炎及各种类型肝损伤有直接联系[3],而文献报道双环醇对以上几种肝病均有不同程度的保护作用。因此,基于本研究的结论,我们推测双环醇对细胞凋亡的抑制或在各种病因引起的肝病中具有不同程度的作用。
综上所述,双环醇通过抑制TNF-α/D-GalN诱导的线粒体凋亡途径缓解爆发性肝损伤,其机制与抑制线粒体膜通道转换孔开放、减少线粒体内细胞色素C释放进而抑制凋亡级联反应通路有关。本研究补充了双环醇对肝损伤过程中细胞凋亡的影响,为其在急性肝损伤防治中的更广泛应用提供了参考。
( 致谢: 本研究在中国医学科学院医药生物技术研究所动物实验室和病毒室完成,感谢在实验的指导老师及各位参与者!)
| [1] |
Thawley V. Acute liver injury and failure[J]. Vet Clin North Am Small Anim Pract, 2017, 47: 617-30. doi:10.1016/j.cvsm.2016.11.010 |
| [2] |
沈洪, 张蓓. 急性肝损伤研究进展[J]. 现代中西医结合杂志, 2009, 18(18): 2211-3. Shen H, zhang B. Research progress of acute liver injury[J]. Modern J Integr Tradit Chin West Med, 2009, 18(18): 2211-3. doi:10.3969/j.issn.1008-8849.2009.18.086 |
| [3] |
Eichhorst S T. Modulation of apoptosis as a target for liver disease[J]. Expert Opin Ther Targets, 2005, 9: 83-99. doi:10.1517/14728222.9.1.83 |
| [4] |
Ni H M, McGill M R, Chao X, et al. Caspase inhibition prevents tumor necrosis factor-alpha-induced apoptosis and promotes necrotic cell death in mouse hepatocytes in vivo and in vitro[J]. Am J Pathol, 2016, 186: 2623-36. doi:10.1016/j.ajpath.2016.06.009 |
| [5] |
Liu Y, Zhu L, Liang S, et al. Galactose protects hepatocytes against TNF-alpha-induced apoptosis by promoting activation of the NF-kappaB signaling pathway in acute liver failure[J]. Lab Invest, 2015, 95: 504-14. doi:10.1038/labinvest.2015.34 |
| [6] |
吴柯佳, 代洁, 张力. AMPK激活剂减轻TNF-α诱导的爆发性肝损伤[J]. 基因组学与应用生物学, 2017, 36(4): 1396-402. Wu K J, Dai J, Zhang L. AMPK activator alleviates TNF-α-induced fulminant liver injuryin mice[J]. Genomics Appl Biol, 2017, 36(4): 1396-402. |
| [7] |
王宇明, 李燕. 双环醇保肝抗炎药理机制研究新进展[J]. 胃肠病学和肝病学杂志, 2010, 19(7): 674-7. Wang Y M, Li Y. Research progress in mechanism of hepatoprotective and anti-inflammatory by bicyclol[J]. Chin J Gastroenterol Hepatol, 2010, 19(7): 674-7. doi:10.3969/j.issn.1006-5709.2010.07.036 |
| [8] |
谢雯, 于乐成. 双环醇临床应用专家共识—2020版[J]. 中华实验和临床感染病杂志, 2020, 14(3): 177-85. Xie W, Yu L C. Expert consensus on clinical application of bicyclol-2020 edition[J]. Chin J Exp Clin Infect Dis(Electronic Edition), 2020, 14(3): 177-85. doi:10.3877/cma.j.issn.1674-1358.2020.03.001 |
| [9] |
于英男, 郭江, 李烨, 等. 双环醇对刀豆蛋白A引起肝损伤小鼠肝脏基因表达谱的影响[J]. 药学学报, 2008, 43(6): 596-600. Yu Y N, Guo J, Li Y, et al. Effect of bicyclol on gene expression profile in mice with liver injury induced by concanavalin A[J]. Acta Pharm Sin, 2008, 43(6): 596-600. doi:10.3321/j.issn:0513-4870.2008.06.008 |
| [10] |
Wang H, Li Y. Protective effect of bicyclol on acute hepatic failure induced by lipopolysaccharide and D-galactosamine in mice[J]. Eur J Pharmacol, 2006, 534: 194-201. doi:10.1016/j.ejphar.2005.12.080 |
| [11] |
Li H, Li J R, Huang M H, et al. Bicyclol attenuates liver inflammation induced by infection of hepatitis C virus via repressing ROS-Mediated activation of MAPK/NF-kappaB signaling pathway[J]. Front Pharmacol, 2018, 9: 1438. doi:10.3389/fphar.2018.01438 |
| [12] |
Lu C, Kai H, Ling L, et al. AMPK dependent protective effects of metformin on tumor necrosis factor-induced apoptotic liver injury[J]. Biochem Biophys Res Commun, 2015, 465: 381-6. doi:10.1016/j.bbrc.2015.08.009 |
| [13] |
Liu G T. Bicyclol: A novel drug for treating chronic viral hepatitis B and C[J]. Med Chem, 2009, 5: 29-43. doi:10.2174/157340609787049316 |
| [14] |
Czaja A J. Targeting apoptosis in autoimmune hepatitis[J]. Dig Dis Sci, 2014, 59: 2890-904. doi:10.1007/s10620-014-3284-2 |
| [15] |
刘涛, 李晶, 鲍翠玉. 高脂通过线粒体通路诱导H9c2心肌细胞损伤[J]. 中国药理学通报, 2019, 35(4): 494-9. Liu T, Li J, Bao C Y. High fatty acid induced H9c2 cardiomyocytes injury through mitochondrial pathways[J]. Chin Pharmacol Bull, 2019, 35(4): 494-9. doi:10.3969/j.issn.1001-1978.2019.04.010 |
| [16] |
金曼, 吴娟, 黎笔熙. 线粒体膜通透性转换孔在细胞凋亡中的作用[J]. 医学研究生学报, 2019, 32(11): 1222-7. Jin M, Wu J, Li B X. The role of mitochondrial membrane permeability transition pore in apoptosis[J]. J Med Postgra, 2019, 32(11): 1222-7. |
| [17] |
贾岩, 金欢欢, 李蒙蒙, 等. 肝细胞程序性坏死在肝损伤中的研究进展[J]. 中国药理学通报, 2017, 33(12): 1651-5. Jia Y, Jin H H, Li M M, et al. Research progress of hepatocyte necrosis in liver injuries[J]. Chin Pharmacol Bull, 2017, 33(12): 1651-5. doi:10.3969/j.issn.1001-1978.2017.12.006 |

