

呼吸道体外模型常被用于研究外源性化合物、吸入制剂、空气污染物、纳米颗粒物、烟草制品等暴露诱导的吸入毒性和肺部疾病[1]。目前,体外吸入毒性评价多采用稳定传代的细胞系,如A549、Calu3、16HBE、BEAS-2B等构建呼吸道上皮的模型,然而这些细胞系的生理特征与体细胞之间差异较大,对呼吸系统的特征反应具有一定局限性[2]。呼吸道上皮细胞是机体呼吸道防御系统的重要屏障,它形成的假复层纤毛柱状上皮将人体的内环境与外界环境有效隔离[3],呼吸道气管和支气管组织表面分布的细胞包括纤毛细胞、分泌黏液的杯状细胞、无纤毛细胞和基底细胞等[3]。因此,唯有原代培养呼吸道上皮细胞才能在生理功能和结构上更贴近体内气管上皮细胞的自然生长状态,成为研究气管上皮功能和相关疾病的重要体外模型[4]。
气液体界面(air-liquid interface,ALI)培养技术是培养呼吸道上皮细胞的重要方法,ALI培养的研究在国外已有多年的历史[5],但目前国内也只有少数实验室成功建立了该培养平台,而且不同实验室采用的方法各异[6]。其中包括原代细胞的分离方法、ALI培养基成份、预铺胶原类型的选择、细胞的接种密度等都各不相同[7-8]。本研究建立的小鼠气管上皮细胞(mouse tracheal epithelial cells,MTEC)分离和分化培养模型,是从小鼠体内分离气管后,通过ALI培养上皮细胞逐步分化出纤毛,为研究纤毛的形成和气道上皮发育的最佳模型[9]。ALI培养方法的优点,是可以利用体外暴露装置将外源性气溶胶沉积在上皮细胞表面,最大限度地减少各类气溶胶的变性,从而模拟人体呼吸道暴露环境致病因素的生物学特性[10]。本研究对该模型培养细胞的生长状态、紧密连接的形成及细胞分化纤毛等方面进行了评估,为后续外源化合物毒性评价提供了成熟的体外吸入暴露模型。
1 材料与方法 1.1 材料 1.1.1 动物C57BL/6小鼠,成年♂,8周龄,体质量大于20 g。1只小鼠大约可收集(15-20)万个细胞。来源:上海灵畅生物科技有限公司,生产许可证号:SCXK(沪)2018-0003,动物饲养于上海市食品药品检验所动物房,动物饲养房间的温度:(20-25) ℃,湿度:40%-70%,本试验符合实验动物伦理原则,已通过上海市食品药品检验所实验动物管理和使用委员会的审查,编号为IACUC-SIFDC19132。
1.1.2 试剂DMEM/F12培养基(Gibco,批号:11330032);Ham’s/ F12培养基(Gibco,批号:3175068);青霉素/链霉素(Penicillin/streptomycin,Gibco,批号:10378016);胎牛血清(FBS,Hyclone,批号:DBC0520);磷酸盐缓冲液(PBS,Corning,批号:26318001);平衡盐溶液(HBSS,Gibco,批号:14175095);链霉蛋白酶(Pronase,Roche,批号:10165921001);脱氧核糖核酸酶(DNasel,Sigma,批号:DN25);牛血清白蛋白(BSA,absin,批号:abs9157)、胰岛素(Insulin,Sigma,批号:16634,);转铁蛋白(Transferrin,Sigma,批号:T1147);表皮生长因子(EGF,Sigma,批号:E9644);维甲酸(RA,Sigma,批号:R265)、霍乱毒素(CT,absin,批号:abs8001);牛垂体提取物(BPE,absin,批号:abs9919);Ⅳ型胶原(Pure col,BioMatrix,批号:5005);抗荧光淬灭封片液(Beyotime,批号:P0126);DAPI(BD,批号:);TranswellⓇ-Clear培养板(Corning-Costar,批号:3450)PrimariaTM组织培养皿(Corning,批号:353803)。抗体α-tubulin (abcam, 货号:ab24610);β-tubulin-Ⅳ(abcam,货号:ab179509)ZO-1(Cell Signaling Technology,货号:#13663);Foxj1(eBiosciences,货号:14-9965-80);MUC5AC(Cell Signaling Technology,货号:#61193);Anti-Rabbit IgG(Cell Signaling Technology,货号:#4412);Anti-Mouse IgG(Cell Signaling Technology,货号:#4409)。
1.1.3 仪器Heracell VIOS 160i CO2培养箱(德国Thermo Scientific公司);BCM-1300A层流超净台(Airtech公司);Vi-cell XR细胞活力测定仪(德国Beckman counter公司);THUNDER Imager 3D Live Cell(德国Leica公司);Olympus IXplore SpinSR10转盘共聚焦系统(日本Olympus公司)。
1.2 方法 1.2.1 培养小室胶原包被胶原是基膜的主要成分,将细胞培养皿包被胶原,模拟基膜的内环境。将商品化的Ⅳ型胶原3 g·L-1,用无菌水稀释为30-50 mg·L-1,加入12孔或24孔Transwell过滤膜小室中,每孔加0.5-1 mL。37 ℃培养箱孵育过夜。d 2,吸出胶原蛋白涂层溶液,让滤膜风干5 min,放置于生物安全柜中,紫外线消毒。再用无菌PBS冲洗小室和基底层3次,去除游离胶原蛋白。包被好的Transwell培养皿在4 ℃条件下,可存放8周左右。
1.2.2 增殖培养基及分化培养基的配置原代气管上皮细胞的培养基配制是细胞增殖、分化的关键因素,直接影响纤毛分化的成功与否,该研究通过多次分离气管培养试验,总结出细胞增殖与分化的培养基配比成分与浓度。
(1) 气管上皮增殖培养基配制:取475.5 mL DMEM/F12加入7.5 mL HEPES溶液,10 mL谷氨酰胺,2 mL 7.5% NaHCO3溶液,5 mL青霉素/链霉素。取45 mL配制好的DMEM/F12细胞培养基加入5 mL胎牛血清作为基础培养基,随后取45.7 mL基础培养基加入2.5 mL胎牛血清,50 μL 5μmol·L-1维甲酸,250 μL胰岛素溶液,250 μL表皮生长因子,200 μL牛脑垂体提取物,50 μL转铁蛋白溶液,50 μL霍乱毒素溶液,过滤消毒后4 ℃保存可使用2 d。具体浓度如Tab 1。
| Basic medium: DMEM/F12 additive | Final concentration |
| Penicillin/streptomycin (P/S) | 50 U |
| Apo-transferrin | 5 mg·L-1 |
| Insulin | 10 mg·L-1 |
| Epidermal growth factor (EGF) | 25 μg·L-1 |
| Cholera toxin(CT) | 0.1 mg·L-1 |
| Bovine pituitary extract (BPE) | 30 mg·L-1 |
| Fetal bovine serum (FBS) | 5% (V/V) |
| Retinoic acid (RA) | 5×10-2 μmol·L-1 |
(2) 气管上皮分化培养基配制:取上一步配制好的基础培养基250 mL,添加625 μL胰岛素,250 μL转铁蛋白,62.5 μL霍乱毒素溶液,250μL表皮生长因子, 7.5 mg牛脑垂体提取物,2.5 mL BSA,最终容量250 mL,使用前加入250 μL 5 μmol·L-1维甲酸,过滤消毒后4 ℃保存可使用2 d。具体浓度如Tab 2。
| Basic medium: DMEM/F12 additive | Final concentration |
| Penicillin/streptomycin (P/S) | 50 U |
| Apo-transferrin | 5 mg·L-1 |
| Insulin | 5 mg·L-1 |
| Epidermal growth factor (EGF) | 5 μg·L-1 |
| Cholera toxin(CT) | 0.025 mg·L-1 |
| Bovine pituitary extract (BPE) | 30 mg·L-1 |
| Bovine serum albumin (BSA) | 1 g·L-1 |
| Retinoic acid (RA) | 5×10-2 μmol·L-1 |
d 1:小鼠采用颈椎脱位处死,避免破坏颈部和气管组织;在组织培养罩与解剖镜下,取出气管,去除附着组织,将每根清洗过的气管放入无菌Ham’s/ F12培养基中,置于冰上。使用眼科剪把每个气管纵向切开,放入新鲜配制的Pronase中,大约3 mL的Pronase可以覆盖10-30个气管。4 ℃孵育过夜,冰箱放置18-24 h,切勿倒置。d 2:取出装有气管的Pronase离心管,颠倒5次,室温放置10 min;加入预热37 ℃的FBS,终体积为10%;依次加入Ham’s/ F12培养基,丢弃气管,留下培养基,4 ℃,500 ×g,离心10 min;吸取上清液,留下细胞沉淀,用DNasel重悬细胞,体积为200 μL/气管;使用基础培养基DMEM/F12重悬细胞,采用差速贴壁法,将收获的原代细胞接种在PrimariaTM组织培养皿中,放置于细胞培养箱4-6 h,使贴壁速度较快的成纤维细胞贴壁,上皮细胞悬浮;将悬浮细胞收集在离心管中,4 ℃,500 ×g,离心5 min;室温下,吸出上清液,加入Table 1配制好的MTEC增殖培养基,采用细胞计数仪,计算悬液中活细胞数量,接种细胞在包被好Ⅳ型胶原的Transwell培养皿中,每孔接种细胞数量参考Tab 3。
| Plate size |
Insert size (diameter) (mm) |
Membrane area (cm2) |
Basal compartment(lower) medium volume (mL) |
Apical compartment(upper) medium volume (mL) |
Seeding: Cell number/insert |
| 6 well | 24 | 4.67 | 2-3 | 1 | (5-7)×105 cells |
| 12 well | 12 | 1.12 | 1 | 0.5 | (1.5-2)×105 cells |
| 24 well | 6.5 | 0.33 | 0.5 | 0.2 | (0.6-0.8)×105 cells |
使用外科手术刀片从12孔或24孔Transwell细胞培养板中,取下小室的过滤膜,放入干净的细胞培养板中,直接加入4%多聚甲醛,摇床固定10 min,PBS清洗2次,每次5 min;(0.2-0.5)% Triton-100对细胞透化处理30 min,PBS清洗2次,每次5 min;5% BSA室温摇床上孵育2 h,PBS清洗2次,每次5 min。根据抗体稀释比例(1 ∶500/1 000),用一抗稀释液稀释抗体,4 ℃摇床孵育过夜;d 2,取出过滤膜,PBS清洗2次,每次5 min,羊抗鼠IgG二抗、兔抗鼠IgG二抗,湿盒内37 ℃孵育2 h;PBS清洗两次,每次5 min;加入预先配制好的DAPI,常温避光在摇床缓慢孵育。染色后用共聚焦显微镜观察,拍照。
1.2.5 扫描电镜方法(SEM)MTEC培养d 14-21,收集细胞电镜拍照。使用外科手术刀片,取下Transwell小室的过滤膜,放入干净的细胞培养板中,PBS清洗3遍;加入2.5%的戊二醛,4 ℃冰箱固定过夜;0.1 mol·L-1 PBS漂洗3次,每次10 min;1%饿酸固定液固定1-1.5 h,PBS漂洗3次,每次10 min;梯度脱水,30%乙醇10 min,50%乙醇10 min,70%乙醇10 min,80%乙醇10 min,95%乙醇10 min,100%乙醇(无水硫酸钠处理)10 min,重复处理2次;临界点干燥,在没有表面张力的条件下干燥,最大程度保存样品原貌;镀膜仪喷金,厚度为15 nm左右;通过扫描电子显微镜(Quanta 200,FEI,USA)观察拍照。
1.2.6 跨上皮电阻检测(TEER)采用MillicellⓇ细胞电阻仪,在MTEC增殖与ALI分化的不同时间,监测细胞跨上皮电阻值(TEER),12孔Transwell培养板,每孔测量3个有效TEER值,3个孔数据,统计分析。跨上皮电阻值用以下公式进行校正:TEERture (Ωcm2)=(TEERsample-TEERblank)(Ω)×Effective Membrane Area(cm2)。式中:TEERsample: 样品粗测值;TEERblank: 空白值;Effective Membrane Area: 有效生长面积。
1.2.7 统计学方法采用GraphPad Prism 5软件进行数据计算和作图分析,结果表示为x±s。使用SPSS 19统计软件, One-way ANOVA分析进行组间比较。
2 结果 2.1 MTEC培养不同时期细胞形态特征小鼠气管分离上皮细胞,均匀铺板,细胞增殖1-2 d,避免影响贴壁,不做移动。细胞培养3 d后,更换加入新鲜RA的增殖培养基(Tab 1),通过倒置显微镜观察细胞生长状况(Fig 1),细胞培养2 d后,完全贴壁,细胞形态拉长变大;细胞增殖3-5 d,数量增加,镜下可见团块状细胞岛;细胞增殖5-7 d,融合度达到100%,测定细胞跨上皮电阻值(Rt),Rt超过1 000 Ω·cm2后,更换气液界面培养,记作ALI d 0。从Transwell小室吸出培养基,在基底层加入新鲜无血清培养基(Tab 2), 顶层小室保持干燥。隔天换一次基底层培养基,用PBS清洗小室细胞,细胞可在ALI条件下分化,ALI培养d 3-5,细胞变小变圆,呈现立体形态。ALI培养d 7-14,细胞分化良好,出现鹅卵石样外观,镜下可见纤毛摆动,滤膜表面至少有30%纤毛细胞。
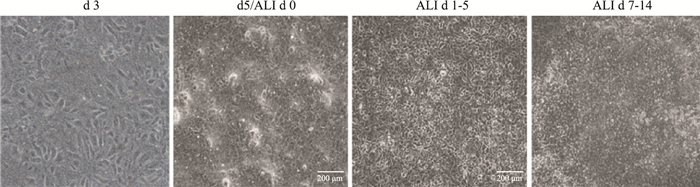
|
| Fig 1 Appearance of MTEC on membranes by light microscopy during culture(×100) |
使用跨上皮电阻仪对MTEC培养过程的不同时期进行TEER值(Rt)的测定,评价细胞间紧密连接的形成情况。试验结果显示(Fig 2),浸没式培养细胞5-7 d后,单层细胞接近完全融合,细胞跨上皮电阻值增加,Rt值>1 000 Ω·cm2,转化为气液界面培养。ALI d 0,Rt值为(1 830±17) Ω·cm2;ALI d 5,Rt值增加到(2 180±169) Ω·cm2;,ALI d 10,Rt值增加到(2 970±242) Ω·cm2。随着ALI培养时间的延长,细胞逐渐分化,ALI d 15,跨上皮电阻值逐渐降低(1 930±52) Ω·cm2。为了将Rt的增加与基因特异性表达相关联,我们对紧密连接蛋白ZO-1进行了评估。ZO-1的表达也提示了细胞大小和数量的改变,我们发现细胞数量在培养的第一周内明显增加,免疫荧光检测各组细胞膜连接中ZO-1在ALI培养不同时间的表达(Fig 3)。

|
| Fig 2 TEER assessment of epithelial cells cultured at an air-liquid interface |

|
| Fig 3 Expression of ZO-1 in cell membrane junctions detected by immunofluorescence at indicated days |
通过扫描电镜观察小鼠气管上皮细胞表面形态(Fig 4)。照片显示,ALI培养d 5-7上皮细胞大而扁平,细胞均匀,有微绒毛,也有少量纤毛。在细胞增殖后,ALI培养过度到上皮细胞分化阶段。上皮细胞分化d 14-20后,ALI培养的MTEC表面形态与小鼠气管形态相似。起初上皮细胞外观,纤毛短且不动,随着时间延长,纤毛变化长度直到成熟。ALI d 7-14,可以观察到运动的成簇的纤毛。

|
| Fig 4 Differentiation of MTEC assessed by scanning EM at indicated days |
β-微管蛋白-Ⅳ(β-tubulin-Ⅳ)的表达标记纤毛轴丝的形成,蓝色荧光为DAPI染色的细胞核,免疫荧光试验在MTEC气液界面培养的不同时间,标记纤毛在细胞分化不同时期的形态特征(Fig 5)。ALI培养6 d β-tubulin标记细胞形态较大,可见微管蛋白典型特征。ALI d 12,细胞形态变圆变小,β-tubulin标记可见典型细胞有丝分裂,纤毛轴丝形成。ALI d17,纤毛分化状态良好,形态清晰,成簇状分布在纤毛细胞的表面,具有纤毛柱状上皮细胞的特征。通过对纤毛的鉴定,可看出本实验构建的小鼠气管假复层柱状上皮模型的纤毛细胞分化良好。

|
| Fig 5 Immunofluorescence and confocal microscopy of β-tubulin at an air-liquid interface |
气液界面培养25 d后,上皮细胞已完全分化,细胞边界更加清晰,排列更加紧密,上层有粘液分泌。初级和运动的纤毛可以用乙酰化的α-微管蛋白(α-tubulin)、β-微管蛋白-Ⅳ(β-tubulin-Ⅳ)抗体来标记,分泌的粘液可以用粘液蛋白MUC5AC进行标记,MUC5AC蛋白主要是由上皮细胞中的杯状细胞分泌和合成的,对MUC5AC的检测能够说明杯状细胞的分化形成。如Fig 6,结果显示细胞的纤毛分化状态良好,纤毛清晰,成簇状分布在纤毛细胞的表面,纤毛细胞在上皮中分布均匀且数量较多,具有纤毛柱状上皮细胞的特征。绿色荧光分别标记3种抗体,从而在蛋白的水平上证明了纤毛细胞与分泌细胞的分化形成,但杯状细胞的数量较纤毛细胞少。
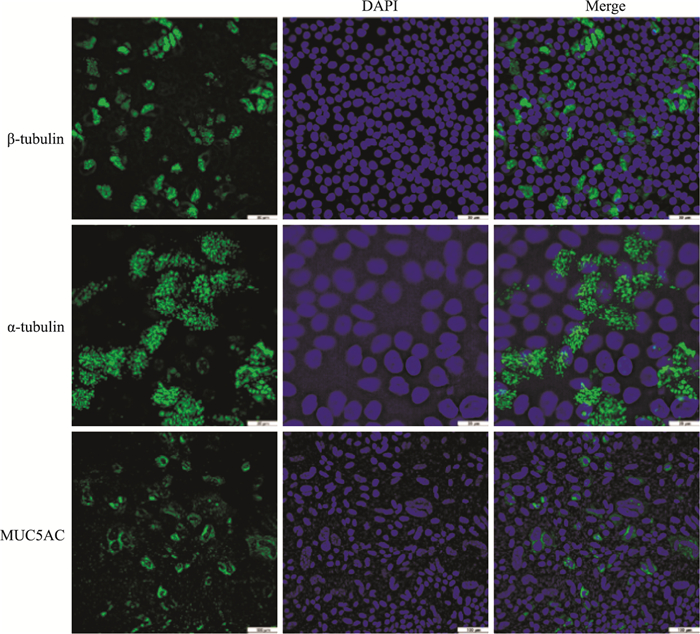
|
| Fig 6 Immunofluorescence and confocal microscopy of ciliated cell cultured at an air-liquid interface |
原代气管上皮细胞为假复层纤毛柱状上皮,其正常生理功能的实现取决于细胞分化程度以及细胞极性的形成与维持。细胞单层生长的情况下,使用无极性和低分化的原代培养细胞和永生化细胞系对于呼吸道上皮细胞研究来说价值有限,并不能完全反映体内生理功能。本研究总结的小鼠气管上皮细胞原代培养方法,是将成年小鼠气管通过蛋白酶消化分离得到上皮细胞,随后接种到预先包被胶原的Transwell半透膜中,在气液界面的条件下进行培养。本文通过对培养基改造(无血清培养)和培养皿胶原包被的特殊处理,实现了对小鼠呼吸道上皮细胞稳定有效的大量获取,与其他已有实验相比,具有获得细胞数量稳定、可靠、分化程度高等优势[11]。当细胞完全融合后,细胞间形成紧密连接,构成完整的生物屏障作用,通过细胞跨上皮电阻检测和紧密连接蛋白的表达与定位,评价细胞间紧密连接形成与细胞极化分析。细胞在分化培养基中过渡到气液体界面(air-liquid interface,ALI)培养条件,经过一段时间的ALI培养后,上皮细胞经过分化后能产生纤毛细胞、杯状细胞、基细胞等多种细胞,并由细胞分泌的粘液覆盖,产生类似于体内生理结构和功能的假复层纤毛柱状上皮组织。气液界面培养技术的广泛应用,为吸入毒理学的体外研究提供了技术支持[12]。ALI模型培养的细胞在功能和结构上都贴近体内气管上皮细胞的自然生长状态,为研究气管上皮的功能和相关疾病奠定了良好的基础[13]。在呼吸系统疾病研究方面,ALI培养提供了一种有效的细胞模型,被广泛地应用于多种呼吸道病毒的分离培养和致病机制的研究。
本研究结果显示,小鼠气管分离得到上皮祖细胞需要2 d;小鼠气管、基底细胞在浸没培养中增殖,直到融合并产生初级纤毛需要5-10 d;细胞融合后,转为气液界面培养,诱导分化为多纤毛细胞和其他类型的气道上皮细胞需要10-14 d;成熟的假复层纤毛柱状上皮可以存活40 d左右。纤毛细胞形成开始于ALI培养后2-5 d。在随后的1周内,在其他基底细胞中诱导分化,因此在ALI培养14 d后,超过30%的上皮细胞是多纤毛细胞。由于在体内难以研究活动纤毛的生物作用,且缺乏多纤毛细胞[14]。因此,本研究利用纤毛蛋白的免疫荧光标记,识别和表征纤毛形成途径的不同阶段。在气管和MTEC中,活动的纤毛发生是高度不同步的,因此本文描述的细胞培养时间是近似的,在这个过程的大多数阶段,免疫标记的结构与电子显微镜鉴定的形态特征相关[15]。紧密连接蛋白ZO-1在MTEC增殖与分化的不同时期,表达稳定。MTEC细胞呈立体结构,细胞核位置低于细胞表面。因此,观察小室细胞的结构,用紧密连接蛋白定位比标记细胞核更有利用观察。
通过实验表明,MTEC增殖和分化的培养方法和条件较复杂,各种生长因子,特别是胰岛素、转铁蛋白、表皮生长因子和维甲酸对细胞增殖、纤毛形成和粘液细胞分化至关重要。本研究参照已有文献[16],对已有方法进行优化,采用低温过夜酶消化法,保持了分离到的细胞活性,在无血清的培养环境中获得生长和维持分化的上皮细胞。采用差速贴壁法,促进了细胞的增殖,并消除了成纤维细胞的污染,提高了培养细胞的纯度;在培养皿中预铺Ⅳ型胶原,为细胞提供了生长基质,促进细胞的贴壁生长[17]。试验研究结果表明,小鼠原代气管上皮细胞(mouse tracheobronchial epithelial cells,MTEC)模型构建成功,后续可作为外源性化合物毒性筛选、吸入制剂安全性评价及毒性机制研究的最佳模型[18]。
| [1] |
Gao W, Li L, Wang Y, et al. Bronchial epithelial cells: The key effector cells in the pathogenesis of chronic obstructive pulmonary disease?[J]. Respirology, 2015, 20(5): 722-9. doi:10.1111/resp.12542 |
| [2] |
Bur M, Lehr C. Pulmonary cell culture models to study the safety and efficacy of innovative aerosol medicines[J]. Expert Opin Drug Deliv, 2008, 5(6): 641-52. doi:10.1517/17425247.5.6.641 |
| [3] |
Ahmad S, Ahmad A, Neeves K B, et al. Cell culture model for toxic inhaled chemical testing[J]. J Vis Exp, 2014, 8(87): 51539. |
| [4] |
Sørli J. An in vitro method for predicting inhalation toxicity of impregnation spray products[J]. ALTEX, 2015, 32(2): 101-11. |
| [5] |
Upadhyay S, Palmberg L. Air-Liquid Interface: Relevant in vitro models for investigating air pollutant-induced pulmonary toxicity[J]. Toxicol Sci, 2018, 164(1): 21-30. doi:10.1093/toxsci/kfy053 |
| [6] |
Lin H, Li H, Cho H, et al. Air-liquid interface (ALI) culture of human bronchial epithelial cell monolayers as an in vitro model for airway drug transport studies[J]. J Pharm Sci, 2007, 96(2): 341-50. doi:10.1002/jps.20803 |
| [7] |
Fizeşan I, Cambier S, Moschini E, et al. In vitro exposure of a 3D-tetraculture representative for the alveolar barrier at the air-liquid interface to silver particles and nanowires[J]. Part Fibre Toxicol, 2019, 16(1): 14. doi:10.1186/s12989-019-0297-1 |
| [8] |
Loret T, Peyret E, Dubreuil M, et al. Air-liquid interface exposure to aerosols of poorly soluble nanomaterials induces different biological activation levels compared to exposure to suspensions[J]. Part Fibre Toxicol, 2016, 13(1): 58. doi:10.1186/s12989-016-0171-3 |
| [9] |
Vladar E K, Brody S L. Analysis of ciliogenesis in primary culture mouse tracheal epithelial cells[J]. Methods Enzymol, 2013, 525: 285-309. |
| [10] |
Klein S G, Serchi T, Hoffmann L, et al. An improved 3D tetraculture system mimicking the cellular organisation at the alveolar barrier to study the potential toxic effects of particles on the lung[J]. Part Fibre Toxicol, 2013, 10(1): 31. doi:10.1186/1743-8977-10-31 |
| [11] |
Eenjes E, Mertens T C J, Buscop-van Kempen M J, et al. A novel method for expansion and differentiation of mouse tracheal epithelial cells in culture[J]. Sci Rep, 2018, 8(1): 7349. doi:10.1038/s41598-018-25799-6 |
| [12] |
胡玥, 冯红敏, 盛云华, 等. 雾化丙三醇气液界面云暴露对人肺上皮细胞的毒性[J]. 中国药理学通报, 2020, 36(5): 640-5. Hu Y, Feng H M, Sheng Y H, et al. Effects of aerosolized glycerol on human lung epithelial cells by air-liquid interface cloud exposure[J]. Chin Pharmacol Bull, 2020, 36(5): 640-5. doi:10.3969/j.issn.1001-1978.2020.05.010 |
| [13] |
Lam H C, Choi A M K, Ryter S W. Isolation of mouse respiratory epithelial cells and exposure to experimental cigarette smoke at air liquid interface[J]. J Vis Exp, 2011(48): e2513. |
| [14] |
Mao H, Wang Y, Yuan W, et al. Ciliogenesis in cryopreserved mammalian tracheal epithelial cells cultured at the air-liquid interface[J]. Cryobiology, 2009, 59(3): 250-7. doi:10.1016/j.cryobiol.2009.07.012 |
| [15] |
You Y, Richer E J, Huang T, et al. Growth and differentiation of mouse tracheal epithelial cells: Selection of a proliferative population[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 283(6): L1315-21. doi:10.1152/ajplung.00169.2002 |
| [16] |
Rowe R K, Brody S L, Pekosz A. Differentiated cultures of primary hamster tracheal airway epithelial cells[J]. In Vitro Cell Dev Biol Anim, 2004, 40(10): 303-11. doi:10.1290/0408056.1 |
| [17] |
Davidson D J, Gray M A, Kilanowski F M, et al. Murine epithelial cells: Isolation and culture[J]. J Cyst Fibros, 2004, 3: 59-62. doi:10.1016/j.jcf.2004.05.013 |
| [18] |
Lenz A, Stoeger T, Cei D, et al. Efficient bioactive delivery of aerosolized drugs to human pulmonary epithelial cells cultured in air-liquid interface conditions[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 51(4): 526-35. |

