

在世界范围内,男性不孕不育比例正在逐年上升。世界卫生组织预测, 在21世纪, 不孕不育将成为继肿瘤、心脑血管疾病之后的第三大顽疾,因此,不孕不育症等人群的生殖健康情况也被看作是全世界范围内须重点关注的公共卫生问题[1]。研究显示,25%-30%的不孕夫妇是由于男性因素导致不孕,而其高达90%的问题都是源于精子数量减少、精子活力低下和精子畸形[2],但其具体发病机制仍不完善。
有性生殖是真核生物最常见的生殖形式,以一系列大规模的细胞或组织修复为特征。近年来的研究表明,在哺乳动物中,自噬是精子发生和卵子发生所不可缺少的,它参与胚胎的早期发育,为亲本和子代之间提供了分子基础[3],是造福下一代的重要途径。自噬在正常的生理过程中起着“管家”的作用,也是机体实现物质再循环、维持细胞代谢平衡及内稳态的一种重要的细胞机制[4]。
大量的研究证明,睾丸内精子发生的过程中自噬的有序发生对于维持精原细胞内环境的稳定[5]、调节生精细胞的凋亡、精子顶体的形成[6]和非必须成分的降解[7]至关重要。研究表明,睾丸内的精子产生后,需经过附睾才能成熟并获得运动和识别卵子透明带的能力,附睾在精子成熟、保护、运输和贮存过程中发挥着重要作用[8]。根据生化功能和结构差异可将附睾分为3部分:头、体和尾。根据蛋白表达不同,又可细分为10部分[9],其中,附睾头分泌的蛋白约占管腔内总蛋白的90%,是最具代谢活性的区域[8],也是使精子获得运动能力的重要部位。研究表明,在附睾头中,其4-5段的自噬核心蛋白Atg5在附睾头4-5段表达量最较高,说明自噬可能参与了附睾头中的某些生物学功能(精子成熟、蛋白和离子的分泌与吸收等),然而,目前自噬在附睾中的功能尚不明确。因此我们提出科学假设:附睾头中的自噬功能在精子成熟的过程中发挥重要作用,并通过附睾头4-5段主细胞中Atg5特异性敲除小鼠模型探讨附睾头4-5段Atg5的缺失对附睾功能以及精子成熟过程的影响。
1 材料与方法 1.1 材料 1.1.1 实验动物Lcn5-Cre基因工程小鼠模型由中国科学院上海生命科学研究院张永莲研究员所提供,附睾头4-5段主细胞中Atg5特异性敲除小鼠模型购自上海南方模式生物科技股份有限公司,动物生产许可证号为SCXK(沪)2017-0010。小鼠于广东药科大学动物中心的无菌环境中进行繁殖和饲养,实验动物饲养设施合格证号为SYXK(粤)2017-0125。动物保护指南是由广东药科大学动物护理委员会所制定。
1.1.2 试剂DNA提取试剂盒(南京诺唯赞生物科技有限公司);Atg5抗体(CST12994,CST);LC3(CST4108S,CST);p62(CSTS144S,CST);苏木素伊红染色试剂盒(上海碧云天生物技术有限公司);0.9%氯化钠注射液(陕西圣奥动物药业有限公司)。
1.1.3 仪器石蜡包埋机(MPS/P1,德国SLEE);石蜡切片机(美国Thermo);冷冻台(中威电子仪器有限公司);精子动力分析仪(南宁松景天伦生物科技有限公司);CMAXPLUS + 酶标仪(美国);-80 ℃冰箱(中国美菱);Leica荧光显微镜(Leica德国)。
1.2 方法 1.2.1 动物模型制备按照基因型将小鼠分为3组,每组6-7只:对照组(Atg5f/f)、杂合敲除组(Atg5f/-)以及纯合敲除组(Atg5-/-),所有小鼠(每笼1-4只)饲养在可控环境内,光照/黑暗周期12 h,恒温22 ℃,湿度60%-70%,并自由进食标准鼠粮和高压灭菌水。小鼠喂食8周后,进行合笼实验,合笼实验结束后喂食至14周,对雄鼠进行取材,取其附睾,一侧放置于4%多聚甲醛中用于固定,一侧附睾尾放入预热至37 ℃的生理盐水中用于检测精子活力和精子数目,附睾头冻存至-80 ℃。
使用以下引物对所有小鼠进行基因分型,以区分野生型、杂合敲除基因型和纯合敲除基因型。
Atg5-Flox上游引物:5′-TTCAGTGTACCCTGTGTATTGG-3′, 下游引物:5′-GGGAAACAGTTGTGTTCTTTGT-3′; Lcn5-Cre上游引物:5′-CAGGGTGTTATAAGCAATCCC-3′, 下游引物:5′-GCCTGCATTACCGGTCGATGC-3′。
1.2.2 合笼实验三组雄鼠与野生型雌鼠以1 ∶2比例进行3次为期1周的合笼(每次合笼间隔5 d且更换新的雌鼠),根据怀孕雌鼠的数量计算每只雄鼠的致孕率。怀孕母鼠分娩后,每胎小鼠的数量即产仔数。致孕率计算公式:单只雄鼠致孕率/%=孕鼠的数量/6×100%。
1.2.3 精子活力的测量按解剖结构定位切取附睾尾,置于预热至37 ℃的500 μL生理盐水中,将附睾尾剪碎,放置于于37 ℃水浴静置5 min,使精子充分释放到生理盐水中,取3 μL精子悬液,通过精子动力分析仪进行精子活力的测量。
1.2.4 精子数目的检测用生理盐水将精子悬液稀释至30倍,吸取10 μL至细胞计数板中于显微镜下进行计数,并通过精子数量计算公式得出精子终浓度。精子数量的计算公式:精子数量(个/mL)=(A+B+C+D)/4×104×30 (稀释倍数),其中A、B、C、D分别为显微镜下计数板上的4个区域内的精子数。
1.2.5 病理组织染色石蜡切片样本放置60 ℃烘箱中1-2 h→二甲苯10 min→二甲苯10 min→二甲苯10 min→100%乙醇3 min→100%乙醇3 min→95%乙醇3 min→85%乙醇3 min→80%乙醇3 min→70%乙醇3 min→蒸馏水3 min→苏木素2 min→蒸馏水2 min→1%盐酸酒精分化1-3 s→水洗2 min→氨水返蓝10-30 s→80%乙醇2 min→90%乙醇2 min→伊红5 s→蒸馏水2 min, 显微镜下快速观察染色效果→100%乙醇3 min→100%乙醇3 min→100%乙醇3 min→二甲苯10 min→二甲苯10 min →二甲苯10 min →中性树胶封片。
1.2.6 免疫荧光石蜡切片样本放置60 ℃烘箱中1-2 h→二甲苯10 min→二甲苯10 min→二甲苯10 min→100%乙醇3 min→100%乙醇3 min→95%乙醇3 min→85%乙醇3 min→80%乙醇3 min→70%乙醇3 min→PBS浸泡5 min→柠檬酸纳修复15 min→PBST洗5 min,3次→Triton 5 min→PBST洗5 min,3次→5%驴血清封闭封闭1 h→4 ℃过夜敷一抗(2.5%驴血清稀释一抗)→PBST洗5 min,3次→避光操作→室温敷二抗1 h(PBS稀释)→PBS洗5 min,3次→DAPI 5 min→PBS洗5 min,3次→封片,避光条件下使用荧光显微镜观察。
1.2.7 附睾组织蛋白的检测从-80 ℃冰箱取出组织,置于1.5 mL离心管中,加入150 μL RIPA和3 μL PMSF,放入匀浆仪中进行研磨,得到组织匀浆,冰上静置5 min后,1 2000 g,4 ℃离心20 min,吸取上清至新的1.5 mL EP管中,BCA测量蛋白浓度,加入5× Loading Buffer,放入95 ℃水浴中,10 min,使蛋白变性,通过Western blot检测附睾头ATG5的表达。
1.3 统计学分析每组实验独立重复3次以上,实验数据柱状图和图表数据以x±s表示。数据经过正态分布和方差齐性检验后,两组之间比较采用t检验,多组之间比较采用单因素方差分析。
2 结果 2.1 附睾头4-5段主细胞中Atg5特异性敲除模型鼠的鉴定将转基因小鼠合笼一周(雄鼠∶雌鼠=1 ∶2)进行子代的繁育,剪取子代小鼠的尾巴,进行DNA的提取,通过聚合酶链式反应(polymerase chain reaction,PCR)对小鼠进行基因型鉴定,并通过特异性引物来区分野生型、杂合基因型和纯合敲除基因型小鼠(Fig 1B)。
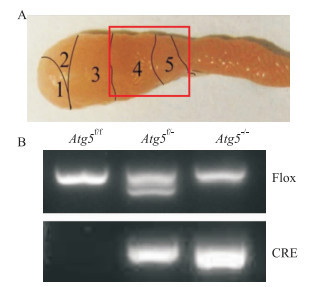
|
| Fig 1 Generation of Atg5 conditional knockout mice (Atg5-/-) A: Schematic diagram of epididymal caput structure. B: Genotyping of the mice was performed by PCR using specific primers to distinguish wild-type or Atg5-/-. |
在基因鉴定的基础上,我们进一步通过Western blot和免疫荧光技术来检测3组转基因小鼠的Atg5敲除效率,结果显示,较Atg5f/f和Atg5f/-小鼠相比,Atg5-/-小鼠附睾头4-5段中的ATG5的表达水平显著降低(P < 0.0001);此外,免疫荧光染色结果显示,与Atg5f/f和Atg5f/-小鼠相比,Atg5-/-小鼠附睾头4-5段绿色荧光极其微弱,表明ATG5表达量极微,说明附睾头4-5段主细胞几乎没有Atg5基因表达,即特异性敲除小鼠模型构建成功。
2.3 小鼠附睾头4-5段主细胞中Atg5的缺失对其自噬水平的影响为了探索Atg5的特异性敲除对敲除部位自噬发生水平的影响,我们通过Western blot检测了附睾头4-5段自噬底物类似物p62、以及自噬标记蛋白LC3-Ⅰ和LC3-Ⅱ的蛋白丰度。结果表明,与Atg5f/f和Atg5f/-小鼠相比,Atg5-/-小鼠附睾头4-5段的p62以及LC3-Ⅰ蛋白的表达水平显著上升(Fig 3A,3B)(P < 0.001),LC3-Ⅰ与LC3-Ⅱ的比值也增加(P < 0.01),LC3-Ⅰ向LC3-Ⅱ的转化受阻。以上结果表明,Atg5-/-小鼠的Atg5基因特异性敲除后,附睾头4-5段主细胞的自噬过程被阻断。
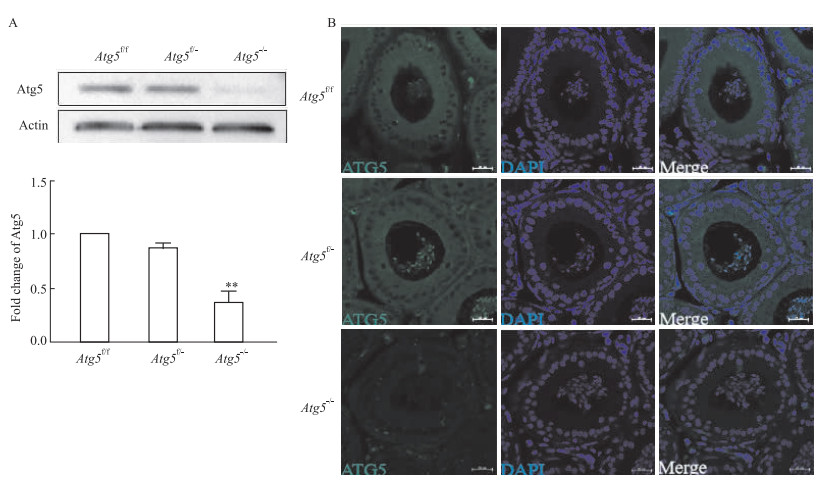
|
| Fig 2 Atg5 deletion in caput epididymidis A: Detection of Atg5 in caput epididymidis using Western blotting, and the protein level was normalized to Actin (x±s, n=6). B: Immunostaining of Atg5 in caput and cauda epididymidis. Bar =50 μm. ATG5, green; DNA, blue. **P < 0.01 vs Atg5-/- |
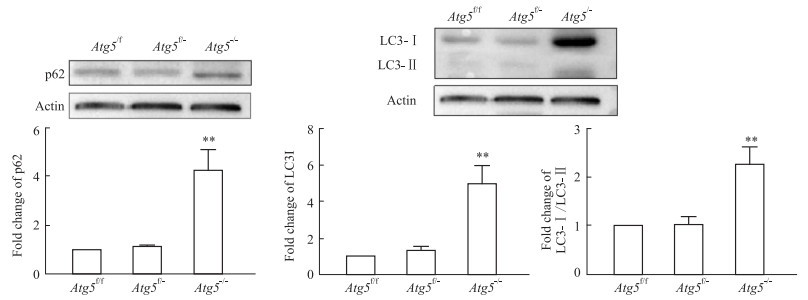
|
| Fig 3 The decreased autophagy activity in caput of the Atg5-/- mice epididymis A: Detection of p62 in caput epididymidis using Western blot (x±s, n=6). B: Detection of LC3 in caput epididymidis using Western blot (x±s, n=6). **P < 0.01 vs Atg5-/-. |
为了研究Atg5的缺失对附睾头4-5段组织形态的影响,我们对3种不同基因型小鼠的附睾头4-5段的组织进行了H&E染色。从病理组织切片结果(Fig 4)得知,Atg5-/-小鼠附睾头4-5段组织的管腔排列整齐,细胞形态正常,与Atg5f/f和Atg5f/-小鼠相比,没有发生明显变化。说明,在自然条件下,Atg5缺失对附睾头4-5段的组织形态没有影响。
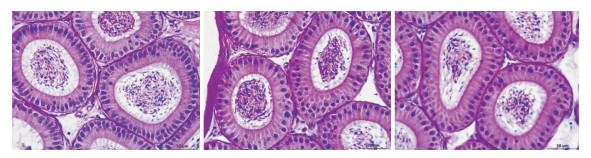
|
| Fig 4 HE staining of caput epididymidis in 14-week-old mice (Bar = 50 μm). From left to right: Atg5f/f, Atg5f/-, Atg5-/- |
为了探索Atg5的缺失对雄性小鼠生殖能力的影响,在小鼠8周龄时,我们通过合笼实验检测小鼠的致孕率和产仔数,并在小鼠14周龄时,检测3组雄性小鼠的精子活力和精子数目。从实验结果得知,Atg5f/f、Atg5f/-和Atg5-/- 3种基因型小鼠之间的精子活力(Fig 5A)、精子数目(Fig 5B)、致孕率(Fig 5C)及产仔数(Fig 5D)的差异无统计学意义,表明自然条件下,Atg5的缺失对雄性小鼠的精子活力、精子数目以及生殖能力没有影响。
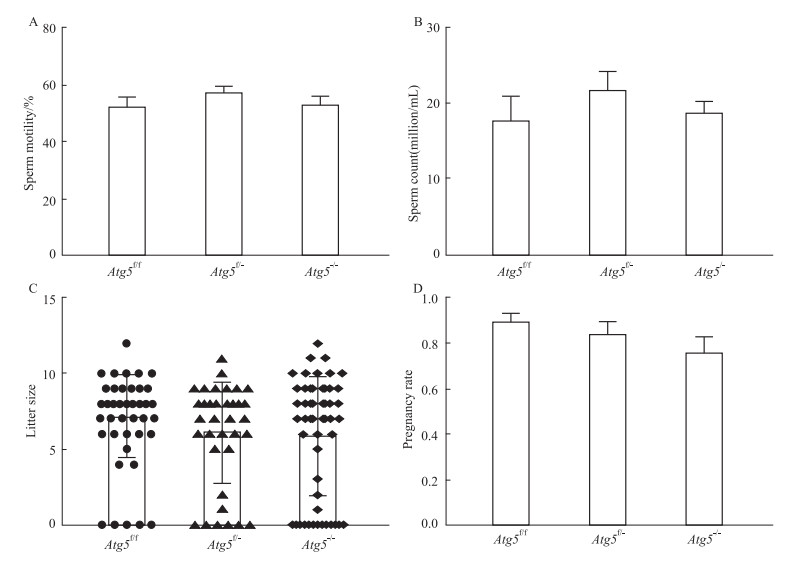
|
| Fig 5 Effect of deletion of Atg5 in caput epididymidis on sperm motility, sperm count, litter rize and pregnancy rate A: Sperm motility (x±s, n=7); B: Sperm count (x±s, n=7); C: Litter rize (x±s, n=52). (D) Pregnancy rate (x±s, n=7). |
自噬是一个高度保守的细胞内溶酶体分解代谢的过程,降解、清除细胞内部分非功能性蛋白或胞内细胞器和细胞质成分,以维持细胞内环境能量新陈代谢[4]。自噬有3种主要途径:巨自噬、微自噬和伴侣介导的自噬。巨自噬是最普遍的形式,通常称为自噬。在自噬的发生过程中,细胞首先形成双层膜结构的自噬泡,自噬泡双层膜经过延伸闭合,包裹着待降解的细胞质或细胞器形成自噬体,随后自噬体与溶酶体结合形成自噬溶酶体[4],最后,溶酶体通过各种水解酶将自噬溶酶体中包裹的物质降解,促进细胞更新代谢[10]。有研究表明自噬参与精子的分化和成熟,自噬的缺失会导致精子活力减弱,精子形态遭到破坏,出现严重的畸形精子症[11],可见自噬功能对精子发生有着重要的调控作用。
精子发生指的是在睾丸中产生有功能的精子细胞的过程,睾丸中产生的精子需在附睾中成熟并在女性生殖道中完成获能才具备与卵子结合的能力,从而参与授精过程。既往的研究多数聚焦于精子在生殖道的获能过程。而对于精子在附睾头中成熟机制调控的相关研究少之又少,尤其是在附睾头中,自噬对于精子成熟的调控机制更是尚不明确。因此,本研究利用附睾头4-5段主细胞Atg5特异性敲除模型鼠,深入研究附睾头4-5段自噬功能在精子成熟过程中发挥的作用。
自噬发生时,Atg5可与Atg12、Atg16L1形成多聚体,参与LC3-Ⅰ型(游离型)向LC3-Ⅱ型(膜结合型)的转化,从而进一步参与自噬泡双层膜的形成[10]。研究表明,自噬标记蛋白LC3-Ⅰ向LC3-Ⅱ型转化效率显著降低时,自噬泡双层膜的形成受阻,从而使与LC3和泛素化蛋白相连接的自噬底物类似物p62蛋白水平显著上升[12],此时自噬过程被成功阻断。本研究首先验证了附睾头4-5段Atg5的特异性敲除成功,并进一步验证了随着Atg5的敲除,纯合敲除组(Atg5-/-)出现了自噬底物类似物p62积累以及LC3-Ⅰ至LC3-Ⅱ型转化受阻,表明纯合敲除组的附睾头4-5段自噬过程被阻断,同时也说明自噬在附睾头中是以特定的节律进行着。
为了检测Atg5缺失及自噬阻断对雄性小鼠生殖能力和精子成熟过程的影响,我们在8周龄时对对照组(野生型)、杂合敲除组和纯合敲除组小鼠的致孕率和产仔数量进行了检测,结果表明,在8周龄时3组小鼠的致孕能力与产仔数量均无差异。随后,在14周龄时,我们检测了附睾头组织形态、附睾尾精子数量以及精子活力的变化。结果显示,与对照组野生型小鼠相比,纯和敲除组、杂合敲除组的附睾头组织形态没有发生明显变化,精子数目、精子活力也没有受到影响。说明,在正常情况下,附睾头4-5段Atg5基因缺失不会影响精子的成熟。
已有研究发现,生殖细胞中Atg5的缺失破坏了自噬通量,导致顶体生物发生缺陷、线粒体重排、剩余细胞质和残体保留以及个体化失败[13],使精子的形成和功能受损,从而导致生育能力下降。但结果显示,与野生型小鼠相比,纯合敲除鼠的附睾头组织形态没有发生明显变化,而且精子数目、精子活力、致孕率以及产仔数也没有受到影响。这一结果提示我们:第一,在附睾头4-5段可能发生不依赖于Atg5的替代性自噬。这种不依赖于Atg5的自噬最初检测到的是在Atg5-/-小鼠胚胎成纤维细胞[14]中,随后发现其在红细胞分化和分化细胞向诱导多能干细胞转化过程中调节线粒体清除[15]。以及在Atg5-/-小鼠胚胎成纤维细胞中检测到内质网生成的自噬体样结构,提示传统的自噬仍在缓慢发生[16]。因此,不依赖于Atg5的替代性自噬或残存的自噬活性可能使附睾头4-5段保持原有功能,维护精子的成熟,形成有功能的精子;第二,自噬是机体细胞的自我保护的程序,例如当细胞处于饥饿状态时, 会通过激活自噬来为细胞提供营养物质, 因此不排除附睾组织中的自噬功能只有在应激情况下才会参与到精子成熟的调控,而正常情况下Atg5缺失对附睾的功能和精子的成熟没有影响。第三,以Lcn5启动子来驱动的Cre酶是在小鼠出生后30 d才逐渐有表达的[17],因此我们不能排除ATG5蛋白及其参与的自噬功能是在出生前30 d内(即附睾组织细胞的分化过程中)发挥作用的。综上,我们会继续关注Atg5的缺失引起的局部功能和蛋白的变化以及应激条件下、出生后的生命早期Atg5的缺失对精子成熟过程的影响。
虽然本研究中自然条件下未发现Atg5缺失会对精子成熟过程产生影响,但本研究对于后续围绕自噬在附睾中的功能开展研究,有一定的借鉴和参考意义。在后续的研究中,期待阐明自噬是否在生命早期参与了附睾上皮细胞的分化过程、自噬是否调控了附睾内一些蛋白分泌过程、应激条件下自噬是否能缓解附睾中精子成熟异常的状况。
| [1] |
孙文希, 胡凌娟. 国内外不孕不育症现状及我国的干预策略探讨[J]. 人口与健康, 2019, 12: 19-23. Sun W X, Hu L J. The present situation of infertility at home and abroad and the intervention strategy in China were discussed[J]. Popul Heal, 2019, 12: 19-23. |
| [2] |
Mu Y, Yan W J, Yin T L, et al. Diet-induced obesity impairs spermatogenesis: A potential role for autophagy[J]. Sci Rep, 2017, 7: 43475. doi:10.1038/srep43475 |
| [3] |
Leaver R B. Male infertility: An overview of causes and treatment options[J]. Br J Nurs, 2016, 25(18): S35-40. doi:10.12968/bjon.2016.25.18.S35 |
| [4] |
Gao H, Khawar M B, Li W. Essential role of autophagy in resource allocation during sexual reproduction[J]. Autophagy, 2020, 16(1): 18-27. doi:10.1080/15548627.2019.1628543 |
| [5] |
李帅, 鲍翠玉, 李晶. 自噬相关通路在糖尿病心肌病中的研究进展[J]. 中国药理学通报, 2019, 35(6): 753-6. Li S, Bao C Y, Li J. Research progress of autophagy in diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2019, 35(6): 753-6. doi:10.3969/j.issn.1001-1978.2019.06.004 |
| [6] |
张友旺, 刘俊, 马开槐, 等. 自噬对精子发生及活力的影响[J]. 中华男科学杂志, 2019, 25(1): 72-6. Zhang Y W, Liu J, Ma K H, et al. Effects of autophagy on spermatogenesis and sperm motility[J]. Natl J Androl, 2019, 25(1): 72-6. |
| [7] |
Zhang M, Jiang M, Bi Y, et al. Autophagy and apoptosis act as partners to induce germ cell death after heat stress in mice[J]. PLoS One, 2012, 7(7): e41412. doi:10.1371/journal.pone.0041412 |
| [8] |
Liu C, Song Z, Wang L, et al. Sirt1 regulates acrosome biogenesis by modulating autophagic flux during spermiogenesis in mice[J]. Development, 2017, 144(3): 441-51. doi:10.1242/dev.147074 |
| [9] |
Cornwall G A. New insights into epididymal biology and function[J]. Human reproduction update, 2009, 15(2): 213-27. |
| [10] |
Cosentino M J, Cockett A T. Structure and function of the epididymis[J]. Urological Res, 1986, 14(5): 229-40. |
| [11] |
Parzych K R, Klionsky D J. An overview of autophagy: morphology, mechanism, and regulation[J]. Antioxid Redox Signal, 2014, 20(3): 460-73. doi:10.1089/ars.2013.5371 |
| [12] |
尤旭, 赵海霞, 马琼艳, 等. 增龄对大鼠睾丸自噬水平和血睾屏障完整性的影响[J]. 中国药理学通报, 2020, 36(1): 64-9. You X, Zhao H X,, Ma Q Y, et al. Effects of aging on testicular autophagy and integrity of blood-testis barrier in rats[J]. Chin Pharmacol Bull, 2020, 36(1): 64-9. |
| [13] |
张续蓝, 王婷, 郑杰, 等. 从AMPK-mTOR信号途径研究淫羊藿总黄酮对衰老大鼠皮层自噬的调节作用[J]. 中国药理学通报, 2020, 36(10): 1445-9. Zhang X L, Wang T, Zheng J, et al. Regulatory effect of total flavonoids of epimedium on autophagy in cerebral cortex of natural aging rats via AMPK-mTOR signaling pathway[J]. Chin Pharmacol Bull, 2020, 36(10): 1445-9. doi:10.3969/j.issn.1001-1978.2020.10.021 |
| [14] |
Huang Q, Liu Y, Zhang S, et al. Autophagy core protein ATG5 is required for elongating spermatid development, sperm individualization and normal fertility in male mice[J]. Autophagy, 2020, 1-15. |
| [15] |
Nishida Y, Arakawa S, Fujitani K, et al. Discovery of Atg5/Atg7-independent alternative macroautophagy[J]. Nature, 2009, 461(7264): 654-8. doi:10.1038/nature08455 |
| [16] |
Ma T, Li J, Xu Y, et al. Atg5-independent autophagy regulates mitochondrial clearance and is essential for iPSC reprogramming[J]. Nat Cell Biol, 2015, 17(11): 1379-87. doi:10.1038/ncb3256 |
| [17] |
Tsuboyama K, Koyama-Honda I, Sakamaki Y, et al. The ATG conjugation systems are important for degradation of the inner autophagosomal membrane[J]. Science, 2016, 354(6315): 1036-41. doi:10.1126/science.aaf6136 |
| [18] |
Xie S, Xu J, Ma W, et al. Lcn5 promoter directs the region-specific expression of cre recombinase in caput epididymidis of transgenic mice[J]. Biol Reproduct, 2013, 88(3): 71. |

