

2. 宁夏医科大学总医院感染科,宁夏回族自治区, 宁夏 银川 750004;
3. 宁夏医科大学药学院,宁夏回族自治区, 宁夏 银川 750004;
4. 宁夏医科大学宁夏血管损伤与修复研究重点实验室,宁夏回族自治区, 宁夏 银川 750004;
5. 宁夏医科大学国家卫生健康委代谢性心血管疾病研究重点实验室,宁夏回族自治区, 宁夏 银川 750004
 ,
JIAO Yun2,
WU Xin-yan1,
HAI Xiu-ling2,
XU Long1,
ZHANG Hui1,
GUO Wei1,
HAO Yin-ju3,
JIANG Yi-deng1,4,5
,
JIAO Yun2,
WU Xin-yan1,
HAI Xiu-ling2,
XU Long1,
ZHANG Hui1,
GUO Wei1,
HAO Yin-ju3,
JIANG Yi-deng1,4,5

2. Dept of Infectious Diseases, General Hospital of Ningxia Medical, National Health Commission, Ningxia Medical University, Yinchuan 750004, China;
3. School of Pharmacy, NingxiaMedical University, National Health Commission, Ningxia Medical University, Yinchuan 750004, China;
4. Ningxia Key Lab of Vascular Injury and Repair Research, National Health Commission, Ningxia Medical University, Yinchuan 750004, China;
5. Key Lab of Metabolic Cardiovascular Disease Research, National Health Commission, Ningxia Medical University, Yinchuan 750004, China
高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)是由蛋氨酸代谢中胱硫醚β-合成酶(cystathionine β synthase,CBS)活性缺乏或减少导致同型半胱氨酸(homocysteine,Hcy)在体内的大量积聚造成的[1]。HHcy可参与肝硬化、慢性肾病和心脑血管等多种疾病的发生发展[2-3]。本课题组前期的多项研究表明,HHcy能够明显引起肝脏损伤[4-5]。细胞内诱导细胞凋亡的场所在内质网,而且过度的内质网应激会诱导细胞凋亡[6]。内质网应激在肝脏损伤中发挥重要作用,参与肝炎、肝硬化、肝癌等肝脏疾病中肝细胞凋亡的调控[7-8]。激活转录因子6(activate transcription factor 6,ATF6)作为内质网的传感器,当内质网(endoplasmic reticulum,ER)应激诱导非折叠蛋白反应(unfolded protein reaction,UPR)时被激活。ATF6在细胞中表达增加,进而调控促凋亡蛋白C/EBP同源蛋白(C/EBP homologous protein,CHOP)使得半胱氨酸天冬酰胺酶12(cysteine-containing aspartate-specific protease 12,caspase12)发生活化,促进细胞凋亡的发生[9-10],但是ATF6是否在Hcy诱导肝细胞凋亡中发挥调控作用未见报道。叉头框蛋白O1(forkhead box O1,FoxO1)是Fox基因家族的重要成员,广泛参与哺乳动物细胞增殖、分化、代谢和凋亡等生物学功能[11],在Hcy诱导的肝细胞凋亡中,DNA低甲基化是造成FoxO1表达上调的重要原因[12],但其机制尚不明确。因此,本研究以ATF6表达改变为切入点,探讨FoxO1在Hcy介导的肝细胞凋亡中的潜在机制,将为进一步研究肝损伤的发病机制提供理论依据。
1 材料与方法 1.1 主要试剂和仪器同型半胱氨酸(BCBV1026),购自Sigma公司;cbs+/-与cbs+/+实验小鼠由杰克逊实验室(Bar Harbor, ME)提供,饲养于宁夏医科大学动物中心。Annexin V-FITC/PI细胞凋亡检测试剂盒(9009907),购自沈阳万类生物生物技术有限公司;蛋白提取试剂盒(P0013F)、蛋白定量试剂盒(20191101),购自上海碧云天生物技术有限公司;FoxO1(ab179450)、ATF6(ab227830)、Bcl-2 (ab32124)和Bax(ab32503)抗体,均购自Abcam公司;内参抗体β-actin(TA-09),购自北京中杉金桥生物技术有限公司;胎牛血清(2021472)和RPMI 1640培养液(812006),购自Gibco公司;超净工作台,购自苏州安泰有限公司;总RNA提取试剂盒(U8604),购自北京天根生物技术有限公司;ATF6,FoxO1引物由上海生工合成;逆转录试剂盒(AJ90851A)与qRT-PCR试剂盒(AJE1566A),购自宝日医生物技术(北京)有限公司;流式细胞仪,购自美国ACEA;普通PCR仪与qRT-PCR仪,购自耶拿公司;CO2培养箱和5415D型微量台式离心机,购自Eppendorf公司;BS110S型精密天平,购自Sartoriu公司;垂直电泳仪和Model680全自动酶标仪,购自BioRad公司。
1.2 细胞培养人正常肝细胞株HL-7702,购自上海名劲生物科技有限公司。用含10%胎牛血清的RPMI 1640培养基培养,并将细胞置于37 ℃、5% CO2的培养箱中进行培养。当细胞密度增长至50%时,以0、100 μmol·L-1 Hcy干预48 h的人肝细胞分别作为对照组和Hcy组,收集细胞用于后续实验。
1.2.1 siRNA转染肝细胞转染前1 d,在400 μL的培养基(不加抗生素)中接种2×105个细胞。将250 μL RPMI 1640纯培养基和0.5OD 6.25 μL的siRNA(序列如Tab 1所示)混合,轻轻吹吸3-4次。再将250 μL 1640纯培养基与5 μL的Lipofectamine 2000混合,轻轻吹吸3-4次,静置5 min。将混合转染试和siRNA稀释液混合,轻轻吹吸3-4次,于室温下静置20 min。将上述转染混合物加入培养瓶中,再加入1.5 mL纯培养基,轻摇培养瓶混合均匀。将培养瓶置于37 ℃,5%CO2培养箱中培养6 h,更换新鲜的培养基,并加入Hcy药物干预48h,进行后续其他实验。
| Gene name | Sequence | |
| Sense(5′-3′) | Antisense(5′-3′) | |
| FoxO1-homo-1039 | CCUACACAGCAAGUUCAU UTT | AAUGAACUUGCUGUGUAG GTT |
| FoxO1-homo-1152 | CCAUGGACAACAACAGUA ATT | UUACUGUUGUUGUCCAUG GTT |
| FoxO1-homo-1338 | GCUCAAAUGCUAGUACUA UTT | AUAGUACUAGCAUUUGAG CTT |
| ATF6-homo-1734 | GUGAGCUACAAGUGUAUU ATT | UAAUACACUUGUAGCUCA CTT |
| ATF6-homo-2105 | GCACCAUCCCUGAGUCAU UTT | AAUGACUCAGGGAUGGUG CTT |
| ATF6-homo-1038 | GGAGACAGCAACGUAUGA UTT | AUCAUACGUUGCUGUCUC CTT |
用胰蛋白酶消化肝细胞,1 500 g离心5 min,收集肝细胞,用4 ℃预冷的PBS将细胞洗涤2次,再次1 500 g离心5 min收集肝细胞,用500 μL 1×Annexin V结合液悬浮细胞,其浓度大约为1 × 109 cells/L。接着加入5 μL Annexin V-FITC和10 μL PI染色液,轻轻混匀后置于避光处孵育15 min,并在1 h内用流式细胞仪检测肝细胞凋亡率。
1.2.3 Western blot检测FoxO1、ATF6以及凋亡相关蛋白的表达按照蛋白提取试剂盒配置的蛋白裂解液将收集的肝细胞裂解,使用BCA法对蛋白裂解液进行定量,将浓度定量的总蛋白加入适量的蛋白上样缓冲液煮沸5 min以彻底变性,经SDS-PAGE凝胶电泳,半干转至PVDF膜,并用5%脱脂奶粉封闭2 h,PBST洗膜10 min×3次,与1 ∶1 000稀释的FoxO1、ATF6、Bax和Bcl2的一抗在4 ℃孵育过夜,PBST洗膜10 min×3次,再与1 ∶5 000稀释的辣根过氧化物酶标记的二抗室温孵育2 h,PBST洗膜10 min×3次,采用ECL化学发光试剂显色,用Image Lab软件分析检测结果的灰度值,计算目的条带灰度值与内参β-actin灰度值的比值,进行结果分析。
1.2.4 qRT-PCR检测FoxO1和ATF6的mRNA表达按照总RNA提取试剂盒操作提取组织与细胞的总RNA,根据Gene Bank查询序列并交由生工设计引物,FoxO1(人源):Forward:GTACGCCGACCTCAT CACCAAG,Reverse: GCACGCTCTTCACCATCCACTC;FoxO1(鼠源):Forward:TGTCCTACGCCGACCTCAT CAC,Reverse: GCACGCTCTTGACCATCCACTC;ATF6(人源)Forward:GCGGAGCCACTGAAGGAAGATAAG,Reverse:TGTTTGAGTCTTGGGTGCTGCTG;ATF6(鼠源)Forward:TGCCTTGGGAGTCAGACCTATGG,Reverse:CTGTGGACCGAGGAGAGGAGATG。逆转录条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃ forever;qRT-PCR扩增程序95 ℃ 30 s 1x,95 ℃ 5 s 60 ℃ 34 s 40 x,Dissociation 95 ℃ 15 s,60 ℃ 1 min,75 ℃ 15 s,以内参作为对照,目的基因的相对量根据公式2-△△Ct,△△Ct=[Ct目的基因(待测样本)-Ctβ-actin(待测样本)]-[Ct目的基因(校正样本)-Ctβ-actin(校正样本)]。
1.2.4 统计学方法采用Prism 6.0统计软件对实验数据进行分析整理,计量资料以x±s表示,两样本均数间比较采用Student’s t检验,多样本均数间比较采用One-way ANOVA检验,组间的两两比较采用Student-Newman-Keuls检验。
2 结果 2.1 FoxO1在cbs小鼠肝脏及人源肝细胞中的表达情况qRT-PCR和Western blot检测cbs+/+与cbs+/-小鼠肝脏中FoxO1的mRNA和蛋白表达水平改变。结果显示,与cbs+/+相比,cbs+/-小鼠肝脏中FoxO1的mRNA与蛋白表达水平显著增加(P < 0.01,Fig 1A,B)。使用100 μmol·L-1 Hcy干预肝细胞48 h,模拟体外HHcy, 接下来用qRT-PCR和Western blot检测FoxO1的mRNA与蛋白表达,结果显示,与control组相比,Hcy组FoxO1的表达显著增加(P < 0.01,Fig 1C,D),提示FoxO1表达增加可能在Hcy诱导肝损伤过程中发挥关键作用,见Fig 1。

|
| Fig 1 Expression of FoxO1 in hepatocytes detected by qRT-PCR and Western blot A: qRT-PCR was used to detect the FoxO1 mRNA expression in liver of cbs+/+ and cbs+/- mice(x±s, n=8); B: Western blot was used to detect FoxO1 protein expression in liver of cbs+/+ and cbs+/- mice(x±s, n=8); C: qRT-PCR was used to detect the FoxO1 mRNA expression in hepatocytes (x±s, n=3); D: Western blot was used to detect FoxO1 protein expression in hepatocytes (x±s, n=3). **P < 0.01 vs cbs+/+group or control group. |
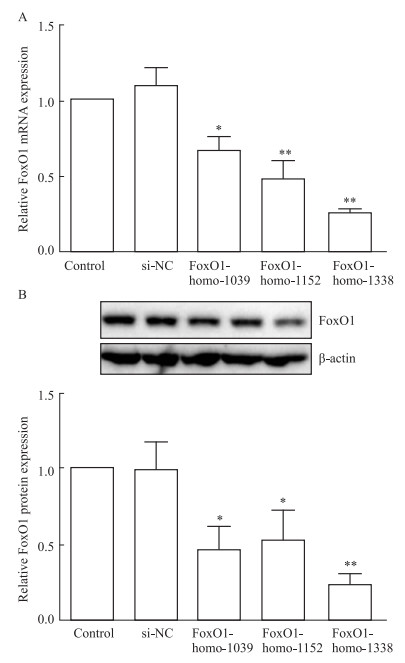
构建FoxO1的siRNA并转染肝细胞,qRT-PCR和Western blot检测FoxO1表达改变。结果显示,3组干扰片段均能引起FoXO1表达下调(Fig 2A,B),且以FoxO1-siRNA-1338(siFoxO1)效果最好,可用于后续试验。
|
| Fig 2 mRNA and protein expression of FoxO1 in hepatocytes detected by qRT- PCR and Western blot A: qRT-PCR was used to detect the FoxO1 mRNA expression in hepatocytes (x±s, n=3); B: Western blot was used to detect FoxO1 protein expression in hepatocytes(x±s, n=3). *P < 0.05, **P<0.01 vs si-NC group. |
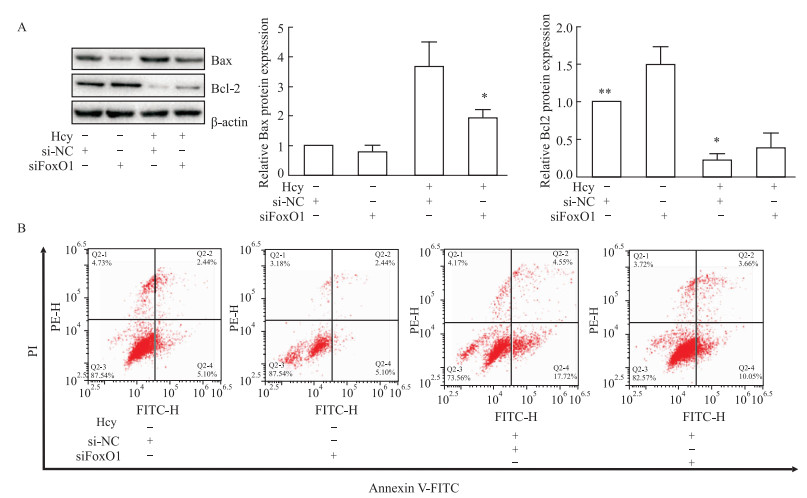
转染FoxO1 siRNA至肝细胞后,且用Hcy处理48 h。结果显示,与Hcy+si-NC组相比,Hcy+siFoxO1组Bax的表达显著降低(P < 0.05,Fig 3A),Bcl2的表达显著增加(P < 0.01,Fig 3A),同时流式细胞术显示肝细胞凋亡率显著降低(P < 0.01,Fig 3B),提示FoxO1敲低可下调肝细胞凋亡水平。
|
| Fig 3 Hcy induced hepatocyte apoptosis inhibited by decreased FoxO1 expression A: Western blot was used to detect Bcl2 and Bax protein expression(x±s, n=3); B: Apoptotic rate of hepatocytes (x±s, n=3). *P < 0.05, **P < 0.01 vs Hcy+si-NC group. |
ATF6作为内质网应激中未折叠蛋白反应致细胞凋亡的重要蛋白,为了验证其在肝细胞凋亡中的作用,首先采用qRT-PCR和Western blot检测小鼠肝脏组织和肝细胞中ATF6的表达。结果显示,与cbs+/+组相比,cbs+/-组肝脏组织中ATF6的表达明显增加(P < 0.05,Fig 4A),同时Hcy处理的肝细胞中表达明显上调(P < 0.01,Fig 4B),结果与动物水平保持一致。肝细胞转染FoxO1 siRNA后,qRT-PCR和Western blot检测ATF6的表达改变,与Hcy+si-NC组相比,Hcy+siFoxO1组ATF6表达显著降低(Fig 4C)(P < 0.05),说明Hcy通过上调FoxO1促进ATF6表达进而激活内质网应激反应。

|
| Fig 4 Expression of ATF6 in hepatocytes regulated by FoxO1 A: qRT-PCR and Western blot was used to detect ATF6 expression in liver(x±s, n=8);B: qRT-PCR and Western blot was used to detect ATF6 expression inhepatocytes; C: Hepatocytes were transfected with FoxO1 siRNA, Hcy to interfere with hepatocytes, and ATF6 expression was detected by qRT-PCR and Western blot(x±s, n=3). *P < 0.05, **P < 0.01 νs control and Hcy+si-NC group. |
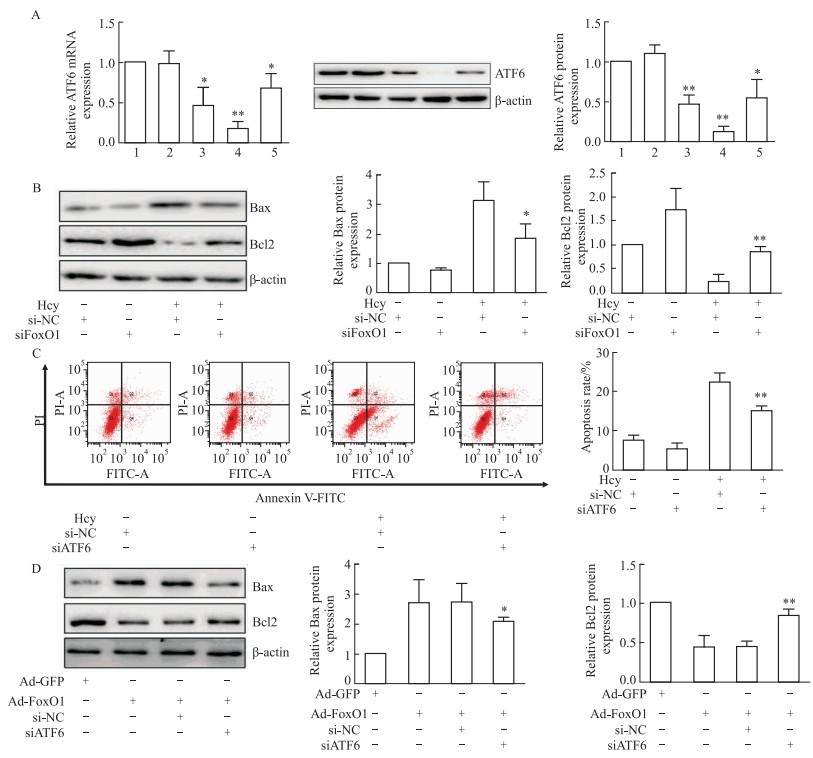
为了进一步探讨FoxO1在调控肝细胞凋亡中的分子机制,构建ATF6 siRNA并转染肝细胞。qRT-PCR和Western blot结果显示,在引起ATF6表达下调的3个干扰片段中,siRNA-ATF6-homo-2105 (siATF6)敲低效果最佳,可用于后续试验(Fig 5A)。为证明ATF6在Hcy诱导肝细胞凋亡过程中的调控作用,将ATF6 siRNA转染肝细胞,Western blot和流式细胞术分别观察肝细胞凋亡情况。结果显示,与Hcy+si-NC组相比,Hcy+siATF6组Bax蛋白表达显著降低(P < 0.01,Fig 5B),而Bcl2蛋白表达明显增加(P < 0.05,Fig 5B)。流式细胞术的结果显示肝细胞凋亡率亦显著降低,这与Western blot结果一致(P < 0.01,Fig 5C)。为进一步的证明FoxO1通过调控ATF6的表达改变调控肝细胞凋亡,在Hcy干预的条件下,肝细胞分别转染FoxO1过表达腺病毒或转染FoxO1过表达腺病毒加ATF6siRNA,Western blot检测Bax和Bcl2的表达改变,结果显示,与Ad-FoxO1组相比,Ad-FoxO1+siATF6组Bax表达显著降低(P < 0.05, Fig 5D),Bcl2的表达显著增加(P < 0.05,Fig 5D)。以上结果说明,FoxO1通过调控ATF6表达改变调控Hcy诱导的肝细胞凋亡。
|
| Fig 5 Hcy-induced hepatocyte apoptosis significantly relieved by down-regulation of ATF6 A: Hepatocytes were transfected with ATF6 siRNAs, qRT-PCR and Western blot to detect ATF6 expression (x±s, n=3); B: Hepatocytes were transfected with ATF6 siRNA, Western blot to detect Bax and Bcl2 expression (x±s, n=3); C: Hepatocytes were transfected with ATF6 siRNA, observation of hepatocyte apoptotic rate by flow cytometry(x±s, n=3);D: FoxO1 overexpression adenovirus or FoxO1 overexpression adenovirus plus ATF6siRNA in hepatocytes, Western blot to detect Bax and Bcl2 expression(x±s, n=3). 1:Control; 2:si-NC; 3: ATF6-homo-1734;4: ATF6-homo-2105;5: ATF6-homo-1038. *P < 0.05, **P < 0.01 νs control+si-NC group or Ad-FoxO1 group. |
Hcy是一种含硫氨基酸,在生物体内硫醇新陈代谢中起到的关键作用。当血浆Hcy浓度高于15 μmol·L-1时,将会超出机体自身调节能力,使机体患有严重疾病,包括造血功能异常、阿尔茨海默病、神经毒性和肝脏损害等[13]。大量研究表明,肝脏正常情况下肝细胞很少发生凋亡,当肝细胞大量凋亡发生时,肝脏会出现明显的损伤,因此研究肝细胞的凋亡机制对于预防肝脏损伤至关重要。本课题组前期的大量研究表明,高同型半胱氨酸血症显著引起肝脏损伤,肝细胞凋亡在其中发挥了重要的调控作用,且采用不同浓度的Hcy处理体外培养肝细胞,发现肝细胞损伤随着Hcy浓度的增加而逐渐加重[4-5]。
FoxO1是体内重要信号传导途径中的关键调节剂之一。研究表明缺氧状态下颗粒细胞(granulosa cell,GC)中FoxO1的表达增加,通过JNK途径的细胞凋亡显著增加,敲低FoxO1表达后显著抑制缺氧暴露后GC的凋亡[14]。课题组前期的研究亦发现,FoxO1启动子区的低甲基化造成FoxO1的表达增加,可能在Hcy诱导的肝细胞内质网应激未折叠蛋白反应中发挥重要作用[12],但是抑制FoxO1的表达后,Hcy诱导肝细胞内质网应激未折叠蛋白反应致肝细胞凋亡是否会缓解,以及FoxO1通过何种途径缓解肝细胞凋亡均未知,基于此,本课题进行了大量研究,研究结果证明,Hcy能够显著促进FoxO1的表达,在抑制FoxO1的表达后,Hcy处理的肝细胞凋亡程度显著降低。内质网应激在诱导细胞凋亡过程中发挥着重要的作用,内质网应激未折叠蛋白反应主要由3条途径激活分别是:(1)PERK /eIF2α/ ATF4分支,二聚化和自磷酸化会激活PERK,导致eIF2α发生磷酸化并抑制蛋白质表达,eIF2α磷酸化后会促进转录表达因子4(activate transcription factor 6,ATF4)[15]。(2)IRE1 / XBP1分支,病理状态下IRE1与葡萄糖调节蛋白(glucose-regulated protein 78,GRP78)解键激活,并导致XBP1的进一步剪接。新产生的剪接XBP1(sXBP1)作为转录因子调节ER蛋白的表达[16]。(3)ATF6分支,当发生内质网应激时,ATF6从GRP78上解离,导致ATF6表达增加并易位至细胞核并诱导ER应激反应基因CHOP的表达,促进细胞凋亡[17]。本课题组前期的研究同样也表明,Hcy显著促进肝细胞发生内质网应激未折叠蛋白反应[5],也证明了Hcy促进肝细胞中ATF6的表达增加,FoxO1能够调控ATF6的表达,为进一步的证明ATF6途径在Hcy诱导肝细胞凋亡中的重要作用,Hcy干预肝细胞的状态下敲低ATF6的表达,发现Hcy引起的肝细胞凋亡显著降低,说明在内质网应激未折叠蛋白反应中ATF6途径发挥着重要的调控作用。在Hcy干预的基础上,过表达FoxO1,发现Bax的表达显著增加,Bcl2的表达降低,与此同时过表达FoxO1的同时敲低ATF6的表达,Bax的表达显著降低,Bcl2的表达增加,此时凋亡相关蛋白Bax和Bcl2的变化与只敲低ATF6的结果是一样的,与只过表达FoxO1的结果是正好相反的,这说明FoxO1必须经过ATF6才能发挥功能,提示ATF6在FoxO1在调控肝细胞凋亡过程中发挥着关键的作用。
综上所述,Hcy通过促进FoxO1的表达激活ATF6途径发生内质网应激未折叠蛋白反应造成肝细胞凋亡导致肝脏损伤,这为深入研究HHcy引起肝细胞凋亡提供了新的实验依据,而且为HHcy引起的肝损害提供了新的防治依据和治疗靶点。
| [1] |
Zaric B L, Obradovic M, Bajic V, et al. Homocysteine and hyperhomocysteinaemia[J]. Curr Med Chem, 2019, 26(16): 2948-61. doi:10.2174/0929867325666180313105949 |
| [2] |
Ankur J, Sathyanarayanan R, Lucas W, et al. Hyperhomocysteinemia leads to exacerbation of ischemic brain damage: Role of GluN2A NMDA receptors[J]. Neurobiol Dis, 2019, 127: 287-302. doi:10.1016/j.nbd.2019.03.012 |
| [3] |
Majumder A, Singh M, Behera J, et al. Hydrogen sulfide alleviates hyperhomocysteinemia-mediated skeletal muscle atrophy via mitigation of oxidative and endoplasmic reticulum stress injury[J]. Am J Physiol Cell Physiol, 2018, 315(5): C609-22. doi:10.1152/ajpcell.00147.2018 |
| [4] |
孙磊, 郭伟, 马鹏俊, 等. miR-30a-5p启动子区DNA甲基化在同型半胱氨酸致肝损伤中的作用[J]. 中国病理生理杂志, 2020, 36(1): 119-26. Sun L, Guo W, Ma P J, et al. Effect of DNA methylation of miR-30a-5p promoter region on hepatic injury induced by homocysteine[J]. Chin J Pathophysiol, 2020, 36(1): 119-26. doi:10.3969/j.issn.1000-4718.2020.01.017 |
| [5] |
Yang A, Sun Y, Mao C, et al. Folate protects hepatocytes of hyperhomocysteinemia mice from apoptosis via cystic fibrosis transmembrane conductance regulator (CFTR)-activated endoplasmic reticulum stress[J]. J Cell Biochem, 2017, 118(9): 2921-32. doi:10.1002/jcb.25946 |
| [6] |
谢琳, 张辉, 丁宁, 等. ASPP2调控GRP78在L-NAME诱导胎盘滋养细胞凋亡中的作用[J]. 中国药理学通报, 2019, 35(6): 765-70. Xie L, Zhang H, Ding N, et al. Effect of ASPP2 on regulating GRP78 in apoptosis of placental trophoblast cells induced by L-NAME[J]. Chin Pharmacol Bull, 2019, 35(6): 765-70. doi:10.3969/j.issn.1001-1978.2019.06.007 |
| [7] |
Zhou H, Zhu J, Yue S, et al. The dichotomy of endoplasmic reticulum stress response in liver ischemia-reperfusion injury[J]. Transplantation, 2016, 100(2): 365-72. doi:10.1097/TP.0000000000001032 |
| [8] |
Chi X, Jiang Y, Chen Y, et al. Suppression of microRNA27a protects against liver ischemia/reperfusion injury by targeting PPARγ and inhibiting endoplasmic reticulum stress[J]. Mol Med Rep, 2019, 20(5): 4003-12. |
| [9] |
Wu Y, Yue Y, Fu S, et al. Icariside Ⅱ prevents hypertensive heart disease by alleviating endoplasmic reticulum stress via the PERK/ATF-4/CHOP signalling pathway in spontaneously hypertensive rats[J]. J Pharm Pharmacol, 2019, 71(3): 400-7. doi:10.1111/jphp.13041 |
| [10] |
Saraswat O S, Hetman M, Whittemore S R, et al. ATF6α deletion modulates the ER stress response after spinal cord injury but does not affect locomotor recovery[J]. J Neurotrauma, 2018, 35(3): 486-91. doi:10.1089/neu.2015.3993 |
| [11] |
Park J, Ko Y S, Yoon J, et al. The forkhead transcription factor FOXO1 mediates cisplatin resistance in gastric cancer cells by activating phosphoinositide 3-kinase/Akt pathway[J]. Gastric Cancer, 2014, 17(3): 423-30. doi:10.1007/s10120-013-0314-2 |
| [12] |
谢琳, 丁宁, 徐灵博, 等. FoxO1 DNA甲基化在同型半胱氨酸致肝细胞凋亡中的作用[J]. 实用医学杂志, 2018, 34(16): 2659-62, 69. doi:10.3969/j.issn.1006-5725.2018.16.007 |
| [13] |
Gao F, Zhang J, Ni T, et al. Herpud1 deficiency could reduce amyloid-β40 expression and thereby suppress homocysteine-induced atherosclerosis by blocking the JNK/AP1 pathway[J]. J Physiol Biochem, 2020, 76(3): 383-91. doi:10.1007/s13105-020-00741-5 |
| [14] |
Liu Z, Li C, Wu G, et al. Involvement of JNK/FOXO1 pathway in apoptosis induced by severe hypoxia in porcine granulosa cells[J]. Theriogenology, 2020, 154: 120-7. doi:10.1016/j.theriogenology.2020.05.019 |
| [15] |
Li J, Zhuo J Y, Zhou W, et al. Endoplasmic reticulum stress triggers delanzomib-induced apoptosis in HCC cells through the PERK/eIF2α/ATF4/CHOP pathway[J]. Am J Transl Res, 2020, 12(6): 2875-89. |
| [16] |
Rohde C, Becker S, Krähling V, et al. Marburg virus regulates the IRE1/XBP1-dependent unfolded protein response to ensure efficient viral replication[J]. Emerg Microbes Infect, 2019, 8(1): 1300-13. doi:10.1080/22221751.2019.1659552 |
| [17] |
Hirsch I, Weiwad M, Prell E, et al. ERp29 deficiency affects sensitivity to apoptosis via impairment of the ATF6-CHOP pathway of stress response[J]. Apoptosis, 2014, 19(5): 801-15. doi:10.1007/s10495-013-0961-0 |