

熊伟(1979-),男,博士,教授,博士生导师,研究方向:神经生物学,E-mail:wxiong@ustc.edu.cn。
维生素C(vitamin C,VC)也称抗坏血酸,可以通过血脑屏障或细胞膜上的2型钠离子依赖性维生素C转运体(sodium-dependent vitamin C transporter-type 2,SVCT2)进入脑内及神经细胞中,并且脑中VC的浓度水平高于其它器官中VC的浓度水平[1],这说明了VC可能对神经系统有着重要的生物学意义。如VC可以影响神经元的发育和髓磷脂的形成,另外有研究指出VC对Ⅰ型多巴胺受体、Ⅱ型多巴胺受体以及N-甲基-D天冬氨酸受体等多种膜蛋白的功能都有影响[1-3]。
神经系统中有两种重要的抑制性的神经递质,分别为甘氨酸(glycine,Gly)和γ-氨基丁酸(γ-aminobutyric acid,GABA)[4]。其中,Gly特异性的受体——甘氨酸受体(glycine receptor,GlyR)在中枢神经系统中分布广泛且大量存在于脊髓、脑干中。GlyR主要由两种亚基构成,分别为α和β,到目前为止发现α亚基存在多种亚型,而β亚基只有一种亚型。根据组成GlyR的α亚基的亚型不同,可以将GlyR分为4种亚型,分别为α1、α2、α3、α4亚型(GlyRα1、GlyRα2、GlyRα3、GlyRα4)[5-6]。现已发现很多物质都可以调节GlyR的功能,例如大麻素、酒精、锌离子等[7]。然而,目前尚无VC对GlyR调节作用的报道。鉴于两者在中枢神经系统中的重要性,本实验采用电生理技术,探究VC对GlyR所介导的电流的影响,以期阐明VC与GlyR之间的关系。
1 材料与方法 1.1 试剂和材料NaCl、KCl、CaCl2、Glucose、HEPES、MgCl2、Vitamin C、Glycine均购于Sigma。DMEM (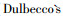
细胞外液(mmol·L-1):140 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 10 Glucose、10 HEPES,pH用NaOH调至7.4。电极内液(mmol·L-1),140 CsCl, 4 MgCl2, 10 EGTA, 10 HEPES, 0.5 Na-GTP、2 Mg-ATP,pH用CsOH调至7.2。含血清细胞培养基:体积占比0.9的DMEM,体积占比0.1的纯胎牛血清,体积占比0.01的双抗(青霉素,链霉素)。
1.3 细胞培养和质粒转染实验中所用细胞为HEK-293T,细胞培养方法参照文献[8-9]和实验室以往经验,使用含血清的细胞培养基在37 ℃,5 % CO2细胞培养箱中培养。转染质粒前,挑选细胞生长密度合适的细胞进行转染。瞬时转染按照LipofectamineTM 2000试剂盒说明书进行,将1 μg编码GlyR(野生型或突变型)和1 μg编码绿色荧光蛋白(green fluorescent protein,GFP)的质粒以共转的形式转入细胞中。细胞处理6 h后,换液继续培养。转染后2 d,便可进行相关实验检测。
1.4 单细胞膜片钳记录在进行电生理记录前2 h,将细胞用胰酶处理成单个悬浮细胞后,加入含血清的细胞培养基在合适的培养条件下培养,待细胞重新贴壁后使用。电生理记录过程中需要将细胞置于细胞外液中,并向电极中加入适量的电极内液,电极(外径1.50 mm,内径0.84 mm)是在MODEL P-1000电极拉制仪中拉制而成,拉制后的电极需保证入水电阻在3-4 MΩ之间。膜片钳实验在OLYMPUS倒置荧光显微镜的观察下进行,使用电极封接吸破细胞形成全细胞记录方式后,需要将细胞从皿底抬升至适当高度,然后使用Warner公司的步进电极驱动的给药系统为细胞施加药物,然后使用Axopatch 200B放大器在全细胞模式下记录GlyR在Gly刺激下所介导的电流大小,整个全细胞模式的记录过程中,细胞膜电位钳制在-60 mV(在上述参数和条件下记录到的电流一般为氯离子电流[10-12]),最后使用软件pClamp 10.4获取数据。
1.5 数据统计和分析使用GraphPad Prism 8.0软件对数据进行分析,计量资料以x±s表示, 并使用t检验或Kolmogorov-Smirnov检验(K-S检验)。
2 结果 2.1 维生素C对甘氨酸受体不同亚型功能的增强效果首先,我们分别在HEK-293T细胞中转染表达GlyR的不同亚型(GlyRα1、GlyRα2、GlyRα3)的cDNA质粒以及表达绿色荧光蛋白GFP的cDNA质粒,然后我们对发出绿色荧光的细胞进行电生理记录。实验中我们首先记录GlyR在Gly刺激下所诱发的氯离子电流大小(glycine-activated chloride current,IGly),Gly的浓度为可以激活GlyR介导的最大电流2 %的浓度(concentration for 2% of maximal effect,EC2)。随后,我们为细胞孵育1 μmol·L-1的VC,每孵育1min,记录一次IGly,共记录5 min,然后改为孵育细胞外液以洗脱VC,每孵育1 min,记录一次IGly,共记录3 min。实验结果表明,在1 μmol·L-1 VC的作用下GlyRα1所介导的电流大小显著增强(P < 0.05)(Fig 1A,B)。而GlyRα2所介导的电流大小在1 μmol·L-1 VC的作用下无显著性变化(Fig 1C,D)。GlyRα3所介导的电流大小在1 μmol·L-1 VC的作用下显著增强(P < 0.05)(Fig 1E,F)。
|
| Fig 1 Effects of 1 μmol·L-1 vitamin C on glycine-activated currents (IGly) in HEK-293T cells A-F. Representative trace currents and average values of IGly in HEK-293T cells expressing GlyR α1 (A-B), α2 (C-D) and α3 subunits (E-F), n=6. Data are represented as x±s. *P < 0.05, **P < 0.01 vs control(Time=0 min) based on unpaired t-tests. |
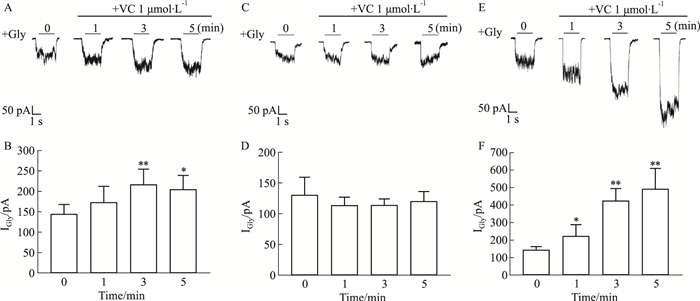
接下来,我们对GlyRα1、GlyRα2和GlyRα3介导的电流大小随时间的变化率进行了统计。随着VC孵育时间的增加,GlyRα1和GlyRα3介导的电流逐渐增大。此外,我们发现1 μmol·L-1 VC对GlyRα3的功能影响最明显,对GlyRα1的功能影响次之,而对GlyRα2功能无明显作用。在停止孵育VC改为施加细胞外液后,这一效果有所下降(Fig 2)。
|
| Fig 2 Time course of average percentage potentiation of IGly induced by 1 μmol·L-1 vitamin C during a 5-min period of continuous incubation and a 3-min period of drug wash out in HEK-293T cells transfected with GlyR α1, α2 and α3 subunits(x±s, n=6). **P < 0.01 vs α2 group, ##P < 0.01 vs α1 group. |
以上结果表明,1 μmol·L-1的VC可显著增强GlyRα1亚基和GlyRα3亚基的功能,而对GlyRα2亚基功能的作用十分微弱。并且GlyRα3亚基对VC的作用最为敏感。
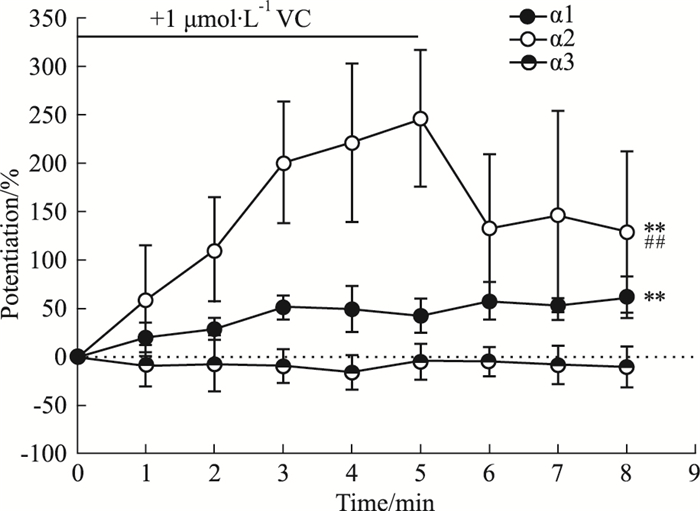
2.2 维生素C对甘氨酸受体功能的增强效果的量效关系我们首先记录转染了GlyR不同亚型的细胞在孵育VC前的IGly,然后分别对细胞孵育不同浓度的VC,同时记录IGly。结果表明,GlyRα1所介导的电流大小在不同浓度VC的作用下均有不同程度的增强(Fig 3A),并且VC浓度越高,VC对GlyRα1功能的增强效果越明显(Fig 3B)。GlyRα3的实验结果与GlyRα1的实验结果相类似,但VC对GlyRα3功能的增强效果明显大于对GlyRα1功能的增强效果,如在0.01 μmol·L-1 VC作用下,VC对GlyRα1功能的作用十分微弱,统计数值为(2.5±4.5)%,而VC对GlyRα3功能的增幅已经达到了(109.1±12.3)%(Fig 3E,F)。与GlyRα1,GlyRα3不同的是,VC为10 μmol·L-1时,才对GlyRα2功能表现出微弱的增强效果,增幅为(44.9±8.6)%(Fig 3C,D)。
|
| Fig 3 Effects of different concentrations of vitamin C on function of various subtypes of GlyRs (A-F) Trace records of IGly activated by EC2 glycine and bar graphs of VC induced potentiating effect on IGly in HEK-293T cells expressing GlyR α1 (A-B), α2 (C-D) and α3 subunits (E-F) before and after a 5-min continuous incubation with VC at different concentrations, n=6. **P < 0.01 vs control(VC=0.01 μmol·L-1), ##P < 0.01 vs control(VC=0.1 μmol·L-1). |
以上结果显示,VC对GlyR功能的增强效果存在着量效关系。与上述结果类似的是,GlyRα3亚基对VC的作用更为敏感。
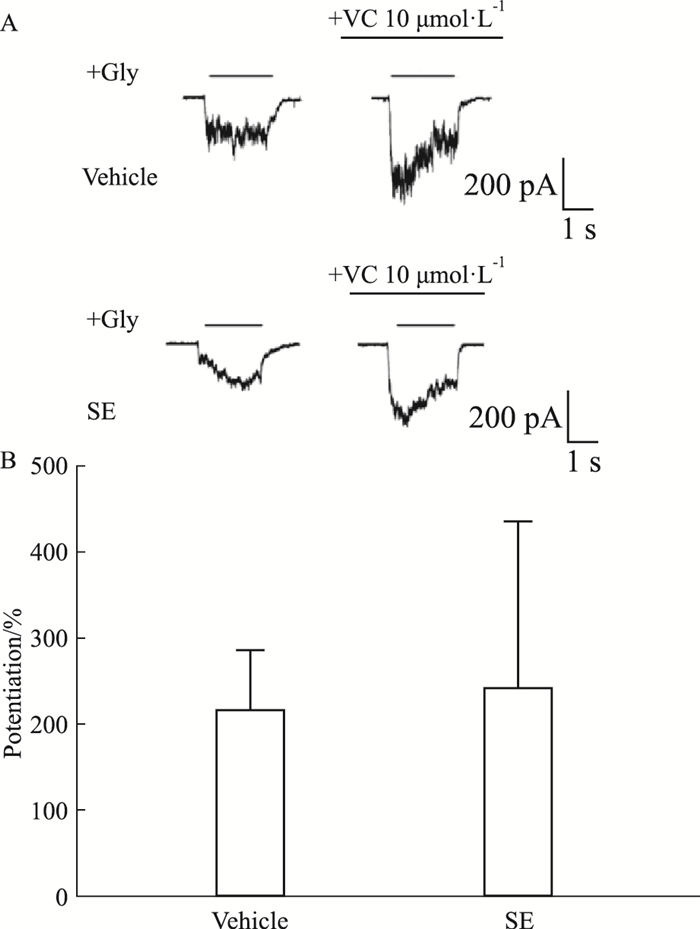
2.3 孵育磺吡酮不影响维生素C对甘氨酸受体的增强效果研究表明,VC可以通过细胞膜上的SVCT2进入细胞中。接下来的实验中我们参考前人的实验方法[13],对转染了GlyRα3的细胞施加1 mmol·L-1 SVCT2的特异性抑制剂磺吡酮(sulfinpyrazone,SE)以抑制SVCT2的功能,防止VC进入细胞内,然后再孵育10 μmol·L-1的VC,并记录IGly。我们发现,孵育SE并不会影响VC对GlyR功能的增强效果(Fig 4B)。
|
| Fig 4 Effects of SVCT2 blocker sulfinpyrazone on vitamin C induced potentiation of GlyRs (A-B) Trace records of IGly activated by EC2 glycine (A) and bar graphs of VC induced potentiating effect on IGly (B) in HEK-293T cells expressing GlyR α3 subunits with or without preincubation of 1 mmol·L-1 sulfinpyrazone, a SVCT2 inhibitor, n=6. |
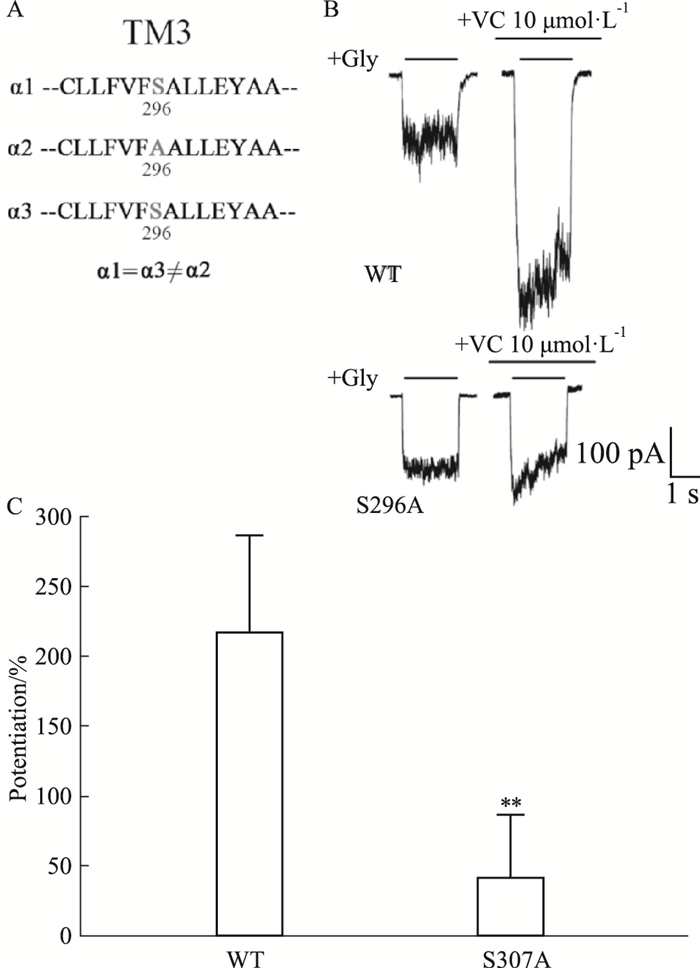
为了寻找VC作用于GlyR的具体位点,我们对GlyR不同亚型的跨膜序列进行了比对,根据VC对不同亚型GlyR功能增强效果的不同(VC对GlyRα1, GlyRα3功能存在增强效果,而对GlyRα2无增强效果),我们最终在GlyR第3跨膜结构域找到了相应位点,即第296位的氨基酸(在该位点α1,α3为丝氨酸S296,α2为丙氨酸A296)(Fig 5A)。为了验证该位点是否的确是VC的作用位点,我们以GlyRα3为例,将其第296位的丝氨酸突变为丙氨酸(GlyRα3 S296A),并将其质粒转入HEK-293T细胞中,然后再孵育10 μmol·L-1的VC,并记录IGly。结果显示,与野生型GlyRα3相比,10 μmol·L-1 VC对突变体GlyRα3 S296A介导的电流大小的增强效果明显下降(P < 0.05)(Fig 5B,C)。
|
| Fig 5 Effects of S296A mutation on vitamin C potentiation of GlyRα3 A.Amino acid alignment of the TM3 region flanking S296 (α3) or equivalent residues in the α1 and α2 subunits. (B-C) Trace records of IGly activated by EC2 glycine (B) and bar graphs of VC induced potentiating effect on IGly (C) in HEK-293T cells expressing wild-type (WT) and S296A mutant GlyR α3 subunits, n=6. **P < 0.01 vs WT group. |
以上结果表明,VC可能作用在GlyR的跨膜片段上,且第3跨膜片段的第296位的氨基酸在该相互作用中起关键作用。
3 讨论本实验中,通过在人工培养的HEK-293T细胞中转染表达GlyR的cDNA质粒,获得细胞膜上含有GlyR的HEK-293T细胞,然后采用单细胞膜片钳技术记录GlyR所介导的电流大小。实验中转染GlyR的HEK-293T细胞系,细胞膜边缘清晰、完整且细胞立体感强,说明细胞状态良好。电生理记录过程中,微玻璃电极与细胞膜之间易形成高阻封接,封接电阻平均大于1 GΩ,说明膜片钳封接稳定,所得电生理数据可靠。
GlyR是大型Cys-loop超家族的成员。激活后,GlyR可以选择性的通透氯离子,进而导致神经元超极化和介导中枢神经系统的抑制性的神经信号传递[6, 14]。GlyR功能正常与否对生物体有着巨大的影响,如家族性惊厥的患者中,GlyR均有不同程度的功能紊乱,这将引起患者肌肉反复抽搐或类似癫痫的症状[15]。
VC对中枢神经系统中多种离子通道的功能都有调节作用,如研究发现VC可以降低N-甲基-D-天冬氨酸受体激活后对神经元兴奋性的影响;VC可以通过清除胞外的谷氨酸进而降低谷氨酸受体激活后对细胞产生的毒性作用;VC还可以抑制多巴胺受体的功能[1]。但目前VC与GlyR之间的联系还尚不明确。本研究发现,VC可以增强GlyR的功能,且这一效果与VC浓度之间存在量效关系,这说明VC水平紊乱可能会引起GlyR功能的障碍,反之,通过调节中枢神经系统中VC的浓度水平来得以缓解。
综上所述,VC可以增强GlyR的功能,其增强效果对于不同亚型的GlyR都各不相同,并且这一作用可能并非是由于VC进入细胞内而产生的。本工作有助于加深对VC在中枢神经系统中生物学意义的认识,也为进一步研究VC与GlyR之间的关系提供实验依据。
| [1] |
Harrison F E, May J M. Vitamin C function in the brain: Vital role of the ascorbate transporter SVCT2[J]. Free Radic Biol Med, 2009, 46(6): 719-30. doi:10.1016/j.freeradbiomed.2008.12.018 |
| [2] |
Lee J Y, Chang M Y, Park C H, et al. Ascorbate-induced differentiation of embryonic cortical precursors into neurons and astrocytes[J]. J Neurosci Res, 2003, 73(2): 156-65. doi:10.1002/jnr.10647 |
| [3] |
Eldridge C F, Bunge M B, Bunge R P, et al. Differentiation of axon-related schwann cells in vitro. I. Ascorbic acid regulates basal lamina assembly and myelin formation[J]. J Cell Biol, 1987, 105(2): 1023-34. doi:10.1083/jcb.105.2.1023 |
| [4] |
Bowery N G, Smart T G. GABA and glycine as neurotransmitters: a brief history[J]. Br J Pharmacol, 2006, 147(S1): S109-19. doi:10.1038/sj.bjp.0706443 |
| [5] |
Betz H, Laube B. Glycine receptors: Recent insights into their structural organization and functional diversity[J]. J Neurochem, 2006, 97(6): 1600-10. doi:10.1111/j.1471-4159.2006.03908.x |
| [6] |
Dutertre S, Becker C M, Betz H. Inhibitory glycine receptors: An update[J]. J Biol Chem, 2012, 287(48): 40216-23. doi:10.1074/jbc.R112.408229 |
| [7] |
Breitinger U, Breitinger H G. Modulators of the inhibitory glycine receptor[J]. ACS Chem Neurosci, 2020, 11(12): 1706-25. doi:10.1021/acschemneuro.0c00054 |
| [8] |
李静, 杨洋, 肖涛, 等. 稳定表达hOAT1的HEK293细胞系的建立及鉴定[J]. 中国药理学通报, 2018, 34(10): 1471-6. Li J, Yang Y, Xiao T, et al. Establishment and identification of HEK293 cell lines with stable expression of hOAT1[J]. Chin Pharmacol Bull, 2018, 34(10): 1471-6. doi:10.3969/j.issn.1001-1978.2018.10.028 |
| [9] |
黄娟, 明露, 陈艳芬, 等. 稳定表达TRPA1通道的HEK-293T细胞模型的建立[J]. 中国药理学通报, 2019, 35(3): 440-3. Huang J, Ming L, Chen Y F, et al. Establishment of HEK-293T cell model stably expressing TRPV1 channel[J]. Chin Pharmacol Bull, 2019, 35(3): 440-3. |
| [10] |
de la Roche J, Leuwer M, Krampfl K, et al. 4-Chloropropofol enhances chloride currents in human hyperekplexic and artificial mutated glycine receptors[J]. BMC Neurol, 2012, 12: 104. doi:10.1186/1471-2377-12-104 |
| [11] |
de la Roche J, Buchholz V, Dengler R, et al. Paracetamol fails to positively modulate and directly activate chloride currents in human alpha1-glycine receptors[J]. Pharmacology, 2011, 87(1-2): 115-20. doi:10.1159/000323557 |
| [12] |
Haeseler G, Ahrens J, Krampfl K, et al. Structural features of phenol derivatives determining potency for activation of chloride currents via alpha(1) homomeric and alpha(1) beta heteromeric glycine receptors[J]. Br J Pharmacol, 2005, 145(7): 916-25. doi:10.1038/sj.bjp.0706254 |
| [13] |
Pierce M R, Raj A, Betke K M, et al. Sodium-dependent vitamin c transporter-2 mediates vitamin c transport at the cortical nerve terminal[J]. J Neurosci Res, 2015, 93(12): 1881-90. doi:10.1002/jnr.23669 |
| [14] |
Nemecz A, Prevost M S, Menny A, et al. Emerging molecular mechanisms of signal transduction in pentameric loigand-gated ion channels[J]. Neuron, 2016, 90(3): 452-70. doi:10.1016/j.neuron.2016.03.032 |
| [15] |
Andrew M, Owen M J. Hyperekplexia: abnormal startle response due to glycine receptor mutations[J]. Br J Psychiatry, 1997, 170: 106-8. doi:10.1192/bjp.170.2.106 |
