

2. 浙江省中医药研究院中药研究中心,浙江 杭州 310000
寿旦(1973-),女,博士,研究员,研究方向:中药学,通讯作者,E-mail:shoudanok@163.com
2. Dept of Medicine, Zhejiang Academy of Traditional Chinese Medicine, Hangzhou 310000, China
慢性骨髓炎(chronic osteomyelitis,CO)是一种涉及骨组织、骨髓、骨皮质及周围软组织的慢性炎症过程[1]。其发病机制复杂,在炎症刺激下成骨细胞与破骨细胞之间的平衡被打破[2],破骨细胞将死骨边缘吸收,成骨细胞不断分化包绕在死骨周边,最终导致局部血运差,骨愈合能力低下,造成骨量丢失[3]。而骨修复是CO治疗的主要难点之一。因此,探索副作用少、有效促进骨修复的药物对CO治疗具有积极意义。
中医学认为淫羊藿具有补肾壮阳,益精健骨的功效[4]。其对骨科疾病的治疗已有广泛的应用和确切的疗效证明。淫羊藿总黄酮(total flavones of epimedium,TFE)是由淫羊藿药材提取所得的黄酮单体类成分的总称,体内外实验结果证明,TFE是淫羊藿治疗骨伤类疾病的有效部位[5]。TFE可有效减缓骨质疏松大鼠骨丢失,增加骨密度,改善骨代谢[6]。课题组前期发现TFE对CO具有治疗作用[7]。然而其对CO骨修复的作用机制尚不明确。有研究报道,miRNA是骨损伤疾病最重要和最活跃的调控因子之一,一些miRNAs可以通过调控破骨细胞及成骨细胞功能参与骨损伤疾病的病理过程[8]。经前期试验研究在对兔慢性骨髓炎模型转录组测序后发现:模型组骨组织中miR-34a-5p水平较正常组显著下降。然而TFE调控miR-34a-5p治疗CO的机制尚未阐明。
本实验建立脂多糖(lipopolysaccharide,LPS)诱导的成骨细胞模型,运用生物信息学技术和双荧光素酶报告基因确定miR-34a-5p的靶基因。采用ELISA法检测细胞炎性因子,RT-PCR检测miR-34a-5p、SMAD2、Runt相关转录因子2(Runt-related transcriptionfactor 2,RUNX2)、碱性磷酸酶(alkaline phosphatase,ALP)mRNA表达,Western blot检测SMAD2、RUNX2、ALP蛋白表达。阐明TFE影响miR-34a-5p进而调控成骨相关因子促进骨修复的作用机制,为补肾中药治疗CO的机制提供新思路和新靶点。
1 材料 1.1 实验动物40只SPF级8周龄SD大鼠,♂,体质量(200±20) g,购于浙江省动物实验中心,动物实验许可证号:SYXK(浙)20190010。
1.2 药物与试剂中药淫羊藿购自浙江中医药大学饮片厂,经浙江省中医药研究院俞忠明副主任中药师鉴定,为小檗科淫羊藿属植物朝鲜淫羊藿Epimedium koreanum Nakai。胎牛血清、胰蛋白酶、DMEM培养基(美国Gibco公司);MTT、ELISA试剂盒(南京建成生物科技有限公司);全蛋白提取试剂盒、BCA蛋白定量试剂盒、茜素红染色试剂盒、碱性磷酸酶染色试剂盒(江苏凯基生物技术股份有限公司);TRIzol提取试剂盒(美国Ambion公司);反转录试剂盒、qPCR试剂盒(杭州博日科技有限公司);Real-time PCR引物(上海生工生物公司);miR-34a-5p mimics、miR-34a-5p inhibitor、miRNA Negative Control及双荧光素酶构建载体、LipofectamineTM2000转染试剂盒、双荧光素酶报告系统(中国上海吉玛制药技术有限公司);双荧光素酶报告基因检测试剂盒(上海翊圣生物科技有限公司);RUNX2抗体(bs-1134R)、SMAD2抗体(bs-0718R)、ALP抗体(bs-52252R)(北京博奥森生物技术有限公司);GAPDH抗体(ab181602)及辣根酶标记山羊抗兔IgG(ab6721)(英国Abcam公司)。
1.3 主要仪器CO2培养箱(美国Thermo Scientific公司);ECLIPSE TS100-F倒置显微镜(日本Nikon公司);MRZ14M010高速冷冻离心机(美国Beckman公司);SpectraMax190多功能酶标仪(上海美谷分子仪器有限公司);ChemiDocXRS凝胶成像仪(美国Bio-Rad公司);ABI7500实时荧光定量聚合酶链式反应(PCR)仪(美国Applied Biosystems公司);UV-2450紫外可见分光光度计(日本岛津公司)。
2 方法 2.1 TFE及含药血清制备朝鲜淫羊藿药材,粉碎过40目筛,精密称取药材粉末50 g,置于圆底烧瓶中,加8倍量70%乙醇,90 ℃水浴加热回流2次,每次2 h,趁热过滤,合并滤液。减压浓缩至生药浓度0.25 mg·L-1,经紫外可见分光光度计测得总黄酮含量为6.563%,提取液冰箱放置备用。取SD大鼠,参照文献方法制备含药血清[9]。将大鼠随机分为给药组和对照组。给药组每天给予2 mL TFE提取物150 mg·kg·d-1,连续灌胃1周。对照组灌胃给予等体积蒸馏水。末次给药后1 h,无菌条件下腹主动脉取血,4 000r·min-1离心15 min分离血清,56 ℃水浴灭活30 min,0.22 μm微孔滤膜过滤,-20 ℃保存备用。
2.2 原代成骨细胞的制备及分组以新生大鼠颅盖骨制备原代大鼠成骨细胞,培养于含10%胎牛血清,100 kU·L-1双抗的DMEM高糖培养基中。以10 mg·L-1 LPS干预成骨细胞为模型组;DMEM高糖培养基培养为正常对照组;TFE含药血清组在给予LPS的同时给予TFE含药血清(5%、10%、15%, 20%)。
2.3 MTT法测定细胞活性取第3代生长良好的大鼠成骨细胞,以2×107个·L-1接种于96孔培养板,培养24 h后,按实验分组分别加入不同的培养基100 μL。继续培养48 h后,每孔加入20 μL MTT试液,4 h后弃去MTT及培养基,每孔加入150 μL DMSO,振荡10 min。在490 nm测定吸光度(A),按照公式计算细胞存活率:细胞存活率/%= (A实验组/A对照组)×100%。
2.4 成骨细胞碱性磷酸酶合成及钙沉积的测定取对数生长期的成骨细胞,接种于6孔板中,每孔2 mL,培养24 h后,更换无血清的DMEM培养基培养12 h。将细胞随机分3组:正常对照组、模型组(LPS 10 mg·L-1)、TFE含药血清组(10%),隔天换液。继续培养48 h后,按照碱性磷酸酶试剂盒操作说明进行染色,培养14 d后进行茜素红染色。
2.5 ELISA法检测炎性因子表达的影响各组细胞培养48 h后,收集、离心取上清,按照试剂盒说明书,用ELISA检测试剂盒测定白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、骨钙素(osteocalcin,OC)的表达。
2.6 荧光素酶报告质粒的构建和荧光素酶活性分析运用TargetScan、PicTar、MiRBase、BibiServ、Tarbase等多个生物信息学软件,对miR-34a-5p潜在的靶基因进行预测分析,确定SMAD2为miR-34a-5p的潜在靶基因。构建野生型和突变型基因靶点SAMD2的3′UTR荧光素酶表达载体(WT-SAMD2和MUT-SMAD2),GP-miRGLO空白载体质粒作为对照。实验分为4组:共转染野生型SMAD2+miR-34a-5p mimics组、共转染野生型SMAD2+ NC组、突变型SMAD2+miR-34a-5p mimics组、突变型SMAD2+NC组。使用LipofectamineTM2000共转染进HEK293T细胞,转染24 h后收集细胞,用双荧光素酶报告基因检测试剂盒测量荧光素酶活性。
2.7 细胞转染将成骨细胞接种于6孔板中,接种密度为40%~60%,在不含双抗的10%FBS DMEM培养基中培养24 h后,使用LipofectamineTM2000转染试剂向成骨细胞转染miR-34a-5p mimics与miR-34a-5p inhibitor。转染6 h后,分别更换相应培养基继续培养48 h后,收集细胞进行后续实验。细胞分组如下:正常对照组,LPS模型组(培养液加入LPS 10 mg·L-1)、mimics NC组(mimics NC+LPS)、miR-34a-5p组(miR-34a-5p mimics+LPS)、TFE含药血清组(LPS+TFE)、inhibitor NC组(inhibitor NC+LPS+TFE)、miR-34a-5p inhibitor组(miR-34a-5p inhibitor+LPS+ TFE)。
2.8 RT-PCR检测成骨细胞各组转染前后RUNX2、ALP、miR-34a-5p、SMAD2 mRNA表达水平按TRIzol说明书提取细胞总RNA,按照逆转录试剂盒说明书进行反转录。荧光定量PCR反应体系为:SYBRPremix10 μL,上下游引物各1 μL,cDNA产物稀释10倍后加入2 μL,ddH2O 6 μL。反应在7500荧光定量PCR仪上进行,扩增程序为:94 ℃ 2 min;94 ℃ 10 s;60 ℃ 15 s;72 ℃ 30 s,共40个循环。引物如下:miR-34a-5p上游引物5′-TGCGCTGGC AGTGTCTTAGCTG-3′,下游引物5′-CCAGTGCAG GGTCCGAGGTA-3′;SMAD2上游引物5′-CTCTCCG GCTGAACTGTCTC-3′,下游引物5′-GCCGTCTACAG TGAGTGAGG-3′;RUNX2上游引物5′-CATGGCCG GGAATGATGAG-3′,下游引物5′-TGTGAAGACCGT TATGGTCAAAGTG-3′;ALP上游引物5′-CATCGCC TATCAGCTAATGCACA-3′,下游引物5′-ATGAGGT CCAGGCCATCCAG-3′;U6上游引物5′-CGCTTCAC GAATTTGCGTGTCAT-3′,下游引物5′-CAAAGTGCT TACAGTGCAGGTAG-3′;β-actin上游引物5′-GGA GATTACTGCCCTGGCTCCTA-3′,下游引物5′-GACT CATCGTACTCCTGCTTGCTG-3′。
2.9 Western blot检测成骨细胞各组转染前后SMAD2、ALP、RUNX2蛋白的表达收集培养48 h的各组细胞,裂解并提取细胞总蛋白,BCA法测定蛋白浓度,并在99 ℃下变性5 min。每组取蛋白质样本20 μg,12%聚丙烯酰胺凝胶电泳分离蛋白,转移至聚偏二氟乙烯膜(PVDF)。室温下,5% BSA封闭0.5 h,封闭后与1 :1 000稀释的一抗(SMAD2、ALP、RUNX2、GAPDH抗体)4 ℃孵育过夜。次日加入对应的二抗室温孵育1 h,PBS洗涤3次,用化学发光底物试剂检测,BioRad系统曝光。用Image Lab软件对蛋白灰度值进行分析。
2.10 统计学处理采用SPSS 22.0统计软件进行数据分析。所有数据以x±s表示,采用单因素方差分析进行组间比较。
3 结果 3.1 MTT检测成骨细胞增殖率的比较MTT法检测结果显示(Fig 1),与正常成骨细胞组比较,模型组(LPS 10 mg·L-1)诱导的成骨细胞存活率下降至53.55% (P < 0.01),降低程度适中,重复性好。与模型组相比,TFE含药血清作用浓度为10%时,细胞活力最高,为77.38%。

|
| Fig 1 Effect of TFE-containing serum on survival rate of LPS-induced osteoblasts(x±s, n=3) **P < 0.01 vs control groups; ##P < 0.01 vs model groups |
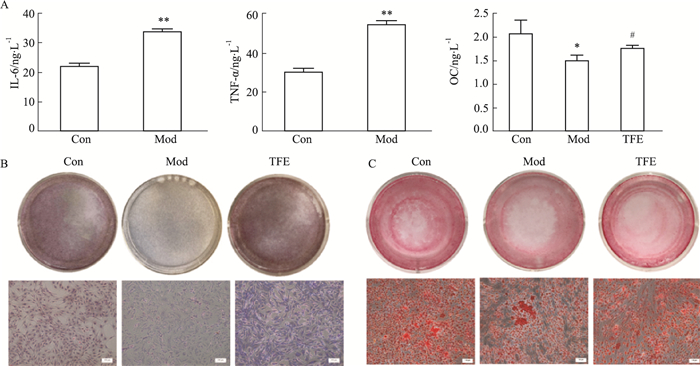
ELISA结果表明,LPS诱导的成骨细胞IL-6和TNF-α炎性因子表达水平增加(P < 0.01)(Fig 2A)。与正常组相比,模型组骨钙素分泌减少,10% TFE含药血清作用细胞48 h后,骨钙素质量浓度高于LPS组(P < 0.05)。碱性磷酸酶染色结果显示,模型组碱性磷酸酶表达减弱,TFE作用后促进碱性磷酸酶的表达(Fig 2B)。茜素红染色结果显示,LPS抑制大鼠成骨细胞钙结节形成,TFE含药血清组钙结节较模型组增加(Fig 2C)。
|
| Fig 2 Expression of IL-6, TNF-α, OC, alkaline phosphatase, and calcium nodules in osteoblasts(x±s, n=3) A: IL-6, TNF-a and OC activity were detected by ELISA; B: ALP staining was performed on day 2; C: Alizarin red staining was performed to indicate mineral deposition on day 14. *P < 0.05, **P < 0.01 vs control groups; #P < 0.05, ##P < 0.01 vs model groups |
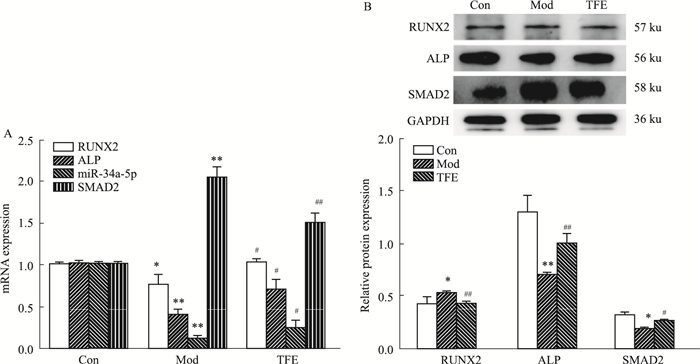
与正常对照组相比,模型组miR-34a-5p mRNA,RUNX2、ALP mRNA及蛋白表达降低,SMAD2 mRNA及蛋白表达升高(P < 0.05)。与模型组相比,TFE含药血清组miR-34a-5p mRNA,RUNX2、ALP mRNA及蛋白表达升高,SMAD2 mRNA及蛋白表达降低(P < 0.05)(Fig 3A, B)。以上结果表明,TFE能上调LPS诱导的成骨细胞miR-34a-5p水平,下调SMAD2蛋白表达,并促进相关成骨因子ALP、RUNX2的表达。
|
| Fig 3 Effect of TFE-containing serum on RUNX2, ALP, miR-34a-5p, SMAD2 mRNA and protein expression in LPS-induced osteoblasts(x±s, n=3) A: RT-PCR was performed to analyze the expressions of RUNX2, ALP, miR-34a-5p, SMAD2 mRNA. B: Western blot research showed the protein levels of RUNX2, ALP, SMAD2, *P < 0.05, **P < 0.01 vs control groups; #P < 0.05, ##P < 0.01 vs model groups. |
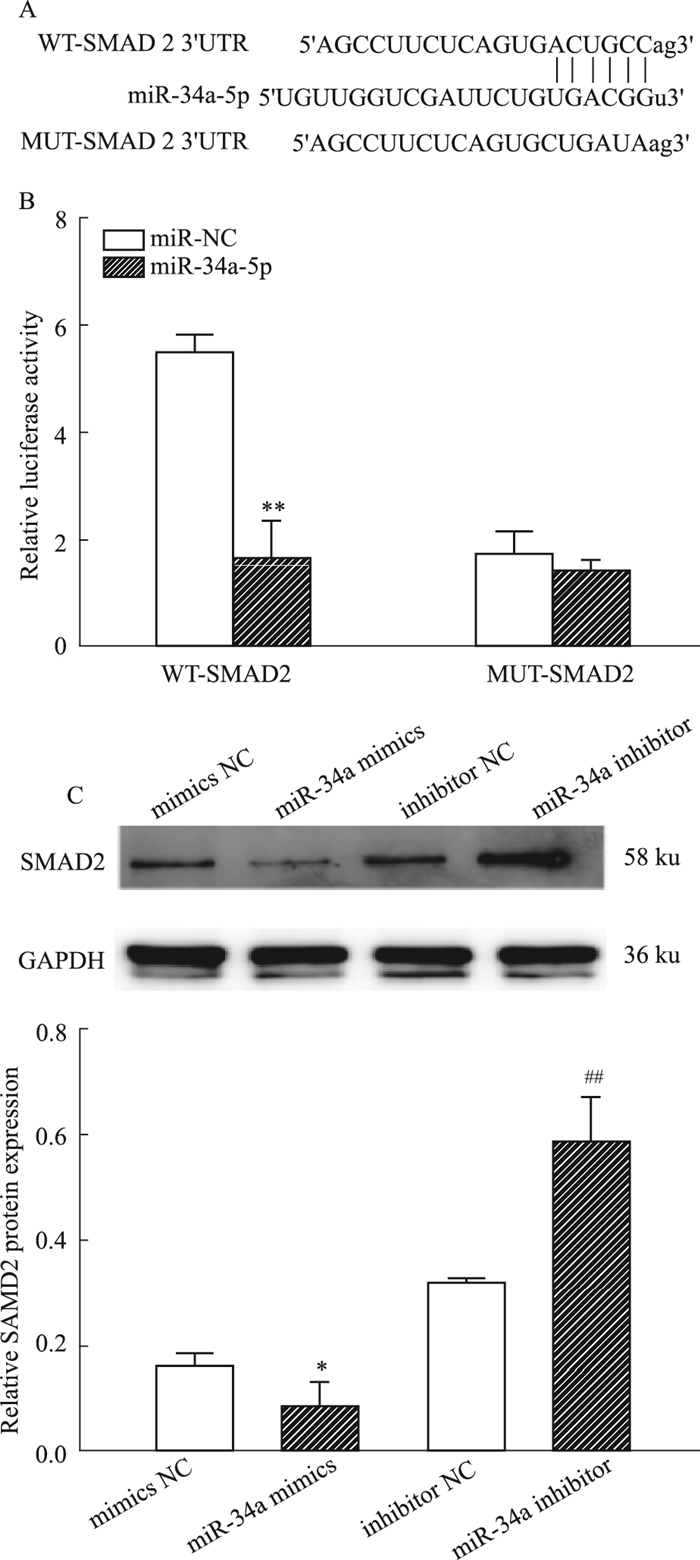
生物信息学软件Targetscan等预测miRNA靶序列,确定miR-34a-5p的潜在靶基因为SMAD2(Fig 4A)。双荧光素酶报告系统结果显示,与阴性对照组比较,miR-34a-5p模拟物组可抑制与SMAD2 3’UTR融合的荧光素酶报告基因(P < 0.01)(Fig 4B)。Western blot结果发现,与mimics NC组比较,miR-34a-5p mimics组的SMAD2蛋白表达量降低(P < 0.05);与inhibitor NC组比较,miR-34a-5p inhibitor组的SMAD2蛋白表达量升高(P < 0.05)(Fig 4C),提示miR-34a-5p可以直接靶向调节SMAD2的表达。
|
| Fig 4 SMAD2 expression inhibited by miR-34a-5p via binding to its 3' UTR(x±s, n=3) A: Diagram of putative miR-34a-5p binding sequence in SMAD2 3′UTR and its mutant in luciferase reporter assay. B: Luciferase reporter assay was performed to measure luciferase activity in osteoblasts. C: Western blot analysis of SMAD2 protein level in osteoblasts. *P < 0.05, **P < 0.01 vs mimics NC groups; #P < 0.05, ##P < 0.01 vs inhibitor NC groups. |
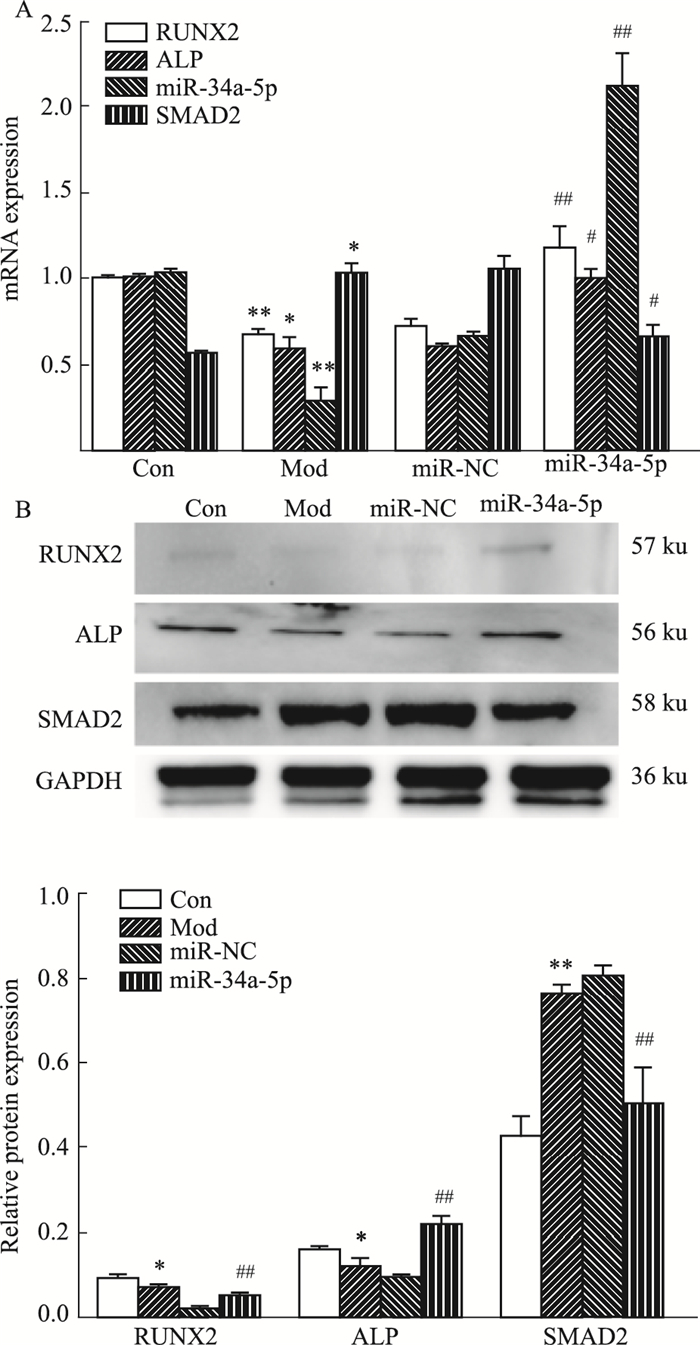
与正常对照组比较,模型组miR-34a-5p mRNA,RUNX2、ALPmRNA及蛋白表达降低,SMAD2 mRNA及蛋白表达增加(P < 0.05)。与模型组比较,miR-34a-5p组miR-34a-5p mRNA,RUNX2、ALPmRNA及蛋白表达明显增加,SMAD2mRNA及蛋白表达明显降低(P < 0.05)(Fig 5A, B)。
|
| Fig 5 Effect of overexpression of miR-34a-5p on RUNX2, ALP, SAMD2, miR-34a-5p mRNA expression in LPS-induced osteoblasts (x±s, n=3) A, B: qRT-PCR and Western blot were performed to analyze the mRNA and protein levels of osteogenic-specific markers after transfection of miR-34a-5p mimics. *P < 0.05, **P < 0.01 vs control groups; #P < 0.05, ##P < 0.01 vs model groups. |
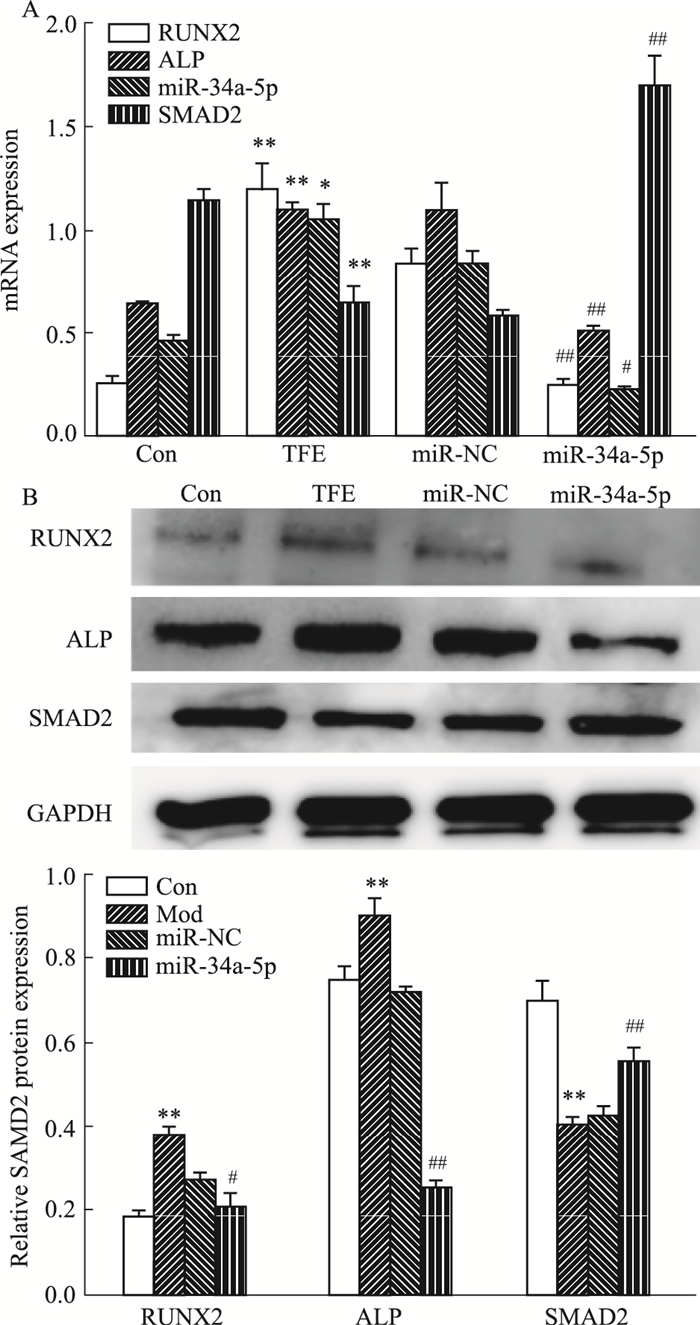
结果如Fig 6A和B所示,与模型组相比,TFE组miR-34a-5p mRNA,RUNX2、ALP mRNA及蛋白表达升高,SMAD2mRNA表达降低(P < 0.05),但抑制miR-34a-5p能消除上述作用。
|
| Fig 6 Effect of TFE-containing serum on RUNX2, ALP, SAMD2, miR-34a-5p mRNA expression in LPS-induced osteoblasts after inhibition of miR-34a-5p(x±s, n=3) A, B: RT-PCR and Western blot were performed to analyze the mRNA and protein levels of osteogenic-specific markers after miR-34a-5p inhibitor transfection.*P < 0.05, **P < 0.01 vs model groups; #P < 0.05, ##P < 0.01 vs TFE-containing serum groups. |
CO具有发病率高、肢残率髙、反复发作、治疗难度大等特点,严重影响患者的生活质量及生命安全。目前,根除骨感染和病灶清除后骨缺损的修复仍然是治疗CO的主要挑战[10]。研究表明TFE可通过多靶点多途径有效发挥骨保护作用。TFE不仅能够刺激成骨细胞的增殖,还能提高其矿化成熟能力[11-12],淫羊藿苷[13]可促进骨髓间充质干细胞成软骨分化并抑制破骨细胞活性。本研究发现,TFE可调控LPS诱导的大鼠成骨细胞ALP表达,提高OC活性,减轻成骨细胞损伤。
研究发现[14],miR-34a是一种内源性破骨细胞抑制剂,可通过抑制Tgif2来间接抑制OPG/RANK/RANKL通路,达到抑制破骨细胞增殖、分化的作用。此外,miR-34a可以抑制LPS诱导的巨噬细胞炎症应答,抑制破骨细胞的形成,从而改善骨质疏松,并且可以促进骨髓间充质干细胞及脂肪干细胞成骨分化[15]。本研究结果表明,TFE可上调LPS诱导的成骨细胞miR-34a-5p表达。生物信息学提示,SMAD2是miR-34a-5p的靶基因。SMAD2是转化生长因子β(transforming growth factor beta,TGF-β)超家族主要成员之一,属于受体调节型Smads (R-Smads),SMAD蛋白作为关键的细胞内信使,可将细胞外信号转导至细胞核,进而激活下游基因转录。SMAD2被TGF-β受体激活并诱导TGF-β反应,充当成骨和骨再生的调节剂。研究发现,SMAD2的下调可以上调ALP、RUNX2等成骨基因的表达,促进骨髓间充质干细胞向成骨细胞分化[16]。本实验研究发现,在LPS诱导的大鼠成骨细胞中,TFE含药血清作用后抑制了SMAD2mRNA和蛋白表达,并促进ALP和RUNX2蛋白表达,进而增加成骨细胞成骨能力,减轻成骨细胞损伤。miR-34a-5p inhibitor转染细胞后ALP、RUNX2 mRNA与蛋白降低,SMAD2 mRNA与蛋白表达量升高,表明抑制miR-34a-5p表达逆转了TFE对LPS诱导的大鼠成骨细胞损伤的保护作用。
综上所述,TFE通过促进miR-34a-5p表达,靶向抑制SMAD2蛋白表达,促进成骨细胞ALP和RUNX2蛋白表达,进而促进成骨细胞活性,减轻LPS诱导大鼠成骨细胞损伤的作用机制。
| [1] |
Govaert G A, IJpma F F, McNally M, et al. Accuracy of diagnostic imaging modalities for peripheral post-traumatic osteomyelitis-a systematic review of the recent literature[J]. Eur J Nucl Med Mol Imaging, 2017, 44(8): 1393-407. |
| [2] |
Ramraj R, Chun C, Marcovici P. Chronic recurrent multifocal osteomyelitis in Crohn's Disease-Complete resolution with anti TNF-α therapy[J]. J Pediatr Gastroenterol Nutr, 2018, 67(3): e57. |
| [3] |
Meent M M V D, Wetselaar-Glas M J M, Fiocco M, et al. Non-surgical treatment of adults with chronic diffuse sclerosing osteomyelitis/tendoperiostitis of the mandible[J]. J Craniomaxillofac Surg, 2019, 47(12): 1922-8. |
| [4] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社, 2015: 21. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[S]. Beijing: Chin Med Sci Technol Press, 2015: 21. |
| [5] |
戈勋, 曹广尚, 孙洪胜, 等. 淫羊藿活性成分促进骨细胞增殖分化研究进展[J]. 中国实验方剂学杂志, 2018, 24(3): 228-34. Ge X, Cao G S, Sun H S, et al. Effect of active components of Epimedii folium in promoting proliferation and differentiation of osteoblasts[J]. Chin J Exper Tradit Med Formul, 2018, 24(3): 228-34. |
| [6] |
汪小飞, 李晶晶. 淫羊藿总黄酮对老年骨质疏松大鼠Notch和Smads通路蛋白表达的影响[J]. 中国中医骨伤科杂志, 2019, 27(2): 1-5. Wang X F, Li J J. The influence of total flavonoids from Herba Epimedii on the protein expression of Notch and Smads signal pathway in senile osteoporosis rats model[J]. Chin J Tradit Med Traumatol Orthop, 2019, 27(2): 1-5. |
| [7] |
Shou D, Zhang Y, Shen L F, et al. Flavonoids of Herba Epimedii enhances bone repair in a rabbit model of chronic osteomyelitis during post-infection treatment and stimulates osteoblast proliferation in vitro[J]. Phytother Res, 2017, 31(2): 330-9. |
| [8] |
Fang S J, Deng Y, Gu P, et al. MicroRNAs regulate bone development and regeneration[J]. Int J Mol Sci, 2015, 16(4): 8227-53. |
| [9] |
陈云刚, 谭国庆, 任维龙, 等. 骨碎补含药血清经wnt/β-catenin信号通路对大鼠骨髓间充质干细胞成骨分化的影响[J]. 中国药理学通报, 2017, 33(6): 830-6. Chen Y G, Tan G Q, Ren W L, et al. Effect of rhizoma drynariae drug-containing serum on osteogenic differentiation of bone marrow mesenchymal stem cells by wnt/beta-catenin signaling pathway[J]. Chin Pharmacol Bull, 2017, 33(6): 830-6. |
| [10] |
Uskokovi V. Nanostructured platforms for the sustained and local delivery of antibiotics in the treatment of osteomyelitis[J]. Crit Rev Ther Drug Carrier Syst, 2015, 32(1): 1-59. |
| [11] |
Cao H, Ke Y, Zhang Y, et al. Icariin stimulates MC3T3-E1 cell proliferation and differentiation through up-regulation of bone morphogenetic protein-2[J]. Int J Mol Med, 2012, 29(3): 435-9. |
| [12] |
Yin X X, Chen Z Q, Liu Z J, et al. Icariine stimulates proliferation and differentiation of human osteoblasts by increasing production of bone morphogenetic protein2[J]. Chin Med J (Engl), 2007, 120(3): 204-10. |
| [13] |
Zhang D W, Fong C C, Jia Z B, et al. Icariin stimulates differentiation and suppresses adipocytictransdifferentiation of primary osteoblasts through estrogen receptor-mediated pathway[J]. Calcif Tissue Int, 2016, 99(2): 187-98. |
| [14] |
Krzeszinski J Y, Wei W, Huynh H D, et al. miR-34a blocks osteoporosisand bone metastasis by inhibiting osteoclastogenesis and Tgif2[J]. Nature, 2014, 512(7515): 431-5. |
| [15] |
高涵. miR-34a对健康及感染状态下MG63细胞成骨分化的影响[D].长春: 吉林大学, 2017. Gao H. Effects of miR-34a on osteogenic differentiation of MG63 cells inhealthy and infected conditions[D].Changchun: Jilin University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10183-1017148801.htm |
| [16] |
Li H L, Fan J F, Fan L Y, et al. MiRNA-10b reciprocally stimulates osteogenesis and inhibits adipogenesis partly through the TGF-β/SMAD2 signaling pathway[J]. Aging Dis, 2018, 9(6): 1058-73. |

