


2. 潍坊医学院 护理学院,山东 潍坊 261053;
3. 潍坊医学院 医学研究实验中心,山东 潍坊 261053
 ,
ZHENG Quan1,
CHE Xing-nian1,
ZHANG Li-ping1,
ZHOU Dan-dan1,
YIN Chong-gao2,
LI Hong-li3,
LIU Yu-qing1
,
ZHENG Quan1,
CHE Xing-nian1,
ZHANG Li-ping1,
ZHOU Dan-dan1,
YIN Chong-gao2,
LI Hong-li3,
LIU Yu-qing1

2. College of Nursing, Weifang Medical University, Weifang Shandong 261053, China;
3. Medical Research Center, Weifang Medical University, Weifang Shandong 261053, China
在过去的30年间,癌症的总死亡率持续下降27%,使实际癌症死亡人数比死亡率保持在高峰时期的预期死亡人数减少约200万人[1]。大多数癌症的存活率呈稳步上升趋势,与之相比,肺癌的进展一直比较缓慢,部分原因是超过半数病例在晚期阶段才得以诊断,肺癌相关死亡以≥40岁男性和60岁女性为主;另一方面则由于侵袭转移,肺癌患者死亡率居高不下[2]。肺腺癌是肺癌中占比最多的组织学类型,是发病率最高的肺癌类型之一,其死亡率也较高。
上皮-间充质转化(epithelial mesenchymal transition,EMT)的主要特征是胞间粘附的丧失,以致迁移侵袭能力增加。从静止上皮细胞到活动间充质细胞的反式分化对于胚胎发生、纤维化、组织修复、伤口愈合和肿瘤进展至关重要[3]。在癌症中,EMT多发生在转移的初始阶段,而肺癌的诊断大多在晚期阶段,化疗耐药性使其治疗难度增加[4]。因而更有潜力的标志物和替代治疗手段愈加需要。在人类基因组中,长链非编码RNA-H19(long non-coding RNA-H19,LncRNA-H19)定位于11p15.5[5]。在癌症中,LncRNA-H19通常高表达,并与癌症发展的许多方面有关[6]。LncRNA-H19可促进肺癌细胞的耐药性或调控miRNA从而促进肺癌细胞的凋亡等[7-8],但其是否参与肺腺癌的淋巴结转移或远处转移以及侵袭转移的机制仍未完全清楚。因此本研究通过检测LncRNA-H19在伴或不伴淋巴结转移的肺腺癌组织中的表达情况,探讨LncRNA-H19对肺腺癌细胞增殖侵袭能力的影响,为预防肺腺癌的侵袭转移提供潜在靶点。
1 材料与方法 1.1 材料 1.1.1 主要试剂QuantiNova SYBR Green PCR Kit购自德国Qiagen公司,Transwell小室购自Corning公司,Matrigel购自BD公司,抗体鼠抗人β-actin单抗(ab8226)(1:1 000)、鼠抗人E-cadherin单抗(ab1416)(1 :500)、鼠抗人Vimentin单抗(ab8978)(1 :1 000)购自Abcam公司。
1.1.2 组织样本收集伴或不伴淋巴结转移的肺腺癌组织各32例。患者为2014年1月~2018年1月于潍坊医学院附属医院就诊,肺腺癌病理诊断明确。所有纳入研究的患者均签署知情同意书,术前未接受放化疗。
1.1.3 仪器高速低温离心机、CO2培养箱、ABI 7500 FAST Real-Time PCR仪(Thermo Fisher Scientific公司),双垂直电泳槽、梯度PCR仪(Bio-Rad公司)。
1.2 方法 1.2.1 细胞培养人肺腺癌细胞NCI-H1299和A549分别使用RPMI 1640培养基和Ham's F-12K培养基并含体积分数为0.1的胎牛血清,人正常肺支气管上皮细胞BEAS-2B使用DMEM培养基含体积分数为0.1的胎牛血清,均于5% CO2,37 ℃培养箱中培养。将细胞分组,1) NCI-H1299组:常规培养,不做任何处理;2) NCI-H1299/Si-NC组:转入敲减对照质粒;3) NCI-H1299/Si-LncRNA-H19组:转入LncRNA-H19敲减质粒;4) A549组:常规培养,不做任何处理;5) A549/NC组:转入过表达对照质粒;6) A549/LncRNA-H19组:转入LncRNA-H19过表达质粒。
1.2.2 实时荧光定量PCR转染24 h后,TRIzol法提取各组细胞的总RNA,逆转录后使用QuantiNova SYBR Green PCR Kit进行聚合酶链式反应。引物序列如下:LncRNA-H19上游引物:5′-CAGTGG ACTTGGTGACGCTGTATG-3′,下游引物:5′-CGCC TCGCCTAGTCTGGTCTC-3′;GAPDH上游引物:5′-G TTGGAGGTCGGAGTCAACGG-3′,下游引物:5′-GAG GGATCTCGCTCCTGGAGGA-3′。GAPDH作为内参,3次独立重复实验。
1.2.3 CCK-8增殖实验收集各组细胞,每组设置4个复孔,每孔2×103个细胞铺于96孔板中。常规培养,分别在d 1、d 2、d 3和d 4加入10 μL CCK-8溶液,孵育1 h后测定450 nm处的吸光度。3次独立重复实验。
1.2.4 Transwell侵袭实验实验步骤参照课题组文献[9]。37 ℃ 5% CO2孵育24 h后,PBS洗涤上室,使用100%甲醇固定,配制Giemsa染色液对细胞进行染色,显微镜下拍照。随机选取6个视野拍照并进行统计学分析。3次独立重复实验。
1.2.5 Western blot实验提取各组转染细胞的总蛋白,用于SDS-PAGE凝胶电泳。按照相应抗体的稀释度在5%阻断缓冲液中制备一抗。4 ℃孵育过夜后室温洗涤,二抗孵育1 h。洗涤后,使用ECL化学发光液显影。β-actin作为内参,3次独立重复实验。
1.2.6 统计学分析收集实验所得数据,使用SPSS 24.0进行统计学分析。两独立样本t检验应用于计量资料的两组间比较,单因素方差分析用于多组间比较。
2 结果 2.1 伴有淋巴结转移的肺腺癌组织与不伴淋巴结转移的肺腺癌组织相比LncRNA-H19表达上调分别收集伴或不伴淋巴结转移的肺腺癌组织各32例,分别检测样本中LncRNA-H19的表达量,如Fig 1所示,LncRNA-H19在伴有淋巴结转移的肺腺癌组织中的表达量明显高于不伴淋巴结转移的肺腺癌组织(P < 0.05)。
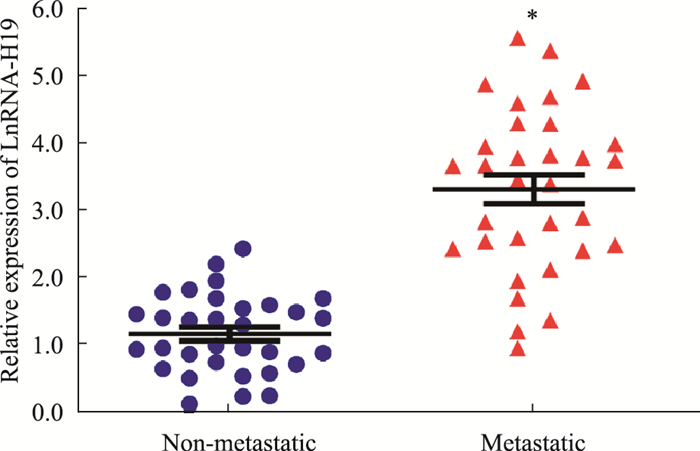
|
| Fig 1 The relative expression of LncRNA-H19 in non-metastatic and metastatic lung adenocarcinoma tissues detected by qRT-PCR(x±s, n=32) *P < 0.05 vs non-metastatic group. |
qRT-PCR检测LncRNA-H19在正常肺支气管上皮细胞BEAS-2B,肺腺癌细胞A549及NCI-H1299中的表达量。如Fig 2所示,与BEAS-2B相比,LncRNA-H19在A549及NCI-H1299中的表达量均明显升高,并且NCI-H1299中LncRNA-H19的表达量高于A549(P < 0.05)。
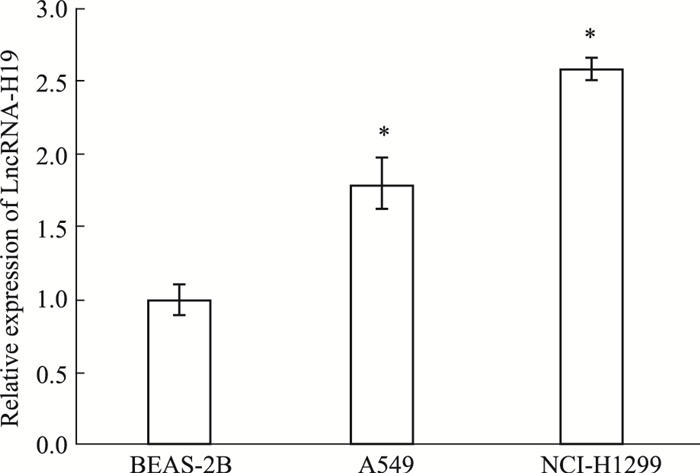
|
| Fig 2 The relative expression of LncRNA-H19 in BEAS-2B, A549 and NCI-H1299 (x±s, n=3) *P < 0.05 vs BEAS-2B group. |
由于LncRNA-H19在NCI-H1299中的表达量高于A549,我们分别对NCI-H1299及A549转染敲减或过表达质粒,并应用qRT-PCR检测转染效率。如Fig 3所示,转染敲减质粒的NCI-H1299细胞中LncRNA-H19的表达量明显降低,与之相反,LncRNA-H19在转染过表达质粒的A549细胞中显著升高,表明转染成功(P < 0.05)。
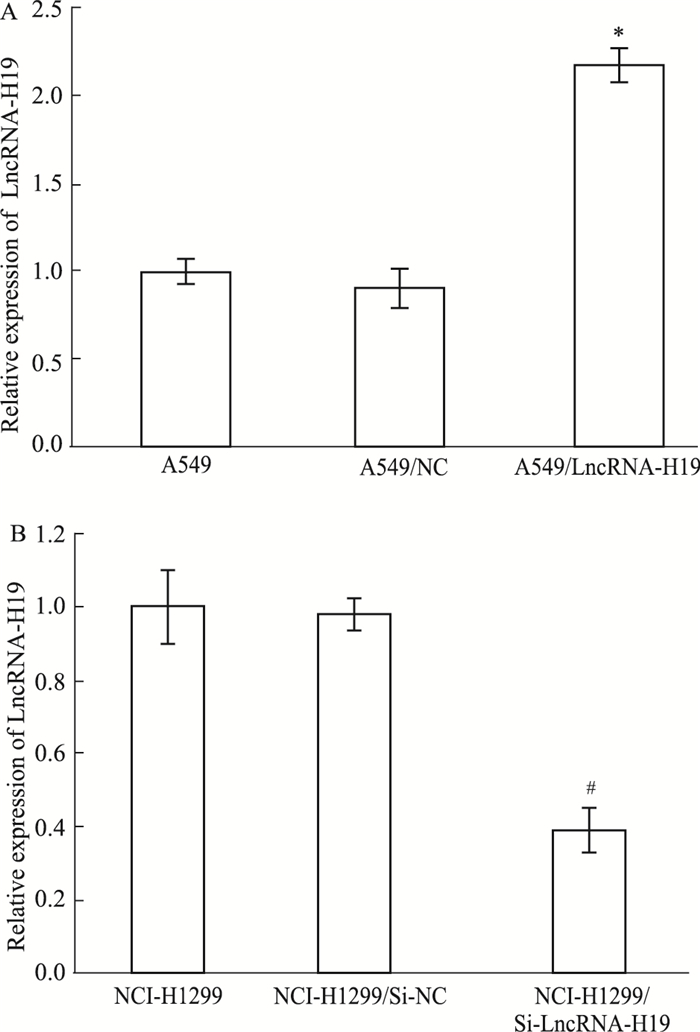
|
| Fig 3 The relative expression of LncRNA-H19 in different lung adenocarcinoma cells(x±s, n=3) A:Expression of LncRNA-H19 in A549 cells, A549/NC and A549/LncRNA-H19 cells; B:Expression of LncRNA-H19 in NCI-H1299 cells, NCI-H1299/Si-NC and NCI-H1299/Si-LncRNA-H19 cells. *P < 0.05 vs A549/NC cells. #P < 0.05 vs NCI-H1299/Si-NC group. |
通过CCK-8增殖实验检测敲减或过表达LncRNA-H19对肺腺癌细胞增殖能力的影响,如Fig 4所示,与A549组及A549/NC组相比,A549/LncRNA-H19组随时间增加吸光度明显升高,表明该组增殖能力升高,而NCI-H1299/Si-LncRNA-H19组吸光度相较NCI-H1299组及NCI-H1299/Si-NC组明显降低,表明增殖能力受到抑制(P < 0.05)。结果表明,LncRNA-H19对肺腺癌细胞的增殖能力有促进作用。
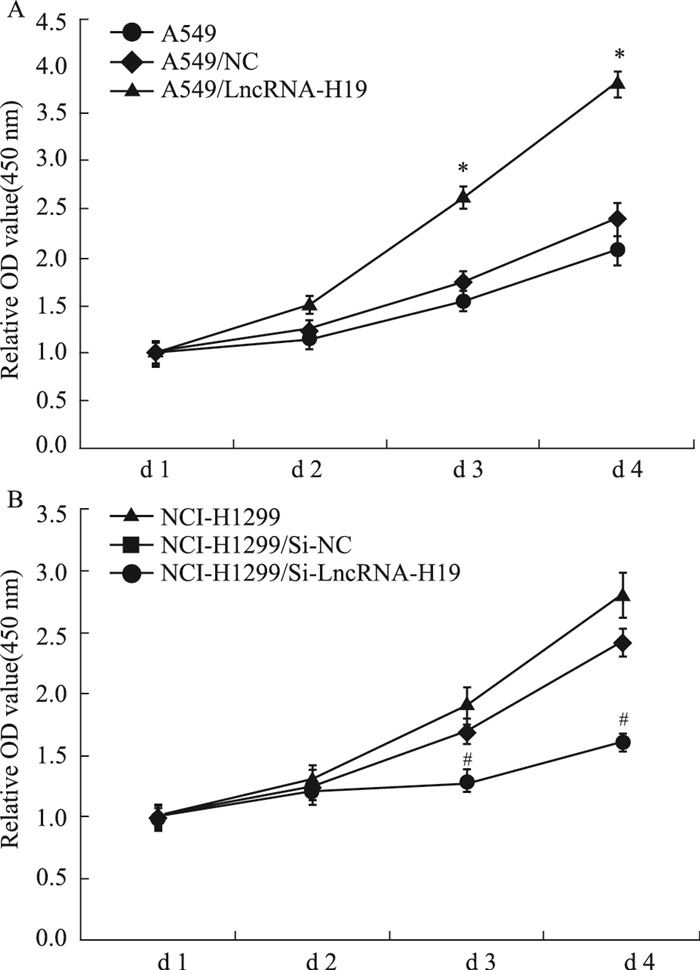
|
| Fig 4 The proliferation ability of lung adenocarcinoma cells after transfection(x±s, n=3) A: Relative OD value of indicated groups of A549 cells; B: Relative OD value of indicated groups of NCI-H1299 cells. *P < 0.05 vs A549/NC group. #P < 0.05 vs NCI-H1299/Si-NC group. |
使用Transwell侵袭实验检测敲减或过表达LncRNA-H19后肺腺癌细胞侵袭能力的变化,如Fig 5所示,NCI-H1299/Si-LncRNA-H19组穿过小室基质胶的细胞数比NCI-H1299/Si-NC组及NCI-H1299组显著减少,而A549/LncRNA-H19组与A549/NC组及A549组相比,细胞数则明显增加(P < 0.05,差异具有统计学意义)。实验表明,LncRNA-H19对肺腺癌细胞的侵袭能力有促进作用。
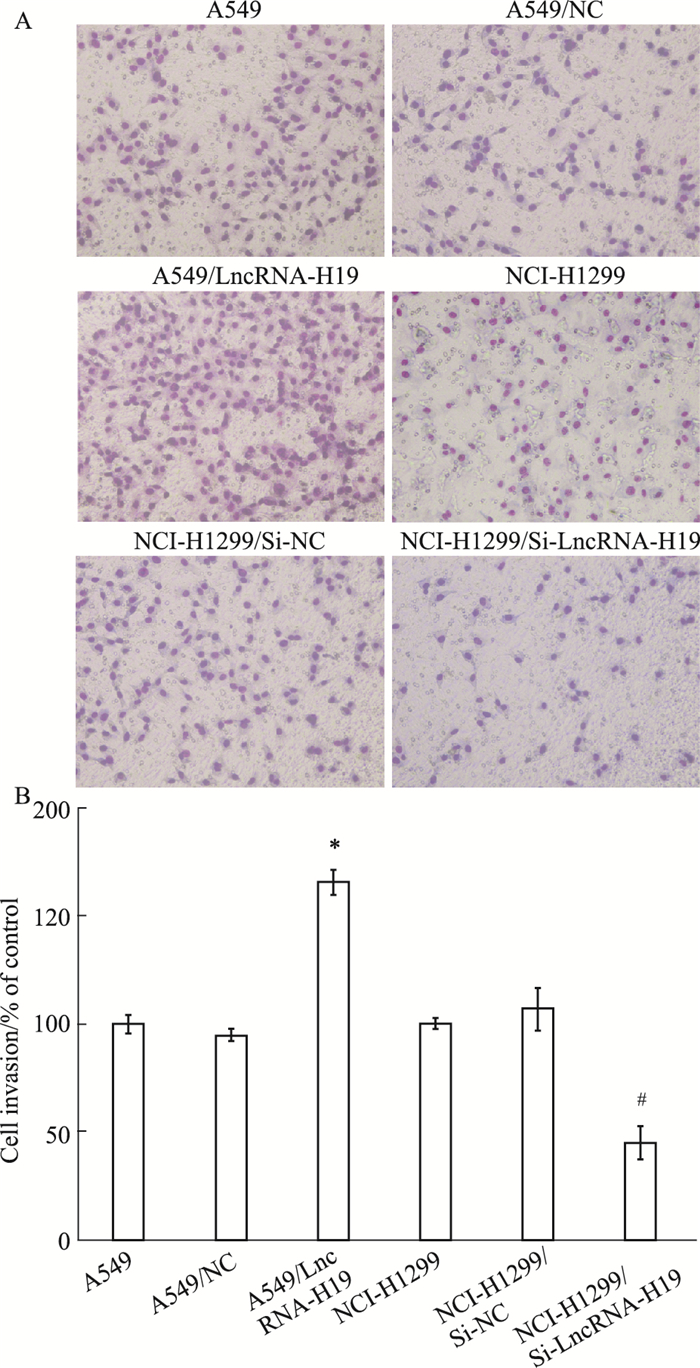
|
| Fig 5 The cell invasion of lung adenocarcinoma cells after transfection(x±s, n=3) A: Cells that invaded through chamber membrane of indicated groups; B: Relative invasion rate of indicated groups. *P < 0.05 vs A549/NC group. #P < 0.05 vs NCI-H1299/Si-NC group. |
Western blot检测敲减或过表达LncRNA-H19对上皮-间充质转化标记物E-cadherin、Vimentin在肺腺癌细胞中表达量的影响。如Fig 6所示,与NCI-H1299/Si-NC相比,NCI-H1299/Si-LncRNA-H19细胞中E-cadherin的表达明显升高,而Vimentin的表达明显降低;而与A549/NC相比,A549/LncRNA-H19细胞中的E-cadherin的表达明显降低,而Vimentin的表达明显升高(P < 0.05)。实验表明,LncRNA-H19可促进肺腺癌细胞的上皮-间充质转化。
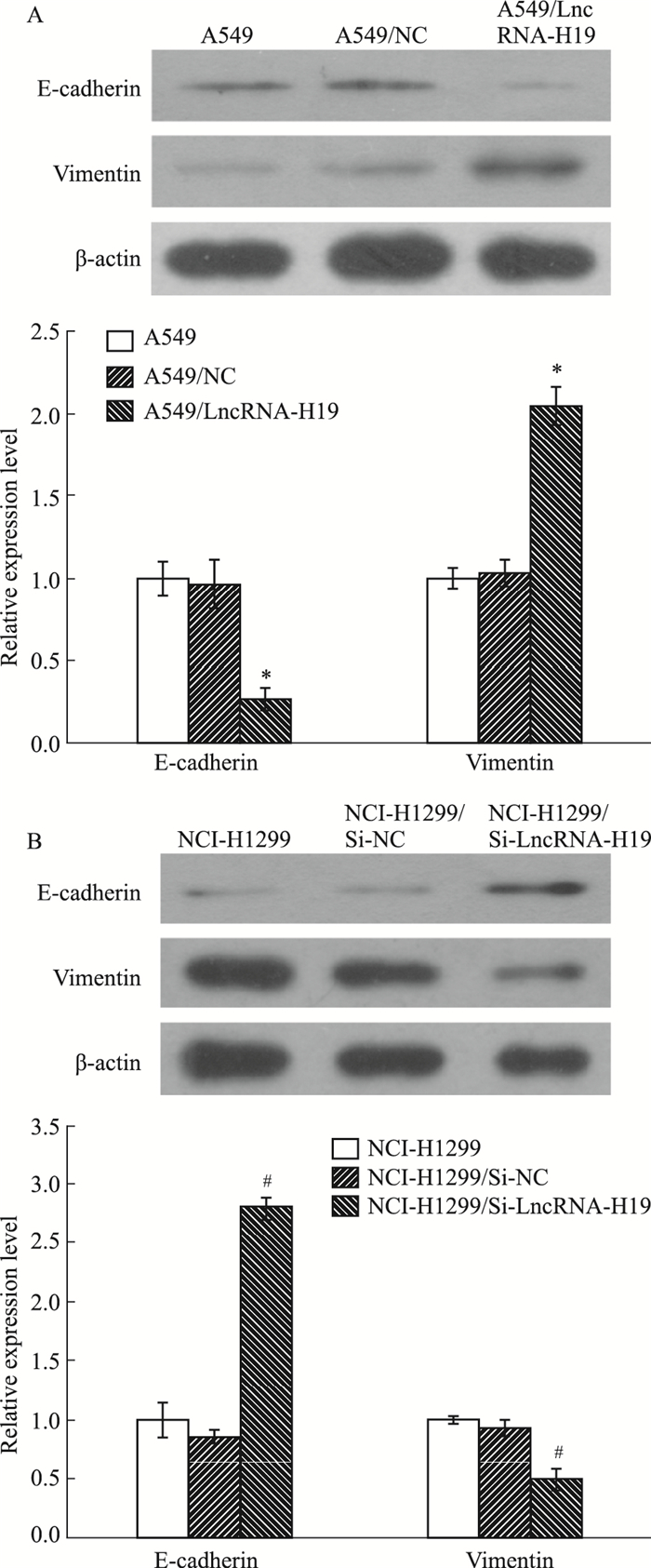
|
| Fig 6 The relative expression of EMT markers of different lung adenocarcinoma cells(x±s, n=3) A: E-cadherin and Vimentin expression of indicated groups of A549 cells; B: E-cadherin and Vimentin expression of indicated groups of NCI-H1299 cells. *P < 0.05 vs A549/NC group. #P < 0.05 vs NCI-H1299/Si-NC group. |
LncRNA-H19的表达上调见于乳腺癌[10],大肠癌[11]等多种癌症。研究显示,LncRNA-H19的高表达与晚期非小细胞肺癌肿瘤(TNM)分期及肿瘤大小呈正相关[12]。本研究检测了LncRNA-H19在伴或不伴淋巴结转移的肺腺癌组织中的表达情况,发现LncRNA-H19在伴有淋巴结转移的肺腺癌组织中的表达显著高于不伴淋巴结转移的肺腺癌组织,而LncRNA-H19在肺腺癌细胞中的表达亦明显高于人正常肺支气管上皮细胞。CCK-8实验及Transwell实验显示,过表达LncRNA-H19可促进肺腺癌细胞的增殖、侵袭能力,而敲低LncRNA-H19则抑制肺腺癌细胞的增殖、侵袭能力。
有关LncRNA的研究日益增多,它们在表观遗传、转录和转录后水平上起作用,是包括细胞生长、凋亡和转移在内的病理生理关键通路的调节因子[13]。肺癌是全球癌症相关死亡的主要原因,LncRNA参与了肺癌发生的许多方面,诸如调节细胞增殖、干细胞维持、EMT等基本的细胞过程,同时也作为信号转导的重要角色[14]。LncRNA-H19可通过抑制miR-196b在加速肺癌生长过程中诱导LIN28B表达[15]。本研究通过Western blot实验检测肺腺癌细胞中LncRNA-H19对EMT标志物E-cadherin、Vimentin的影响,发现敲减细胞中的LncRNA-H19后,上皮标志物E-cadherin蛋白的表达明显升高,而间充质标志物Vimentin蛋白的表达明显降低,而过表达细胞中的LncRNA-H19后E-cadherin及Vimentin的变化与之相反。
综上所述,LncRNA-H19在伴有淋巴结转移的肺腺癌组织中的表达高于不伴淋巴结转移的肺腺癌组织,并且LncRNA-H19可促进肺腺癌细胞的增殖、侵袭及EMT。然而仍需扩大样本量及进一步的体内实验进行验证,我们将深入探究LncRNA-H19参与侵袭转移的分子机制及其可能调控的靶基因,以寻找更有效的标志物,使肺腺癌诊断治疗的理论基础更加完善。
| [1] |
Siegel R L, Miller K D, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. doi:10.3322/caac.21551 |
| [2] |
Torre L A, Siegel R L, Jemal A. Lung cancer statistics[J]. Adv Exp Med Biol, 2016, 893: 1-19. |
| [3] |
李汉清, 可燕. 上皮间质转化的机制研究进展[J]. 中国药理学通报, 2017, 33(10): 1342-4. Li H, Ke Y. Mechanism of epithelial-mesenchymal transition[J]. Chin Pharmacol Bull, 2017, 33(10): 1342-4. doi:10.3969/j.issn.1001-1978.2017.10.003 |
| [4] |
Mender I, LaRanger R, Luitel K, et al. Telomerase-mediated strategy for overcoming non-small cell lung cancer targeted therapy and chemotherapy resistance[J]. Neoplasia, 2018, 20(8): 826-37. doi:10.1016/j.neo.2018.06.002 |
| [5] |
Gabory A, Jammes H, Dandolo L. The H19 locus: Role of an imprinted non-coding RNA in growth and development[J]. Bioessays, 2010, 32(6): 473-80. doi:10.1002/bies.200900170 |
| [6] |
Raveh E, Matouk I J, Gilon M, et al. The H19 long non-coding RNA in cancer initiation, progression and metastasis - a proposed unifying theory[J]. Mol Cancer, 2015, 14: 184. doi:10.1186/s12943-015-0458-2 |
| [7] |
Zhang Q, Li X, Li X, et al. LncRNA H19 promotes epithelial-mesenchymal transition (EMT) by targeting miR-484 in human lung cancer cells[J]. J Cell Biochem, 2018, 119(6): 4447-57. doi:10.1002/jcb.26537 |
| [8] |
Zheng Z H, Wu D M, Fan S H, et al. Upregulation of miR-675-5p induced by lncRNA H19 was associated with tumor progression and development by targeting tumor suppressor p53 in non-small cell lung cancer[J]. J Cell Biochem, 2019, 1-12. |
| [9] |
杨玉玲, 王照岩, 杨志一, 等. miR-125a-5p通过PI3K/Akt/MMP信号通路抑制乳腺癌细胞的侵袭与转移[J]. 中国药理学通报, 2018, 34(8): 1145-9. Yang Y L, Wang Z Y, Yang Z Y, et al. MiR-125a-5p inhibits invasion and metastasis of breast cancer through PI3K/Akt/MMP signal pathway[J]. Chin Pharmacol Bull, 2018, 34(8): 1145-9. doi:10.3969/j.issn.1001-1978.2018.08.022 |
| [10] |
Berteaux N, Aptel N, Cathala G, et al. A novel H19 antisense RNA overexpressed in breast cancer contributes to paternal IGF2 expression[J]. Mol Cell Biol, 2008, 28(22): 6731-45. doi:10.1128/MCB.02103-07 |
| [11] |
Tsang W P, Ng E K, Ng S S, et al. Oncofetal H19-derived miR-675 regulates tumor suppressor RB in human colorectal cancer[J]. Carcinogenesis, 2010, 31(3): 350-8. doi:10.1093/carcin/bgp181 |
| [12] |
Zhang E, Li W, Yin D, et al. c-Myc-regulated long non-coding RNA H19 indicates a poor prognosis and affects cell proliferation in non-small-cell lung cancer[J]. Tumour Biol, 2016, 37(3): 4007-15. |
| [13] |
Roth A, Diederichs S. Long noncoding RNAs in lung cancer[J]. Curr Top Microbiol Immunol, 2016, 394: 57-110. |
| [14] |
Ricciuti B, Mencaroni C, Paglialunga L, et al. Long noncoding RNAs: New insights into non-small cell lung cancer biology, diagnosis and therapy[J]. Med Oncol, 2016, 33(2): 18. doi:10.1007/s12032-016-0731-2 |
| [15] |
Ren J, Fu J, Ma T, et al. LncRNA H19-elevated LIN28B promotes lung cancer progression through sequestering miR-196b[J]. Cell Cycle, 2018, 17(11): 1372-80. doi:10.1080/15384101.2018.1482137 |