

2. 重庆两江新区第一人民医院药剂科,重庆 401121
2. Dept of Pharmacy, First People′s Hospital of Chongqing Liang jiang New District, Chongqing 401121, China
近年来,伴随着社会人口老年化加剧,脑卒中在我国的发病率逐年攀升,已成为最主要的致死、致残性疾病,给社会、家庭带来沉重的负担[1]。然而目前还没有一个公认的神经保护作用的药物可在临床上有效改善脑卒中结局。因此,继续寻找有效治疗缺血性脑卒中的药物具有重要研究价值及临床意义。
自噬作为一种细胞的生物学过程,具有抑制炎症因子的产生,降低氧自由基,抑制细胞凋亡,并能为细胞器的更新提供原料的功能。在维持细胞内稳态,保证机体健康状态扮演重要角色[2-3]。线粒体自噬发生在线粒体中,其可选择性清除受损及功能障碍线粒体,目前有关线粒体自噬在脑缺血/再灌注损伤(ischemia/reperfusion injury,I/R)中作用的研究较多,但其在脑I/R过程中扮演的确切角色仍存在较大争议[4]。因此,进一步探究并开发作用于线粒体自噬相关靶点的药物对脑I/R的防治意义重大。
贝沙罗汀(Bexrotene)是一种FDA批准用于治疗皮肤淋巴瘤的药物,其具有较小的分子量,较高的脂溶性,易透过血脑屏障等优点[5]。近年来的研究证实,其可通抑制抗炎、凋亡等途径对多种神经系统疾病有保护作用[6]。Huuskonen等[7]报道了Bexarotene能通过调节自噬,改善滔蛋白病变小鼠脑缺血/再灌注损伤后的神经行为学评分及脑梗死体积,但其对线粒体自噬的研究尚未见报道。本研究通过中动脉栓塞(transient middle cerebral artery occlusion,tMCAO)模型,使用药物Bexarotene干预后观察小鼠行为学评分,脑梗死体积,损伤部位组织学、线粒体功能变化以及自噬相关蛋白表达情况,探讨Bexarotene对脑缺血/再灌注损伤的保护作用以及其对线粒体自噬的影响。
1 材料 1.1 实验动物C57BL/6小鼠, ♂,体质量(20~25)g,SPF级,购买于重庆医科大学实验动物中心,许可证号:SYXK渝2018-0003。
1.2 试剂ATP检测试剂盒(S0026)、线粒体膜电位检测试剂盒(JC-1)(C2006)、组织线粒体分离试剂盒(C3606)、蛋白印迹相关试剂,均购于Beyotime Biotechnology公司;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-tetrazolium chloride solution,TTC),购于Sigma公司;抗体p62(5114S),LC3B(3868S), TOM20(#42406),均购自于CST公司;β-actin(60008-1-lg),TOM20(66777-1-1g),购于Proteintech公司。
1.3 仪器-80 ℃超低温冰箱(美国Thermo Scientific);低温离心机(美国Thermo Scientific);多功能酶标仪(美国Thermo Scientific);湿式转膜仪、垂直电泳槽(北京六一仪器厂);凝胶成像系统(美国Bio-Rid公司);正置显微镜(日本Nikon公司,ECLIPSE50i);透射电镜(HITACHI公司),倒置显微镜(日本Olympus)。
2 方法 2.1 小鼠I/R模型的建立♂ C57小鼠, 通过tMCAO建立小鼠I/R模型,过程如下,首先用1%异戊巴比妥钠麻醉小鼠后将其仰卧固定,颈部备皮,75%酒精消毒局部皮肤,颈中线切口2cm,分离颈前肌,右侧胸锁乳突肌,显微镜下仔细分离右颈总动脉(common carotid artery,CCA),颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA),结扎颈总和颈外,暂时夹闭颈内,随后在颈总靠近心脏一端剪一“V”型小口将线栓通过CCA残端插入ICA,有阻力感时停止插入,并活结固定线栓。缺血1 h后,拔出线栓,缝合伤口,开始再灌注过程(24 h),假手术组的小鼠除不插入线栓外,其余操作均相同。手术过程中使用恒温红外灯将小鼠体温维持在(37±0.5) ℃。
2.2 分组与给药60只小鼠随机分为假手术组(sham),模型组(I/R组),药物组(bexarotene),每组20只。20 mg bexarotene先用DMSO溶解。聚乙二醇(1, 5)-羟基硬脂酸镁、乙醇、水以15 : 10 : 75的比例配制的混合液作为溶剂稀释。除假手术组外,药物组术前每天腹腔注射上述配置好的bexarotene(5 mg·kg-1),于第5次给药1 h后建立I/R模型。模型组则仅给予等量的溶剂(除不含药物外,其余成分均相同)。
2.3 神经功能评分再灌注结束后,参照改良的Longa五步四分评分法对小鼠的神经功能进行评分[8]。评分值越高,神经行为功能损害越严重。
2.4 TTC染色评估脑梗死程度再灌注结束后,小鼠在深度麻醉下断头取脑,首先置于-20 ℃冰箱中30 min,取出后置冰面,弃去嗅球部分,做冠状切片。随后放入装有2% TTC染液的培养皿中,锡箔纸包裹避光,置于有提前37 ℃水浴预热双面染色20 min。染色结束后后置于4%多聚甲醛中固定4 ℃后冰箱过夜。置于深色背景面观察,红色为正常脑组织,白色为梗死后脑组织。
2.5 HE染色再灌注24 h后,小鼠深度麻醉后固定,先后使用PBS及4%多聚甲醛经心脏灌注,取脑后置于4%多聚甲醛溶液中固定36 h。石蜡包埋后切片,行HE染色。不同光学显微镜下观察损伤部位海马神经元细胞完整性,细胞核有无固缩等情况。
2.6 组织线粒体的提取组织线粒体的提取参照试剂盒说明书进行,步骤如下:取PBS清洗后的新鲜损伤侧海马脑组织与培养皿中,剪碎后,加入0.1 mg·μL-1的线粒体分离试剂A。研磨后收集匀浆液,(600)×g,4 ℃离心10 min,收集上清液后再次(11 000)×g,4 ℃离心10 min。沉淀即为线粒体,收集沉淀(线粒体),置于-80 ℃保存备用。
2.7 透射电镜观察线粒体自噬的现象再灌注结束后,小鼠深度麻醉后固定,断头取脑,分离出损伤侧海马组织,冰面上制备成1 mm3大小的组织块,迅速置于4 ℃的戊二醛溶液中固定。送至电镜室后处理并采集图片。
2.8 免疫荧光染色再灌注24 h后,小鼠深度麻醉后固定,先后使用PBS及4%多聚甲醛经心脏灌注,结束后取脑并将其由前向后做冠状冰冻切片(5 μm厚)备后续用。在4 ℃下采用1 : 100稀释的兔来源的LC3, TOM20多克隆抗体(CST, 1 : 250)对冰冻切片组织进行孵育。过夜后,在37 ℃下,采用荧光二抗在避光条件下对切片组织进行孵育1 h,使用荧光显微镜对切片拍照。
2.9 Western blot法检测损伤侧海马线粒体自噬相关蛋白及线粒体膜蛋白表达再灌注结束后,深度麻醉下断头取脑,收集各组小鼠的损伤侧海马组织,将组织在液氮中研碎后提取总蛋白,总蛋白浓度采用BCA法测定。上样量每孔30 μg,经过SDS-PAGE凝胶电泳,转膜,室温5% BSA封闭2 h,一抗4 ℃孵育过夜,洗膜,二抗室温孵育并洗膜后显色成像。成像结果用Image-Lab检测图像灰度值并分析结果,以目标蛋白与β-actin灰度值的比值表示蛋白的表达水平。
2.10 ATP含量的测定参照ATP检测试剂盒说明书,进行以下操作:首先将新鲜的缺血侧海马组织按照每20 mg组织加入约100~200 μL裂解液的比例加入裂解液中,然后用玻璃匀浆器匀浆裂解。充分裂解后4 ℃ 12 000×g离心5 min,取上清,用于后续的测定。在37 ℃下将ATP试剂添加到微孔中5 min,然后添加样品或者标准品并混合10 s,最后用多功能酶标仪进行测量。绘制标准曲线,并根据标准曲线计算出每组ATP的含量。
2.11 线粒体膜电位(mitochondrial membrane potential,MMP)检测MMP检测参照试剂盒说明书进行,步骤如下:按说明书要求配制好JC-1染色工作液和缓冲液。0.9 mL稀释后的JC-1染色工作液中加入0.1 mL总蛋白量为10~100 μg纯化的线粒体,多功能酶标仪进行检测,检测单体(绿色)最大激发波长为514 nm,最大发射波长为529 nm;检测JC-1聚合物(红色)最大激发波长为585 nm,最大发射波长为590 nm,MMP=(红色/绿色)%。
2.12 统计学处理所有实验数据以 x±s形式表示。所有数据均使用SPSS 20版本软件进行分析,神经行为学评分采用Mann-Whitney test分析,其余指标各组间比较采用单因素方差分析(ANOVA)。
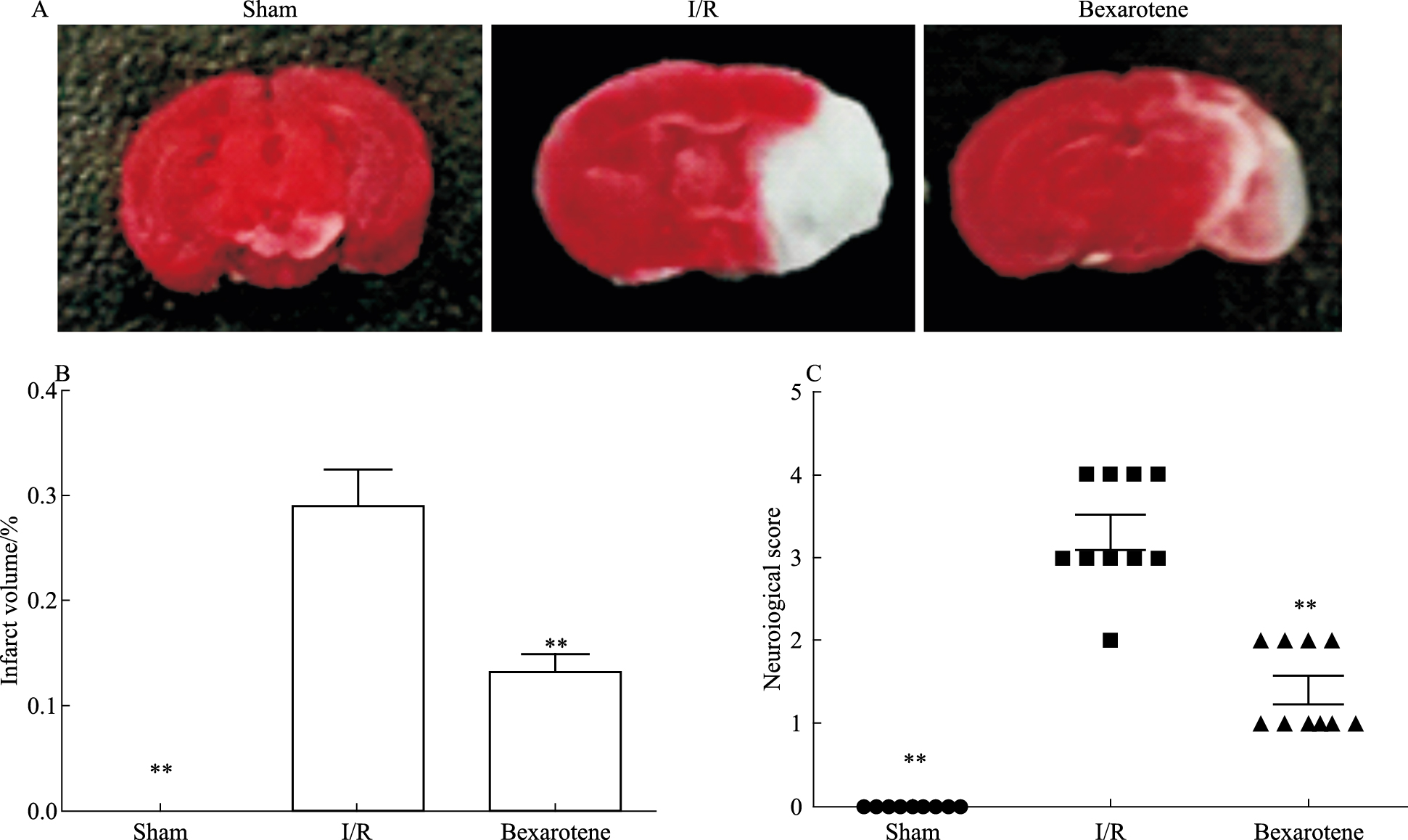
3 结果 3.1 Bexarotene预处理减轻了I/R诱导的脑损伤TTC染色和行为学评分结果显示,与I/R组相比,Bexarotene预处可以明显减少I/R小鼠损伤侧脑梗死体积(Fig 1A、1B)且降低明显改善神经功能缺损评分(Fig 1C)。
|
| Fig 1 Brain damage in I/R micereducedby bexarotene pretreatment A: Representative picture of TTC staining; B:The quantitative diagram of A(x±s, n=5);C:Neurological score to evaluate neurological deficits(x±s, n=10).**P < 0.01 vs I/R. |
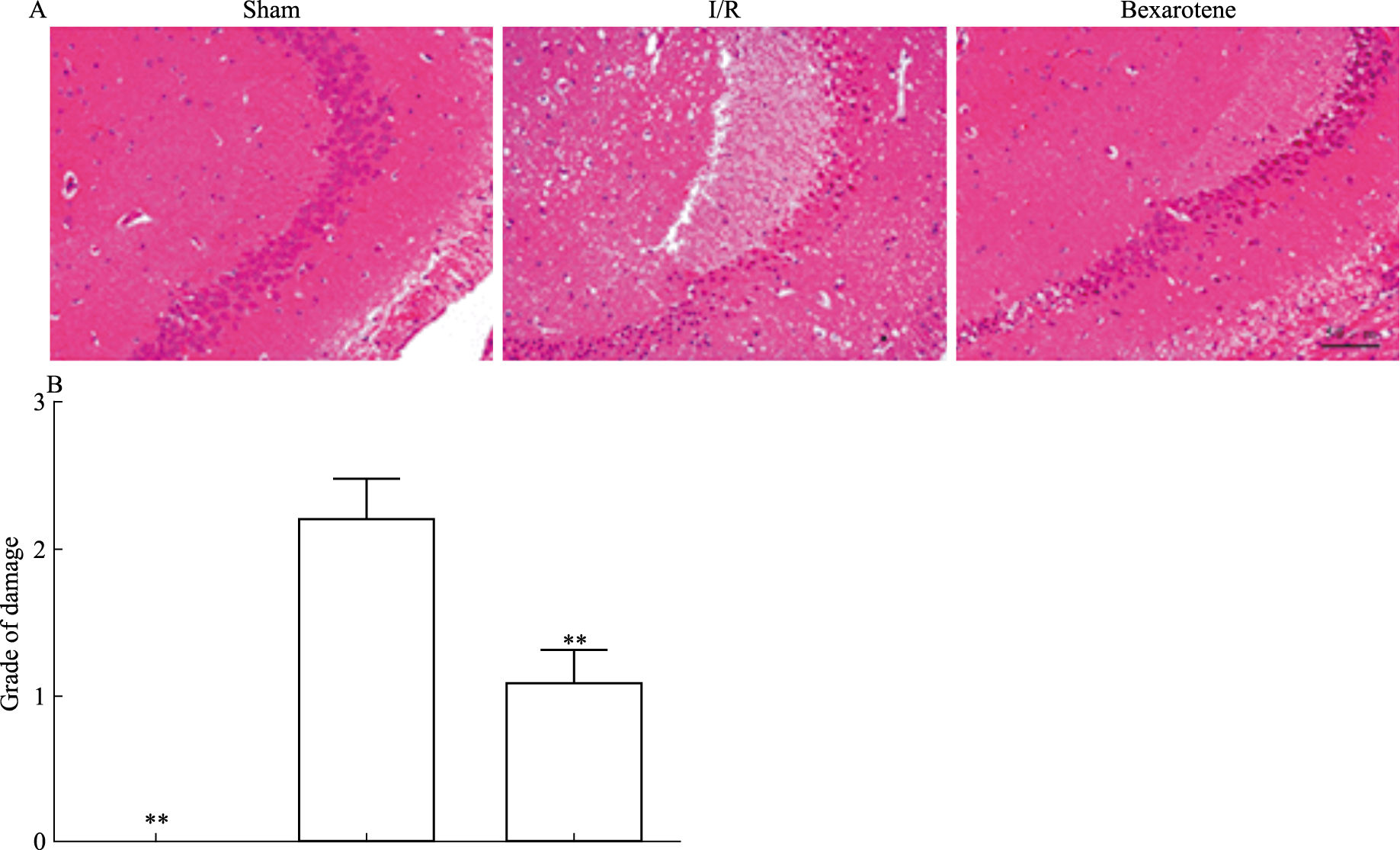
HE染色结果显示,I/R组小鼠损伤侧海马区神经元排列混乱,细胞核缩小且染色加深,有较多的死亡细胞。Bexarotene组中细胞排列比较整齐,且可以见到清晰的核仁,只有少量细胞死亡(Fig 2)。
|
| Fig 2 Damage in ischemic hippocampus tissue cells of I/R miceimproved by bexarotene pretreatment(x±s, n=4) **P < 0.01 vs I/R |
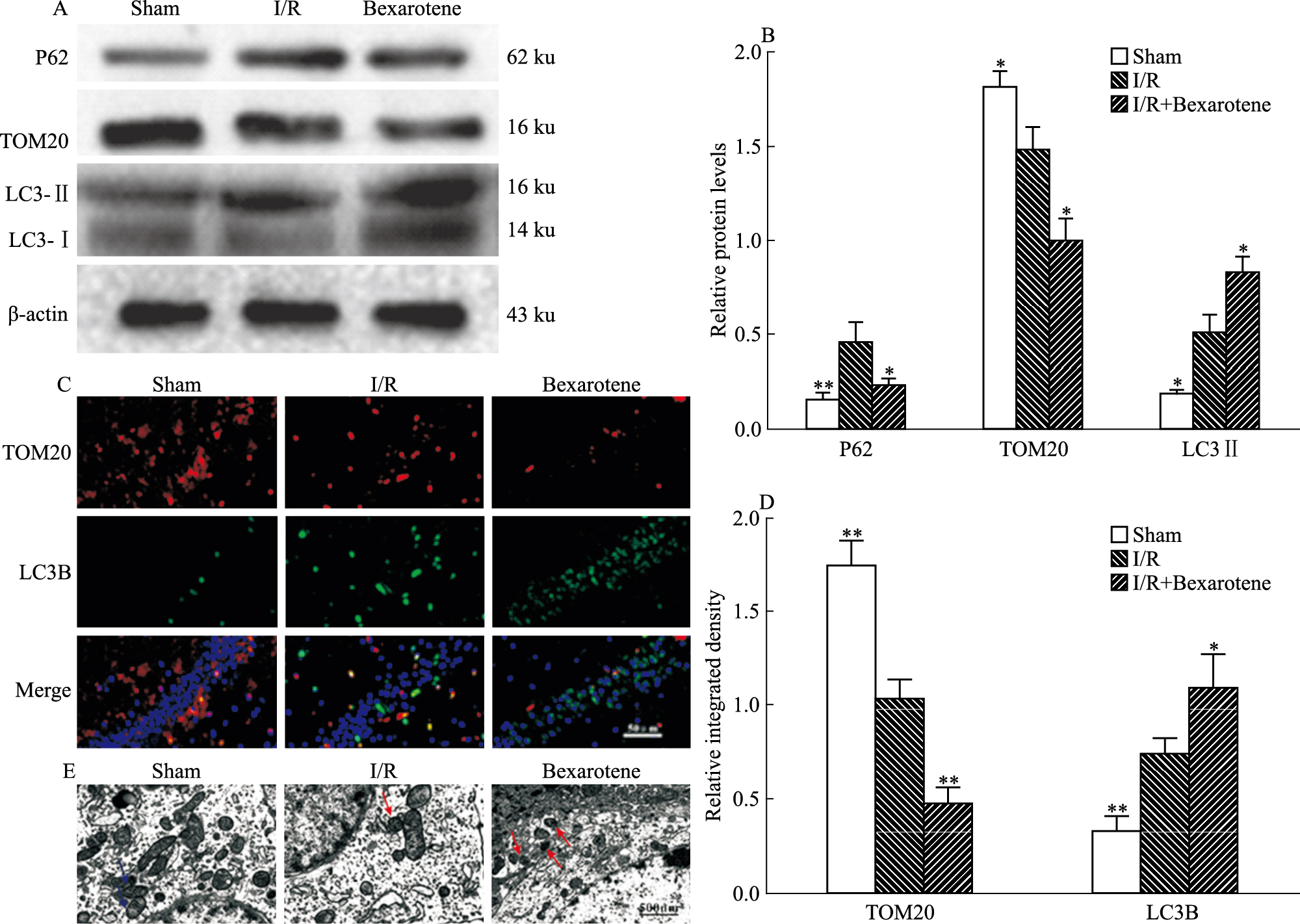
Western blot结果证明,与I/R组相比Bexarotene预处理可明显上调自噬相关蛋白LC3B,同时线粒体膜蛋白TOM20和P62表达水平降低(Fig 3A-D)。组织荧光结果显示得到的结果与Western blot结果一致,即Bexarotene预处理可明显上调缺血侧海马区LC3B的表达,下调TOM20的表达(Fig 3E-G)。另外,透射电镜结果显示,与I/R组相比,Bexarotene组双层膜结构的自噬小体明显增多(Fig 3H)。这些结果揭示Bexarotene预处理可增加I/R小鼠的线粒体自噬水平。
|
| Fig 3 Mitophagy in I/R mice up-regulated by bexarotene pretreatment (x±s, n=5) A~ B:P62, TOM20, LC3B protein band diagram and relative protein expression ratio; C~D: Immunofluorescence staining of LC3B and TOM20 expression level in the ischemic hippocampus of I/R mice(scale bar=50 μm, magnification 400×).The top row shows TOM20(red), the middle row shows LC3B(green) and the bottom row shows the merged image. E: TEM image(scale bar: 500 nm), blue arrows indicate normal mitochondria, and red arrows indicate autophagosomes.*P < 0.05, **P < 0.01 vs I/R |
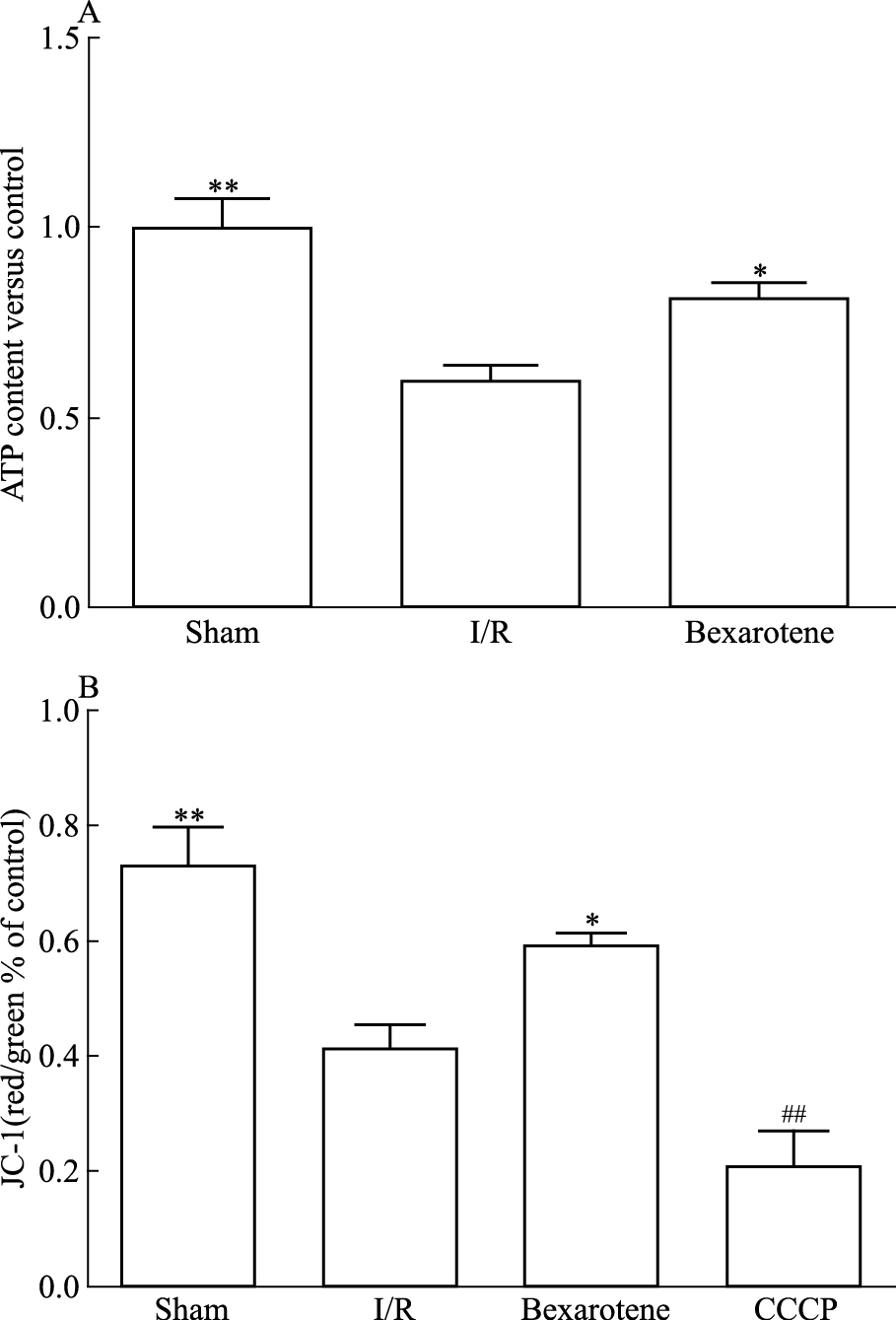
ATP含量和MMP结果显示,与I/R组相比,Bexarotene组ATP含量和MMP都明显增高(Fig 4A、4B)。由此说明Bexarotene可以改善I/R诱导的线粒体的损伤。
|
| Fig 4 Mitochondrial function inI/R mice improved by bexarotene pretreatmen (x±s, n=5) A:ATP content statistics of each group; B: Mitochondrial membrane potential statisticsof each group.*P < 0.05, **P < 0.01 vs I/R; ##P < 0.01 vs Sham |
目前有关线粒体自噬在脑缺血/再灌注损伤中作用的研究较多,但其在缺血/再灌注损伤过程中扮演的确切角色仍存在较大争议。Baek等[9]研究认为,肌肽可通过下调自噬信号而改善线粒体功能,减轻脑缺血/再灌注损伤。Zhang等[10]研究表明,自噬在脑缺血阶段发挥有害作用,而在再灌注阶段通过激活线粒体自噬而发挥保护作用。而Yuan等[11]研究认为,上调线粒体自噬,能通过及时清除受损线粒体而产生对脑缺血/再灌注损伤的保护作用,这与Li等[12]的研究结果一致。因此进一步探究线粒体自噬与脑缺血/再灌注损伤的关系,将为缺血性脑损伤的治疗提供重要依据。
Bexrotene为选择性的视黄酸X受体激动剂,近年来研究显示,其具有抗炎,调节自噬,抗氧化应激等作用,在帕金森病,创伤性脑病,蛛网膜下腔出血等中枢神经系统疾病中的保护作用被广泛报道[6]。Martín等[13]认为神经元细胞中线粒体的代谢和结构异常在AD病理生理中起着至关重要的作用,应用Bexrotene干预后,可以上调线粒体自噬,及时清除受损线粒体也是对AD模型保护作用的重要机制。本研究首次在脑I/R模型中探索本Bexrotene保护作用的新机制,研究中发现,与模型组相比,bexarotene预处理可明显改善I/R损伤组小鼠的神经功能缺损,减少脑梗死体积及降低缺血区组织细胞的坏死,上调线粒体自噬标记蛋白表达,提高线粒体MMP和ATP水平,因此bexarotene的神经保护作用与其改善线粒体功能有关。
自噬标记蛋白LC3主要包括存在于细胞质里面的LC3I和存在以自噬小体膜上的LC3II两种形式组成,两者可相互转化,其中LC3II常被认为是自噬形成的标志分子。P62可充当支架蛋白的形式与LC3相结合,进而被溶酶体酶降解,当自噬水平降低时,P62表达水平通常较高,反之当自噬水平升高时,表达量通常降低。因此,本研究本实验选取LC3,P62,作为观察自噬发生的关键蛋白。为观察I/R及药物干预后线粒体变化情况,我们选取线粒体膜蛋白TOM20表达水平来反应线粒体含量变化[14]。我们的研究结果发现,同时上调自噬标记蛋白LC3的表达,而P62及TOM20表达水平明显降低。以上结果表明,bexarotene预处理可有效的激活线粒体自噬,这与电镜观察结果一致。大脑内线粒体含量远高于其他部位,脑I/R后因线粒体膜除极化、膜孔蛋白通透性改变等原因,导致了脑缺血部位的线粒体功能障碍[15]。本研究为验证药物干预后线粒体功能的变化,我们检测了各组线粒体ATP含量及线粒体膜电位水平,结果显示bexarotene预处理后ATP含量及膜电位水平较I/R组明显升高,有效的改善了线粒体水平。
综上所述,bexarotene对小鼠脑组织I/R损伤有保护作用,其可能机制与上调线粒体自噬,及时清除受损线粒体,同时为合成新的线粒体提供原料,确保细胞内线粒体质量有关。本研究为进一步寻找脑I/R损伤中线粒体自噬相关靶点的治疗药物提供新思路。
| [1] |
Naghavi M, Wang H, Lozano R, et al. Global, regional, andnational age-sex-specific all cause and cause-specific mortality for 240 causes of death, 1990-2013: asystematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 385(9963): 117-71. doi:10.1016/S0140-6736(14)61682-2 |
| [2] |
Rubinsztein D C, Codogno P, Levine B. Autophagy modulation as a potential therapeutic target for diverse diseases[J]. Nat Rev Drug Discov, 2012, 11(9): 709-30. doi:10.1038/nrd3802 |
| [3] |
Lin N Y, Beyer C, Giessl A, et al. Autophagy regulates TNFα-mediated joint destruction in experimental arthritis[J]. Ann Rheum Dis, 2013, 72(5): 761-8. doi:10.1136/annrheumdis-2012-201671 |
| [4] |
Kirkin V, McEwan D G, Novak I, et al. A role for ubiquitin in selective autophagy[J]. Mol Cell, 2009, 34(3): 259-69. doi:10.1016/j.molcel.2009.04.026 |
| [5] |
Cramer P E, Cirrito J R, Wesson D W, et al. ApoE-directed therapeutics rapidly clear beta-amyloid and reverse deficits in AD mousemodels[J]. Science, 2012, 335(6075): 1503-6. doi:10.1126/science.1217697 |
| [6] |
Zhong J, Cheng C, Liu H, et al. Bexarotene protects against traumatic brain injury in mice partially through apolipoprotein E[J]. Neuroscience, 2017, 343: 434-48. doi:10.1016/j.neuroscience.2016.05.033 |
| [7] |
Huuskonen M T, Loppi S, Dhungana H, et al. Bexarotene targets autophagy andis protective against thromboembolic stroke in aged mice with tauopathy[J]. Sci Rep, 2016, 6: 33176. doi:10.1038/srep33176 |
| [8] |
Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [9] |
Baek S H, Noh A R, Kim K A, et al. Modulation of mitochondrial function and autophagy mediates carnosine neuroprotection against ischemic brain damage[J]. Stroke, 2014, 45(8): 2438-43. doi:10.1161/STROKEAHA.114.005183 |
| [10] |
Zhang X, Yan H, Yuan Y, et al. Cerebral ischemia-reperfusioninduced autophagy protects against neuronal injury by mitochondrial clearance[J]. Autophagy, 2013, 9(9): 1321-33. doi:10.4161/auto.25132 |
| [11] |
Yuan Y, Zhang X, Jiang L, et al. Endoplasmic reticulum stress induced by tunicamycin and thapsigargin protects against transient ischemic brain injury:Involvement of PARK2-dependent mitophagy[J]. Autophagy, 2014, 10(10): 1801-13. doi:10.4161/auto.32136 |
| [12] |
Li Q, Zhang T, Wang J, et al. Apamycin attenuates mitochondrial dysfunction via activation of mitophagy in experimental ischemic stroke[J]. Biochem Biophys Res Commun, 2014, 444(2): 182-8. doi:10.1016/j.bbrc.2014.01.032 |
| [13] |
Martín-Maestro P, Sproul A, Martinez H, et al. Autophagy induction by bexarotene promotes mitophagy in presenilin 1 familial Alzheimer′s disease iPSC-derived neural stem cells[J]. Mol Neurobiol, 2019, 56(12): 8220-36. doi:10.1007/s12035-019-01665-y |
| [14] |
向菲, 李明航, 徐露, 等. 白藜芦醇通过促进线粒体自噬减轻小鼠脑缺血/再灌注损伤的实验研究[J]. 中国药理学通报, 2019, 35(6): 815-21. Xiang F, Li M H, Xu L, et al. Resveratrol alleviates cerebralischemia /reperfusion injury in mice by promoting mitophagy[J]. Chin Pharmacol Bul, 2019, 35(6): 815-21. doi:10.3969/j.issn.1001-1978.2019.06.016 |
| [15] |
Wang M, Feng L, Zheng J, et al. Improvement of mitochondrial function mediated the neuroprotective effect of 5-(4-hydroxy-3-dimethoxybenzylidene)-2-thioxo-4-thia zolidinone in rats with cerebral ischemia-reperfusion injuries[J]. Oncotarget, 2017, 8(37): 6193-202. |

