


2. 南昌大学第一附属医院药学部,江西 南昌 330006;
3. 江西省人民医院药学部,江西 南昌 330006;
4. 中国医学科学院血液学研究所, 天津 300020
魏筱华(1964-),女,学士,教授,硕士生导师,研究方向:临床药物治疗,通讯作者,E-mail:wxh-hello@163.com
 ,
JING Yan1,
ZOU De-qin2,
HOU Xiong-jun3,
PENG Hong-wei1,2
,
JING Yan1,
ZOU De-qin2,
HOU Xiong-jun3,
PENG Hong-wei1,2
 ,
ZHOU Jian2,
LI Yu-hua2,
XIONG Dong-sheng4,
WEN Jin-hua2,
WEI Xiao-hua1,2
,
ZHOU Jian2,
LI Yu-hua2,
XIONG Dong-sheng4,
WEN Jin-hua2,
WEI Xiao-hua1,2

2. Dept of Pharmacy, the First Affiliated Hospital of Nanchang University; Nanchang 330006, China;
3. Jiangxi Provincial People's Hospital, Nanchang 330006, China;
4. Institute of Hematology, Chinese Academy of Medical Sciences, Tianjin 300020, China
他克莫司(Tacrolimus)又名FK506,由于其较强免疫抑制作用及较低的不良反应发生率,在目前临床中已经逐渐取代环孢素,成为器官移植术后应用的最为广泛的抗免疫排斥药物。然而该药物治疗窗狭窄,存在较大个体化差异,价格昂贵且需长期坚持服用,给患者带来沉重的经济负担。FK506主要由肝肠中的CYP氧化酶(主要是CYP3A4和CYP3A5)代谢,是糖蛋白(P-glycoprotein,P-gp)的底物[1]。研究证明,五酯胶囊与FK506联用能明显提高正常人或移植术后患者的FK506血药浓度及生物利用度,同时可改善肝功能和降低不良反应发生率,而发挥作用的是五酯片中所含的五味子木脂素。五味子木脂素能抑制CYP3A活性,同时也是P-gp抑制剂,而五味子甲素(schisandra A,Sch-A)是五味子木脂素中的主要成分,其通过介导CYP3A酶的代谢对FK506起增效作用[2]。靛蓝是青黛的主要成分,研究证明对肝药酶表达有调控作用[3]。我们从靛蓝中提取到其有效成分——靛玉红,PHⅡ-7是以靛玉红为模板合成的衍生物,它可调节细胞表面ABCB1的表达,揭示核受体蛋白对ABCB1的激活作用,体内外实验已经证明,在有效剂量下对正常细胞毒性较低[4]。
结合FK506的体内过程及对PHⅡ-7的前期研究结果,我们推测PHⅡ-7可能对FK506具有增效作用,并且可能是通过核受体(pregnane X receptor,PXR)-CYP3A5/ABCB1的信号通路影响FK506的转运及代谢,从而提高FK506的疗效。本研究以五酯胶囊的有效成分Sch-A为阳性对照,通过体内外实验初步探索PHⅡ-7对FK506的增效作用及其机制,旨在为今后开发新的FK506节约剂提供理论依据。
1 材料 1.1 动物♂ SD大鼠,清洁级,体质量(270~290) g,由卡文斯公司提供,许可证号:SCXK(苏)2016-0010。
1.2 药物PHⅡ-7由我室自主合成,由DMSO溶解成50 mmol·L-1母液,Sch-A(S818221)购自上海麦克林生化科技有限公司,由DMSO溶解成20 mmol·L-1母液,置-20 ℃冰箱备用,用完全培养基稀释母液至所需药物浓度,其中DMSO的终浓度 < 1%。FK506(T101159)购自上海阿拉丁生化科技有限公司,原药用55% PEG400+25%丙二醇+20%水溶解成所需溶度使用。
1.3 培养基DMEM培养基(北京索莱宝公司);胎牛血清(澳洲Gibco公司)。
1.4 其他试剂MTT(M2128)购自美国Sigma公司;RNA提取试剂(003340)购自美国Axygen公司;逆转录(RR037A)和RT-qPCR试剂盒(RR064A)购自日本TaKaRa公司;由华大基因公司合成β-actin、PXR、ABCB1、CYP3A4、CYP3A5引物;兔抗人β-actin(20536-1-AP)购自武汉三鹰公司;ABCB1(129450)、CYP3A4(124921)、CYP3A5(108624)抗体购自美国Abcam公司;鼠抗人PXR(61816)抗体购自美国Novus公司;山羊抗兔IgG(ZB-5301)、山羊抗鼠IgG(ZB-2301)购自北京中杉金桥公司;BCA定量试剂盒(E112-01)购自南京诺唯赞公司;
1.5 细胞培养HepG2(人肝癌细胞株)、LS174T(人结肠癌细胞株)由上海富衡细胞库提供。孵箱条件:37 ℃,5% CO2。
1.6 实验仪器QT-2A旋涡混合器(天津恒祥泰科技公司);高效液相色谱仪(美国安捷伦公司);细胞培养箱(济南宇鑫生物公司);倒置显微镜(美国赛默飞公司);酶标仪(上海精其仪器有限公司);高速低温离心机(德国艾本德公司);q-PCR仪(美国应用生物公司);电泳仪(美国伯乐公司)。
2 方法 2.1 大鼠体内实验 2.1.1 动物处理将8只大鼠随机均分为对照组(FK506+Sch-A),实验组(FK506+PHⅡ-7),每组4只,灌胃给药,给药前大鼠禁食8 h(自由饮水),对照组给予FK506:SchA为1.89 mg·kg-1:10 mg·kg-1,实验组给予FK506:PHⅡ-7为1.89 mg·kg-1:3 mg·kg-1,仅给药1次,给药4 h后给予动物饲料。两组大鼠于0、0.167、0.5、0.75、1、2、3、4、6、8、12和24 h由大鼠颈静脉穿刺采血,收集全血约0.2 mL,置于EDTA抗凝管,血液样本分析前存放于-80 ℃冰箱。
2.1.2 检测条件色谱条件AcclaimTM 120 C18色谱柱,250×4.6 mm,(5 μm);流动相:甲醇- 0.1%甲酸- 104 mmol·L-1醋酸铵(80 :15 :5);柱温:40 ℃;进样量6 μL。
质谱条件电喷雾离子化源四级杆串联质谱系统;离子源温度550 ℃;离子化电压5 500 V;源内压力70 psi(气体1),60 psi(气体2);喷撞气:8 psi;多重反应监测模式。乙腈(acetonitrile)作为内标溶液,具体检测条件如Tab 1所示。
| Compound | Ion pair | Ion source model | DP(V) | CE(V) |
| FK506 | m/z 821.5/768.7 | Positive | 50 | 27 |
| Sch-A | m/z 417.2/316.3 | Positive | 170 | 30 |
| PHⅡ-7 | m/z 267.0/221.1 | Positive | 150 | 20 |
| Acetonitrile | m/z 271.4/155.0 | Positive | 110 | 23 |
将血样高速离心后,取1支1.5 mL离心管,加入20 μL血浆和180 mL乙腈溶液后,混旋3 min后,8 ℃,13 000 r·min-1条件下,离心15 min,取6 μL上机检测。
2.2 细胞活力检测接种7.5×104个每毫升状态良好的HepG2和LS174T细胞于96孔板中,每孔200 μL(约15 000个/孔),隔天,待融合率为80%左右时,经(0~30 μmol·L-1)PHⅡ-7和(0~60 μmol·L-1)Sch-A处理,每个浓度设置3个重复孔,阴性对照组用同体积的培养基代替,使得每孔的终体积为200 μL,24 h后,加入20 μL MTT溶液,避光孵育4 h后弃除上清,加入150 μL DMSO溶液,震荡混匀,于酶标仪检测490 nm波长处吸光度。计算3次重复实验的平均半数抑制浓度IC50值。
2.3 实时荧光定量PCR检测PXR/CYP3A4/3A5/ABCB1基因mRNA的表达接种2.5×105个每毫升状态良好的HepG2和LS174T细胞于6孔板中,每孔2 mL,其中实验分组进行如下处理:9 μmol·L-1 PHⅡ-7孵育HepG2细胞24 h,18 μmol·L-1 PHⅡ-7分别孵育HepG2细胞24 h或72 h;3.5 μmol·L-1 PHⅡ-7孵育LS174T细胞24 h,7 μmol·L-1 PHⅡ-7分别孵育LS174T细胞24 h或48 h;20 μmol·L-1 Sch-A孵育HepG2细胞24 h,40 μmol·L-1 Sch-A分别孵育HepG2细胞24 h或48 h;22 μmol·L-1 Sch-A孵育LS174T细胞24 h,44 μmol·L-1 Sch-A分别孵育LS174T细胞24 h或48 h,收集不同组别细胞,提取细胞总RNA,cDNA合成根据TaKaRa cDNA合成试剂盒说明操作,RT-qPCR检测细胞内各个基因表达水平,内参为β-actin。每个组别设置3个重复孔,根据比较Ct值法获得不同组别相关基因的表达值。
本研究所用的引物序列信息由Gene-Bank数据库提供,采用Primer 6.0软件设计,经BLAST验证后,由华大基因公司合成。如Tab 2所示。
| Primer | Sequence |
| β-actin forward primer | 5′-CTACAATGAGCTGCGTGTGGC-3′ |
| reverse primer | 5′-CAGGTCCAGACGCAGGATGGC-3′ |
| PXR forward primer | 5′-TGTAGGGAGTGAAGCCACAG-3′ |
| reverse primer | 5′-GCAACCTTGCCTCTCTGATG-3′ |
| CYP3A4 forward primer | 5′-GCACCGAGTGGATTTCCTTC-3′ |
| reverse primer | 5′-CGTGGTTTCATAGCCAGCCAA-3′ |
| CYP3A5 forward primer | 5′-GGTCATTGCTGTCTCCAACC-3′ |
| reverse primer | 5′-TTTCAAGGTGACAGGCTTGC-3′ |
| ABCB1 forward primer | 5′-TCCTTCACCCAGGCAATGAT-3′ |
| reverse primer | 5′-CCATGGCACCAAAGACAACA-3′ |
接种2.5×105个每毫升状态良好的HepG2和LS174T细胞于6孔板中,每孔2 mL,其中实验分组进行如下处理:9 μmol·L-1 PHⅡ-7孵育HepG2细胞24 h,18 μmol·L-1 PHⅡ-7分别孵育HepG2细胞24 h和72 h;3.5 μmol·L-1 PHⅡ-7孵育LS174T细胞24 h,7 μmol·L-1 PHⅡ-7分别孵育LS174T细胞24 h和48 h;20 μmol·L-1 Sch-A孵育HepG2细胞24 h,40 μmol·L-1 Sch-A分别孵育HepG2细胞24 h和48 h;22 μmol·L-1 Sch-A孵育LS174T细胞24 h,44 μmol·L-1 Sch-A分别孵育LS174T细胞24 h和48 h。收集不同组别细胞,提取总蛋白后定量,再用于Western blot检测。以每孔100 μg蛋白量上样,进行电泳,转膜,封闭后分别与PXR(1 :1 000)、ABCB1(1 :1 000)、CYP3A4(1 :5 000)、CYP3A5(1 :10 000)及β-actin(1 :10 000)抗体溶液于4 ℃孵育,过夜,再与二抗室温孵育1 h后,化学发光法发光曝片。
2.5 统计学处理选择Phoenix-WinNonlin8.1软件以非房室模型分析大鼠体内药动学实验,计算待测药物的t1/2、Vd、CL、AUC、Cmax、Tmax、MRT等药代动力学参数;计量资料以(x±s)表示,采用软件SPSS 16.0对实验数据进行统计分析,多组间的比较选择单因素方差分析。
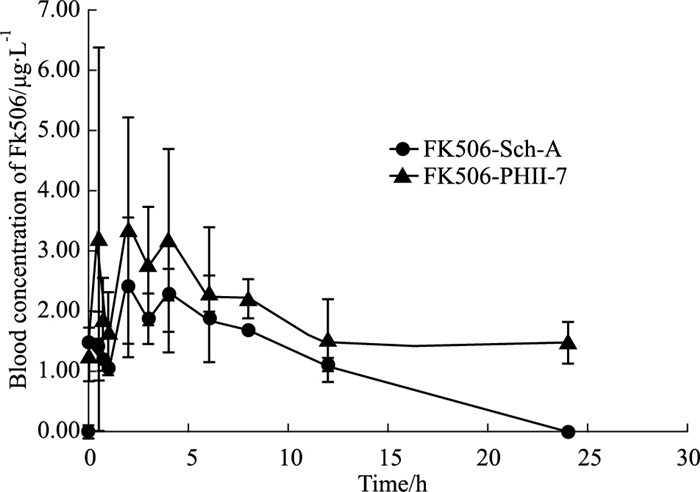
3 结果 3.1 PHⅡ-7和Sch-A对大鼠FK506药动学的影响根据检测结果,以采血时间为横坐标,FK506血药浓度为纵坐标,绘制两组大鼠的药-时曲线(Fig 1),大鼠血浆中的FK506药动学参数计算结果如Tab 3所示。
| Parameter | Unit | FK506+Sch-A | FK506+PHⅡ-7 | P | |
| x±s | x±s | ||||
| t1/2 | h | 5.35±0.55 | 7.40±2.05 | 0.258 | |
| Tmax | h | 3.00±1.15 | 2.63±1.49 | 0.705 | |
| Cmax | ng·mL-1 | 2.99±0.71 | 4.63±1.64 | 0.117 | |
| AUC(0-t) | ng·h·mL-1 | 13.61±9.07 | 35.58±9.70 | 0.016* | |
| AUC(0-∞) | ng·h·mL-1 | 24.47±8.17 | 54.15±18.55 | 0.108 | |
| Vd/F | L·kg-1 | 620.25±145.46 | 397.40±147.41 | 0.155 | |
| CL/F | L·h-1·kg-1 | 81.79±27.32 | 38.19±13.28 | 0.048* | |
| MRT(0-t) | h | 4.19±1.48 | 8.14±3.17 | 0.083 | |
| MRT(0-∞) | h | 9.31±1.33 | 14.83±2.08 | 0.029* | |
| *P < 0.05 vs FK506+Sch-A group | |||||
|
| 图 1 Blood concentration-time curve of FK506 in rats of FK506+Sch-A and FK506+PHⅡ-7 combination group (x±s, n=4) |
结果显示,与FK506+Sch-A组比较,FK506+PHⅡ-7组AUC0-t、CL明显增加(P < 0.05);提示PHⅡ-7像Sch-A一样,可提高FK506 Cmax,增加AUC0-t、CL。
3.2 PHⅡ-7和Sch-A对细胞的毒性作用以药物浓度为横坐标,生存率为纵坐标,绘制细胞生存曲线,观察药物对细胞生长的抑制作用。结果显示,PHⅡ-7和Sch-A均会抑制HepG2或LS174T细胞生长,HepG2和LS174T细胞关于PHⅡ-7的IC50分别为(17.82±1.33) μmol·L-1和(7.17±0.37) μmol·L-1,关于Sch-A的IC50分别为(40.38±4.1) μmol·L-1和(44.1±1.94) μmol·L-1(Fig 2)。

|
| 图 2 Effect of PHⅡ-7 and Sch-A on HepG2 or LS174T, Sch-A as positive control (x±s, n=3) A:HepG2 cells were exposed to different concentrations of PHⅡ-7;B:HepG2 cells were exposed to different concentrations of Sch-A; C:LS174T cells were exposed to different concentrations of PHⅡ-7;D:LS174T cells were exposed to different concentrations of Sch-A. |
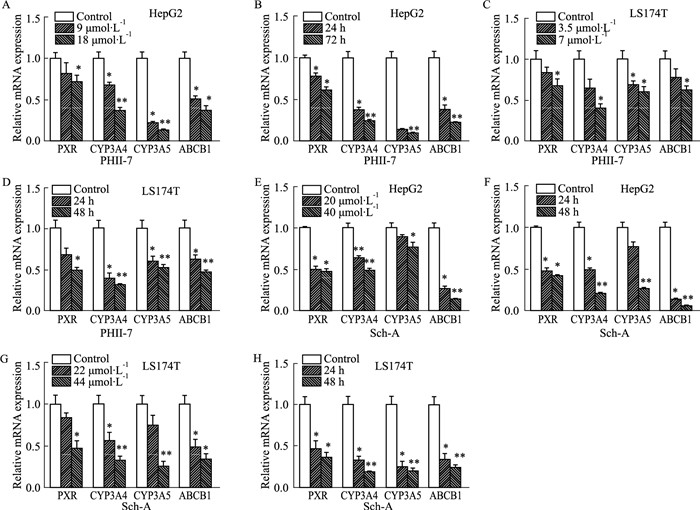
将(0~18 μmol·L-1)PHⅡ-7和(0~44 μmol·L-1)Sch-A分别作用于HepG2和LS174T细胞,作用24、48或72 h后,与control组相比,PHⅡ-7和Sch-A加药处理后,HepG2和LS174T细胞的PXR、CYP3A4、CYP3A5和ABCB1基因mRNA表达明显降低,且呈剂量依赖性与时间依赖性(Fig 3)。
|
| 图 3 Effect of PHⅡ-7 and Sch-A on different gene mRNA in HepG2 and LS174T cells(x±s, n=3) A:HepG2 cells were exposed to 9 or 18 μmol·L-1 PHⅡ-7 for 24 h; B:HepG2 cells were exposed to 18 μmol·L-1 PHⅡ-7 for 24 or 72 h; C:LS174T cells were exposed to 3.5 or 7 μmol·L-1 PHⅡ-7 for 24 h; D:LS174T cells were exposed to 7 μmol·L-1 PHⅡ-7 for 24 or 48 h; E:HepG2 cells were exposed to 20 or 40 μmol·L-1 Sch-A for 24 h; F:HepG2 cells were exposed to 40 μmol·L-1 Sch-A for 24 or 48 h; G:LS174T cells were exposed to 22 or 44 μmol·L-1 Sch-A for 24 h; H:LS174T cells were exposed to 44 μmol·L-1 Sch-A for 24 or 48 h. |
将(0~18 μmol·L-1)PHⅡ-7和(0~44 μmol·L-1)Sch-A分别作用于HepG2和LS174T细胞,作用24、48或72 h后,与control组相比,PHⅡ-7和Sch-A加药处理后,HepG2和LS174T细胞的PXR、CYP3A4、CYP3A5和ABCB1基因蛋白表达降低,且呈剂量依赖性与时间依赖性(Fig 4)。

|
| 图 4 Effect of PHⅡ-7 and Sch-A on different gene protein in HepG2 and LS174T cells (x±s, n=3) A:HepG2 cells were exposed to 9 or 18 μmol·L-1 PHⅡ-7 for 24 h; B:HepG2 cells were exposed to 18 μmol·L-1 PHⅡ-7 for 24 or 72 h; C:HepG2 cells were exposed to 20 or 40 μmol·L-1 Sch-A for 24 h; D:HepG2 cells were exposed to 40 μmol·L-1 Sch-A for 24 or 48 h; E:LS174T cells were exposed to 3.5 or 7 μmol·L-1 PHⅡ-7 for 24 h; F:LS174T cells were exposed to 7 μmol·L-1 PHⅡ-7 for 24 or 48 h; G:LS174T cells were exposed to 22 or 44 μmol·L-1 Sch-A for 24 h; H:LS174T cells were exposed to 44 μmol·L-1 Sch-A for 24 or 48 h. |
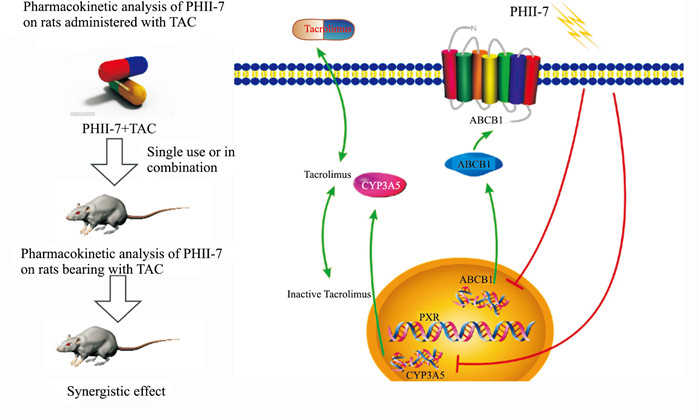
根据上述实验结果,PHⅡ-7对他克莫司作用机制为:PHⅡ-7可通过调节PXR降低CYP3A4、CYP3A5、ABCB1基因的表达,从而影响FK506的转运与代谢,提高血药浓度。相关信号通路如下(Fig 5)。
|
| 图 5 Schemic pathway of PHⅡ-7 on tacrolimus pharmacokinetic pathway in vivo and in vitro |
FK506是目前疗效好无肾毒性的一线免疫抑制剂,但长期应用易引起糖尿病、高血压等并发症,且药物价格高。因此,降低移植术后FK506的用药剂量有十分重要的临床意义和经济学价值。
本实验首次通过体内实验证实PHⅡ-7对FK506具有增效作用,与FK506“节约剂”五酯胶囊的有效成分Sch-A对比发现,PHⅡ-7较Sch-A有更强的增效作用。体外实验表明,PHⅡ-7可通过调节PXR降低CYP3A4、CYP3A5、ABCB1基因的表达,从而影响FK506的转运与代谢,提高血药浓度。我们的实验结果表明,小分子化合物PHⅡ-7作为FK506增效剂具有较好的开发前景,我们今后将进一步完善实验设计,探索PHⅡ-7调节上述基因表达的具体机制。
FK506血药浓度差异的主要受个体间CYP3A酶基因表达强弱的影响,CYP3A4和CYP3A5是CYP3A家族中的主要成员,富集于人的肝脏与小肠,参与包括FK506在内的50%以上临床药物的代谢[5-6]。各种原因引起的CYP3A4/CYP3A5表达降低将增加FK506的体内暴露量,提高药物浓度[7]。大量研究证明,CYP3A5基因多态性对FK506体内代谢过程影响更大[8-9]。除CYP3A5外,在胃肠道中广泛表达的ABC转运蛋白也会对FK506的浓度产生影响,其中最具代表性的就是ABCB1。体内外实验均已证明ABCB1对FK506药动学特性有一定影响[10]。因此本研究以CYP3A5/ABCB1作为研究靶点。
PXR属于核受体中的一员,可调节细胞色素基因及药物转运蛋白的表达。药物可视作PXR配体,吸收进入细胞并与之结合,激动PXR受体,与视黄醛X受体(retinaldehyde X receptor,RXR)发生聚合反应形成复合物,该产物转移至CYP3A5或ABCB1基因上游调控部位,从而影响CYP3A5和ABCB1基因的表达[11]。
五酯胶囊是中药南五味子经醇提获得的脂溶性活性产物,其主要成分为Sch-A[2]。大量的临床研究已发现,FK506与五酯胶囊联用后血药浓度明显升高,目前我国临床上器官移植受者合用FK506和五酯胶囊较为普遍。五酯胶囊不仅可升高FK506浓度,还可能降低FK506慢性肾脏毒性的风险[12]。然而五酯胶囊对FK506的增效作用影响因素较多:五酯胶囊有效成分中虽然Sch-A抑制CYP450酶系作用最强,但五味子醇甲、五味子醇乙、五味子甲素、五味子乙素等均具有抑制P-gp/CYP3A酶系的活性[13],在临床应用过程中可能会带来更大的个体差异,且目前缺乏准确方便的定量方法前瞻性地系统评价五酯胶囊对他克莫司的增效作用,不利于制定患者的联合用药方案。本实验主要采取国家药典中载明的五酯胶囊主要有效成分Sch-A作为阳性对照药物。开发新型的他克莫司小分子增效药物可克服目前五酯胶囊由于成分复杂带来的不确定性,有利于制定规范的个体化联合用药方案,减轻肾移植患者的经济负担。
联合我们的前期研究发现,当归龙荟丸中主要成分青黛对肝药酶表达具有调节作用,靛蓝是青黛的主要成分,PHⅡ-7作为靛蓝中有效成分-靛玉红的衍生物,已有实验证明,它可升高活性氧水平,抑制ABCB1表达,且体内外实验证实有效作用剂量下对细胞毒性较低[14],因此推测PHⅡ-7可能对FK506也有增效作用。
FK506用于肝移植抗排斥的推荐剂量为0.1~0.3 mg·kg-1,折算成大鼠等效剂量为0.63~1.89 mg·kg-1[15],本实验取1.89 mg·kg-1。通过大鼠体内实验及药代动力学分析,表明PHⅡ-7可以提高FK506血药浓度。然后利用分子手段,以人肝癌细胞株HepG2和结肠癌细胞株LS174T为实验对象,发现在抑制作用的浓度范围内,PHⅡ-7对PXR、CYP3A4、CYP3A5、ABCB1 mRNA的表达存在一定的抑制作用,且在蛋白水平得到证实;构建CYP3A5、ABCB1启动子,分别与表达PXR质粒共转染,进一步证明PXR对CYP3A5/ABCB1表达的转录调控作用,利福平有较强的PXR激活效应,在研究药物对核受体信号通路调节作用时(尤其是对核受体抑制时)常作为阳性对照[16],探索药物通过PXR对下游蛋白转录调节作用机制,这种效应可被酮康唑抑制,邓蓉蓉等[17]通过类似的报告基因分析,确定了白黎芦醇(RES)作为PXR激活剂。
FK506是CYP3A和P-gp的底物,而Sch-A作为五酯胶囊的有效成分,也是两者底物,与该药联合应用时会产生竞争性作用,抑制其代谢与转运,从而提高其血药浓度[2]。本实验首次对靛玉红衍生物PHⅡ-7对FK506增效作用及其机制阐述,目前关于PHⅡ-7对FK506的增效作用尚未见报道,本研究从细胞、动物水平多角度首次系统阐述PHⅡ-7通过核受体信号通路对CYP3A5/ABCB1表达的调节作用,证实PHⅡ-7可作为潜在的FK506增效剂进一步开发,也可为开发新的FK506增效剂提供参考。
| [1] |
Provenzani A, Santeusanio A, Mathis E, et al. Pharmacogenetic considerations for optimizing tacrolimus dosing in liver and kidney transplant patients[J]. World J Gastroenterol, 2013, 19(48): 9156-73. doi:10.3748/wjg.v19.i48.9156 |
| [2] |
Qin X L, Chen X, Zhong G P, et al. Effect of Tacrolimus on the pharmacokinetics of bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) and the potential roles of CYP3A and P-gp[J]. Phytomicine, 2014, 21(5): 766-72. |
| [3] |
Kumagai T, Aratsu Y, Sugawara R, et al. Indirubin, a component of Ban-Lan-Gen, activates CYP3A4 gene transcription through the human pregnane X receptor[J]. Drug Metab Pharmacokinet, 2016, 31(2): 139-45. doi:10.1016/j.dmpk.2016.01.002 |
| [4] |
Peng H, Yuan X, Luo S, et al. Reactive oxygen species contribute to TRAIL receptors upregulation; the mechanism for PHⅡ-7 augmenting TRAIL induced apoptosis in leukemia cells[J]. Eur J Pharmacol, 2015, 746: 344-52. doi:10.1016/j.ejphar.2014.10.028 |
| [5] |
Ozdemir V, Kalow W, Tang B K, et al. Evaluation of the genetic component of variability in CYP3A4 activity: a repeated drug administration method[J]. Pharmacogenetics, 2000, 10(5): 373-88. doi:10.1097/00008571-200007000-00001 |
| [6] |
Kamdem L K, Streit F, Zanger U M, et al. Contribution of CYP3A5 to the in vitro hepatic clearance of tacrolimus[J]. Clin Chem, 2005, 51(8): 1374-81. doi:10.1373/clinchem.2005.050047 |
| [7] |
Elens L, Haufroid V. Genotype-based tacrolimus dosing guidelines: with or without CYP3A4*22[J]. Pharmacogenomics, 2017, 18(16): 1473-80. doi:10.2217/pgs-2017-0131 |
| [8] |
Suzuki Y, Homma M, Doki K, et al. Impact of CYP3A5 genetic polymorphism on pharmacokinetics of tacrolimus in healthy Japanese subjects[J]. Br J Clin Pharmacol, 2008, 66(1): 154-5. doi:10.1111/j.1365-2125.2008.03162.x |
| [9] |
Staatz C E, Goodman L K, Tett S E. Effect of CYP3A and ABCB1 single nucleotide polymorphisms on the pharmacokinetics and pharmacodynamics of calcineurin inhibitors: Part II[J]. Clin Pharmacokinet, 2010, 49(4): 207-21. doi:10.2165/11317550-000000000-00000 |
| [10] |
Genvigir F D V, Salgado P C, Felipe C R, et al. Influence of the CYP3A4/5 genetic score and ABCB1 polymorphisms on tacrolimus exposure and renal function in Brazilian kidney transplant patients[J]. Pharmacogenet Genomics, 2016, 26(10): 462-72. doi:10.1097/FPC.0000000000000237 |
| [11] |
油文亭, 周涛, 马增春, 等. 人参皂苷F1通过激活孕烷X受体诱导CYP3A4的表达[J]. 中国药理学通报, 2015, 31(11): 1536-40. You W T, Zhou T, Ma Z C, et al. Ginsenoside F1 induces CYP3A4 expression by activating progesterone X receptor[J]. Chin Pharmacol Bull, 2015, 31(11): 1536-40. doi:10.3969/j.issn.1001-1978.2015.11.012 |
| [12] |
Li J L, Chen S Y, Qin X L, et al. Schisandra sphenanthera Wuzhi Tablet (Extract) is a promising tacrolimus-sparing agent for renal transplant recipients who are CYP3A5 expressers: a two-phase prospective study[J]. Drug Metab Dispos, 2017, 45(11): 1114-9. doi:10.1124/dmd.117.076737 |
| [13] |
Wei H, Tao X, Di P, et al. Effects of traditional Chinese medicine Wuzhi capsule on pharmacokinetics of tacrolimus in rats[J]. Drug Metab Dispos, 2013, 41(7): 1398-403. doi:10.1124/dmd.112.050302 |
| [14] |
Peng H W, Yuan X F, Shi R Z, et al. PHⅡ-7 inhibits cell growth and induces apoptosis in leukemia cell line K562 as well as its MDR-counterpart K562/A02 through producing reactive oxygen species[J]. Eur J Pharmacol, 2013, 718(1-3): 459-68. doi:10.1016/j.ejphar.2013.07.038 |
| [15] |
中华医学会器官移植学分会.他克莫司在临床肝移植中的应用指南[J].临床肝胆病杂志, 2015, 31(9): 1372-4. Chinese society of organ transplantation. Guidelines for the application of tacrolimus in clinical liver transplantation [J]. Clin J Clin Hepatol, 2015, 31(9): 1372-4. http://www.cqvip.com/QK/90100X/201509/666244811.html |
| [16] |
刘志浩, 李燕. 核受体对药物代谢酶和转运体的调控[J]. 药学学报, 2012, 47(12): 1575-81. Liu Z H, Li Y. Regulation of nuclear receptors on drug metabolizing enzymes and transporters[J]. Acta Pharm Sin, 2012, 47(12): 1575-81. |
| [17] |
Deng R, Xu C, Chen X, et al. Resveratrol suppresses the inducible expression of CYP3A4 through the pregnane X receptor[J]. J Pharmacol Sci, 2014, 126(2): 146-54. doi:10.1254/jphs.14132FP |