

2. 山东大学附属山东省千佛山医院呼吸内科,山东 济南 250014;
3. 山东第一医科大学第二附属医院呼吸内科,山东 泰安 271000
2. Shandong Provincial Qianfoshan Hospital, Shandong University, Jinan 250014, China;
3. The Second Affiliated Hospital of Shandong First Medical University, Taian Shandong 271000, China
支气管哮喘是由多种细胞参与的气道炎症性疾病,长期慢性炎症导致气道高反应性、气道阻塞、粘液分泌过多和气道重塑。但近年来,人们逐渐认识到仅靠气道炎症并不足以解释哮喘的发病机制。气道重塑包括细胞外基质蛋白沉积导致基底膜增厚、上皮下纤维化、杯状细胞化生、粘液分泌过多,引起气流受限进一步导致气道高反应性,肺功能下降,从而损害肺的结构和功能[1]。
白介素27(interleukin-27,IL-27)是一种属于IL-12家族的细胞因子,主要由抗原呈递细胞产生,包括树突状细胞、单核细胞、巨噬细胞等[2]。这种细胞因子与IL-27受体结合并传递信号。IL-27可以通过刺激单核细胞、成纤维细胞、肥大细胞、上皮细胞等诱发一系列炎症事件[3]。另一方面,IL-27具有抗炎作用,能抑制Th1、Th2、Th17细胞亚群的发育,进一步促进IL-10的产生[4]。此外,研究表明,IL-27能够抑制哮喘小鼠的气道炎症[5]。
PI3K/Akt信号通路是参与细胞生长、存活、增殖、凋亡、蛋白合成、逆转录和自噬的重要信号通路。罗红霉素可能通过PI3K/Akt通路抑制气道平滑肌细胞增殖[6]。Xu等[7]发现,黄芩通过PI3K/Akt/NF-κB通路减轻香烟烟雾介导的COPD大鼠气道重塑。益肺散结方通过PI3K/Akt/mTOR信号通路增强小鼠肺纤维化模型的自噬作用进而抑制肺纤维化[8]。我们通过建立哮喘小鼠模型,进一步研究IL-27对哮喘小鼠气道重塑的影响及其可能机制。
1 材料与方法 1.1 实验动物18只清洁级BALB/c ♀小鼠,8~10周龄,体质量(20±2)g,购于山东大学实验动物中心,合格证号:SCXK(鲁)20190003。
1.2 主要试剂卵蛋白(ovalbumin,OVA)购于美国Sigma公司, 鼠IL-27因子(货号:2799-ML-010)购于美国R&D公司,抗α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)抗体(货号:56856S)、p-Akt抗体(货号:4060T)、Akt抗体(货号:4691T)购于美国CST公司,抗GAPDH抗体(货号:60004-1-Ig)购于美国protein Technology Group公司,TRIzol试剂购于Invitrogen公司;SDS-PAGE凝胶配制试剂盒和超敏ECL化学发光试剂盒购于中国碧云天生物技术研究所。超声雾化器购于德国PARI BOY RX公司,Bio-Rad CFX96 Touch q-PCR系统购于美国Bio-Rad Laboratories公司,Olympus光学显微镜购于日本OLYMPUS公司。
1.3 方法 1.3.1 哮喘小鼠模型[5]18只小鼠按照随机的原则分为3组:对照组、哮喘组、IL-27治疗组。IL-27治疗组在d 0~d 14给予IL-27(50 ng/只,每天2次)滴鼻治疗,哮喘组和IL-27组在d 7和d 14腹腔注射OVA混悬液(1 mg OVA+100 mg氢氧化铝)致敏,空白组以等量PBS代替。在d 21~d 35,哮喘组和IL-27治疗组给予1% OVA溶液(OVA 0.1 g+生理盐水10 mL)雾化30 min,每天1次,IL-27治疗组在雾化前30 min给予IL-27(50 ng/只)滴鼻,对照组用等量PBS雾化吸入。在最后一次激发后24 h内麻醉并处死各组小鼠。
1.3.2 肺组织HE染色取部分肺组织固定,脱水, 石蜡包埋、切片,厚度4 μm,HE染色,封片,400倍光镜下观察,观察每组小鼠炎症细胞的浸润情况、气道壁的厚度及气道损伤情况。采用Image-Pro Plus 6.0软件对气道壁总面积(Wat)进行评估,采用基底膜周长(Pbm)对Wat进行统一化。采用Wat/Pbm比值(Wat/Pbm)评价气道重构。
1.3.3 肺组织Masson染色部分肺组织切片脱蜡, 苏木精染色,中性树胶固定。在光学显微镜下观察,最后用Image-Pro Plus 6.0分析软件对测定上皮下Masson阳性面积(μm2)和支气管基底膜周长(μm),以支气管基底膜周长进行标准化,分析胶原沉积情况。
1.3.4 免疫组织化学法测定α-SMA表达量固定好的肺组织切片,脱蜡、再水化,抗原修复。在37℃下用5%牛血清封闭20 min。抗α-SMA抗体(1 :600)在4 ℃孵育过夜。在室温下,用多克隆山羊抗兔免疫球蛋白/辣根过氧化物酶(1 :200)孵育30 min。光学显微镜下观察切片,使用Image-Pro Plus 6.0分析软件进行分析。
1.3.5 实时荧光PCR检测α-SMA在肺组织中mRNA的表达小鼠肺组织总RNA的提取用TRIzol试剂,然后用PrimeScript RT试剂盒反转录成cDNA。用SYBR预混剂进行扩增。α-SMA上游引物:5′-CCCAACTGGGACCACATGG-3′, 下游引物5′-GAAGTTACAGGGGGCGTACAT-3′;GADPH上游引物:5′-CCCATGTTTGTGATGGGTGT-3′, 下游引物:5′-TGGTGTCAGGTACGGTAGTG-3′。反应程序:95 ℃ 5 min,95 ℃ 30 s和65 ℃ 30 s,30个扩增循环。根据2-△△CT公式计算α-SMA mRNA的相对表达量。
1.3.6 Western blot检测α-SMA、p-Akt、Akt在肺组织中蛋白的表达肺组织溶解于RIPA缓冲液中。匀浆冰上静置30 min,离心(12 000 r·min-1,4 ℃,30 min)取上清。测定蛋白质浓度,以4 :1混于5×上样缓冲液中,金属浴15 min。配8%分离胶和5%浓缩胶进行蛋白凝胶电泳,将蛋白转移到PVDF膜上。用5%脱脂牛奶进行封闭,并在4 ℃孵育过夜:α-SMA(1 :1 000)和GAPDH(1 :2 000),用含Tween的TBS洗3次,每次10 min,二抗(1 :10 000)在室温下孵育2 h,TBST重复洗3次,ECL发光试剂盒显影。用Imag J分析条带的积分光密度值。
1.3.7 统计分析GraphPad Prism 5.0进行统计分析和统计图的绘制, 数据用 x±s表示。各组数据均采用单因素方差分析(one-way ANOVA), 组间两两比较采用LSD法。
2 结果 2.1 哮喘模型评估OVA激发后,哮喘组小鼠出现明显的狂躁、易激惹、打喷嚏、流涕、呼吸频率急促、体质量减轻等症状。对照组和IL-27治疗组未见明显变化。
2.2 HE染色对照组小鼠肺组织管腔完整,支气管内无明显炎性细胞浸润,气道平滑肌未见增厚;哮喘组可见支气管腔狭窄,气道和血管周围可见明显的炎性细胞浸润;IL-27治疗组较哮喘组明显改善,炎性细胞明显减少,但仍不能恢复到对照组的水平。哮喘组气管壁厚度高于对照组(P<0.05);IL-27治疗组较哮喘组明显下降, 但仍高于对照组, 差异有统计学意义(P<0.05), 见Fig 1。
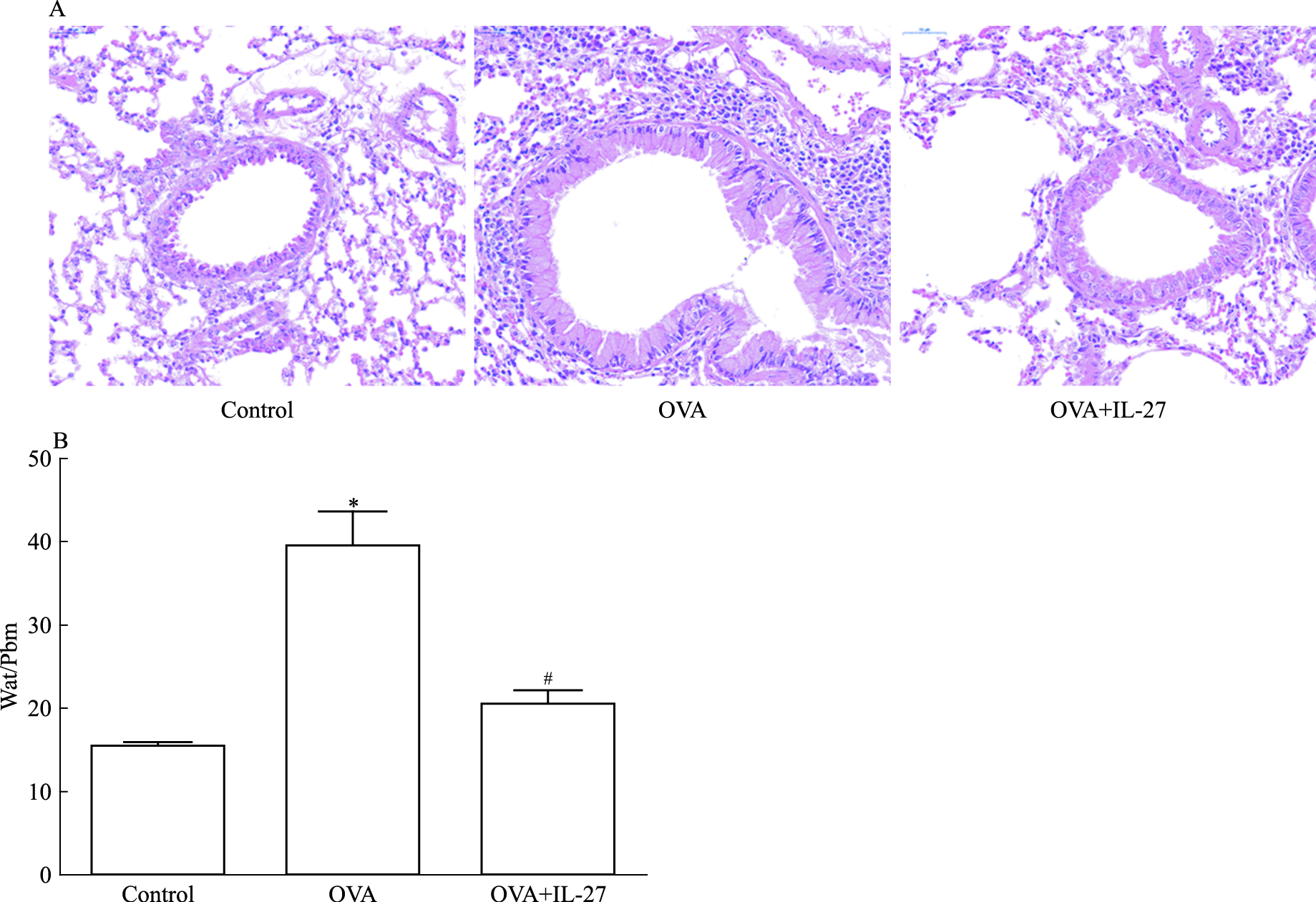
|
| Fig 1 IL-27 reduced airway inflammation and airway wall thickness in asthmatic mice(x±s, n=6) A:HE staining of lung tissues at 400× magnification; B:The quantitative analysis of the thickness of airway wall.*P < 0.05 vs control; #P < 0.05 vs OVA |
Masson染色结果显示对照组肺组织可见少量蓝色胶原,哮喘组和IL-27治疗组较对照组支气管上皮下胶原沉积明显加重(P<0.05),且IL-27组上皮下胶原沉积情况较哮喘组明显减轻(P<0.05), 见Fig 2。
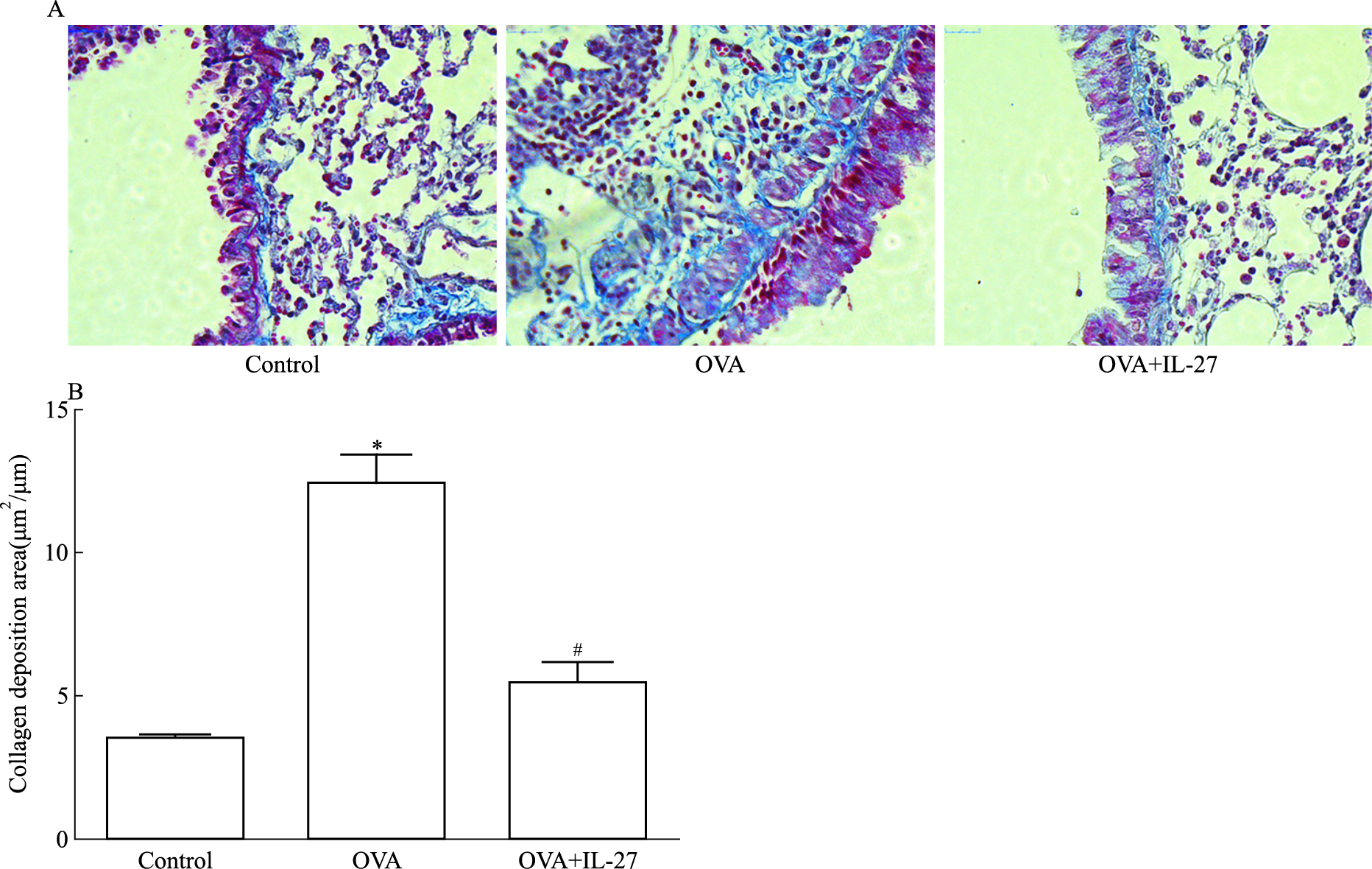
|
| Fig 2 IL-27 suppressed collagen deposition in asthmatic mice(x±s, n=6) A: Masson′s staining of lung tissue at (400×); B: The quantitative analysis of collagen deposition.*P < 0.05 vs control; #P < 0.05 vs OVA |
免疫组化结果显示,哮喘组小鼠肺组织α-SMA阳性面积明显高于对照组(P<0.01),而IL-27治疗后α-SMA阳性面积较哮喘组明显下降,差异有统计学意义(P<0.01),见Fig 3。
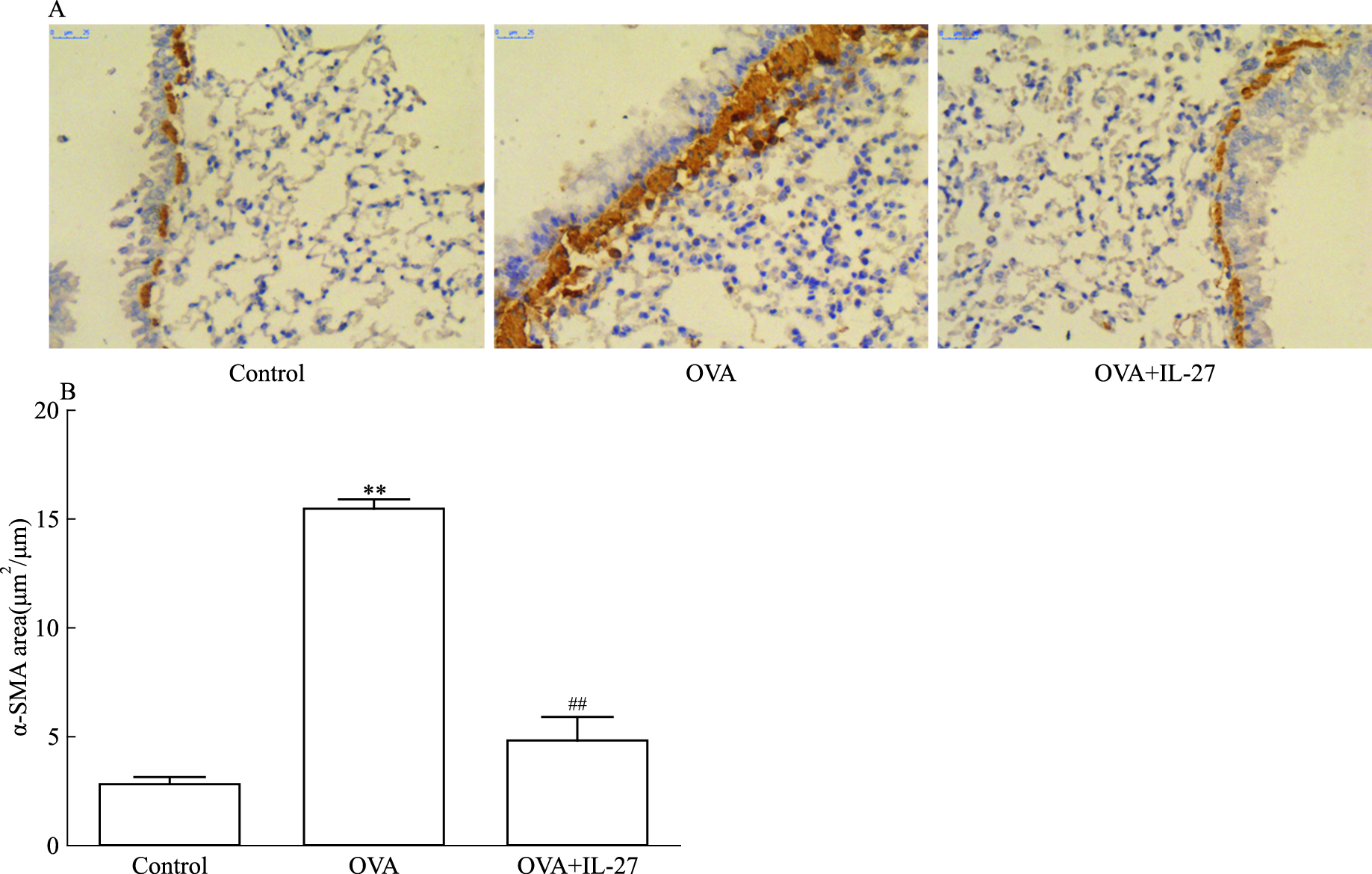
|
| Fig 3 IL-27 inhibited proliferation of airway smooth muscle cells in asthmatic mice(x±s, n=6) A: The expression of α-SMA in lung tissue were examined by immunohistochemistry (×400); B: The semiquantitative analysis of α-SMA.**P < 0.01 vs control; ##P < 0.01 vs OVA |
在mRNA水平上,哮喘组小鼠α-SMA的表达量较对照组明显升高(P<0.05), 而IL-27治疗组小鼠α-SMA的表达较哮喘组下降,差异有统计学意义(P<0.05)。在蛋白水平上,与对照组相比,哮喘组小鼠α-SMA的表达明显增加,IL-27治疗能明显下调这一表达,差异有统计学意义(P<0.05),见Fig 4。
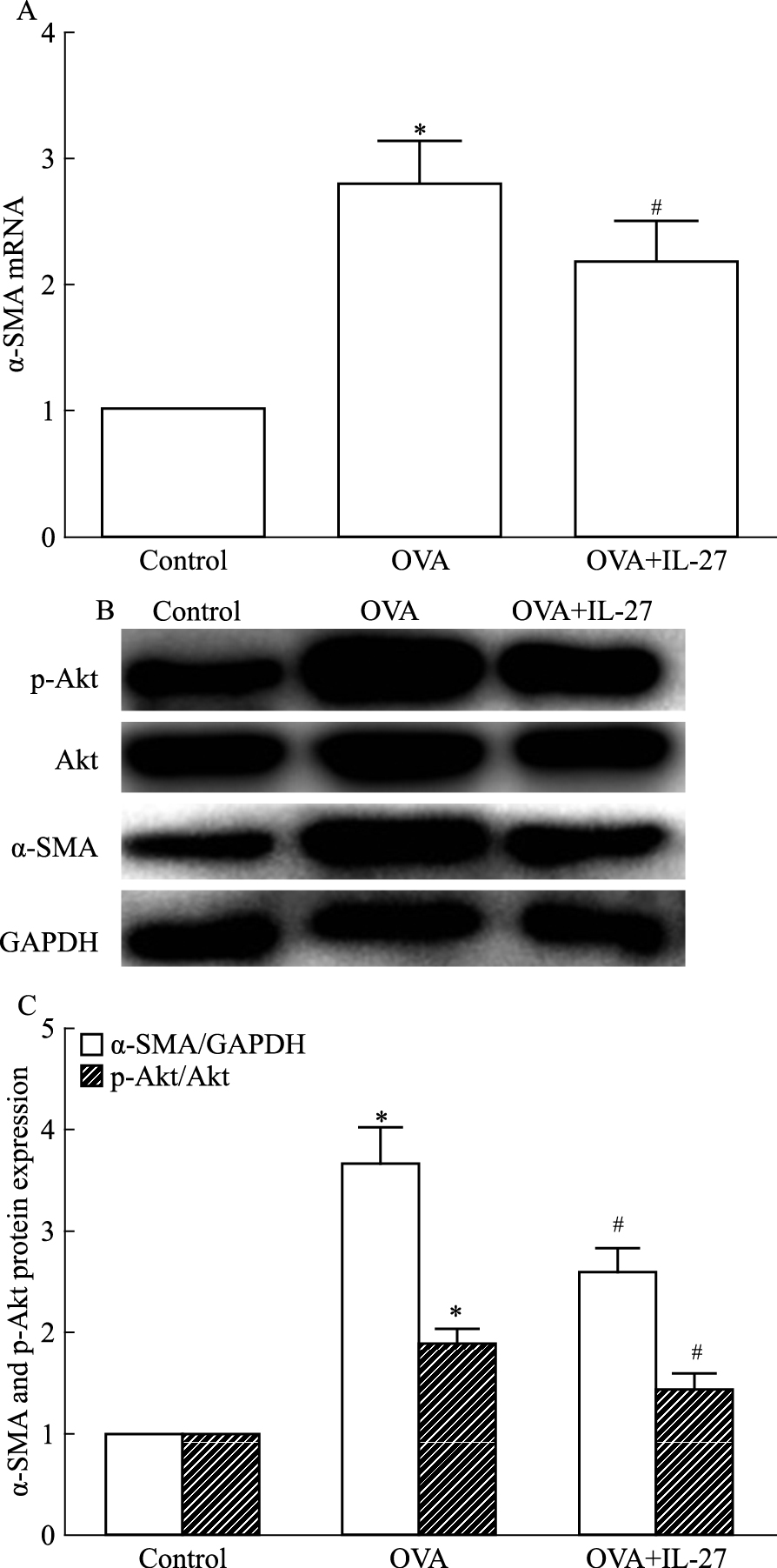
|
| Fig 4 IL-27 inhibited expression of α-SMA and phosphorylationof Akt in asthmatic mice(x±s, n=6) A: The expression of α-SMA mRNA in the lung tissues were determined by RT-PCR; B: The expression of α-SMA, p-Akt and Akt was assessed by Western blot; C: The analysis of the α-SMA and p-Akt expressioprotein.*P < 0.05 vs control; #P < 0.05 vs OVA |
采用Western blot对小鼠肺组织Akt蛋白的磷酸化水平进行检测,结果显示:与对照组相比,哮喘组小鼠肺组织Akt磷酸化水平明显升高(P<0.05),IL-27治疗下调了Akt蛋白的磷酸化水平(P<0.05)。Akt的总蛋白表达在3组间未见明显的变化。因此IL-27可以抑制Akt蛋白的磷酸化,提示IL-27是通过PI3K/Akt通路抑制气道重塑(Fig 4)。
3 讨论哮喘是常见的呼吸系统疾病之一,发病率居高不下,影响到全球3亿多人,每年大约有25万人死亡。过去,人们认为气道炎症是导致气道重塑的主要原因。大量的研究表明,气道重塑不仅仅是慢性炎症反应的结果,甚至与气道炎症同时存在。一些研究表明,IL-27治疗可减轻胶原诱导的关节炎[9]。IL-27能够抑制TGF-β1诱导的肺成纤维细胞增殖、分化和胶原合成[10]。而且,IL-27通过调节Th17细胞的分化能够减轻博莱霉素诱导的肺纤维化[11]。因此,我们推测IL-27能够抑制哮喘小鼠的气道重塑。
气道炎症是哮喘最主要的特征之一,炎症细胞包括嗜酸性粒细胞、中性粒细胞、肥大细胞、巨噬细胞和T淋巴细胞等。炎症细胞浸润可促进气道平滑肌细胞的增殖和迁移,气道平滑肌的重塑是影响哮喘气道重塑病理改变严重程度的重要因素,可释放大量的细胞外基质蛋白,在受到刺激时也能够促进炎症细胞迁移。α-SMA不仅是气道平滑肌的标志物, 而且在成纤维细胞以及上皮细胞向肌成纤维细胞转化和活化的过程中起作用。此外,上皮下胶原过度沉积也是引起气道重塑的重要特征。
本实验成功构建哮喘小鼠气道重塑模型,我们的研究显示:IL-27能够明显抑制哮喘小鼠气道平滑肌的增生、炎性细胞的浸润,减少气管及血管周围胶原沉积面积。哮喘组小鼠α-SMA在气道黏膜下大量沉积,且α-SMA在蛋白及mRNA水平表达明显增高,而IL-27治疗能明显抑制哮喘小鼠α-SMA的表达。因此,本研究证明IL-27除了能够抑制哮喘小鼠的气道炎症外还能抑制气道重塑。
近年来,证据表明,PI3K/Akt信号通路在支气管哮喘中发挥着重要作用。特异性PI3K抑制剂(LY294002)能显著下调小鼠肺组织中Akt的磷酸化,抑制Th2细胞因子的产生、嗜酸性粒细胞浸润、粘液的产生和气道高反应性[12]。过表达miR-200a可能下调FOXC1,通过抑制PI3K/Akt信号通路的激活,最终抑制哮喘患者的气道平滑肌增殖和气道重塑[13]。IL-27通过抑制Akt途径,增强细胞毒性,诱导细胞凋亡,抑制卵巢囊腺癌细胞增殖[14]。IL-27通过激活PI3K/Akt信号通路,诱导支气管上皮细胞表达趋化因子CXCL10[15]。然而,很少有研究报道IL-27与Akt信号通路在哮喘气道重塑上的相关性。Akt作为PI3K的直接下游底物,可通过观察p-Akt的表达来预测PI3K/Akt通路是否激活。在本实验中,研究结果显示,哮喘组小鼠p-Akt的表达明显高于对照组,IL-27组能降低Akt的磷酸化水平。这些结果证实,IL-27通过抑制PI3K/Akt通路而抑制哮喘小鼠的气道重塑。
综上所述,本实验证明IL-27对哮喘小鼠的气道炎症和气道重塑有抑制作用,其机制是通过抑制PI3K/Akt通路。IL-27与气道重塑之间的关系的深入研究,可能为我们治疗顽固性哮喘提供新方向。
| [1] |
咸哲民, 王重阳, 朴玉华, 等. 欧前胡素通过TGF-β1/Smad3和PI3K/Akt信号通路对哮喘小鼠气道重塑模型的影响[J]. 中国药理学通报, 2018, 34(12): 1719-24. Xian Z M, Wang C Y, Piao Y H, et al. Effects of imperatorin on airway remodeling in asthmatic mice through TGF-β1/Smad3 and PI3K/Akt signaling pathways[J]. Chin Pharmacol Bull, 2018, 34(12): 1719-24. doi:10.3969/j.issn.1001-1978.2018.12.019 |
| [2] |
Pflanz S, Timans J C, Cheung J, et al. IL-27, a heterodimeric cytokine composed of EBI3 and p28 protein, induces proliferation of naive CD4+T cells[J]. Immunity, 2002, 16(6): 779-90. doi:10.1016/S1074-7613(02)00324-2 |
| [3] |
Kalliolias G D, Ivashkiv L B. IL-27 activates human monocytes via STAT1 and suppresses IL-10 production but the inflammatory functions of IL-27 are abrogated by TLRs and p38[J]. J Immunol, 2008, 180(9): 6325-33. doi:10.4049/jimmunol.180.9.6325 |
| [4] |
Hall A O, Silver J S, Hunter C A. The immunobiology of IL-27[J]. Adv Immunol, 2012, 115: 1-44. doi:10.1016/B978-0-12-394299-9.00001-1 |
| [5] |
Su X, Pan J, Bai F, et al. IL-27 attenuates airway inflammation in a mouse asthma model via the STAT1 and GADD45gamma/p38 MAPK pathways[J]. J Transl Med, 2016, 14(1): 283. doi:10.1186/s12967-016-1039-x |
| [6] |
徐慧, 戴元荣, 李凤琴, 等. 罗红霉素对哮喘平滑肌细胞增殖以及微囊蛋白-1及PI3K/Akt的影响[J]. 中国药理学通报, 2015, 31(3): 407-11. Xu H, Dai Y R, Li F Q, et al. Effect of roxithromycin on asthma smooth muscle cells proliferation, caveolin-1 and PI3K/Akt pathway[J]. Chin Pharmacol Bull, 2015, 31(3): 407-11. doi:10.3969/j.issn.1001-1978.2015.03.022 |
| [7] |
Xu F, Lin J, Cui W, et al. Scutellaria baicalensis attenuates airway remodeling via PI3K/Akt/NF-kappaB pathway in cigarette smoke mediated-COPD rats model[J]. Evid Based Complement Alternat Med, 2018, 2018: 1281420. |
| [8] |
Yu J Z, Ying Y, Liu Y, et al. Antifibrotic action of Yifei Sanjie formula enhanced autophagy via PI3K-AKT-mTOR signaling pathway in mouse model of pulmonary fibrosis[J]. Biomed Pharmacother, 2019, 118: 109293. doi:10.1016/j.biopha.2019.109293 |
| [9] |
Niedbala W, Cai B, Wei X, et al. Interleukin 27 attenuates collagen-induced arthritis[J]. Ann Rheum Dis, 2008, 67(10): 1474-9. doi:10.1136/ard.2007.083360 |
| [10] |
Dong Z, Zhao X, Tai W, P, et al. IL-27 attenuates the TGF-beta1-induced proliferation, differentiation and collagen synthesis in lung fibroblasts[J]. Life Sci, 2016, 146: 24-33. doi:10.1016/j.lfs.2016.01.004 |
| [11] |
Dong Z, Lu X, Yang Y, et al. IL-27 alleviates the bleomycin-induced pulmonary fibrosis by regulating the Th17 cell differentiation[J]. BMC Pulm Med, 2015, 15: 13. doi:10.1186/s12890-015-0012-4 |
| [12] |
Duan W, Aguinaldo Datiles A M, Leung B P, et al. An anti-inflammatory role for a phosphoinositide 3-kinase inhibitor LY294002 in a mouse asthma model[J]. Int Immunopharmacol, 2005, 5(3): 495-502. doi:10.1016/j.intimp.2004.10.015 |
| [13] |
Liu Y, Miao Y, Gao X, et al. MicroRNA-200a affects the proliferation of airway smooth muscle cells and airway remodeling by targeting FOXC1 via the PI3K/AKT signaling pathway in ovalbumin-induced asthmatic mice[J]. Cell Physiol Biochem, 2018, 50(6): 2365-89. doi:10.1159/000495097 |
| [14] |
Zhang Z, Zhou B, Zhang K, et al. IL-27 suppresses SKOV3 cells proliferation by enhancing STAT3 and inhibiting the Akt signal pathway[J]. Mol Immunol, 2016, 78: 155-63. doi:10.1016/j.molimm.2016.09.014 |
| [15] |
Cao J, Zhang L, Li D, et al. IL-27 is elevated in patients with COPD and patients with pulmonary TB and induces human bronchial epithelial cells to produce CXCL10[J]. Chest, 2012, 141(1): 121-30. |

