


汤小雨(1995-),女,硕士生,研究方向:抗炎免疫药理学,共同第一作者, E-mail: 3354961649@qq.com;
蔡小雨(1994-),女,硕士生,研究方向:抗炎免疫药理学,共同第一作者, E-mail: cxyahmu@126.com。
魏伟(1960-),男,博士,教授,博士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail: wwei@ahmu.edu.cn
类风湿关节炎(rheumatoid arthritis,RA)以慢性滑膜炎及关节、软骨和骨组织的破坏为特征,可导致全身性炎症和自身抗体的产生,它是一种全身性自身免疫性疾病。T细胞亚群的失衡与T细胞的异常活化是RA发生、发展的关键因素之一,其中Th17细胞作为辅助性T细胞(helper T cell,Th)的新亚型之一,在自身免疫病中占据重要地位。JAK是一种新型RA药物作用靶点,JAK/STAT信号通路参与细胞的增殖、分化、凋亡以及免疫调节过程,具有强效抗炎作用[1]。JAK/STAT信号通路的激活能够促进转录因子维A酸相关孤独受体γ-t(retinoic acid-related orphan nuclear hormone receptor γ-t,RORγ-t)的表达。RORγ-t是Th17细胞的特异转录因子,它的激活可以促进Th17细胞的分化及细胞因子IL-17A的分泌,参与炎症进程[2, 3]。白芍总苷于1998年在中国被批准用于治疗RA,具有抗炎和免疫调节作用。芍药苷-6′-O-苯磺酸酯(CP-25)是对白芍总苷的主要有效成分芍药苷进行化学结构修饰得到的活性单体。实验室前期研究发现,CP-25可能通过调控T细胞亚群分化和活化对胶原性关节炎[4]、佐剂性关节炎[5]和干燥综合征[6]动物模型发挥治疗作用,但是否通过JAK/STAT3/RORγ-t/IL-17A信号通路调控T细胞分化,目前尚不清楚。本实验以JAK/STAT3及下游信号通路的活化为切入点,研究CP-25对人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中JAK/STAT3/RORγ-t/IL-17A信号通路的调节及Th17细胞分化的影响。
1 材料 1.1 样本从健康人外周血(取自安徽医科大学第一附属医院)中分离的PBMCs。
1.2 药物与试剂CP-25由安徽医科大学临床药理研究所制药部门提供,白色粉末,纯度大于98%;Recombinant Human TNF-α购自novoprotein公司(批号:C008);细胞刺激混合物(包含佛波酯、离子霉素、布雷菲尔德菌素A)购于美国eBioscience公司(批号:00-4975-03);艾拉莫德购于江苏先声药业有限公司国家药品标准H20110084(25 mg·14粒/盒); 托法替布购于美国MCE公司(批号:HY-40354A); 人淋巴细胞分离液购于深圳达科为公司(批号:7111011);RPMI 1640培养液购于美国Gibco公司(批号:11875093);四季青特级胎牛血清购于浙江天杭公司(批号:13011-8611);细胞增殖试剂盒购于天津百萤生物(批号:35001);PE通道小鼠抗人IL-17A(批号:560438)、FITC通道小鼠抗人CD4抗体(批号:555346)购自Becton Dickinson公司; STAT3(批号:12640)、p-STAT3(批号:9145)、JAK1(批号:3344)、JAK2(批号:3230)、JAK3(批号:8863)抗体购自Cell Signaling Technology公司; p-JAK1(批号:YP0154)、p-JAK3(批号:YP0756)抗体购自Immunoway公司; p-JAK2(批号:ARG57812)、IL-17A(批号:ARG55256)抗体购自Arigobio公司; RORγ-t抗体购自Novus Biologicals公司(批号:NBP2-24449);Alexa Fluor 647标记山羊抗兔荧光二抗(批号:FMS-RBaf64701)、Alexa Fluor 647标记山羊抗小鼠荧光二抗(批号:FMS-Msaf64701)购自南京福麦斯生物技术有限公司; ECL发光显色试剂盒购于美国Thermo Pierce试剂公司(批号:NCI4106)。
1.3 仪器BioTek Elx×808酶标仪(美国Bio Tek公司); FC500流式细胞仪(美国Beckman公司); KDC-40超速离心机(科大创新中佳公司); ImageQuant LAS 4000荧光及化学发光成像系统(美国GE公司); BX-50型正置显微镜(日本Olympus公司)。
2 方法 2.1 密度梯度离心法分离人PBMCs在无菌离心管中加入一定体积的人淋巴细胞分离液,用无菌PBS按照1 :1稀释新鲜人抗凝全血。将稀释后的血样小心加到分离液上方后3 000 r·min-1离心30 min。用无菌巴氏吸管将血浆层与分离液层间单个核细胞层吸出,加入无菌PBS洗涤两遍,离心弃上清,用含有10% FBS的RPMI 1640将底部离心下来的细胞重悬备用,得到的细胞悬液即为人PBMCs。
2.2 CCK-8法检测CP-25对人PBMCs增殖功能的影响将2.1分离出的人PBMCs悬液计数,调整细胞密度为1×109·L-1。在96孔板中每孔加入100 μL细胞悬液,加入TNF-α(10 μg·L-1)与细胞刺激混合物(2 mL·L-1)联合刺激。按照空白对照组、刺激组、CP-25组(10 μmol·L-1)、艾拉莫德组(80 μmol·L-1)、托法替布组(10 μmol·L-1),每组设5个复孔,置于5% CO2,37 ℃培养箱中培养24 h后,加入10 μL CCK-8试剂,用锡箔纸包好培养板避光,置于5% CO2,37 ℃培养箱中避光培养30 min、1 h、2 h和3 h后,用酶标仪检测A450 nm值,选取合适时间点进行数据统计分析。
2.3 流式细胞术检测STAT3、p-STAT3、RORγ-t和IL-17A在人PBMCs中Th细胞的表达将人PBMCs细胞悬液铺于24孔板中,每组4个孔,每孔5×106个细胞,按照空白对照组、细胞刺激剂刺激组、CP-25组、艾拉莫德组、托法替布组进行刺激加药处理,培养24 h后将培养板中的每孔细胞吸取转移至ep管中,用PBS清洗2次,离心弃上清。加入150 μL PBS和5 μL表面抗体CD4(FITC通道)重悬细胞,避光室温孵育20 min。PBS洗涤离心后进行固定、破膜、封闭等操作,加入150 μL PBS重悬细胞,标记每组的4管细胞分别为a、b、c、d。a管加入10 μL IL-17A(PE通道)进行直接荧光标记; b、c、d管分别加入10 μL STAT3、10 μL p-STAT3、10 μL RORγ-t一抗,避光室温孵育1 h。加入PBS清洗两次离心弃上清,a管直接加入250 μL PBS重悬细胞。b、c、d管分别加入10 μL相对应的荧光二抗(Alexa Fluor 647)进行间接荧光标记避光室温孵育2 h,PBS清洗离心弃上清,加入250 μL PBS重悬细胞。a、b、c、d管经纱网过滤转移至流式管,上机分别检测人PBMCs中Th细胞中p-STAT3、STAT3、RORγ-t和IL-17A指标的变化。
2.4 Westernblot检测相关蛋白表达取人PBMCs细胞悬液接种于6孔板中,按照空白对照组、细胞刺激剂刺激组、CP-25组、艾拉莫德组、托法替布组进行刺激加药处理,培养24 h后用移液枪转移至ep管中,离心弃上清。加入预冷PBS缓冲液洗涤两次,离心弃上清。按照RIPA :PMSF :磷酸酶抑制剂=98 :1 :1的比例配制110 μL的细胞裂解液,加入配制好的细胞裂解液充分混匀,冰上裂解30 min后,冰上超声1 min,4 ℃,12 000 r·min-1,15 min离心留上清,即为总蛋白。取10 μL样品进行蛋白定量,剩余100 μL上清液加入蛋白上样缓冲液混匀,沸水中煮10 min。配10%浓度的分离胶,经过上样、电泳、转膜和封闭等操作后,4 ℃孵育过夜一抗(1 :500):p-JAK1、JAK1、p-JAK2、JAK2、p-JAK3、JAK3、p-STAT3、STAT3、RORγ-t、IL-17A,次日孵育二抗,显影。
2.5 统计学分析实验所得的相关数据均采用SPSS17.0进行统计学分析,两组采用t检验进行比较,多组间数据进行比较采用单因素方差分析(ANOVA),实验数据x±s进行比较。利用GraphPad Prism 5.0软件进行实验数据相关图形的绘制。
3 结果 3.1 CP-25对人PBMCs增殖功能的影响采用CCK-8法分析CP-25对人PBMCs增殖功能的影响。Fig 1结果显示,与空白对照组相比,用细胞刺激剂刺激人PBMCs 24 h后,PBMCs的增殖反应增强,差异有统计学意义(P < 0.01)。与刺激组相比,CP-25、艾拉莫德和托法替布能明显抑制细胞刺激剂诱导的人PBMCs的增殖反应(P < 0.01)。提示CP-25能够抑制体外诱导的人PBMCs异常增殖反应。

|
| 图 1 Effect of CP-25 on proliferation rate of human PBMCs(x±s, n=3) **P < 0.01 vs control; ##P < 0.01 vs stimulated |
采用流式细胞术分析CP-25对人PBMCs中CD4+ Th细胞的p-STAT3和STAT3表达的影响。与空白对照组相比,细胞刺激剂作用于人PBMCs 24 h后,可以明显升高人PBMCs中Th细胞的p-STAT3和STAT3的表达,差异具有统计学意义(P < 0.01)。与刺激组相比,CP-25、艾拉莫德和托法替布能明显降低人PBMCs中Th细胞的p-STAT3和STAT3的表达,差异具有统计学意义(P < 0.01)(Fig 2A和2B)。提示CP-25可能通过调节JAK/STAT3信号通路下调人PBMCs中Th细胞的中p-STAT3和STAT3指标。
3.3 CP-25对人PBMCs中CD4+Th细胞的RORγ-t表达和Th17细胞百分比的影响流式细胞术结果显示,与空白对照组相比,细胞刺激剂作用于人PBMCs 24 h后,可以明显升高人PBMCs中CD4+ Th细胞的RORγ-t的表达和CD4+ IL-17A+ Th17细胞的百分比,差异具有统计学意义(P < 0.01)。与刺激组相比,CP-25、艾拉莫德和托法替布能明显降低人PBMCs中Th细胞的RORγ-t表达和CD4+ IL-17A+ Th17细胞的百分比,差异具有统计学意义(P < 0.01)(Fig 3A和3B)。提示CP-25可能通过调控JAK/STAT3/RORγ-t/IL-17A信号通路抑制Th17细胞的分化。
3.4 CP-25对人PBMCs中JAK/STAT3信号通路的影响采用Western blot分析CP-25对人PBMCs中JAK/STAT3信号通路的影响。Fig 4结果显示,与空白对照组相比,细胞刺激剂作用于人PBMCs 24 h后,可以明显升高人PBMCs中p-JAK1、p-JAK2、p-JAK3、p-STAT3和STAT3蛋白表达,差异具有统计学意义(P < 0.01),而对JAK1、JAK2、JAK3蛋白表达无明显作用。与刺激组相比,CP-25和托法替布能明显降低人PBMCs中p-JAK1、p-JAK2、p-JAK3、p-STAT3和STAT3蛋白表达,差异具有统计学意义。艾拉莫德能明显降低人PBMCs中p-JAK1、p-JAK2、p-JAK3、p-STAT3蛋白表达,差异具有统计学意义(Fig 4A和4B)。进一步验证了CP-25对JAK/STAT3信号通路的调控作用。
3.5 CP-25对人PBMCs中RORγ-t、IL-17A蛋白表达的影响Westernblot结果显示,与空白对照组相比,细胞刺激剂作用于人PBMCs 24 h后,可以明显升高人PBMCs中RORγ-t、IL-17A蛋白表达,差异具有统计学意义(P < 0.01)。与刺激组相比,CP-25、艾拉莫德和托法替布能明显降低人PBMCs中RORγ-t和IL-17A蛋白表达(P < 0.01),差异具有统计学意义(Fig 5A和5B)。进一步验证CP-25可能通过调控JAK/STAT3/RORγ-t/IL-17A信号通路抑制Th17细胞的分化。
4 讨论 4.1 CP-25是一个潜在炎症免疫反应软调节药物已经上市的治疗RA的药物主要包括非甾体抗炎药、甾体抗炎药、传统改善病情抗风湿药等药物,虽然治疗作用明确但也存在不良反应。炎症免疫反应软调节(soft regulation of inflammatory immune responses, SRIIR)药物能够选择性调控机体组织细胞功能、基因和蛋白异常变化所致的病理状态并使其恢复至生理水平,该类药物控制炎症免疫应答相关细胞过度活化且不损害其生理功能,因此,研发SRIIR药物是未来抗炎免疫药物的一个趋势[7]。课题组前期研究发现,CP-25能够恢复干燥综合征、佐剂性关节炎和胶原诱导性关节炎动物模型的炎症指标,缓解关节肿胀、降低脾脏组织病理学评分。CP-25主要通过调节T、B细胞亚群的增殖、活化和分化[8],抑制成纤维样滑膜细胞[9]、内皮细胞的异常活化,抑制M1巨噬细胞活化,增强M2巨噬细胞极化,对免疫功能异常发挥调节作用[11]。CP-25还可以通过调节GRK2的685位丝氨酸的磷酸化, 从而影响GRK2与EP4的结合, 使EP4受体复敏,改善RA患者滑膜细胞株功能从而发挥治疗RA的作用[12]。本实验研究发现,TNF-α与细胞刺激混合物联合刺激能诱发人PBMCs的异常增殖,CP-25能明显抑制细胞刺激剂诱导人PBMCs的异常增殖,提示CP-25是一个潜在炎症免疫反应软调节药物。
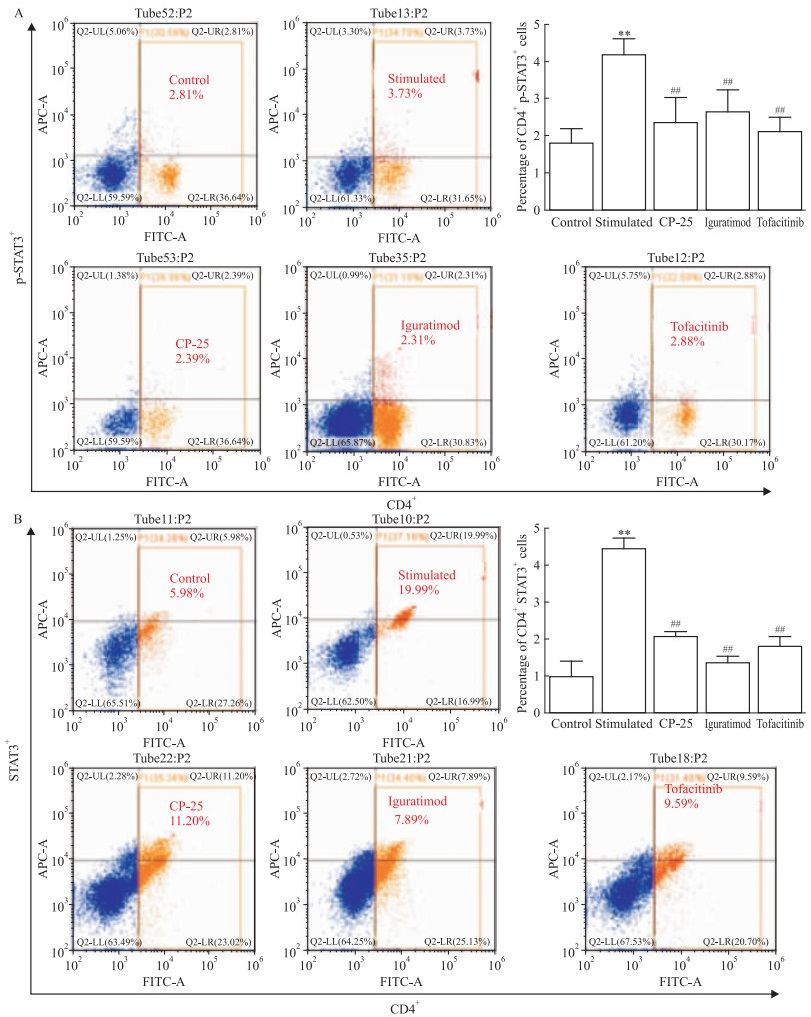
|
| 图 2 Effect of CP-25 on p-STAT3 and STAT3 expression of Th cells in human PBMCs(x±s, n=3) A:Effect of CP-25 on p-STAT3 expression of Th cells in human PBMCs; B:Effect of CP-25 on STAT3 expression of CD4+Th cells in human PBMCs.**P < 0.01 vs control; ##P < 0.01 vs stimulated |

|
| 图 3 Effect of CP-25 on RORγ-t expression of Th cells and Th17 percentage in human PBMCs(x±s, n=3) A:Effect of CP-25 on RORγ-t expression of CD4+Th cells in human PBMCs; B:Effect of CP-25 on CD4+ IL-17A+ Th17 percentage in human PBMCs.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs stimulated |
RA炎症条件下,JAK/STAT3通路的激活使RORγ-t表达增加,RORγ-t作为控制Th17细胞分化的关键转录因子,它的激活可以启动Th17细胞的分化,并刺激Th17细胞分泌IL-17A[2]。除此之外,IL-6和TNF-α也可激活Th17细胞的分化以及IL-17A、IL-22等促炎症因子的分泌。IL-17A具有强致炎作用,可诱导炎性细胞因子的产生和招募白细胞,在促炎症反应和自身免疫性疾病中发挥着重要作用[13]。细胞刺激混合物主要成分包括佛波酯、离子霉素、布雷菲尔德菌素A,前两者可以刺激细胞分泌IL-17A,第3个成分能够抑制IL-17A穿过细胞膜分泌到细胞外。艾拉莫德是国家食品药品监督管理局2011年8月临床批准的Ⅰ类新药,用于治疗成人活动性RA。文献报道艾拉莫德可以通过下调Th17细胞百分比,同时上调Treg细胞百分比来恢复RA患者内环境的细胞稳态,从而缓解疾病发展[14]。托法替布是一种与ATP高度相似、但无磷酸基团的小分子化合物,这种结构相似性使其能与ATP竞争性结合并抑制JAK激酶活性[15]。托法替布作为最早被批准用于治疗RA的JAK抑制剂,能明显抑制JAK3、JAK1活性,较小程度抑制JAK2活性,对RA等炎症免疫疾病发挥治疗作用,本实验选用艾拉莫德和托法替布作为阳性对照药。
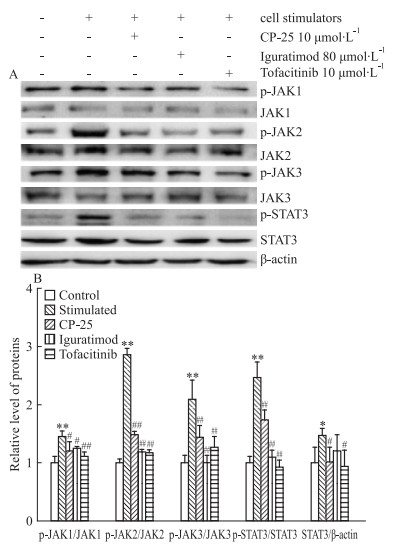
|
| 图 4 Effect of CP-25 on JAK/STAT3 signaling pathway in human PBMCs(x±s, n=3) A:Expression of p-JAK1, JAK1, p-JAK2, JAK2, p-JAK3, JAK3, p-STAT3 and STAT3 protein was detected by Western blot; B: The difference of p-JAK1, p-JAK2, p-JAK3, p-STAT3 and STAT3 protein expression in human PBMCs between different groups was compared.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs stimulated |
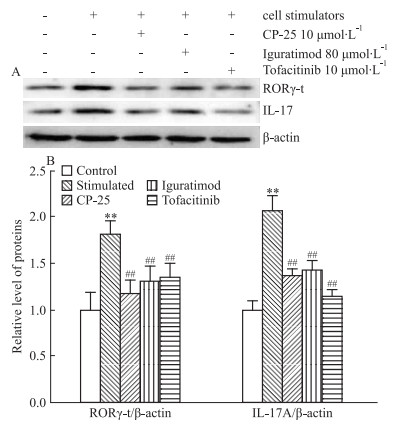
|
| 图 5 Effect of CP-25 on expression of RORγ-t and IL-17A protein in human PBMCs(x±s, n=3) A:Expression of RORγ-t and IL-17A protein was detected by Western blot; B: The difference of RORγ-t and IL-17A protein expression in human PBMCs between different groups was compared.**P < 0.01 vs control; ##P < 0.01 vs stimulated. |
实验结果发现,TNF-α与细胞刺激混合物联合刺激的人PBMCs中CD4+ IL-17A+ Th17细胞的百分比显著升高,CP-25能明显降低人PBMCs中CD4+ IL-17A+ Th17细胞的百分比,抑制人PBMCs的异常增殖,这些结果表明CP-25可能通过抑制Th17细胞的分化抑制人PBMCs的异常增殖,缓解炎症反应。流式细胞术实验发现细胞刺激剂诱导人PBMCs中CD4+Th细胞的p-STAT3、STAT3、RORγ-t、IL-17A表达明显升高,CP-25能明显降低p-STAT3、STAT3、RORγ-t、IL-17A表达。为了进一步验证CP-25是否通过调节JAK/STAT3/RORγ-t/IL-17A信号通路抑制Th17细胞的分化,我们采用Western blot实验检测通路相关蛋白。结果表明细胞刺激剂诱导人PBMCs中p-JAK1、p-JAK2、p-JAK3、p-STAT3、STAT3、RORγ-t和IL-17A蛋白表达明显升高,CP-25能明显降低人PBMCs中p-JAK1、p-JAK2、p-JAK3、p-STAT3、STAT3、RORγ-t和IL-17A蛋白表达。上述结果提示CP-25可能通过调节JAK/STAT3/RORγ-t/IL-17A信号通路抑制Th17细胞的分化,从而调节T细胞的功能。
综上所述,JAK/STAT3信号通路的激活促进了Th17细胞的分化,导致T细胞亚群失衡。CP-25可能通过调节JAK/STAT3/RORγ-t/IL-17A信号通路抑制Th17细胞的分化,参与T细胞亚群平衡的调节,提示CP-25具有良好的抗炎免疫软调节活性。本研究为进一步阐明CP-25药理作用机制以及将CP-25开发为治疗RA的抗炎免疫软调节药物提供了实验依据。
| [1] |
Serra L J, Morell B A, Castaneda S. JAK-STAT inhibitors for the treatment of immunomediated diseases[J]. Med Clin(Barc), 2019, 152(9): 353-60. |
| [2] |
张伟, 涂敏芳, 邓焕华. 转录因子ROR-γt与Th17介导的中性粒细胞性哮喘[J]. 中国免疫学杂志, 2018, 34(9): 1366-71. Zhang W, Tu M F, Deng H H. Transcription factor ROR-γt and neutrophilic asthma mediated by Th17[J]. Chin J Immunol, 2018, 34(9): 1366-71. doi:10.3969/j.issn.1000-484X.2018.09.017 |
| [3] |
柯杨, 程韵枫. STAT3蛋白调节Th17细胞的分化及其与自身免疫相关性血液疾病的关系[J]. 中国临床医学, 2016, 23(5): 662-6. Ke Y, Cheng Y F. STAT3 protein regulates Th17 cell differentiation and its relationship with autoimmune blood diseases[J]. Chin Clin Med, 2016, 23(5): 662-6. |
| [4] |
汤小雨, 王琛, 韩乐, 等. CP-25通过调控T细胞亚群治疗大鼠胶原性关节炎[J]. 安徽医科大学学报, 2019, 54(7): 1001-8. Tang X Y, Wang C, Han L, et al. CP-25 treated collagen-induce arthritis in rats by regulating T cell subsets[J]. Acta Univ Med Anhui, 2019, 54(7): 1001-8. |
| [5] |
高梅, 章敏, 司敏, 等. CXCL12/CXCR4在佐剂性关节炎大鼠脾脏中的表达及芍药苷-6′-O-苯磺酸酯的作用[J]. 中国药理学通报, 2018, 34(5): 639-44. Gao M, Zhang M, Si M, et al. Paeoniflorin-6′-O-benzene sulfonate influences expression of CXCL12 /CXCR4 in spleen of adjuvant-induced arthritis[J]. Chin Pharmacol Bull, 2018, 34(5): 639-44. doi:10.3969/j.issn.1001-1978.2018.05.011 |
| [6] |
Gu F, Xu S, Zhang P, et al. CP-25 alleviates experimental sjogren′s syndrome features in NOD/Ltj mice and modulates T lymphocyte subsets[J]. Basic Clin Pharmacol Toxicol, 2018, 123: 423-34. doi:10.1111/bcpt.13025 |
| [7] |
魏伟. 炎症免疫反应软调节[J]. 中国药理学通报, 2016, 32(3): 297-303. Wei W. Soft regulation of inflammatory immune response[J]. Chin Pharmacol Bull, 2016, 32(3): 297-303. doi:10.3969/j.issn.1001-1978.2016.03.001 |
| [8] |
Wu Y J, Chen H S, Chen W S, et al. CP-25 attenuates the activation of CD4(+) T cells stimulated with immunoglobulin D in human[J]. Front Pharmacol, 2018, 9: 4. doi:10.3389/fphar.2018.00004 |
| [9] |
Chen J, Wang Y, Wu H, et al. A modified compound from paeoniflorin, CP-25, suppressed immune responses and synovium inflammation in collagen-induced arthritis mice[J]. Front Pharmacol, 2018, 9: 563. doi:10.3389/fphar.2018.00563 |
| [10] |
Zhang M, Gao M, Chen J, et al. CP-25 exerts anti-angiogenic effects on a rat model of adjuvant-induced arthritis by promoting GRK2-induced downregulation of CXCR4-ERK1/2 signaling in endothelial cells[J]. Mol Med Rep, 2019, 20(6): 4831-42. |
| [11] |
Chang Y, Jia X, Wei F, et al. CP-25, a novel compound, protects against autoimmune arthritis by modulating immune mediators of inflammation and bone damage[J]. Sci Rep, 2016, 6: 26239. doi:10.1038/srep26239 |
| [12] |
韩陈陈. G蛋白偶联受体激酶2对人成纤维样滑膜细胞EP4受体信号通路的调节及CP-25的作用[D].安徽医科大学, 2017 Han C C. Regulation of EP4 receptor signaling pathway of human fibroblast synovial cells by G protein coupled receptor kinase 2 and the effect of CP-25[D]. Anhui Med Univ, 2017. |
| [13] |
Wang Y H, Liu Y J. The IL-17 cytokine family and their role in allergic inflammation[J]. Curr Opin Immunol, 2008, 20(6): 697-702. doi:10.1016/j.coi.2008.09.004 |
| [14] |
王清泰, 肖燕萍, 章尤权, 等. 艾拉莫德对类风湿关节炎患者Th17细胞与Treg细胞失衡的调节作用[J]. 医疗装备, 2018, 31(10): 6-8. Wang Q T, Xiao Y P, Zhang Y Q, et al. Regulation of the imbalance between Th17 cells and Treg cells in patients with rheumatoid arthritis[J]. Chin J Med Device, 2018, 31(10): 6-8. doi:10.3969/j.issn.1002-2376.2018.10.004 |
| [15] |
Hodge J A, Kawabata T T, Krishnaswami S, et al. The mechanism of action of tofacitinib-an oral Janus kinase inhibitor for the treatment of rheumatoid arthritis[J]. Clin Exp Rheumatol, 2016, 34(2): 318-28. |

