


2. 安徽省公安厅物证鉴定中心, 安徽 合肥 230061;
3. 安徽医科大学科研实验中心, 安徽 合肥 230032
 ,
JIANG Rong1,
WEN Ji-yue1,
CHEN Lin2,
XIE Qi-wen2,
FANG Jun-jie2,
WAN Yang2,
QIN Ming2,
LI Jing2,
CHEN Guan-jun3,
CHEN Zhi-wu1
,
JIANG Rong1,
WEN Ji-yue1,
CHEN Lin2,
XIE Qi-wen2,
FANG Jun-jie2,
WAN Yang2,
QIN Ming2,
LI Jing2,
CHEN Guan-jun3,
CHEN Zhi-wu1

2. Institute of Forensic Science, Dept of Anhui Public Security, Hefei 230061, China;
3. Research and Experiment Center of Anhui Medical University, Hefei 230032, China
氯化琥珀胆碱(succinylcholine chloride,Suc)又称司可林、氯化琥珀酰胆碱等,化学名为二氯化2, 2′-[(1, 4-二氧代-1, 4-亚丁基)双(氧)]双[N, N, N-三甲基乙铵]二水合物。Suc在临床上用作为手术时的肌肉松弛剂,但若超量注射或在无呼吸机配合使用的情况下,可致患者呼吸麻痹,甚至死亡[1]。因此,Suc不仅是一种药物,还是一种有毒化学品,危险类别为6.1 (b)[2]。近年来,犯罪分子将Suc用于飞镖射杀家禽、家畜类动物,甚至用作射杀人的毒药[3]。因此,快速、准确地检测出体内的Suc成为当今司法实践中的一个新课题。
目前,检测Suc有高效液相色谱法[4]、气相色谱质谱联用法[5],离子色谱法[6]、酶电极法[7]等方法,这些方法虽可准确地检测体外的Suc,但Suc一旦进入体内被很快代谢分解成胆碱和琥珀酸,大约只有2%以原形存在,浓度极低,而且代谢产物胆碱也可由体内的乙酰胆碱分解产生,琥珀酸也是机体中的一种内源性物质[8],这些检测方法难以进行体内的Suc中毒的鉴定且灵敏度较低;或者采用柱后反应生成胆碱过氧化物的衍生化方法,但过程较为复杂[9]。目前主流方法侧重于液相色谱质谱联用法[10]。本研究根据Suc的理化性质和结构特征建立了专属于Suc的超高效液相色谱-质谱法(ultra high performance liquid chromatography-tandem massspectrometry, UHPLC-MS/MS)[11],为了提高分析测定的精密度和准确度,采用Oasis WCX固相萃取柱进行纯化检测样品;为了提高方法的灵敏度和检测速度,选择Phenomene Luna NH2柱进行样品的色谱分离。按照分析方法验证要求,对上述方法进行了严格的方法学确证,相较于现有的检测手段,该方法能快速、准确地测定Suc中毒大鼠体内的药量。
1 材料与方法 1.1 实验材料 1.1.1 仪器30AD超高效液相色谱系统(DGU-20A5R在线真空脱气机、LC-30AD泵、SIL-30AC自动进样器、CBM-20A系统控制器、CTO-20AC色谱柱柱温箱),由日本岛津(SHIMADZU)公司出品;TRIPLE QUADAPTM 5500三重四极杆质谱仪,由美国AB公司出品。
1.1.2 药品与试剂Suc,为白色结晶性粉末,购自上海药明康德新药开发有限公司,批号:ES8621-4-P1,纯度为99%;乙腈和甲醇,购自美国Sigma公司,均为色谱纯,批号分别为WXBC7599V和WXBC7987V,纯度为98%;甲酸,购自北京百灵威科技有限公司,为色谱纯,批号:L240T13,纯度为98%;5%氨水,购自合肥英博生物有限公司,批号:20180501。
1.1.3 实验动物健康SD大鼠(清洁级),♂,体质量(180~220)g,全部是安徽医科大学实验动物中心提供,实验动物生产许可证号为scxk(皖)2017-001,实验室内饲养温度为(22±3) ℃。
1.2 实验方法 1.2.1 Suc中毒大鼠的制备大鼠背部脱毛后,随机分成生理盐水(NS)对照组、Suc 0.75、1.5和3.0 mg·kg-1 3个剂量组,共4组,每组6只大鼠。各组大鼠分别皮下注射各剂量的Suc和等体积的NS,4 h后,存活的大鼠处死,采集各大鼠血液备用;然后进行大鼠尸体解剖,取出心、肝、脾、肺、肾、脑、胃、肠及肌肉等脏器组织,置-80 ℃保存。
另取一批大鼠,分别皮下注射NS和0.75 mg·kg-1 Suc,4 h后,取肾脏在室温下放置不同时间后,进行肾组织中Suc稳定性的检测。
1.2.2 Suc的大鼠急性毒性实验取大鼠60只,背部脱毛后,随机分为6组,每组10只,各组大鼠分别按剂量1.84、1.66、1.50、1.35、1.21、0 mg·kg-1皮下注射Suc,观察并记录给药后2 h内大鼠死亡数(腹式呼吸消失),按照改良寇氏法进行计算。
1.2.3 样品处理 1.2.3.1 血样品处理将上述取得的血样品立即4 000 r·min-1离心10 min,制成血清后置-80 ℃保存。实验时,取血清0.2 mL,加入2倍体积的乙腈,涡旋震荡2 min,12 000 r·min-1离心15 min,取上清,过0.22 μm有机滤膜,待UHPLC-MS/MS法测试分析。
1.2.3.2 组织样品处理分别取上述1.2.1制备的各组织样品0.1 g,用滤纸吸去残留血液并用超纯水冲洗3次,再用滤纸吸去残留水分,加1 mL超纯水用匀浆器进行研磨90 s后加入2倍体积的乙腈使其完全沉淀,涡旋震荡2 min,超声10 min,12 000 r·min-1离心15 min,取上清0.5 mL过活化后的固相萃取WCX柱,在WCX柱中依次加入5%氨水溶液3 mL和100%甲醇清洗液3 mL清洗,再加入含2%甲酸的甲醇溶液3 mL进行洗脱,收集流下的液体,氮气吹干,加入0.3 mL的水-乙腈溶液(150 : 150,V : V)溶解,涡旋,过0.22 μm有机滤膜,待UHPLC-MS/MS法测试分析。
1.2.4 色谱条件及优化Suc不溶于乙醚,易溶于水,水溶液呈酸性,文献报道[12]采用Acquity UPLCTM BEH HILIC色谱柱,虽可分离药物,但出峰时间较慢,本实验室既往研究发现选用Phenomene Luna NH2柱,灵敏度高,出峰时间快,可快速检测出药物。因此,本研究采用了Luna NH2柱(2 mm×100 mm, 3 μm,Phenomenex公司)作为色谱柱;同时考察了流动相和流速的影响,由于盐类物质容易导致色谱柱堵塞,易污染,所以选择0.1%甲酸水溶液-乙腈为流动相;流动相的流速为0.2 mL·min-1时,出峰时间短,并且色谱峰响应值与流速为0.1 mL·min-1时无明显差异,所以流速采用0.2 mL·min-1。柱温是37 ℃,进样时间为5min。在该条件下出峰时间快,峰型好,响应值和分离度高。
1.2.5 质谱分析条件电喷雾离子源(ESI),正离子扫描下多反应监测(MRM),喷雾电压是5 500 V,雾化气温度为500 ℃,气帘气体压力为35 psi。由于氯化琥珀胆碱为双电荷离子[M]2+,所以一级母离子是145.1,两个离子对m/z:145.1→115.4,m/z:145.1→93.3,碰撞能分别为16 V和19 V,去簇电压均为54 V,其中m/z:145.1→115.4的响应值高,作为定量离子对。
血及各组织样品经上述优化的超高效液相色谱分离后的质谱法测定数据由Analyst1.6.3数据处理软件系统(AB公司)处理,并通过标准曲线来计算Suc含量。
1.2.6 方法学验证依据FDA关于分析方法验证指导原则进行方法学验证,分别对方法的选择性、线性范围与检测限、精密度与准确度、回收率、基质效应以及稳定性等方面进行考察。
1.2.6.1 方法的选择性分别取空白血清0.2 mL、空白血清加标准品0.2 mL,按照步骤1.2.3项方法操作,得色谱图,见Fig 1。结果表明,大鼠内源性物质对Suc的测定不产生干扰。
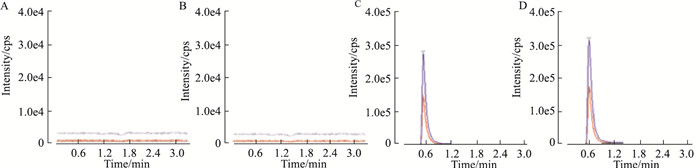
|
| Fig 1 Selectivity of method (UHPLC-MS/MS method) A~B: The chromatogram of blank serum. In the map, red curve and blue curve indicate qualitative and quantitative measurements, respectively; C~D: The chromatogram of blank serum spiked with Suc at 20 μg·L-1. |
分别配制系列浓度血清标准样品,按照1.2.3项方法操作处理,上机分析,以血清中Suc浓度为横坐标,Suc峰面积为纵坐标做线性回归,得到血清中Suc回归方程为y=1.483 01e5x+16 493.54(r=0.997 4),线性范围是0.03~1 000 μg·L-1,以S/N≥10确定本方法的最低定量下限是0.03 μg·L-1,以S/N≥3确定本方法的最小检测限为0.01 μg·L-1。
1.2.6.3 精密度与准确度分别用大鼠血清配制低、中、高3个浓度(0.5、20、80 μg·L-1)的样品,每个浓度进行6个样本分析,连续测定5 d,根据当日随行标曲,分别计算样品浓度,以其标示浓度为参照,按方差分析方法计算测定方法的准确度和日内、日间精密度,见Tab 1。结果表明,该方法具有良好的准确度和精密度,日内、日间精密度均小于15%,准确度为-8.0~9.7。
| Spiked concentration /μg·L-1 |
Recoveries /% |
Matrix effects /% |
Intra-precision /% |
Intra-accuracy /% |
Inter-precision /% |
Inter-accuracy /% |
| 0.5 | 95.4 | 107.8 | 14.8 | -8.0 | 11.4 | -7.5 |
| 20 | 90.8 | 88.9 | 1.48 | 5.9 | 8.1 | 6.0 |
| 80 | 89.5 | 90.4 | 1.69 | 8.1 | 13.6 | 9.7 |
取空白血清0.2 mL,添加不同量的Suc标准工作溶液,配制成低、中、高3个浓度(0.5、20、80 μg·L-1)的样品,每一浓度平行6个样品,按照线性方程计算回收率,见Tab 1。结果表明,本方法具有良好的回收率。
1.2.6.5 基质效应取空白血清0.2 mL,配制成低、中、高3个浓度(0.5、20、80 μg·L-1)的样品, 每一浓度平行6个样品,得到Suc的峰面积A1,测得3个浓度样品的峰面积为A2。基质效应M=A1/A2×100%,计算结果见Tab 1。结果表明,该方法不存在明显的基质效应。
1.2.6.6 稳定性取空白血清0.2 mL,配制成低、中、高3个浓度(0.5、20、80 μg·L-1)的样品,每一浓度平行3个样品,分别考察上述样本在4 ℃保存24 h、反复冻融3次,以及-80 ℃冷冻保存两个月的稳定性,见Tab 2,结果显示,该样品具有良好的稳定性。
| Spiked concentration /μg·L-1 |
Stability at 4 ℃, 24 h/% | Freeze/thaw, 3 cycles/% | Long-term freeze, 2 mon/% |
| 0.5 | 8.7 | 9.7 | 11.5 |
| 20 | 6.5 | 6.5 | 1.2 |
| 80 | 7.5 | 2.6 | 1.3 |
所有数据分析采用SPSS 12.0统计软件处理,所有数据均以x±s表示,采用单因素方差分析和t检验。
2 结果 2.1 Suc致大鼠中毒情况在皮下注射4 h内,NS对照组和Suc 0.75 mg·kg-1组的6只大鼠均未出现死亡,1.5和3.0 mg·kg-1组的6只大鼠中分别有3只和6只死亡。Suc的大鼠急性毒性实验结果显示,Suc的LD50为1.59 mg·kg-1。
2.2 中毒大鼠血清中Suc浓度结果如Fig 2A和2B所示,NS对照组大鼠血清中未出现Suc的定性及定量色谱峰,表明在该组大鼠血清中未检测到Suc;但Suc给药各剂量组大鼠血清中均出现了Suc的定性和定量色谱峰,并且在0.75 ~ 3.0 mg·kg-1范围内,增大给药剂量,大鼠血清中Suc浓度显著增高。
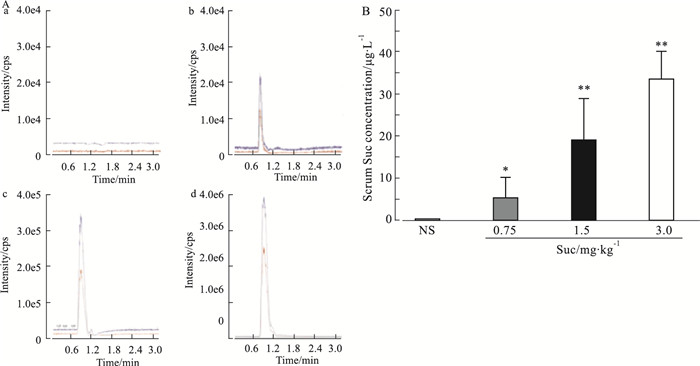
|
| Fig 2 Serum Suc concentration in rats subjected to Suc at poisoning dose (x±s, n=6) A: Original maps of chromatogram of Suc.a:NS, b~d:Suc 0.75, 1.5 and 3.0 mg·kg-1; B: Serum Suc concentration.*P < 0.05, **P < 0.01 vs NS. |
NS对照组大鼠心、肝、脾、肺、肾、脑、胃、肠及肌肉等脏器组织中均没有检测到Suc。Fig 3表明在0.75 mg·kg-1组大鼠除心、脾及肠组织外的上述脏器组织中检测到了Suc;在1.5和3.0 mg·kg-1两组大鼠的上述各脏器组织中都检测到了Suc。这与血清中的检测结果相似,在0.75~3.0 mg·kg-1范围内,随着给药中毒剂量的增大,大鼠各器官组织中Suc含量明显地增高,呈数倍甚至数十倍的增加。在0.75、1.5和3.0 mg·kg-1 3个剂量组的大鼠各脏器组织中,肾脏中Suc含量均为最高,与其它组织比较,有明显的差异。
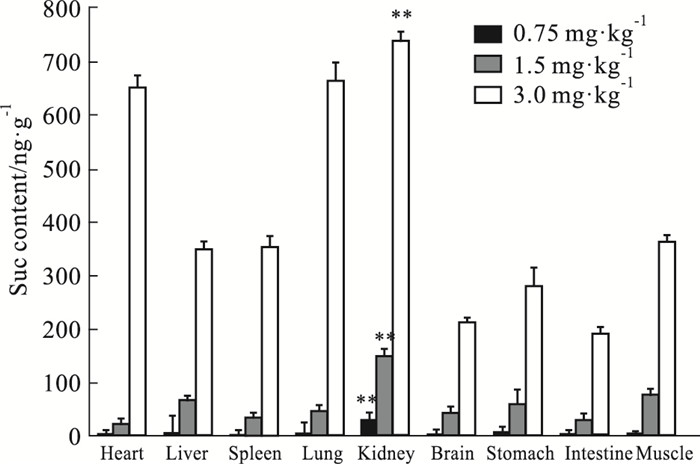
|
| Fig 3 Drug contents in different organs from rats subjected to Suc (x±s, n=6) The content of Suc in heart, liver, spleen, lung, kidney, brain, stomach, intestine and muscle from Suc-administered rats by UHPLC-MS/MS method.**P < 0.01 vs Suc contents in other organs. |
大鼠皮下注射NS和Suc 0.75 mg·kg-1 4 h后,取肾脏,室温下放置一定时间,检测Suc。结果如Fig 4所示,肾组织在室温下放置12、24、36、48和72 h时,均可检测到Suc(P < 0.05或P < 0.01),但放置12 h时,Suc含量有明显下降(P < 0.01),24 h时进一步下降,大约减少了2/3,至72 h时虽仍可测出Suc(P < 0.05),但含量很低。该结果提示在室温下放置,肾组织中Suc发生了明显的降解。
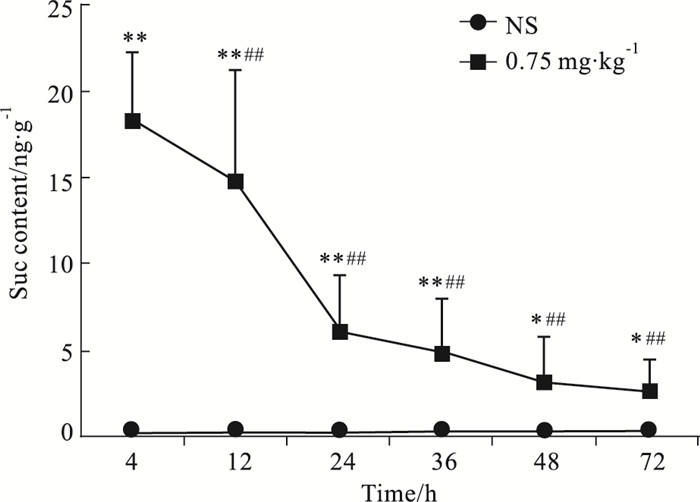
|
| Fig 4 Stability of Suc in renal tissues at room temperature (x±s, n=6) The Suc content in kidney tissues of rats containing Suc after different time at room temperature.*P < 0.05, **P < 0.01 vs NS group, ##P < 0.01 vs Suc content at 4 h. |
本研究首次采用UHPLC-MS/MS方法,研究了中毒量Suc皮下给药在大鼠体内的分布情况,结果表明,UHPLC-MS/MS方法可测定中毒大鼠体内Suc的药量,Suc在大鼠血清及心、肝、肾等组织中均有分布,其中肾脏中含量最高。这可能与其水溶性较好,易于从肾脏排泄有关[13];Suc在肝脏中含量比心脏、肺脏等脏器低,这可能是由于肝脏的血液循环较丰沛,Suc会被血液中的假性胆碱酯酶迅速水解,并且肝脏本身也存在假性胆碱酯酶水解Suc,只有10%~15%的药量到达作用部位肌肉,所以肌肉组织中Suc含量也较少,而脑组织中Suc的含量较肝脏低,这可能与Suc存在血脑屏障有关[14]。这为Suc中毒的法医鉴定取材部位提供了一定的参考。
为模拟Suc飞镖射杀致人死亡案件,本研究采用了皮下注射的方式。研究得出大鼠Suc的LD50为1.59 mg·kg-1,采用了低、中、高(0.75、1.5、3 mg·kg-1)3个浓度进行实验,Suc 3.0mg·kg-1组大鼠全部死亡,1.5 mg·kg-1组大鼠死亡一半,0.75 mg·kg-1组大鼠均无死亡。本研究不仅在1.5和3.0 mg·kg-1组的死亡和存活大鼠血清、心、脾、肝、肺、肾、脑、胃、肠及肌肉组织等主要脏器中均检测到了Suc,在较低剂量的0.75 mg·kg-1组大鼠血清及除心、脾和肠以外的其它上述组织中也检测到了Suc。结果表明UHPLC-MS/MS法不仅可检测中毒死亡的大鼠体内Suc,也可检测中毒较轻的大鼠血清及肾等组织中的Suc,这为今后Suc中毒的司法检验提供了一个有效、可靠的方法。本研究观察到肾组织样品中Suc在室温下稳定性不是很好,放置12 h,Suc含量开始有明显的下降,24 h时进一步下降,大约减少了2/3,这可能与肾组织样品中尚残存能分解Suc的酶或物质有关。因此,对疑似Suc中毒的法医学取材后要尽可能地在12 h内测定或低温保存样本。
此外,无论在大鼠血清中,还是在上述各主要脏器中,在0.75 ~ 3.0 mg·kg-1范围内,随着给药中毒剂量的增大,高剂量组大鼠体内Suc含量呈数倍甚至数十倍的增加,这可能是由于高剂量的中毒给药量明显超过大鼠体内代谢分解Suc的最大能力,导致未被代谢的Suc在体内大量集聚所致。本研究重点观察了中毒剂量的Suc在大鼠体内的分布情况,至于其药物代谢动力学其它有关参数有待今后的进一步研究。
综上所述,本研究首次采用UHPLC-MS/MS方法发现中毒量Suc皮下给药在大鼠血清及心、肝、肾等主要组织中均有分布,其中肾脏中含量最高;同时也为Suc中毒者体内药量的检测提供了一个有效、可靠的方法。
( 致谢: 本实验在安徽医科大学科研实验中心实验室完成,对本实验做出贡献的所有人员表示衷心的感谢!)
| [1] |
芮耀诚. 现代药物学[M]. 北京: 人民军医出版社, 1999: 273. Rui Y C. Modern pharmacology[M]. Beijing: People's Military Medical Press, 1999: 273. |
| [2] |
GA58-93剧毒物品品名表[S]. 2008: 9. GA58-93 list of poisonous articles[S]. 2008: 9. |
| [3] |
马克兢, 陈方园, 张杰, 等. 氯化琥珀胆碱飞镖致死1例[J]. 法医学杂志, 2016, 32(1): 77. Ma K J, Chen F Y, Zhang J, et al. Death of 1 case by succinylcholine chloride dart[J]. J Forensic Med, 2016, 32(1): 77. doi:10.3969/j.issn.1004-5619.2016.01.021 |
| [4] |
Kok F N, Bozoglu F, Hasirci V. Construction of an acetylcholinesterase-choline oxidase biosensor for aldicard determination[J]. Biosens Bioelectron, 2002, 17(6): 531-59. |
| [5] |
Forney R B, Carroll F T, Nordgren I K, et al. Extraction, identification and quantitation of succinylcholine in embalmed tissue[J]. J Anal Toxicol, 1982, 6(3): 115-9. doi:10.1093/jat/6.3.115 |
| [6] |
张姮婕, 郑洪国, 杨梅, 等. 离子色谱法测定氯化琥珀胆碱原料及注射液中的氯化胆碱和氯化琥珀酰单胆碱[J]. 中国现代应用药学, 2019, 36(6): 710-3. Zhang H J, Zheng H G, Yang M, et al. The determination of choline chloride and succinylmonocholine chloride in succinylcholine chloride and injection by ion chromatography[J]. Chin J Mod Appl Pharm, 2019, 36(6): 710-3. |
| [7] |
孙士青, 王宁, 葛淑兰. 酶电极法测定氯化琥珀胆碱注射液氯化琥珀胆碱及琥珀胆碱含量[J]. 中国药学杂志, 1997, 32(10): 35-7. Sun S Q, Wang N, Ge S L. The determination of succinylcholine chloride and succinylcholine in succinylcholine chloride injection by enzyme electrode method[J]. Chin Pharmacol J, 1997, 32(10): 35-7. |
| [8] |
Hoshi K, Hashimoto Y, Matsukawa S. Pharmacokinetics of succinylcholine in man[J]. Tohoku J Exp Med, 1993, 170(4): 245-50. doi:10.1620/tjem.170.245 |
| [9] |
竺凌, 闻俊, 周婷婷, 等. 琥珀胆碱的体内过程及其法医毒物分析研究[J]. 药物分析杂志, 2015, 35(5): 849-55. Zhu L, Wen J, Zhou T T, et al. Study on the in vivo process of succinylcholine and its forensic toxicology[J]. Chin J Pharm Anal, 2015, 35(5): 849-55. |
| [10] |
李祎, 舒科, 申秀华, 等. 高效液相色谱-飞行时间质谱用于琥珀胆碱的快速检测[J]. 刑事技术, 2016, 41(2): 120-2. Li W, Shu K, Shen X H, et al. High performance liquid chromatography-time of flight mass spectrometry for the rapid detection of succinylcholine[J]. Forensic Sci Technol, 2016, 41(2): 120-2. |
| [11] |
何国东, 杨翔宇, 李晓红, 等. 超高效液相色谱-串联质谱法分析骨髓间充质干细胞衰老过程中的全基因组DNA甲基化水平变化[J]. 中国药理学通报, 2017, 33(9): 1298-303. He G D, Yang X Y, Li X H, et al. Changes in genome-wide DNA methylation levels in bone marrow mesenchymal stem cells during senescence were analyzed by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Chin Pharmacol Bull, 2017, 33(9): 1298-303. doi:10.3969/j.issn.1001-1978.2017.09.021 |
| [12] |
张云峰, 赵森, 王炯, 等. 超高效液相色谱-质谱法分析人全血中的氯化琥珀胆碱[J]. 中国法医学杂志, 2013, 28(6): 475-7. Zhang Y F, Zhao S, Wang J, et al. The analysis of succinylcholine chloride in human whole blood by ultra high performance liquid chromatography-mass spectrometry[J]. Chin J Forensic Med, 2013, 28(6): 475-7. |
| [13] |
Malthe-Sorenssen D, Odden E, Blanch J, et al. Determination of succinyldicholine in different tissue samples from guinea pigs after injection of a single intravenous dose[J]. Forensic Sci Int, 1986, 32(3): 171-8. |
| [14] |
Roy J J, Boismenu D, Gao H, et al. Measurement of succinylcholine concentration in human plasma by electrospray tandem mass spectrometry[J]. Anal Biochem, 2001, 290(2): 238-44. |