


胡伟(1976-), 男, 博士, 副教授, 硕士生导师, 研究方向:中药药理学, E-mail:ay2fyhuwei@qq.com。
 ,
LIAO Hai-xiu,
ZHOU Nan-nan,
CHENG Juan,
WANG Qin,
GUAN Shi-he,
ZHOU Qiang,
HU Wei
,
LIAO Hai-xiu,
ZHOU Nan-nan,
CHENG Juan,
WANG Qin,
GUAN Shi-he,
ZHOU Qiang,
HU Wei ,
CHEN Li-wen
,
CHEN Li-wen

肺癌是十大恶性肿瘤之一, 严重危害人类生命健康, 是全球癌症相关死亡的最主要原因之一。在2018年全球癌症统计数据中, 肺癌的发病率和死亡率均居首位, 分别占总病例的11.6%和癌症死亡总数的18.4%[1]。世界卫生组织(World Health Organization, WHO)的组织学分类定义了两种类型的肺癌:非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)。NSCLC约占所有肺癌的80%~85%[2], 腺癌(adenocarcinoma, ADC, 约40%~50%)和鳞状细胞癌(squamous cell carcinoma, SCC, 约20%~30%)是NSCLC的主要组织学亚型[3]。虽然NSCLC在诊治方面取得了很大的进展, 但由于肿瘤的转移和复发, NSCLC的总体生存率仍不理想[4]。
近15年来, 随着分子印迹技术、靶向治疗药物和精准药物的发展, NSCLC的治疗发生了巨大的变化[5]。NSCLC中常见的突变多见于肺腺癌, 表皮生长因子受体(epidermal growth factor receptor, EGFR)、EML4-ALK、c-met等受体酪氨酸激酶是已知的驱动突变, 这些突变通过激活下游信号通路促进肿瘤的生长和转移。例如MEK/ERK/MAPK, PI3K/AKT/mTOR和JAK1/STAT3/5信号通路[6]。在NSCLC中, 体细胞EGFR突变已被证明是生物标志物和有吸引力的药物靶点的强有力的预测因子[7]。靶向突变EGFR治疗已成功应用于NSCLC患者的临床治疗, 如EGFR小分子抑制剂Gefitinib、Erlotinib等, 临床证明能有效延长患者的生存期, 但随着治疗时间的延长, 大多数患者会产生耐药性[8]。本研究主要建立对Gefitinib耐药的肺癌细胞株, 探讨其Gefitinib耐药的之后EGFR下游信号通路的改变, 以及不同细胞株之间的差异。
1 材料与方法 1.1 材料NSCLC细胞系HCC827和H3255购自上海富衡细胞库; RPMI 1640培养基(C11875500BT)购自美国Gibco公司; 胎牛血清购于南美Lonsera公司(S711-001S); 吉非替尼(Gefitinib)购自美国Med Chem Express(MCE)公司(HY-50895);CCK-8购于中国贝博生物公司(BB4221-1);兔抗人单克隆抗体β-actin(AF7018)、Akt(AF6261)、p-Akt(Ser473, AF0016)、p-STAT3(Tyr705, AF3293)均购于美国Affinity公司; 兔抗人单克隆抗体p-ERK1/2(ab214362)、STAT3(ab76315)、CD276(ab227670), 鼠抗人单克隆抗体ERK1/2(ab54230)均购于英国Abcam公司; 羊抗兔(ZB-2301)和羊抗鼠(ZB-2305)二抗均购于中国中杉金桥公司; 磷酸化抑制剂Cocktail l购自美国Med Chem Express(MCE)公司(HY-K0021);蛋白裂解液RIPA购于中国碧云天公司(P0013B); 蛋白酶抑制剂PMSF购于美国Sigma公司(10837091001)。
1.2 方法 1.2.1 人NSCLC细胞H3255和HCC827的培养及构建Gefitinib耐药细胞株H3255/GR和HCC827/GR人NSCLC细胞H3255、H3255/GR、HCC827和HCC827/GR用含胎牛血清(10%)、青霉素(100 KU·L-1)及链霉素(100 mg·L-1)的RPMI 1640培养基于37 ℃, 5% CO2培养箱(HF90/HF240, Heal Force)中常规培养传代。在人NSCLC Gefitinib敏感细胞株H3255的培养基中, 按0.001、0.002、0.005、0.01、0.02、0.05、0.075、0.10 μmol·L-1浓度梯度逐步增加Gefitinib浓度, 使用浓度为0.1 μmol·L-1的Gefitinib维持细胞耐药性, 以构建Gefitinib诱导耐药株H3255/GR, 在人NSCLC Gefitinib敏感细胞株HCC827的培养基中, 按0.001、0.002、0.005、0.01、0.012 5、0.015、0.017 5、0.02 μmol·L-1浓度梯度逐步增加Gefitinib浓度, 使用浓度为0.02 μmol·L-1的Gefitinib维持细胞耐药性, 以构建Gefitinib诱导耐药株HCC827/GR。
1.2.2 CCK8法检测Gefitinib对细胞的半数抑制浓度(IC50)及耐药指数(RI)取对数生长期的细胞以1×106 L-1的密度接种于96孔板, 每孔100 μL, 每组设3个复孔。Gefitinib以0.02、0.05、0.075、0.10、0.15、0.20、0.25、0.30 μmol·L-1(H3255细胞)或0.001、0.002、0.004、0.006、0.008、0.01、0.012 5、0.025 μmol·L-1(HCC827细胞)浓度作用细胞, 细胞培养72 h后, 每孔加入含有10% CCK-8试剂的完全培养基100 μL, 37 ℃, 5% CO2培养箱避光孵育2 h后, 用酶标仪(BioTek Inc., VT, USA)在波长450 nm处检测各孔吸光度值(OD), 根据OD值计算细胞存活率(vital rate, VR):VR=(用药组OD值-空白组OD值)/(对照组OD值-空白组OD值)。根据药物VR, 由药物浓度的对数值与VR线性回归求出药物的半数抑制浓度(50% inhibitory concentration, IC50), 并计算其耐药指数RI(resistance index):RI=IC50(耐药细胞)/IC50(诱导前细胞)。最后取3个平行孔的平均值。
1.2.3 Western blot检测细胞系中p-Stat3、p-ERK1/2和p-Akt的表达水平取2×106个对数生长期的H3255、H3255/GR、HCC827和HCC827/GR细胞种于6孔板中, 待长到80%~90%加入Gefitinib(H3255和H3255/GR为0.05 μmol·L-1, HCC827和HCC827/GR为0.012 5 μmol·L-1)处理24 h后, 预冷PBS洗两遍, 每孔加入100 μL预冷的RIPA裂解液(含1% PMSF和1% Cocktail l)冰上裂解30 min, 4 ℃、13 000×g离心30 min后取蛋白上清, 用BCA蛋白定量试剂盒按照说明书严格操作, 测定各组细胞株蛋白样品浓度。将蛋白样品20 μg经10% SDS-PAGE分离后转移到NC膜上, 经5%脱脂牛奶(TBST稀释)室温封闭1 h后, 分别加入β-actin(1 :10 000)、Akt(1 :1 000)、p-Akt(Ser473 1 :1 000)、p-STAT3(Tyr705 1 :1 000)、p-ERK1/2(1 :1 000)、ERK1/2(1 :1 000)、STAT3(1 :20 000), 4 ℃缓慢匀速振荡过夜, TBST洗涤3次后, 分别加入羊抗鼠二抗(1 :10 000)、羊抗兔二抗(1 :10 000)室温避光孵育1h, TBST洗涤3次后, ECL显色(JS-1070P EV, Peiqing, Shanghai, China)。
1.2.4 数据分析采用SPSS22.0软件进行数据处理, 计量资料以x±s表示, 采用单因素方差分析, 两样本均数比较采用独立样本t检验。
2 结果 2.1 耐Gefitinib的肺腺癌细胞株的建立:H3255/GR和HCC827/GRH3255细胞和HCC827细胞连续6个月暴露在gefitinib浓度不断增加的环境中, 直到H3255细胞能够在0.1 μmol·L-1 Gefitinib中增殖, HCC827细胞能在0.02 μmol·L-1 Gefitinib中增殖。采用CCK-8法检测了HCC827/GR和H3255/GR细胞对Gefitinib的抗性。结果显示, Gefitinib明显降低了HCC827细胞和H3255细胞的存活率, 而相对较高的Gefitinib浓度抑制了HCC827/GR细胞和H3255/GR细胞的存活率。CCK-8结果显示, 0.048±0.002 μmol·L-1, H3255/GR的IC50为0.448±0.171 μmol·L-1(RI=9.566±3.679), HCC827的IC50为0.013±0.003 μmol·L-1, HCC827/GR的IC50为0.18±0.016 μmol·L-1(RI=13.822 2±1.041)。在H3255/GR和HCC827/GR中, Gefitinib的半抑制浓度(IC50)显著升高, 差异具有统计学意义。
2.2 H3255/GR和HCC827/GR细胞的增殖较H3255和HCC827降低在此, 我们进一步研究表明, 与非耐药株相比, Gefitinib耐药导致H3255和HCC827细胞的增殖显著减少。在培养24、48和72 h后, H3255/GR和HCC827/GR株的细胞增殖较敏感株明显减少。
2.3 H3255/GR和HCC827/GR细胞株信号通路的改变我们检测了Gefitinib处理的H3255和H3255/GR, HCC827和HCC827/GR细胞中ERK1/2、AKT和STAT3的总水平和磷酸化水平。结果显示H3255/GR和HCC827/GR的p-AKT、p-ERK1/2和p-Stat3与非耐药株相比未观察到明显变化。在H3255细胞中, Gefitinib对p-AKT和p-STAT3有明显的抑制作用, 对p-STAT3、p-ERK1/2也有中度抑制作用, 而对p-ERK1/2仅有轻度抑制作用。而在H3255/GR细胞中p-ERK1/2和p-Stat3表达水平亦无明显改变, 但p-AKT表达明显下调。结果显示, Gefitinib处理的HCC827细胞的p-ERK1/2, p-AKT和p-STAT3的表达明显降低, p-STAT3和p-ERK1/2的表达也有一定程度的降低, 其中p-AKT和p-STAT3几乎失去表达。在HCC827/GR细胞中, 我们发现Gefitinib处理后其p-AKT和p-STAT3表达几乎不被抑制, p-ERK1/2被中度抑制, Gefitinib几乎失去了对其信号的抑制作用。
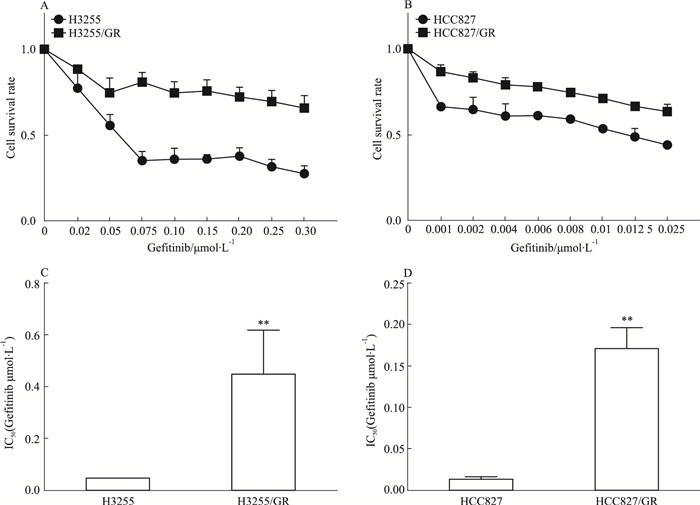
|
| Fig 1 Survival rate and IC50 of H3255, H3255/GR, HCC827 and HCC827/GR cells at different gefitinib concentrations A. The survival rates of H3255 and H3255/GR cell lines were treated with 0~0.3 μ mol·L-1 Gefitinib for 72 hours. B. The survival rates of HCC827 and HCC827/GR cell lines were treated with 0~0.125 μ mol·L-1 Gefitinib for 72 hours. C. Calculation of semi-inhibitory concentration(IC50) of H3255 and H3255/GR cells by SPSS22. D. The semi-inhibitory concentrations(IC50) of HCC827 and HCC827/GR cells were calculated by SPSS22, *P < 0.05, **P < 0.01 |

|
| Fig 2 Proliferation of H3255, H3255/GR, HCC827 and HCC827/GR cells(x±s, n=3) A. The proliferation of H3255 and H3255/GR cells was observed at 0 h, 24 h, 48 h and 72 h. B. The proliferation of HCC827 and HCC827/GR cells was observed at 0 h, 24 h, 48 h and 72 h, *P < 0.05, **P < 0.01 |
大多数携带EGFR突变激活基因的NSCLC病例, 如外显子19缺失(Del E746-A750)和外显子21突变(L858R), 最初对EGFR TKI敏感。吉非替尼通过抑制肿瘤细胞内的多个信号通路的激活, 降低MAPK或者AKT的激活程度, 从而抑制上游转录基因的启动。有研究证实, 吉非替尼能够在抑制癌细胞快速跨越G0期方面发挥作用, 从而降低癌细胞的侵袭, 转移和浸润能力[10]。然而, 他们中的绝大多数最终获得了对药物的耐药性[11]。目前, 非小细胞肺癌患者Gefitinib耐药的机制主要分为EGFR发生二次突变(最常见的为T790M突变)[12], STAT3信号通路的异常激活[13]和PI3K/Akt信号通路的持续活化等[14]。
在本研究中, 我们利用逐步增加Gefitinib浓度法成功建立了Gefitinib耐药株H3255/GR和HCC827/GR株。对亲本细胞H3255、HCC827和耐药细胞H3255/GR、HCC827/GR对Gefitinib敏感性进行检测, 结果发现耐药细胞的IC50明显高于亲本细胞, Gefitinib处理的在H3255/GR细胞中p-ERK1/2和p-Stat3表达水平亦无显著改变, 但p-AKT表达显著下调, 在HCC827/GR细胞中, 我们发现Gefitinib处理后其p-AKT和p-STAT3表达几乎不被抑制, p-ERK1/2被中度抑制。H3255/GR和HCC827/GR细胞Gefitinib耐药的信号机制存在明显差异。而H3255经Gefitinib处理后p-ERK1/2的水平仅轻度下调, 这表明在H3255细胞中, RAS/RAF/MEK/ERK1/2通路在EGFR下游信号通路中没有发挥功能优势, 先前的研究也表明, L858R突变降低了激活ERK1/2的能力, 这是由于EGFR的内吞作用受损和Src同源区2域含磷酸化酶-2(SHP-2)的Y542磷酸化减少所致[15]。另一方面, 这些发现有力地说明了EGFR突变亚型Del E746-A750和L858R在EGFR下游信号通路的旁路激活上的差异。在耐吉非替尼的情况下, H3255/GR和HCC827/GR细胞中的JAK2/STAT3通路和HCC827/GR细胞中的PI3K/AKT通路均可被完全旁路激活。这些发现进一步证实了旁路激活信号的靶向抑制可能是治疗EGFR-TKI耐药的一个有前途的选择。考虑到信号网络具有复杂的调控机制, 未来的研究更需要针对旁路激活, 并将受益于基于EGFR突变亚型的分层。
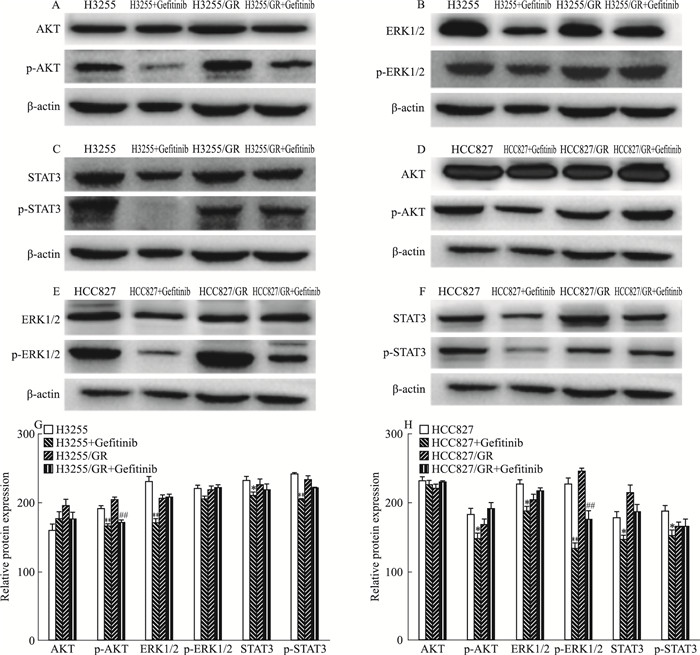
|
| Fig 3 Expression of EGFR downstream signal protein in H3255, H3255/GR, HCC827 and HCC827/GR cells(x±s, n=3) A~C. Detection of p-ERK1/2, p-AKT and p-STAT3 expression in H3255 and H3255/GR cells were treated with or without Gefitinib(0.05 μmol·L-1) by Western blot. D~F. The expression of p-ERK1/2, p-AKT and p-STAT3 in HCC827 and HCC827/GR cells with or without Gefitinib (0.012 5 μmol·L-1).G~H. The gray value of signal protein was analyzed for the difference between groups, *P < 0.05, **P < 0.01 vs H3255 or HCC827;##P < 0.01 vs H3255/GR or HCC827/GR |
综上所述, 吉非替尼耐药导致H3255和HCC827细胞的增殖减少。此外, 证明了在H3255/GR和HCC827/GR细胞系中JAK2/STAT3级联的旁路激活, 以及在HCC827/GR株中PI3K/AKT通路的旁路激活。相比之下, H3255/GR细胞中的PI3K/AKT和HCC827/GR细胞中的Raf/MEK/ERK 1/2通路仍可被EGFR信号激活。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. doi:10.3322/caac.21492 |
| [2] |
Siegel R L, Miller K D, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. doi:10.3322/caac.21551 |
| [3] |
Qu Y, Emoto K, Eguchi T, et al. Pathologic assessment after neoadjuvant chemotherapy for NSCLC: Importance and implications of distinguishing adenocarcinoma from squamous cell carcinoma[J]. J Thorac Oncol, 2019, 14(3): 482-93. |
| [4] |
Rosell R, Bivona TG, Karachaliou N. Genetics and biomarkers in personalisation of lung cancer treatment[J]. Lancet, 2013, 382(9893): 720-31. doi:10.1016/S0140-6736(13)61715-8 |
| [5] |
Herbst R S, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553(7689): 446-54. doi:10.1038/nature25183 |
| [6] |
Pao W, Girard N. New driver mutations in non-small-cell lung cancer[J]. Lancet Oncol, 2011, 12(2): 175-80. doi:10.1016/S1470-2045(10)70087-5 |
| [7] |
Roengvoraphoj M, Tsongalis G J, Dragnev K H, et al. Epidermal growth factor receptor tyrosine kinase inhibitors as initial therapy for non-small cell lung cancer: focus on epidermal growth factor receptor mutation testing and mutation-positive patients[J]. Cancer Treat Rev, 2013, 39(8): 839-50. doi:10.1016/j.ctrv.2013.05.001 |
| [8] |
白祥建, 朱美林, 李博涵, 等. 小白菊内酯对人非小细胞性肺癌H1975细胞凋亡、侵袭与迁移的影响[J]. 中国药理学通报, 2019, 35(5): 673-9. Bai X J, Zhu M L, Li B H, et al. Effect of parthenolide onapoptosis, invasion and migration of human non-small cell lung cancer H1975 cells[J]. Chin Pharmacol Bull, 2019, 35(5): 673-9. doi:10.3969/j.issn.1001-1978.2019.05.017 |
| [9] |
Eberlein C A, Stetson D, Markovets A A, et al. Acquired resistance to the mutant-selective EGFR inhibitor AZD9291 is associated with increased dependence on RAS signaling in preclinical models[J]. Cancer Res, 2015, 75(12): 2489-500. doi:10.1158/0008-5472.CAN-14-3167 |
| [10] |
秦闪闪, 常建华. 第三代EGFR-TKIs在非小细胞肺癌中的耐药机制及应对策略[J]. 中国癌症杂志, 2017, 27(11): 913-6. Qin S S, Chang J H. The resistance mechanism and coping strategy of the third-generation EGFR-TKIs in NSCLC[J]. Chin Oncol, 2017, 27(11): 913-6. |
| [11] |
Nguyen K S, Kobayashi S, Costa D B. Acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancers dependent on the epidermal growth factor receptor pathway[J]. Clin Lung Cancer, 2009, 10(4): 281-9. |
| [12] |
Yoshida T, Zhang G, Smith M A, et al. Tyrosine phosphoproteomics identifies both codrivers andcotargeting strategies for T790M-related EGFR-TKI resistance in non-small cell lungcancer[J]. Clin Cancer Res, 2014, 20(15): 4059-74. doi:10.1158/1078-0432.CCR-13-1559 |
| [13] |
Wu K, Chang Q, Lu Y, et al. Gefitinib resistance resulted from STAT3-mediated Akt activation in lung cancer cells[J]. Oncotarget, 2013, 4(12): 2430-8. doi:10.18632/oncotarget.1431 |
| [14] |
Gadgeel S M, Wozniak A. Preclinical rationale for PI3K/Akt/mTOR pathway inhibitors as therapy for epidermal growth factor receptor inhibitor-resistantnon-small-cell lung cancer[J]. Clin Lung Cancer, 2013, 14(4): 322-32. |
| [15] |
Lazzara M J, Lane K, Chan R, et al. Impaired SHP2-mediated extracellular signal-regulated kinase activation contributes to gefitinib sensitivity of lung cancer cells with epidermal growth factor receptor-activating mutations[J]. Cancer Res, 2010, 70(9): 3843-50. doi:10.1158/0008-5472.CAN-09-3421 |