

2. 福州大学化学院、福建省肿瘤转移药物预防重点实验室,福建 福州 350116;
3. 福建医科大学转化医学研究院、福建省癌症和神经退行性疾病转化研究重点实验室,福建 福州 350108
杨芳(1997-),女,硕士生,研究方向:纳米药物研究,共同第一作者,E-mail:1835962104@qq.com。
2. Cancer Metastasis Alert and Prevention Center, College of Chemistry, Fujian Provincial Key Lab of Cancer Metastasis Chemoprevention and Chemotherapy, Fuzhou University, Fuzhou 350116, China;
3. Fujian Key Lab for Translational Research in Cancer and Neurodegenerative Diseases, Institute for Translational Medicine, Fujian Medical University, Fuzhou 350108, China
2003年2月我国广东暴发的严重急性呼吸系统综合征(severe acute respiratory syndrome, SARS)和2012年9月在沙特暴发的中东呼吸综合征(Middle East respiratory syndrome, MERS)分别由SARS-CoV和MERS-CoV冠状病毒引发。根据WHO的公开资料,我国SARS确诊8098人,丧生774人,但在一年内就完全遏制了。而MERS从2012年9月一直延续到2019年,WHO报告了2 468例确诊和851例死亡。埃博拉病毒在2013年底从几内亚开始肆虐非洲,并扩展至欧洲多国,截至2015年6月3日,埃博拉病毒已造成11 164人死亡。2019年12月,新型冠状病毒疾病(COVID-19,前称2019-nCoV)疫情在武汉爆发,疫情发展极为迅速,短短1个多月的时间确诊感染人数已超过6万人,死亡1千多人(截止2020年2月15日),并波及全球20多个国家和地区。为了遏制疫情的快速扩散,政府采取了积极有效及时的措施,多管齐下,目前每日新增病例数已经开始下降,疫情的拐点逐渐显露,也预示着我们有望在短期内基本控制COVID-19,再次彰显我国政治治理的优越性。
面对2003年后再次袭来的冠状病毒,以及未来还可能卷土重来冠状病毒,我们在研发抗冠状病毒药物方面吸取了哪些经验和教训?为什么至今没有专门的特效药产生?未来这类药物的研发思路和瓶颈是什么?这些都是我们应思考的问题。
病毒是绝对的寄生物种,离开宿主细胞就没有生命了。同时,病毒对宿主细胞的依赖性引导病毒在其微环境产生适应性的演化和变异。我们只能在具体的宿主样本发现病毒、研究病毒。如从呼吸道上皮细胞采样寻找或鉴定流感病毒;在肝炎病人的肝脏和血样中研究乙肝病毒。在没有明确宿主情况下做病毒序列分析,是无法确定病毒的真实性能与致病力。另一方面,病毒以人体肺与呼吸道、胃肠道和泌尿生殖道等部位的细菌为宿主而存在。其可能影响细菌微生态的平衡从而间接影响人类健康。
入侵人类的病毒可分为两类,一类是以人类为长期宿主的病毒群,如人类常见的流行性病毒性疾病:麻疹、天花、疱疹病毒、腮腺炎、甲肝、乙肝、以及人流感病毒,包括HIV、HPV、SARS、Ebola、MERS、Zika等病毒, 这类病毒可与人共处,实现人际传播和疫情。另一类是以临近人类的物种(鸡狗猪马羊等)为长期宿主但能跨物种感染人类的病毒群,如禽流感病毒、狂犬病毒、汉坦病毒等, 这类病毒称为外源病毒群,在其长期宿主发生疫情时(鸡瘟或猪瘟暴发时),病毒才能大量逸出而机遇性跨物种感染人类。
一种新型冠状病毒的急性传染期过后,患者可产生相应的持久(或终身)免疫。因此,从药学经济学角度考虑,几乎没有任何药企会投巨资研发治疗病毒感染的新药。因为即使几年后该新药研发成功上市,其靶向病毒也许不复存在或变异了。因此,虽然目前多种冠状病毒的分离、结构解析在病毒暴发期就已经完成了,但至今没有特效药物。抗冠状病毒药物的研发不但要精准靶向病毒本身,还要针对感染后致命的急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)。所以针对目前和未来冠状病毒感染的药物研发必须在了解病毒侵入、复制和释放的机制及其导致呼吸系统疾病的基础上,采取“老药新用”和联合给药的策略,才能在短时间内取得突破。本文总结了全球冠状病毒老药新用的研发,也提出我们针对抗击COVID-19的研发新思路。
1.1 SARS、MERS和SARS-Cov-2的流行病学研究冠状病毒是具外套膜(envelope)的正链单股RNA病毒。它们属于病毒科冠状病毒亚科,与圆环病毒亚科一起组成了冠状病毒科。冠状病毒分为四种:α-型冠状病毒、β-型冠状病毒、γ-型冠状病毒和δ-型冠状病毒。冠状病毒有着相似的基因组结构。开放阅读框1a和1b接近基因组的2/3,负责编码非结构蛋白。下游开放阅读框编码多种结构蛋白, 包括棘突、核衣壳、包膜和膜蛋白[1-3]。SARS-CoV、MERS-CoV、SARS-Cov-2都同属于β-型冠状病毒。COVID-19也有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60~140 nm。其基因特征与SARS-CoV和MERS-CoV有明显区别[4]。
中国的马蹄蝠是SARS-CoV病毒的疑似宿主[5]。目前尚不清楚人畜共患病的发生和适应机制。从这些蝙蝠中分离出的SARS样病毒与从人类和果子狸中分离出来的SARS病毒的序列相似性高达95%。在疫情暴发的初始阶段,SARS-CoV曾在市场中的棕榈果子狸中分离出来,但在野生果子狸种群中并未发现[6]。蝙蝠体内有许多冠状病毒,是感染果子狸或骆驼等中间宿主的宿主,这些中间宿主再把疾病传播给人类[5]。人与人之间的传播主要是在医护人员,及与患者近距离接触且无保护措施的人群中进行[7, 8]。由于MERS-CoV和蝙蝠冠状病毒是C谱系的一部分,并且在沙特阿拉伯王国的蝙蝠样本中发现了MERS-CoV RNA,研究人员推测蝙蝠可能是MERS-CoV的天然宿主[9, 10]。最近的一项研究结果表明蝙蝠可能是MERS-CoV的宿主, 而骆驼和山羊是潜在的中间宿主[11]。在这项研究中,已从感染了MERS-CoV的单峰驼的鼻分泌物中分离得到MERS-CoV,但这些单峰驼的病情发展时间短,病情轻微。
从现有的资料来看,新型冠状病毒与蝙蝠病毒TG13的全基因组序列一致性高达96%[12]。华南农业大学沈永义团队对新型冠状病毒的可能的动物来源,开展了溯源工作,通过分析测序,对多种野生动物进行了宏基因组学分析,证明穿山甲可能是新型冠状病毒的潜在中间宿主。
1.2 临床特征MERS和SARS的临床特征相似,从无症状到轻度症状到伴有急性呼吸窘迫综合征(ARDS), 以及多器官功能衰竭的重症肺炎[13]。虽然MERS和SARS的临床特征相似,但MERS的死亡率为40%,SARS的死亡率为10%[14]。大约75%的MERS死亡病例伴有并发症,存在并发症患者的死亡率为60%(包括心肺异常、肥胖症和糖尿病)。相比之下,10%~30%的SARS患者伴有并发症,存在并发症患者的死亡率为46%[13, 14]。
截至2月15日19点30分,全国新型冠状病毒感染肺炎确诊病例共66 580起,其中死亡病例1 524起,病死率为2.2%,低于SARS和MERS。但各个年龄段的人都可能被感染,被感染的主要是成年人,特别是老年人和体弱多病者。从武汉市早前公开的44个死亡病例中,有30例(68.2%)患有高血压、冠心病、糖尿病等慢性疾病,也就意味着,本身患有慢性疾病的人对新冠肺炎的抵抗力相对较弱,容易致死。COVID-19最常见的症状是发热、咳嗽、肌痛或疲劳、呼吸困难;影像学特征为肺部CT呈现双侧毛玻璃状影像。
2 潜在的抗病毒药物 2.1 临床应用 2.1.1 SARS药物治疗利巴韦林是一种核苷类似物,可以阻止RNA和DNA病毒的复制,由于其具有广谱效应,因此用于治疗SARS。在台湾的一项研究中,51名SARS患者在确诊后每天服用氟喹诺酮类抗生素(左氧氟沙星500毫克或莫西沙星400毫克)。在51名患者中,44名SARS患者同时静脉注射2 000 mg利巴韦林,每天口服1 200 mg,另外7名SARS患者没有使用利巴韦林,必要时给予皮质激素、静注甲基强的松龙或口服强的松龙治疗恶化的肺浸润和发热。利巴韦林治疗导致缺氧和贫血,反而增加了SARS患者的死亡风险[15]。在一项回顾性分析中,来自香港、新加坡和多伦多的229名患者接受了利巴韦林联合皮质类固醇、免疫球蛋白或抗生素的治疗[16], 利巴韦林没有显示出疗效。香港和新加坡的患者在诊断时口服1 200 mg利巴韦林,然后口服2 400 mg/天,或持续静脉注射利巴韦林[8 mg/kg, 每8小时一次]。在多伦多, 患者首次静脉给药利巴韦林2 000 mg,后续每6 h 1 000 mg持续4 d, 每8 h 300 mg持续3 d。不幸的是,利巴韦林治疗组和对照组的死亡率相似。由于利巴韦林会导致贫血、低氧血症和血红蛋白水平下降等不良反应,并没有改善患者的预后,甚至增加了SARS患者的死亡风险[17]。由于不良反应且疗效不足,加拿大卫生部停止利巴韦林用于治疗SARS[15]。
另一项研究是关于利巴韦林与抗逆转录病毒药物洛匹那韦(lopinavir)联合使用的疗效。洛匹那韦已在体外被证明有抗SARS-CoV活性[18]。在一项非随机、开放临床试验中,152名疑似SARS患者接受了的利巴韦林和糖皮质激素的治疗。而另外41名确诊的SARS患者采用洛匹那韦(400 mg)和利托那韦(100 mg)的联合治疗,治疗组在d 10的拭鼻实验的平均病毒负荷量降到检测限以下。与历史对照组相比,SARS相关症状消退,病情进展较轻,且无不良反应报告。
在另一项22名SARS患者的开放标记、非随机临床研究中,9名患者接受了皮下注射干扰素-1(IFN),初始剂量为9 lg·d-1,持续2 d,并根据病情进展逐渐增加剂量到15 lg·d-1,共10 d。9例患者全部存活且副反应较少[19]。
2.1.2 MERS药物治疗利巴韦林(含或不含干扰素/皮质类固醇)是MERS暴发期间的主要治疗手段。在一项回顾性分析中,20名患者接受口服利巴韦林和皮下注射PEG-IFN-2α治疗,剂量为180 lg/周,持续2周[20]。利巴韦林的初始剂量为2 000 mg,随后根据肌酐清除率调整为200~1 200 mg, 而24例接受支持性护理和皮质激素治疗的患者为对照组。在MERS确诊后14 d,治疗组的存活率为70%, 对照组为29%。诊断后28 d,治疗组的存活率为30%,而对照组的存活率为17%[20]。在另一项病例研究中,一名69岁的希腊患者在吉达感染了MERS后,口服洛必那韦/利托那韦(400/100 mg,每日两次)、PEG-IFN (180 lg皮下注射,每周一次,持续12周)和利巴韦林(从诊断后d 13开始,2 000 mg初始剂量, 后续1 200 mg每8 h,持续8 d)。治疗开始两天后,检测不到病毒血症。然而,在诊断后14周,在病人的粪便、呼吸道分泌物和血清中检测到病毒RNA。尽管存活时间延长,但病人还是诊断后2个月死于脓血性休克[21]。
2.2 具有治疗冠状病毒感染潜力的药物由于新爆发的传染性疾病(如SARS和MERS),已有的治疗方案往往不起作用,因此迫切需要新疗法。传统药物研发由于开发周期非常长,往往无法满足要求。而“老药新用”可能为新型冠状病毒的治疗提供一个新的突破口。首先,如果这些药物的安全性已经得到充分的验证,只要在体外和动物研究中被证实具有治疗作用,那它们可用于抗击新型冠状病毒的第一线。其次,这些药物比较容易得到,可以相对快速地提供给具有紧急使用授权的患者。
齐多夫定最初是在1964年作为一种抗癌药物被开发出来的, 1985年,人类发现齐多夫定对人类免疫缺陷病毒(HIV)活性具有抑制作用。两年后,它成为第一个被批准用于治疗获得性免疫缺陷综合征(AIDS)的药物[22]。
目前,关于已上市的药物用于抗病毒感染(包括冠状病毒)治疗的研究已经有不少被报道。接下来, 本文将总结几类对MERS-CoV和SARS-CoV具有抗病毒活性的药物,同时也包括一些对其他病毒家族有作用、广谱的,并在临床上用于其他病毒感染的药物。需要强调的是,本文所述的治疗方案仅限于学术研究讨论,不推荐直接用于临床。
2.2.1 抗疟药抗疟药氯喹、阿莫地喹、甲氟喹对SARS和MERS-CoV冠状病毒都有效[23-25]。氯喹是美国FDA批准的抗疟药,也可用于治疗自身免疫性疾病,如类风湿关节炎的抗炎[26]。氯喹在体外对多种病毒有抑制作用。在体内对包括登革热病毒(DENV)、托加病毒(CHIKV)、尼帕病毒、流感病毒、艾滋病毒以及埃博拉病毒(EBOV)有效。氯喹的抗病毒作用包括非特异性地阻止病毒早期进入宿主细胞,或抑制病毒后期在宿主细胞复制。氯喹在酸性细胞器中(如核内体、高尔基囊泡和溶酶体)积聚。在这些细胞器中药物质子化可导致囊泡pH增加。病毒依靠这些酸性细胞器进入宿主细胞、复制和后代成熟。MERS-CoV进入细胞依赖于蛋白酶(proteases)。二肽基肽酶4(DPP4)是一种功能性的病毒受体[27]。细胞蛋白酶激活病毒spike糖蛋白(如Ⅱ型跨膜丝氨酸蛋白酶(TMPRSS2)及cathepsin家族) [28]。氯喹可能对这些蛋白酶中的任何一种都有影响。氯喹还影响细胞高尔基体的糖基化,从而影响病毒蛋白运动和成熟。氯喹的抗病毒作用可使SARS-CoV的血管紧张素转换酶2(ACE2)受体的糖基化缺陷[29]。
氯喹的广谱抗病毒活性使它可以“老药新用”的方式治疗新型冠状病毒和其它新发病毒感染。尽管氯喹的体内活性在MERS或SARS动物模型中还没有报道。这种药物抗其它病毒的活性报道的临床前和临床研究结果不一致。氯喹的血浆稳定浓度在小鼠和人约10 μmol·L-1,这一浓度落在其抗MERS-CoV(3.6 μmol·L-1)和抗SARS-CoV(2.3 μmol·L-1)的有效EC50值范围内[30]。小鼠试验证明氯喹可提高流感和埃博病毒感染的存活率。临床研究表明,氯喹能有效地降低无症状HIV患者的病毒负荷[31]。但是氯喹治疗CHIKV和DENV病毒感染的结果不相一致[32, 33]。
氯喹的广谱抗病毒的研究报道有助于抗MERS、SARS和COVID-19的治疗。氯喹的可药性(drugability)特点包括胃肠道吸收快、成本低(我国具有成熟的氯喹生产线)、良好的体内分布。氯喹可能是最佳的与其它抗病毒药物联合用药的候选者。但是还需要增强对其抗病毒药效学、血浆浓度和毒理学的研究[34]。羟基氯喹由于其与氯喹相似的药理作用但毒性低,可以作为替代品。抗疟药阿莫地喹也有体外抗MERS-CoV和SARS-CoV的活性,其抑制丝状病毒复制的机制和作用与氯喹相似[30]。阿莫地喹耐受性好,已经用于许多国家抗疟治疗。阿莫地喹联合青蒿琥酯(artesunate)在2013-2016年EVD病毒流行期间显著降低死亡率[35]。WHO已经报道了阿莫地喹用于非灵长类动物EVD模型的研究。此外,甲氟喹(Mefloquine)可能也是一种具有抗MERS、SARS活性的奎宁衍生物[25]。
2.2.2 干扰素(interferons)干扰素(IFNs)已FDA批准用于丙型肝炎等适应症。尽管IFN-α能够减缓小鼠和灵长类动物体内的SARS-CoV的复制过程[36, 37],但IFN-α对SARS患者的治疗效果不一(见2.1.1节)。从体外研究来看,另一种I型干扰素IFN-β1a可能比IFN-α单独或联合IFN-γ使用更有效[38-40]。在体外实验中,IFN-β和IFN-γ联合使用对抗SARS-CoV有协同作用[40]。
体内外的临床前研究表明,如果在疾病早期给予MERS患者IFN-β2b单用或与利巴韦林联合使用,可能产生治疗效果[41, 42]。然而,在临床试验中,IFN-α2b(与其他治疗联合使用)并没有产生疗效(见2.1.2节)。与IFN-β2a(EC50=160.8 IU·mL-1)、IFN-α2b(EC50=21.4 IU·mL-1)和IFN-c(EC50=56.5 IU·mL-1)相比,IFN-β1a (EC50=1.37 IU·mL-1)在体外对MERS-CoV的活性抑制作用更强。目前一项评估IFN-β1b(与洛品那韦/利托那韦联合)对MERS-CoV的作用随机临床试验正在进行。研究表明IFN-β亚型(1a和1b)与其他抗病毒药物联合具有疗效,因为潜在的协同组合可以减少有效药物剂量和IFN的不良反应[43]。
2.2.3 激酶抑制剂蛋白激酶参与了许多重要细胞通路的调节。Dyall等[25]通过细胞筛选实验发现了两种Abelson (Abl)激酶抑制剂(伊马替尼和达沙替尼)可以抑制MERS-CoV和SARS-CoV感染。两种化合物均能显著抑制MERS-CoV和SARS-CoV活性,其EC50值为微摩尔,细胞毒性较低。其中,Abl2被认为是MERS-CoV和SARS-CoV病毒入侵的关键,这可能是伊马替尼能抑制这两种病毒入侵的原因[44]。最近一项关于MERS-CoV体外感染的系统激酶组学分析研究表明,ERK/MAPK和PI3K/Aκt/mTOR信号通路在病毒感染过程发挥了特殊作用[45]。随后,针对这些信号通路,使用ERK/MAPK激酶抑制剂司美替尼(selumetinib)和曲美替尼(trametinib),发现在MERS-CoV感染前或感染后的抑制率可以达到95%以上[45]。此外,曲米替尼对MERS-CoV的抑制作用明显强于塞鲁米替尼,提示ERK/ MAPK信号通路的特异性中间体可能是病毒生命周期中早期(病毒进入)和晚期(病毒复制)事件的关键靶点。相比之下,索拉菲尼(Raf-1、B-Raf抑制剂)(ERK/MAPK信号通路的组成部分)的抑制剂,在体外细胞实验中,如果在感染前添加,MERS-CoV的抑制率可达90%,但如果在感染后添加,其抑制率则降到30%以下,表明Raf激酶主要参与了病毒生命周期的早期事件。此外,感染后使用Raf激酶抑制剂达拉非尼(dabrafenib),其抑制活性也大大减弱。mTOR抑制剂西罗莫司(sirolimus)或埃维莫司(everolimus),在MERS-CoV感染前或感染后的抑制率都在60%左右,表明mTOR在MERS-CoV感染中起着作用。Wang等[46]最近的一项临床研究,通过随机对照试验,评估了在标准抗病毒治疗之中添加使用西罗莫司和糖皮质激素对重症H1N1肺炎和急性呼吸衰竭患者的疗效。发现西罗莫司可以改善患者的预后,包括减少缺氧和多器官功能障碍,提高病毒清除率。
2.2.4 肉桂硫胺(Cinanserin或Cinnamamine)1960年代,美国药企Squibb合成了一种5-羟色胺抑制剂,即肉桂硫胺(代号SQ 10643;这种代号是美国国立卫生研究院NIH系统设置的,表明NIH参与了这一药物的研发)。肉桂硫胺分子式C20H24N2OS,分子量340.482。动物试验表明它有抗羟色胺作用、中枢神经系统作用、免疫抑制作用和消炎作用[47]。这种药物早期作为免疫抑制剂用于狗的肾移植,可增加肾移植狗的生存率而没有显著骨髓抑制作用。对于肾移植狗,它的主要副作用是每天重复剂量超过40 mg·kg-1·d-1时产生的肝毒性。当静脉输注药物(0.5 mg·kg-1·min-1)时,致死剂量为100 mg·kg-1[48]。对精神分裂症、躁狂症和类癌综合征患者进行了小规模临床试验观察到肉桂硫胺的良好效果,患者口服剂量是600~800 mg·d-1(10 mg·kg-1)。在短期治疗用药最大剂量为1 200 mg·d-1 (20 mg·kg-1)[49]。虽然在人体没有观察到明显的副作用,但进一步的临床试验被FDA暂停。因为在大鼠长期高剂量(120 mg·kg-1·d-1,持续59~81周)给药后发现该药可诱发肝癌[50]。上述数据表明,此药短期、低剂量使用可能是安全的。
由欧盟的4家研究机构和中国的4家研究机构(包括中科院上海药物所)参与的《中欧SARS诊断和抗病毒项目》课题组在我国2003年SARS后,提出肉桂硫胺的老药新用策略[47]。他们将SARS-CoV的3C样蛋白酶(3CLpro)的同型结构和晶体结构与肉桂硫胺进行分子对接,表明该药对酶的活性区结合较好。表面等离子共振(SPR)技术证明肉桂硫胺与SARS-CoV和HCoV-229E均可结合。该药的IC50值是5 μmol·L-1。在无毒性的浓度范围内,该药针对冠状病毒RNA的复制和感染性病毒颗粒的IC50值分别是19和34 μmol·L-1。肉桂硫胺可能是一种有效的控制SARS的药物。
2.2.5 核酸合成抑制剂多种RNA/DNA合成抑制剂对包括SARS-CoV和MERS-CoV等病毒具有广谱活性。肌苷单磷酸脱氢酶(IMPDH)抑制剂,如利巴韦林、麦考酚酸和咪唑比等,可抑制核酸的从头合成过程中的重要步骤。利巴韦林已与干扰素联合应用于临床,用于治疗丙型肝炎等病毒感染。利巴韦林已用于SARS和MERS (见2.1),利巴韦林在体外对MERS-CoV的抑制作用较弱,而关于利巴韦林对SARS-CoV的的抑制作用的数据则有些矛盾[36, 38, 51]。
霉酚酸(MPA)是一种预防器官排斥反应的免疫抑制剂,具有广谱抗病毒活性,并具有抗真菌、抗菌、抗癌和抗银屑病的特性[52-54]。MPA在体外对SARS-CoV的抑制活性较弱,但对MERS-CoV有较好的抑制活性[51, 55]。其前药霉酚酸酯可改善口服生物利用度[56]。咪唑立宾(Mizoribine)也是一种用于器官移植的免疫抑制剂,在体外已经显示出对HCV和牛病毒性腹泻病毒(BVDV)的活性,被作为利巴韦林/IFN联合治疗HCV感染的替代方案[57, 58]。
化疗药物吉西他滨(gemcitabine)在体外具有抗MERS-CoV和SARS-CoV活性[25]。它通过抑制核糖核苷酸还原酶,从而抑制嘧啶的生物从头合成,从而抑制病毒RNA转录和复制,并在小鼠白血病病毒模型中显示了体内抗逆转录病毒活性[59, 60]。
2.2.6 蛋白酶抑制剂MERS-CoV和SARS-CoV需要宿主的蛋白酶来激活其包膜糖蛋白,才能通过内体或非内体途径进入细胞。因此,宿主细胞蛋白酶也是潜在的靶点,其抑制剂作为潜在的抗病毒药物正在研究[61]。丝氨酸蛋白酶TMPRRSS2通过非内体途径介导MERS-CoV和SARS-CoV的进入[28, 62-64]。甲磺酸卡莫司他用于治疗慢性胰腺炎,可抑制TMPSSR2介导的糖蛋白对MERS-CoV、SARS-CoV和流感病毒的激活[61, 65-67]。半胱氨酸蛋白酶抑制剂K11777目前正处于治疗寄生虫感染的临床开发阶段。K11777对冠状病毒(MERS-CoV、SARS-CoV、HCoV-229E)、丝状病毒(EBOV、Marburg病毒)和副粘病毒(Nipah病毒)具有广谱活性[68]。Zhou等证明了卡莫司他和K11777对SARS-CoV有抑制活性,而EBOV仅被K11777抑制,这表明这些病毒所需的宿主蛋白酶不同[68]。E-64-D是一种内泌体半胱氨酸蛋白酶的抑制剂,目前正处于治疗肌营养不良症的Ⅲ期临床试验中。E-64-D也能抑制丝状病毒细胞进入[69, 70]。由于病毒依赖于特定的宿主丝氨酸或半胱氨酸宿主蛋白酶,因此需要进一步了解宿主蛋白酶与病毒发病机制之间的关系,从而选择合适蛋白酶抑制剂,确定最有效的治疗方案。
洛吡那韦(lopinavir)是HIV蛋白酶的抑制剂,临床上用于治疗HIV感染[71]。但其在体外也具有抑制MERS-CoV和SARS-CoV,添加时间实验表明该药物在病毒进入的早期阶段起作用[23]。因为洛必那韦的生物利用度很低,它常与细胞色素P450 3A4抑制剂利托那韦联合使用,以增加血液浓度[71]。洛吡那韦/利托那韦治疗可降低MERS非人灵长类模型的死亡率。洛吡那韦可以靶向SARS-CoV的主要蛋白酶(Mpro)[72],但它也可以作用于冠状病毒在细胞内的其他复制过程,因此需要更多的研究来充分理解洛必那韦的作用机制。在2003年SARS暴发期间,在公开临床试验中使用洛吡那韦/利托那韦联合利巴韦林治疗的患者病程较轻,致死率较历史对照组有所降低[17, 18]。
2.2.7 蛋白质合成抑制剂蛋白合成抑制药能够靶向抑制蛋白质合成,从而抑制冠状病毒,通过与药物联合治疗,将具有抗冠状病毒的潜力。依米汀(emetine)是一种天然的植物生物碱,茴香霉素是一种抗生素,都具有抑制蛋白质的伸长的作用,被用于抗原生动物[73, 74]。此外,依米汀的合成衍生物去氢依米汀(dehydroemetine),其副作用较少,目前也正在药物开发阶段[75]。茴香霉素(anisomycin)最初作为肽基转移酶抑制剂在使用,被发现可以激活MAP激酶信号通路[76]。除了具有抑制MERS-CoV和SARS-CoV的活性外,埃米汀和茴香霉素也具有抑制动物小核糖核酸病毒脑心肌炎病毒的活性[77]。茴香霉素在体外有抗脊髓灰质炎病毒活性[78]。高三尖杉酯碱(omacetaxine mepesuccinate)是一种植物性生物碱,是一种抗癌药物,于2012年获得FDA批准用于治疗慢性髓系白血病。高三尖杉酯碱可抑制MERS-CoV、牛冠状病毒、人肠道冠状病毒和乙型肝炎病毒[79, 80]。
2.2.8 血管紧张素转换酶(ACE)系统药物对肺冠状病毒感染的最新研究肾素-血管紧张素系统(renin-angiotensin system,简称RAS)由血管紧张素原、血管紧张素转化酶(ACE)及其同源血管紧张素转换酶2(ACE2)和血管紧张素Ⅱ(Ang Ⅱ)1型和2型受体(AT1,AT2)组成。ACE将10肽Ang I转变为8肽Ang Ⅱ;而ACE2将Ang Ⅱ切除一个残基生成Ang-(1-7),继而阻断Ang Ⅱ并抑制ACE [81, 82]。从而,ACE2轴负调节ACE活性(Fig 1)。
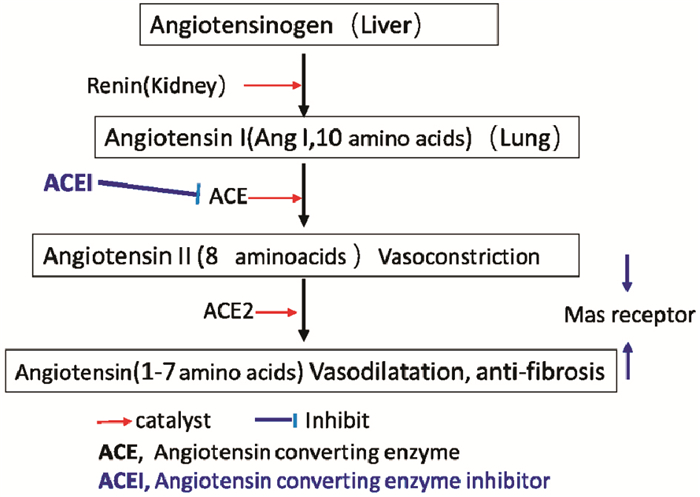
|
| Fig 1 Relationship between ACE, angiotensins and ACEI |
以前人们主要关注RAS在血压稳态和心血管疾病中的作用[83],现在也开始重视RAS在肺病理生理中的作用。肺毛细血管内皮细胞表达20%的ACE[84]。因此,肺血管中大量的ACE可将Ang I转换为Ang Ⅱ,引起血管收缩、血流量降低,导致通气/灌流不匹配和组织缺氧。ACE2主要在Clara细胞和Ⅱ型肺泡上皮细胞产生。在急性呼吸窘迫综合征(ARDS)和/或呼吸机诱发的肺损伤(VILI)时,生成ACE2的能力受损,导致ACE活性占主导地位[85, 86]。活性氧(ROS)、NADPH氧化酶和过氧化氢(H2O2)是RAS和ACE的上游调节剂[7]。RAS诱导细胞内活性氧的产生,进而调节细胞内第二信使及其下游信号。在正常情况下ROS和RAS之间的相互作用维持肺功能的完整性。在ARDS和VILI条件下,ROS和RAS的相互作用失常,导致肺部损伤[85, 87]。
ACE系统与呼吸系统的相互作用很早就阐明了。主要是ACE-AngⅡ轴的可引起肺毛细血管收缩,降低气血交换。Ferrario等[88]报道了ACEI和AngⅡ受体抑制剂对心脏ACE2酶的作用,指出ACE抑制的综合结果是减少AngⅡ的形成和延缓Ang(l-7)的代谢。ACE2本身也可增加AngⅡ的代谢。Imai等人2005年报告ACE2和血管紧张素Ⅱ2型受体(AT2)对小鼠严重急性肺损伤有保护作用,而ACE、血管紧张素Ⅱ和血管紧张素Ⅱ1a型受体(AT1a)则诱发肺水肿、损害肺功能[89];缺乏ACE的小鼠表现出明显的疾病改善,并且重组ACE2单抗对小鼠严重急肺损伤有保护作用。ACE2受体与SARS-CoV的联系因此引起注意。
从5个新型冠状病毒肺炎暴发初期病人支气管肺泡灌洗液中分离出来的病毒全基因组序列与SARS-Cov全基因组序列79.5%相同。新型冠状病毒与SARS-CoV共用ACE2受体进入上皮细胞[4, 12]。冠状病毒表面S蛋白影响病毒对宿主的感染与传播。S1亚基结合细胞表面受体,S2亚基帮助病毒进入细胞。SARS-CoV spike糖蛋白的冷冻电镜结构分析表明,上调S1的C端结构域1(CTD1s)有利于病毒结合[90]。人冠状病毒NL63(HCoV-NL63)感染细胞的3D模型表明[91],感染的第一步是通过硫酸乙酰肝素蛋白多糖(或称HS proteoglycan;mucin)与靶细胞(如LLC-Mk2细胞系)的ACE2受体蛋白相互作用,触发网格蛋白(clathrin),随后囊泡被动力蛋白(dynamin)切断,导致病毒内吞,形成囊泡(vesicle)。后者通过肌动蛋白皮质,完成细胞骨架重组。最后,内体微环境(endosomal microenvironment)的酸化使病毒基因组成功融合并释放到细胞质中。由于发现阻止SARS表面糖蛋白与ACE2的相互作用可能抑制SARS进入宿主细胞,Adedeji等人提出了3种制止SARS-CoV疾病的策略并筛选了相应的3种抑制剂: 1)抑制早期SARS-S-ACE2相互作用;2)抑制clathrin L活性; 3)阻止融合[28]。
目前尚难断定ACEI抑制剂在COVID-19和SARS中的利弊,因为没有直接的临床试验数据可供参考。我们也不知道ACEI是否可以与ACE2结合从而阻止病毒进入细胞,但至少ACEI可舒张肺毛细血管。外源性Ang-(1-7)皮下或注射给药对实验性肾大部切除大鼠可诱发心脏副作用包括高血压、心肌肥厚和纤维化。ACEI药物雷米普利(ramipril)可对抗这种副作用[92]。ACE活性增加或ACE2活性下降可能会促进肺损伤[93]。重组人ACE2抗体(rhACE2;GSK2586881)的临床Ⅱ期结果表明rhACE2是安全的。每天两次输注可导致血浆Ang Ⅱ快速下降,Ang-(1-7)和Ang-(1-5)水平增加,以及血浆IL-6浓度下降[94]。卡托普利可促进ACE2-Ang(1-7)-Mas轴的表达,抑制ACE1、AngⅡ和AT1受体[95]。
2.3 尚在开发中的药物 2.3.1 抑制MERS-CoV和SARS-CoV的潜在靶点除了老药新用外,还需要研发新的抗病毒药物或育苗来对付新冠状病毒,新设计药物通常靶向病毒生命周期、宿主上相关通路的重要靶标蛋白。瑞德西韦(remdesivir、GS-5734)和BCX4430等两种核苷抑制剂有可能成为广谱抗病毒药物,它们作用于病毒RNA所依赖的RNA聚合酶[96, 97]。这两种药物在细胞培养中对MERS-CoV和SARS-CoV均有抑制作用。特别是瑞德西韦,在美国首例VODID-19确诊病例中有优异的临床表现,目前已经通过绿色通道,在我国快速进入Ⅲ期临床试验。
SARS-CoV和MERS-CoV等冠状病毒的表面糖蛋白(S)由两个结构域组成,S1包含细胞外结合所需的受体结合域(RBD),S2含有膜融合释放所需的融合肽。SARS-CoV的内吞作用是通过RBD与宿主细胞上的血管紧张素转换酶2 (ACE2)受体结合而实现的。膜上的组织蛋白酶L裂解S蛋白,使S2融合蛋白暴露,S2再与膜融合并释放病毒RNA。因此,组织蛋白酶L、ACE2-SARS-S1复合物、S2融合肽都可能是抑制SARS-CoV进入的合适靶点[98]。最近的研究发现,病毒进入抑制剂、病毒蛋白酶和解旋酶均可有效抑制MERS-CoV和SARS-CoV[98]。宿主细胞上的蛋白酶,如木瓜蛋白酶和3C样蛋白酶,也可以作为潜在的抗病毒靶点,因为它们会裂解非结构蛋白,而这正是病毒成熟所需要的步骤。现有的大多数蛋白酶抑制剂都属于“自杀”式蛋白酶抑制剂,即不可逆地结合到靶标上。而如果可以设计成可逆的蛋白酶抑制剂,将可能具有更大的潜力,因为毒性更小,病人耐受性更好些[99]。此外,近年来对解旋酶抑制剂的研究表明,N端金属结合域、铰链域和NTP/解旋酶域这三个域靶点具有开发新药的潜力[100]。
2.3.2 RNA干扰定向RNA干扰(RNAi)技术可以通过基因沉默,从而对新型病毒进行特异性治疗[101]。最近的研究表明,小干扰RNA (siRNA)或短发夹RNA可以抑制病毒基因的表达,从而阻断培养细胞中SARS-CoV的复制[102, 103]。小干扰RNA药物siSC2-5,在经鼻给药后,可靶向SARS-CoV开放阅读框1和S蛋白,从而降低非人灵长类的SARS发病[173]。目前已有几种用于治疗病毒感染的RNAi疗法进入了临床试验,包括TKM-Ebola,它是一种治疗EBOV的siRNA/脂质纳米颗粒[101, 104, 105]。由于病毒基因组测序目前可以在很短的时间内完成,这项技术在新发现病毒的治疗上将有很大的潜力,特别是在新型病毒暴发流行的情况下。RNA干扰目前的主要障碍在于如何确定合适的病毒靶标,以及解决药物在体内对靶细胞的传递效率。
2.3.3 肽类病毒进入抑制剂多肽具有阳离子两亲性质,使其容易进入细胞膜,并可以在病毒进入时,对细胞与病毒膜的融合进行干扰。针对包膜病毒的肽类病毒进入抑制剂的研发目前已经取得了一些进展[106],如艾滋病毒抑制剂恩福韦肽(enfuvirtide)就是从HIV gp41的两亲环/c-螺旋七肽重复域中提取的一种含有36个残基肽。通过寻找融合蛋白序列的两亲性序列,并进行合理设计,已经成为开发病毒(包括MERS-CoV和SARS-CoV)的肽抑制剂的有效手段[107-109]。此外,可以通过化学修饰,提高多肽药物在体内的稳定性和生物利用度,提高其在临床应用潜力[110-112]。
3 观点与展望高特异性和广谱抗病毒药物都各有各的优势,抗病毒药物可以在“广谱”和“高度特异性”之间灵活选择[113]。高特异性的药物,针对特定病毒或病毒家族,虽然活性谱较窄,但具有较高的药效和较低的毒性,不过这种药物也容易产生耐药[113]。与之相反,广谱抗病毒药物通常靶向宿主因素或信号通路,作用的范围广,比较不容易产生耐药,但药物的毒性往往较大、活性较低和疗效较慢。
我们关于抗病毒药物开发的大部分经验来自对慢性病毒感染的研究。虽然针对DNA病毒的抗病毒开发策略已经成功地开发出一系列专门针对病毒蛋白的药物,但这种策略在RNA病毒上并不太成功,因为RNA病毒比DNA病毒的变异率更高,从而更容易产生耐药性。
3.1 联合用药为了达到更好的抗病毒效果,往往采用的两种或两种以上药物同时或先后应用,从而增加药物的疗效、为了减轻药物的毒副作用、并可以避免病毒出现耐药性。药物的联合使用可以是广谱抗病毒药与特定抗病毒药、作用机理不同的药物、或针对病毒生命周期不同步骤的药物。将一种或多种有效的活性组合,将有可能大大提高对新型冠状病毒暴发的治疗效果。但是联合用药有时也可能产生相反的结果。所以合理的联合用药,应以提高疗效和(或)降低不良反应为基本原则。联合用药时,药物的相互作用,应包括影响药动学的相互作用,应包括影响药效学的相互作用。已经有人提出建立一个包含药物动力学数据和传染病生物学数据的数据库,这将能够更好地指导药物的联合使用[114]。
许多现有药物具有广谱抗病毒活性的潜力,并且已经在临床上用于治疗其他病毒感染。此外,进入临床试验阶段的药物也可考虑用于联合治疗。但应当对每种组合进行谨慎的药理学评估,以避免药物不良反应及疾病方面的禁忌症。新型广谱复制抑制剂,如瑞德西韦(Gilead Sciences),免疫调节剂(如硝唑胺; 类固醇; 他汀类药物和正在开发的针对冠状病毒的直接作用抗病毒药物是联合用药方案。
3.2 基于结构的药物设计病毒蛋白晶体结构的解析为合理设计药物提供了新的途径。基于蛋白质结构信息进行合理药物设计研究,通过计算机虚拟筛选的方法可以快速筛选出能与病毒靶标结合,具有活性的化合物。HIV-1蛋白酶抑制剂的设计是最成功例子之一。在HIV-1蛋白酶结构发表后仅6年,沙奎那韦就创纪录地从实验室走上临床,并于1995年被批准用于治疗艾滋病[115-117]。从1995年到2000年,有6种通过合理设计针对HIV-1的抗病毒药物被批准上市。此外,基于已知病毒蛋白晶体结构的计算机辅助方法还成功地指导了多个HCV NS3/NS4A蛋白酶抑制剂的设计和合成,如肽酶、特拉匹韦和博西泼韦[118-120]。
目前SARS-CoV和MERS-CoV病毒蛋白酶Mpro和PLpro的晶体结构被解析出来[121]。这些结构已经被用于设计和开发对蛋白酶活性位点具有高结合亲和力的抑制剂。这些结构的确定可以为新型冠状病毒肺炎的药物开发提供新的病毒靶点。
4 结论当前新冠肺炎来势汹汹,尽管政府采取了诸多强有力的防控措施,有效遏制病情的快速发展,但是病毒还是在一个多月感染了6万多人,死亡上千人。目前针对COVID-19的研究刚刚起步,临床上极度缺乏针对性治疗药物,迫切需要寻找和开发新的治疗方法和药物。而开发新的针对性药物及病毒疫苗需要大量的时间和费用,无法满足疫情控制和临床上的迫切需求。而“老药新用”则可能提供一个新的突破口,在已上市药物中筛选出能够抑制病毒活性的药物,将是一个更好的选择。由于已上市药物的安全性已经得到充分的验证,只要在体外和动物研究中被证实具有治疗作用,就可以快速用于抗击疫情的第一线。此外,这些药物比较容易获得,可以相对快速地提供给具有紧急使用的患者。本文总结多种对MERS-CoV和SARS-CoV具有抗病毒活性的已上市药物,包括一些对其他病毒有作用、相对广谱药物,希望能够对当前抗击疫情有所帮助。
我们成功战胜了2003的SARS,今年的新冠肺炎我们也将必胜,但是病毒也在快速变异,将来还可能有新的冠状病毒卷土重来,使已有的诊疗方案失效。因此,在寻找病毒特效药的同时,也需要注意已有广谱药物抗病毒的收集(如中药或已有药物),和新广谱药物研发。在面对新病毒和疫情时,可以从一系列备选药物中快速找到抗病毒的诊疗方案,并采用联合用药的方法,以提高药效,降低不良反应,并减少耐药性,从而能够面对各种新旧病毒的挑战。
| [1] |
Fehr A R, Perlman S. Coronaviruses: An Overview of Their Replication and Pathogenesis[M]//Maier HJ, Bickerton E, Britton P. Coronaviruses: Methods and Protocols. Methods in Molecular Biology. 12822015. p. 1-23.
|
| [2] |
Pasternak A O, Spaan W J M, Snijder E J. Nidovirus transcription: how to make sense...?[J]. J Gen Virol, 2006, 87: 1403-21. doi:10.1099/vir.0.81611-0 |
| [3] |
Perlman S, Netland J. Coronaviruses post-SARS: update on replication and pathogenesis[J]. Nat Rev Microbio, 2009, 7(6): 439-50. doi:10.1038/nrmicro2147 |
| [4] |
Lu R, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. Lancet, 2020. |
| [5] |
Lau S K P, Woo P C Y, Li K S M, et al. Severe acute respiratory syndrome coronavirus-like virus in Chinese horseshoe bats[J]. Proc Natl Acad Sci U S A, 2005, 102(39): 14040-5. doi:10.1073/pnas.0506735102 |
| [6] |
Wang L F, Shi Z, Zhang S, et al. Review of bats and SARS[J]. Emerging Infect Dis, 2006, 12(12): 1834-40. doi:10.3201/eid1212.060401 |
| [7] |
Chowell G, Abdirizak F, Lee S, et al. Transmission characteristics of MERS and SARS in the healthcare setting: a comparative study[J]. BMC Med, 2015, 13: 210. doi:10.1186/s12916-015-0450-0 |
| [8] |
Hunter J C, Duc N, Aden B, et al. Transmission of Middle East respiratory syndrome coronavirus infections in healthcare settings, Abu Dhabi[J]. Emerging Infect Dis, 2016, 22(4): 647-56. doi:10.3201/eid2204.151615 |
| [9] |
Eckerle I, Corman V M, Mueller M A, et al. Replicative capacity of MERS coronavirus in livestock cell lines[J]. Emerging Infect Dis, 2014, 20(2): 276-9. |
| [10] |
Memish Z A, Al-Tawfiq J A, Makhdoom H Q, et al. Respiratory tract samples, viral load, and genome fraction yield in patients with Middle East respiratory syndrome[J]. J Infect Dis, 2014, 21 0(10): 1590-4. |
| [11] |
Adney D R, van Doremalen N, Brown V R, et al. Replication and shedding of MERS-CoV in upper respiratory tract of inoculated dromedary camels[J]. Emerging Infect Dis, 2014, 20(12): 1999-2005. doi:10.3201/eid2012.141280 |
| [12] |
Zhou P, Yang X L, Wang X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020. |
| [13] |
Zumla A, Hui D S, Perlman S. Middle East respiratory syndrome[J]. Lancet, 2015, 386(9997): 995-1007. doi:10.1016/S0140-6736(15)60454-8 |
| [14] |
Rasmussen S A, Watson A K, Swerdlow D L. Middle East respiratory syndrome (MERS)[J]. Microbiology Spectrum, 2016, 4(3). |
| [15] |
Chiou H E, Liu C L, Buttrey M J, et al. Adverse effects of ribavirin and outcome in severe acute respiratory syndrome - Experience in two medical centers[J]. Chest, 2005, 128(1): 263-72. doi:10.1378/chest.128.1.263 |
| [16] |
Leong H N, Ang B, Earnest A, et al. Investigational use of ribavirin in the treatment of severe acute respiratory syndrome, Singapore, 2003[J]. Trop Med Int Health, 2004, 9(8): 923-7. doi:10.1111/j.1365-3156.2004.01281.x |
| [17] |
Chu C M, Cheng V C C, Hung I F N, et al. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings[J]. Thorax, 2004, 59(3): 252-6. doi:10.1136/thorax.2003.012658 |
| [18] |
Chan K S, Lai S T, Chu C M, et al. Treatment of severe acute respiratory syndrome with lopinavir/ritonavir: A multicentre retrospective matched cohort study[J]. HK Med J, 2003, 9(6): 399-406. |
| [19] |
Loutfy M R, Blatt L M, Siminovitch K A, et al. Interferon alfacon-1 plus corticosteroids in severe acute respiratory syndrome - A preliminary study[J]. Jama J Am Med Assoc, 2003, 290(24): 3222-8. doi:10.1001/jama.290.24.3222 |
| [20] |
Omrani A S, Saad M M, Baig K, et al. Ribavirin and interferon alfa-2a for severe Middle East respiratory syndrome coronavirus infection: a retrospective cohort study[J]. Lancet Infect Dis, 2014, 14(11): 1090-5. doi:10.1016/S1473-3099(14)70920-X |
| [21] |
Spanakis N, Tsiodras S, Haagmans B L, et al. Virological and serological analysis of a recent Middle East respiratory syndrome coronavirus infection case on a triple combination antiviral regimen[J]. Int J Antimicrob Agents, 2014, 44(6): 528-32. doi:10.1016/j.ijantimicag.2014.07.026 |
| [22] |
Ashburn T T, Thor K B. Drug repositioning: Identifying and developing new uses for existing drugs[J]. Nat Rev Drug Disc, 2004, 3(8): 673-83. doi:10.1038/nrd1468 |
| [23] |
de Wilde A H, Jochmans D, Posthuma C C, et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture[J]. Antimicrob Agents Chemother, 2014, 58(8): 4875-84. doi:10.1128/AAC.03011-14 |
| [24] |
Chertow D S, Uyeki T M, DuPont H L. Loperamide therapy for voluminous diarrhea in ebola virus disease[J]. J Infect Dis, 2015, 211(7): 1036-7. doi:10.1093/infdis/jiv001 |
| [25] |
Dyall J, Coleman C M, Hart B J, et al. Repurposing of clinically developed drugs for treatment of Middle East respiratory syndrome coronavirus infection[J]. Antimicrob Agents Chemother, 2014, 58(8): 4885-93. doi:10.1128/AAC.03036-14 |
| [26] |
Thome R, Pinto Lopes S C, Maranhao Costa F T, et al. Chloroquine: Modes of action of an undervalued drug[J]. Immunol Lett, 2013, 153(1-2): 50-7. doi:10.1016/j.imlet.2013.07.004 |
| [27] |
Raj V S, Mou H, Smits S L, et al. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC[J]. Nature, 2013, 495(7440): 251-4. doi:10.1038/nature12005 |
| [28] |
Gierer S, Bertram S, Kaup F, et al. The spike protein of the emerging betacoronavirus emc uses a novel coronavirus receptor for entry, can be activated by TMPRSS2, and is targeted by neutralizing antibodies[J]. J Virol, 2013, 87(10): 5502-11. doi:10.1128/JVI.00128-13 |
| [29] |
Vincent M J, Bergeron E, Benjannet S, et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread[J]. Virol J, 2005(2): 69. |
| [30] |
Madrid P B, Chopra S, Manger I D, et al. A systematic screen of FDA-approved drugs for inhibitors of biological threat agents[J]. PLoS One, 2013, 8(4): e60579. doi:10.1371/journal.pone.0060579 |
| [31] |
Sperber K, Chiang G, Chen H C, et al. Comparison of hydroxychloroquine with zidovudine in asymptomatic patients infected with human immunodeficiency virus type 1[J]. Clin Ther, 1997, 19(5): 913-23. doi:10.1016/S0149-2918(97)80045-8 |
| [32] |
De Lamballerie X, Boisson V, Reynier J C, et al. On chikungunya acute infection and chloroquine treatment[J]. Vector Borne Zoonotic Dis, 2008, 8(6): 837-9. doi:10.1089/vbz.2008.0049 |
| [33] |
Tricou V, Nguyet Nguyen M, Toi Pham V, et al. A randomized controlled trial of chloroquine for the treatment of dengue in Vietnamese adults[J]. PLoS Negl Trop Dis, 2010, 4(8): e785. doi:10.1371/journal.pntd.0000785 |
| [34] |
Falzarano D, Safronetz D, Prescott J, et al. Lack of protection against ebola virus from chloroquine in mice and hamsters[J]. Emerging Infect Dis, 2015, 21(6): 1065-7. doi:10.3201/eid2106.150176 |
| [35] |
Gignoux E, Azman A S, de Smet M, et al. Effect of artesunate-amodiaquine on mortality related to ebola virus disease[J]. New Engl J Med, 2016, 374(1): 23-32. |
| [36] |
Barnard D L, Day C W, Bailey K, et al. Evaluation of immunomodulators, interferons and known in vitro SARS-CoV inhibitors for inhibition of SARS-CoV replication in BALB/c mice[J]. Antiviral Chem Chemother, 2006, 17(5): 275-84. doi:10.1177/095632020601700505 |
| [37] |
Haagmans B L, Kuiken T, Martina B E, et al. Pegylated interferon-alpha protects type 1 pneumocytes against SARS coronavirus infection in macaques[J]. Nat Med, 2004, 10(3): 290-3. doi:10.1038/nm1001 |
| [38] |
Cinatl J, Michaelis M, Hoever G, et al. Development of antiviral therapy for severe acute respiratory syndrome[J]. Antiviral Res, 2005, 66(2-3): 81-97. doi:10.1016/j.antiviral.2005.03.002 |
| [39] |
Hensley L E, Fritz E A, Jahrling P B, et al. Interferon-beta 1a and SARS coronavirus replication[J]. Emerging Infect Dis, 2004, 10(2): 317-9. doi:10.3201/eid1002.030482 |
| [40] |
Sainz B, Mossel E C, Peters C J, et al. Interferon-beta and interferon-gamma synergistically inhibit the replication of severe acute respiratory syndrome-associated coronavirus (SARS-CoV)[J]. Virology, 2004, 329(1): 11-7. |
| [41] |
Falzarano D, de Wit E, Martellaro C, et al. Inhibition of novel beta coronavirus replication by a combination of interferon- alpha 2b and ribavirin[J]. Sci Rep, 2013, 3: 1686. doi:10.1038/srep01686 |
| [42] |
Falzarano D, de Wit E, Rasmussen A L, et al. Treatment with interferon-alpha 2b and ribavirin improves outcome in MERS-CoV-infected rhesus macaques[J]. Nat Med, 2013, 19(10): 1313-+. doi:10.1038/nm.3362 |
| [43] |
徐丙发, 范鲁雁, 范清林, 等. 重组人白蛋白干扰素α-2b融合蛋白的抗HBV机制[J]. 中国药理学通报, 2010, 26(2): 274-5. Xu B F, Fan L Y, Fan Q L, et al. Study on mechanisms of anti-HBV activity of recombinant human serum albumin-interferon-α-2b fusion protein[J]. Chin Pharmacol Bull, 2010, 26(2): 274-5. |
| [44] |
Coleman C M, Sisk J M, Mingo R M, et al. Abelson kinase inhibitors are potent inhibitors of severe acute respiratory syndrome coronavirus and Middle East respiratory syndrome coronavirus fusion[J]. J Virol, 2016, 90(19): 8924-33. doi:10.1128/JVI.01429-16 |
| [45] |
Kindrachuk J, Ork B, Hart B J, et al. Antiviral potential of ERK/MAPK and PI3K/AKT/mTOR signaling modulation for Middle East respiratory syndrome coronavirus infection as identified by temporal kinome analysis[J]. Antimicrob Agents Chemother, 2015, 59(2): 1088-99. doi:10.1128/AAC.03659-14 |
| [46] |
Wang C H, Chung F T, Lin S M, et al. Adjuvant treatment with a mammalian target of rapamycin inhibitor, sirolimus, and steroids improves outcomes in patients with severe H1N1 pneumonia and acute respiratory failure[J]. Crit Care Med, 2014, 42(2): 313-21. doi:10.1097/CCM.0b013e3182a2727d |
| [47] |
Chen L L, Gui C S, Luo X M, et al. Cinanserin is an inhibitor of the 3C-like proteinase of severe acute respiratory syndrome coronavirus and strongly reduces virus replication in vitro[J]. J Virol, 2005, 79(11): 7095-103. doi:10.1128/JVI.79.11.7095-7103.2005 |
| [48] |
Rubin B, Piala J J, Burke J C, et al. A NEW, Potent and specific serotonin inhibitor, (sq 10, 643) 2′-(3-dimethylaminopropylthio) cinnamanilide hydrochloride: antiserotonin activity on uterus and on gastrointestinal, vascular, and respiratory systems of animals[J]. Arch Int Pharmacodyn Ther, 1964, 152: 132-43. |
| [49] |
Holden J M, Keskiner A, Gannon P. A clinical trial of an antiserotonin compound, cinanserin, in chronic schizophrenia[J]. J Clin Pharmacol New Drugs, 1971, 11(3): 220-6. |
| [50] |
Itil T M, Polvan N, Holden J M. Clinical and electroencephalographic effects of cinanserin in schizophrenic and manic patients[J]. Dis Nerv Syst, 1971, 32(3): 193-200. |
| [51] |
Hart B J, Dyall J, Postnikova E, et al. Interferon-beta and mycophenolic acid are potent inhibitors of Middle East respiratory syndrome coronavirus in cell-based assays[J]. J Gen Virol, 2014, 95: 571-7. doi:10.1099/vir.0.061911-0 |
| [52] |
Pohjala L, Utt A, Varjak M, et al. Inhibitors of alphavirus entry and replication identified with a stable chikungunya replicon cell line and virus-based assays[J]. PLoS One, 2011, 6(12): e28923. doi:10.1371/journal.pone.0028923 |
| [53] |
Diamond M S, Zachariah M, Harris E. Mycophenolic acid inhibits dengue virus infection by preventing replication of viral RNA[J]. Virology, 2002, 304(2): 211-21. doi:10.1006/viro.2002.1685 |
| [54] |
Kitchin J E S, Pomeranz M K, Washenik K, et al. Rediscovering mycophenolic acid: a review of its mechanism, side effects, and potential uses[J]. J Am Acad Dermatol, 1997, 37(3): 445-9. doi:10.1016/S0190-9622(97)70147-6 |
| [55] |
Chan J F W, Chan K H, Kao R Y T, et al. Broad-spectrum antivirals for the emerging Middle East respiratory syndrome coronavirus[J]. J Infect, 2013, 67(6): 606-16. doi:10.1016/j.jinf.2013.09.029 |
| [56] |
Armstrong V W, Tenderich G, Shipkova M, et al. Pharmacokinetics and bioavailability of mycophenolic acid after intravenous administration and oral administration of mycophenolate mofetil to heart transplant recipients[J]. Ther Drug Monit, 2005, 27(3): 315-21. doi:10.1097/01.ftd.0000163949.40686.0f |
| [57] |
Naka K, Ikeda M, Abe K I, et al. Mizoribine inhibits hepatitis C virus RNA replication: Effect of combination with interferon-alpha[J]. Biochem Biophys Res Commun, 2005, 330(3): 871-9. doi:10.1016/j.bbrc.2005.03.062 |
| [58] |
何子华, 付阳劲, 韦兰萍, 等. 黄芩苷与利巴韦林联用体内外抗流感病毒作用[J]. 中国药理学通报, 2011, 27(11): 1560-4. He Z H, Fu Y J, Wei L P, et al. Effects of the combination of baicalin and ribavirin on influenza A virus infection in vitro and in vivo[J]. Chin Pharmacol Bull, 2011, 27(11): 1560-4. doi:10.3969/j.issn.1001-1978.2011.11.020 |
| [59] |
Clouser C L, Holtz C M, Mullett M, et al. Analysis of the ex vivo and in vivo antiretroviral activity of gemcitabine[J]. PLoS One, 2011, 6(1): e15840. doi:10.1371/journal.pone.0015840 |
| [60] |
Denisova O V, Kakkola L, Feng L, et al. Obatoclax, Saliphenylhalamide, and gemcitabine inhibit influenza a virus infection[J]. J Biol Chem, 2012, 287(42): 35324-32. doi:10.1074/jbc.M112.392142 |
| [61] |
Simmons G, Zmora P, Gierer S, et al. Proteolytic activation of the SARS-coronavirus spike protein: cutting enzymes at the cutting edge of antiviral research[J]. Antiviral Res, 2013, 100(3): 605-14. doi:10.1016/j.antiviral.2013.09.028 |
| [62] |
Glowacka I, Bertram S, Mueller M A, et al. Evidence that TMPRSS2 activates the severe acute respiratory syndrome coronavirus spike protein for membrane fusion and reduces viral control by the humoral immune response[J]. J Virol, 2011, 85(9): 4122-34. doi:10.1128/JVI.02232-10 |
| [63] |
Matsuyama S, Nagata N, Shirato K, et al. Efficient activation of the severe acute respiratory syndrome coronavirus spike protein by the transmembrane protease TMPRSS2[J]. J Virol, 2010, 84(24): 12658-64. doi:10.1128/JVI.01542-10 |
| [64] |
Shulla A, Heald-Sargent T, Subramanya G, et al. A transmembrane serine protease is linked to the severe acute respiratory syndrome coronavirus receptor and activates virus entry[J]. J Virol, 2011, 85(2): 873-82. doi:10.1128/JVI.02062-10 |
| [65] |
Hosoya M, Matsuyama S, Baba M, et al. Effects of protease inhibitors on replication of various myxoviruses[J]. Anti Agents Chem, 1992, 36(7): 1432-6. doi:10.1128/AAC.36.7.1432 |
| [66] |
Kawase M, Shirato K, van der Hoek L, et al. Simultaneous Treatment of Human Bronchial Epithelial Cells with Serine and Cysteine Protease Inhibitors Prevents Severe Acute Respiratory Syndrome Coronavirus Entry[J]. J Virol, 2012, 86(12): 6537-45. doi:10.1128/JVI.00094-12 |
| [67] |
Shirato K, Kawase M, Matsuyama S. Middle east respiratory syndrome coronavirus infection mediated by the transmembrane serine protease TMPRSS2[J]. J Virol, 2013, 87(23): 12552-61. doi:10.1128/JVI.01890-13 |
| [68] |
Zhou Y, Vedantham P, Lu K, et al. Protease inhibitors targeting coronavirus and filovirus entry[J]. Antiviral Res, 2015, 116: 76-84. doi:10.1016/j.antiviral.2015.01.011 |
| [69] |
Chandran K, Sullivan N J, Felbor U, et al. Endosomal proteolysis of the Ebola virus glycoprotein is necessary for infection[J]. Science, 2005, 308(5728): 1643-5. doi:10.1126/science.1110656 |
| [70] |
Schornberg K, Matsuyama S, Kabsch K, et al. Role of endosomal cathepsins in entry mediated by the Ebola virus glycoprotein[J]. J Virol, 2006, 80(8): 4174-8. doi:10.1128/JVI.80.8.4174-4178.2006 |
| [71] |
Sham H L, Kempf D J, Molla A, et al. ABT-378, a highly potent inhibitor of the human immunodeficiency virus protease[J]. Antimicrob Agents Chemother, 1998, 42(12): 3218-24. doi:10.1128/AAC.42.12.3218 |
| [72] |
Wu C Y, Jan J T, Ma S H, et al. Small molecules targeting severe acute respiratory syndrome human coronavirus[J]. Proc Natl Acad Sci U S A, 2004, 101(27): 10012-7. doi:10.1073/pnas.0403596101 |
| [73] |
Sobin B A, Tanner F W. Anisomycin, a new anti-protozoan antibiotic[J]. J Am Chem Soc, 1954, 76(15): 4053. |
| [74] |
Akinboye E S, Brennen W N, Rosen D M, et al. Iterative design of emetine-based prodrug targeting fibroblast activation protein (FAP) and dipeptidyl peptidase IV DPPIV using a tandem enzymatic activation strategy[J]. Prostate, 2016, 76(8): 703-14. doi:10.1002/pros.23162 |
| [75] |
Gupta R S, Krepinsky J J, Siminovitch L. Structural determinants responsible for the biological-activity of (-)-emetine, (-)-cryptopleurine, and (-)-tylocrebrine - structure-activity relationship among related-compounds[J]. Mol Pharmacol, 1980, 18(1): 136-43. |
| [76] |
Zinck R, Cahill M A, Kracht M, et al. Protein-synthesis inhibitors reveal differential regulation of mitogen-activated protein-kinase and stress-activated protein-kinase pathways that converge on elk-1[J]. Mol Cell Biol, 1995, 15(9): 4930-8. doi:10.1128/MCB.15.9.4930 |
| [77] |
Ramabhadran T V, Thach R E. Specificity of protein-synthesis inhibitors in the inhibition of encephalomyocarditis virus-replication[J]. J Virol, 1980, 34(1): 293-6. doi:10.1128/JVI.34.1.293-296.1980 |
| [78] |
Hwang Y C, Chu J J H, Yang P L, et al. Rapid identification of inhibitors that interfere with poliovirus replication using a cell-based assay[J]. Antiviral Res, 2008, 77(3): 232-6. doi:10.1016/j.antiviral.2007.12.009 |
| [79] |
Cao J, Forrest J C, Zhang X. A screen of the NIH Clinical Collection small molecule library identifies potential anti-coronavirus drugs[J]. Antiviral Res, 2015, 114: 1-10. doi:10.1016/j.antiviral.2014.11.010 |
| [80] |
Romero M R, Serrano M A, Efferth T, et al. Effect of cantharidin, cephalotaxine and homoharringtonine on "in vitro" models of hepatitis B virus (HBV) and bovine viral diarrhoea virus (BVDV) replication[J]. Planta Med, 2007, 73(6): 552-8. doi:10.1055/s-2007-967184 |
| [81] |
Yu L, Yuan K, Phuong H T, et al. Angiotensin-(1-5), an active mediator of renin-angiotensin system, stimulates ANP secretion via Mas receptor[J]. Peptides, 2016, 86: 33-41. doi:10.1016/j.peptides.2016.09.009 |
| [82] |
曹金龙, 龚晶婧, 许昌声, 等. ACE2通过下调AT_1R和ERK1/2的磷酸化[J]. 中国药理学通报, 2012, 28(5): 716-20. Cao J L, Gong J J, Xu C S, et al. Inhibitory effect overexpression of ACE2 on the proliferation of vascular smooth muscle cells[J]. Chin Pharmacol Bull, 2012, 28(5): 716-20. doi:10.3969/j.issn.1001-1978.2012.05.027 |
| [83] |
贾力. 血管紧张素转换酶抑制剂的研究进展[J]. 生理科学进展, 1985, 6: 229-34. Jia Lee. Advances in angiotensin-converting enzyme inhibitors[J]. Prog in Phys Sci, 1985, 6: 229-34. |
| [84] |
Metzger R, Franke F E, Bohle R M, et al. Heterogeneous distribution of angiotensin I-converting enzyme (CD143) in the human and rat vascular systems: vessel, organ and species specificity[J]. Microvasc Res, 2011, 81(2): 206-15. doi:10.1016/j.mvr.2010.12.003 |
| [85] |
Zhang R, Pan Y, Fanelli V, et al. Mechanical stress and the induction of lung fibrosis via the midkine signaling pathway[J]. Am J Respir Crit Care Med, 2015, 192(3): 315-23. doi:10.1164/rccm.201412-2326OC |
| [86] |
Wosten-van Asperen R M, Lutter R, Specht P A, et al. Acute respiratory distress syndrome leads to reduced ratio of ACE/ACE2 activities and is prevented by angiotensin-(1-7) or an angiotensin Ⅱ receptor antagonist[J]. J Pathol, 2011, 225(4): 618-27. doi:10.1002/path.2987 |
| [87] |
Marshall R P, Webb S, Bellingan G J, et al. Angiotensin converting enzyme insertion/deletion polymorphism is associated with susceptibility and outcome in acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2002, 166(5): 646-50. doi:10.1164/rccm.2108086 |
| [88] |
Ferrario C M, Jessup J, Chappell M C, et al. Effect of angiotensin-converting enzyme inhibition and angiotensin Ⅱ receptor blockers on cardiac angiotensin-converting enzyme 2[J]. Circulation, 2005, 111(20): 2605-10. doi:10.1161/CIRCULATIONAHA.104.510461 |
| [89] |
Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure[J]. Nature, 2005, 436(7047): 112-6. doi:10.1038/nature03712 |
| [90] |
Gui M, Song W, Zhou H, et al. Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding[J]. Cell Res, 2017, 27(1): 119-29. doi:10.1038/cr.2016.152 |
| [91] |
Milewska A, Nowak P, Owczarek K, et al. Entry of Human Coronavirus NL63 into the Cell[J]. J Virol, 2018, 92(3): e01933-17. |
| [92] |
Burrell L M, Gayed D, Griggs K, et al. Adverse cardiac effects of exogenous angiotensin 1-7 in rats with subtotal nephrectomy are prevented by ACE inhibition[J]. PLoS One, 2017, 12(2): e0171975. doi:10.1371/journal.pone.0171975 |
| [93] |
Zhang H, Baker A. Recombinant human ACE2: acing out angiotensin Ⅱ in ARDS therapy[J]. Crit Care, 2017, 21(1): 305. doi:10.1186/s13054-017-1882-z |
| [94] |
Khan A, Benthin C, Zeno B, et al. A pilot clinical trial of recombinant human angiotensin-converting enzyme 2 in acute respiratory distress syndrome[J]. Crit Care, 2017, 21(1): 234. doi:10.1186/s13054-017-1823-x |
| [95] |
Abuohashish H M, Ahmed M M, Sabry D, et al. ACE-2/Ang1-7/Mas cascade mediates ACE inhibitor, captopril, protective effects in estrogen-deficient osteoporotic rats[J]. Biomed Pharmacother, 2017, 92: 58-68. doi:10.1016/j.biopha.2017.05.062 |
| [96] |
Warren T K, Jordan R, Lo M K, et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys[J]. Nature, 2016, 531(7594): 381-5. doi:10.1038/nature17180 |
| [97] |
Warren T K, Wells J, Panchal R G, et al. Protection against filovirus diseases by a novel broad-spectrum nucleoside analogue BCX4430[J]. Nature, 2014, 508(7496): 402-5. doi:10.1038/nature13027 |
| [98] |
Adedeji A O, Sarafianos S G. Antiviral drugs specific for coronaviruses in preclinical development[J]. Curr Opin Virol, 2014, 8: 45-53. doi:10.1016/j.coviro.2014.06.002 |
| [99] |
Cheng K W, Cheng S C, Chen W Y, et al. Thiopurine analogs and mycophenolic acid synergistically inhibit the papain-like protease of Middle East respiratory syndrome coronavirus[J]. Antiviral Res, 2015, 115: 9-16. doi:10.1016/j.antiviral.2014.12.011 |
| [100] |
Tanner J A, Zheng B J, Zhou J, et al. The adamantane-derived bananins are potent inhibitors of the helicase activities and replication of SARS coronavirus[J]. Chem Biol, 2005, 12(3): 303-11. doi:10.1016/j.chembiol.2005.01.006 |
| [101] |
Leonard J N, Schaffer D V. Antiviral RNAi therapy: emerging approaches for hitting a moving target[J]. Gene Ther, 2006, 13(6): 532-40. doi:10.1038/sj.gt.3302645 |
| [102] |
Wang Z, Ren L L, Zhao X G, et al. Inhibition of severe acute respiratory syndrome virus replication by small interfering RNAs in mammalian cells[J]. J Virol, 2004, 78(14): 7523-7. doi:10.1128/JVI.78.14.7523-7527.2004 |
| [103] |
Zhang Y J, Li T S, Fu L, et al. Silencing SARS-CoV Spike protein expression in cultured cells by RNA interference[J]. FEBS Lett, 2004, 560(1-3): 141-6. doi:10.1016/S0014-5793(04)00087-0 |
| [104] |
Thi E P, Mire C E, Lee A C H, et al. Lipid nanoparticle siRNA treatment of Ebola-virus-Makona-infected nonhuman primates[J]. Nature, 2015, 521(7552): 362-5. doi:10.1038/nature14442 |
| [105] |
Dunning J, Sahr F, Rojek A, et al. Experimental treatment of ebola virus disease with TKM-130803: a single-arm phase 2 clinical trial[J]. PLoS Med, 2016, 13(4): e1001997. doi:10.1371/journal.pmed.1001997 |
| [106] |
Badani H, Garry R F, Wimley W C. Peptide entry inhibitors of enveloped viruses: The importance of interfacial hydrophobicity[J]. Bioch Biophys Acta-Biomembra, 2014, 1838(9): 2180-97. doi:10.1016/j.bbamem.2014.04.015 |
| [107] |
Lu L, Liu Q, Zhu Y, et al. Structure-based discovery of Middle East respiratory syndrome coronavirus fusion inhibitor[J]. Nat Comm, 2014, 5: 3067. doi:10.1038/ncomms4067 |
| [108] |
Sainz B, Rausch J M, Gallaher W R, et al. Identification and characterization of the putative fusion peptide of the severe acute respiratory syndrome-associated coronavirus spike protein[J]. J Virol, 2005, 79(11): 7195-206. doi:10.1128/JVI.79.11.7195-7206.2005 |
| [109] |
Sainz B, Jr., Mossel E C, Gallaher W R, et al. Inhibition of severe acute respiratory syndrome-associated coronavirus (SARS-CoV) infectivity by peptides analogous to the viral spike protein[J]. Virus Res, 2006, 120(1-2): 146-55. doi:10.1016/j.virusres.2006.03.001 |
| [110] |
Bird G H, Madani N, Perry A F, et al. Hydrocarbon double-stapling remedies the proteolytic instability of a lengthy peptide therapeutic[J]. Proc Natl Acad Sci U S A, 2010, 107(32): 14093-8. doi:10.1073/pnas.1002713107 |
| [111] |
Kindrachuk J, Scruten E, Attah-Poku S, et al. Stability, toxicity, and biological activity of host defense peptide BMAP28 and its inversed and retro-inversed isomers[J]. Biopolymers, 2011, 96(1): 14-24. doi:10.1002/bip.21441 |
| [112] |
Walensky L D, Bird G H. Hydrocarbon-Stapled Peptides: Principles, Practice, and Progress[J]. J Med Chem, 2014, 57(15): 6275-88. doi:10.1021/jm4011675 |
| [113] |
De Clercq E. Strategies in the design of antiviral drugs[J]. Nat Rev Drug Disc, 2002, 1(1): 13-25. |
| [114] |
Bai J P F. Pharmacodynamics and systems pharmacology approaches to repurposing drugs in the wake of global health burden[J]. J Pharm Sci, 2016, 105(10): 3007-12. doi:10.1016/j.xphs.2016.07.004 |
| [115] |
Brik A, Wong C H. HIV-1 protease: mechanism and drug discovery[J]. Org Biomol Chem, 2003, 1(1): 5-14. doi:10.1039/b208248a |
| [116] |
Navia M A, Fitzgerald P M D, McKeever B M, et al. 3-dimensional structure of aspartyl protease from human immunodeficiency virus hiv-1[J]. Nature, 1989, 337(6208): 615-20. doi:10.1038/337615a0 |
| [117] |
Wlodawer A, Miller M, Jaskolski M, et al. Conserved folding in retroviral proteases-crystal-structure of a synthetic hiv-1 protease[J]. Science, 1989, 245(4918): 616-21. doi:10.1126/science.2548279 |
| [118] |
Gotte M, Feld J J. Direct-acting antiviral agents for hepatitis C: structural and mechanistic insights[J]. Nat Rev Gastro Hepat, 2016, 13(6): 338-51. doi:10.1038/nrgastro.2016.60 |
| [119] |
Hazuda D J, Burroughs M, Howe A Y M, et al. Development of boceprevir: a first-in-class direct antiviral treatment for chronic hepatitis C infection. Pharmaceutical science to improve the Human Condition: Prix Galien USA 2012. Annals of the New York Academy of Sciences, 12912013. p. 69-76.
|
| [120] |
Kwong A D, Kauffman R S, Hurter P, et al. Discovery and development of telaprevir: an NS3-4A protease inhibitor for treating genotype 1 chronic hepatitis C virus[J]. Nat Biotechnol, 2011, 29(11): 993-1003. doi:10.1038/nbt.2020 |
| [121] |
Hilgenfeld R. From SARS to MERS: crystallographic studies on coronaviral proteases enable antiviral drug design[J]. FEBS J, 2014, 281(18): 4085-96. doi:10.1111/febs.12936 |

