


2. 广西大学医学院, 广西 南宁 530004;
3. 广西中医药大学第一临床学院, 广西 南宁 530001
 ,
FENG Shi1,
TANG Qian-li1
,
FENG Shi1,
TANG Qian-li1
 ,
JIANG Yan1,
TANG Qiang1,
CEN Xiao-ning1,
HUANG Han-ji3,
YIN Xing3
,
JIANG Yan1,
TANG Qiang1,
CEN Xiao-ning1,
HUANG Han-ji3,
YIN Xing3
2. Dept of Medicine, Guangxi University, Nanning 530004, China;
3. Dept of First Clinical Medical, Guangxi University of Chinese Medicine, Nanning 530001, China
慢性难愈合创面是指创面皮肤在一个月内无法实现皮肤的完整性,且炎症反应和组织损伤不断增加的创面[1]。本病发病率高,常影响患者的生活质量,给其带来巨大的心理及经济负担。目前临床针对慢性难愈合创面的治疗方法各式各样,但疗效均具有局限性。因此,人们都尝试以湿润暴露疗法/湿润烧伤膏(moist exposed burn therapy/moist exposed burn ointment,MEBT/MEBO)治疗慢性难愈合创面。
徐荣祥教授发明的MEBT/MEBO应用于烧伤创面,主要是将湿润暴露疗法与湿润烧伤膏的有机结合[2],且临床疗效明显。唐乾利教授研究团队[3-4]将该技术拓展应用于慢性难愈合皮肤溃疡创面,并进行了一系列临床与基础研究,取得了较好的研究成果,但具体作用机制仍然不甚明了,仍待进一步探索。已有研究表明:细胞外基质(ECM)表达的变化在慢性难愈合创面修复方面具有一定的作用效果[5],而基质金属蛋白酶(MMPs)可参与ECM的降解与重塑[6],其中基质金属蛋白酶2(MMP-2)和基质金属蛋白酶9(MMP-9)能够通过降解ECM,进而来参与ECM重塑的调节。但MEBT/MEBO是否通过影响慢性难愈合创面组织中MMP-2和MMP-9的表达来促进创面愈合?尚未得到证实。
有鉴于此,本研究将通过构建大鼠慢性难愈合创面模型,观察大鼠创面组织中MMP-2和MMP-9的动态表达,以及MEBT/MEBO的影响效果,进而阐明MMP-2和MMP-9在创面修复中的具体作用,并完善MEBT/MEBO的部分作用机制,为临床推广提供理论依据。
1 材料与方法 1.1 实验材料 1.1.1 实验动物SPF级Wistar成年大鼠【长沙市天勤生物技术有限公司提供,许可证号SCXK(湘)2014.0011】,♂,12周龄,体质量(235±15)g。
1.1.2 仪器与试剂Western blot全套系统(美国BIO-RAD);超微量紫外分光光度计(德国Backman);酶标仪(美国赛默飞);实时荧光定量聚合酶链反应仪(美国Roche);4 ℃离心机(德国Eppendorf);显微镜(日本Olympus)。美宝湿润烧伤膏(汕头市美宝制药有限公司,国药准字Z20000004);贝复新(珠海亿胜生物制药有限公司,国药准字S20040001);醋酸氢化可的松(上海通用药业股份有限公司,国药准字H31021290);MMP-2和MMP-9一抗(美国Novus);二抗(北京索莱宝);MMP-2、MMP-9和GAPDH引物(上海生工);RNA提取、逆转录、荧光试剂盒(北京天根);MMP-2、MMP-9 ELISA试剂盒(美国R & D公司)。
1.2 实验方法 1.2.1 动物模型的建立将90只SPF级♂ Wistar大鼠,适应性喂养1周后,按数字表法随机分为5组:MEBO组、贝复新组、慢性组、急性组及空白组,每组18只。经10%水合氯醛(3 mL·kg-1)腹腔注射麻醉后,对5组大鼠均进行备皮。除急性组和空白组外,其余3组大鼠均参照付小兵等全层皮肤缺损法和沈氏改良塑料环肉芽肿定量法经改进制成大鼠慢性难愈合创面模型[7-8]。在大鼠靠近脊柱处剪切15 mm圆形全层皮肤开放性创口,随后敷盖消毒干纱布,并胶条固定。再对MEBO组、贝复新组和模型组腹腔注射醋酸氢化可的松[8 mg·(100 g)-1]处理,建立成大鼠慢性难愈合创面模型。急性组以同样的方法进行剪切皮肤包扎处理,但是不注射醋酸氢化可的松。空白组只需进行备皮处理,而没有做任何创面损伤处理。
1.2.2 治疗方法造模成功后,随后进行早晚各一次的常规消毒和换药处理,直至取材完成。换药方法如下:MEBO组在创面均匀涂抹MEBO药膏(约1.0 mm厚)后,再在伤口敷盖浸有MEBO药膏的纱布块[0.2 g·(cm2)-1];贝复新组在创面涂抹贝复新[262.5 U·(cm2)-1]后,再在创面敷盖浸有贝复新的纱布块[60.0 U·(cm2)-1];急性组和慢性组只需将浸有生理盐水的纱布块敷盖于创面上。包扎前均加盖两层干纱布,胶条“丰”型固定。
1.2.3 实验标本采集造模后,分别于d 3、14每组各随机处死9只大鼠,剪取相同部位从深筋膜下层切取距离创缘0.5 cm的整个创面及周围组织的肉芽组织,一部分储存于-80 ℃冰箱,待进行蛋白及基因检测,另一部分则放在10%甲醛中进行固定,待后期行病理切片观察。
1.3 检测方法 1.3.1 创面愈合情况于造模d 3、14,对伤口大小进行透明薄膜覆盖描画及拍照记录。并利用Image J软件对创面进行分析处理,创面愈合率计算公式:创面愈合率/%=[(原始创面面积-残余创面面积)/原始创面面积]×100%。创面愈合时间则以创面伤口完全上皮化为标准进行计算。
1.3.2 HE染色取创面组织后,进行固定脱水包埋切片等操作。再行常规HE染色,在光学显微镜下观察各组创面组织形态学变化。
1.3.3 ELISAMMP-2和MMP-9的检测方法均按照ELISA试剂盒操作说明书进行操作,检测各组织匀浆中MMP-2和MMP-9蛋白表达情况。
1.3.4 Western blot技术取标本后,提取蛋白,检测蛋白浓度。SDS-PAGE电泳,转膜至PVDF膜;室温摇床封闭1 h;清洗(均用TBST清洗3次,每次6 min,下同);4 ℃一抗摇床孵育过夜;清洗;室温二抗孵育1 h;清洗;洗膜结束后进行发光显影。最后利用Image J软件进行灰度分析处理。
1.3.5 qRT-PCR按照试剂盒操作说明书进行提取RNA和逆转录处理,再以逆转录得到的cDNA进行扩增检测目的mRNA转录水平。再将检测到的CT值,用相对定量2-ΔΔCt法进行分析处理。见Tab 1。
| Gene | Sequence (5’-3’) |
| MMP-2 | F:GAACACCAGAGGAAGCCGTCAC |
| R:AGCTGTGGACTCTAGGAGAAGGAC | |
| MMP-9 | F:TGGTGCAGGCAGAGTAGGAGTG |
| R:CTACACGGAGCATGGCAACGG | |
| GAPDH | F:GACATGCCGCCTGGAGAAAC |
| R:AGCCCAGGATGCCCTTTAGT |
数据用x±s表示,两组间比较用两样本的t检验,多组间比较用单因素方差分析(ANOVA),做两两比较用LSD方法。所有计算均使用SPSS 22.0软件进行统计分析。
2 结果 2.1 MEBO对大鼠大体情况的影响造模d 2,慢性组大鼠死亡2只,补同批次大鼠2只,其他各组均无死亡情况。余下老鼠情况良好,能够正常自主饮食饮水。
造模d 3,渗液、水肿情况:急性组、MEBO组和贝复新组轻于慢性组;肉芽组织生长情况:急性组、MEBO组和贝复新组可见肉芽组织的存在,而慢性组则较少见。见Fig 1。

|
| Fig 1 General situation of wound healing on 3rd and 14th day in each group A: Acute wound group; B: Chronic wound group; C: rb-bFGF group; D: MEBO group.1: d 3; 2: d 14. |
造模d 14,急性组、MEBO组和贝复新组创缘长出毛发,创口干燥,且均长出痂皮;而慢性组创口可见色泽暗红、坏死、红肿及渗液渗出。
2.2 MEBO对大鼠创面愈合时间及愈合率的影响急性组、MEBO组和贝复新组创面愈合时间明显短于慢性组,且差异具有统计学意义(P<0.05)。见Fig 2。
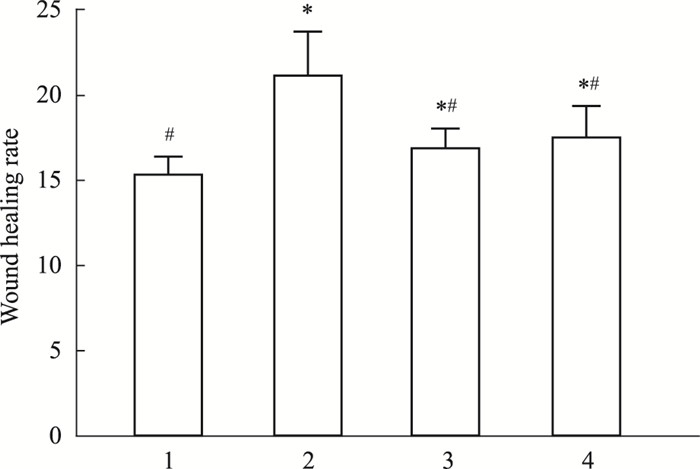
|
| Fig 2 Wound healing in each group(x±s, n=3) 1: Acute wound group; 2: Chronic wound group; 3: rb-bFGF group; 4: MEBO group.*P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |
与慢性组相比,造模d 3,急性组创面愈合率增高,且有统计学意义(P<0.05);MEBO组和贝复新组也增高,但是差异无统计学意义(均P>0.05);而d 14,创面愈合率均升高,差异有统计学意义(均P<0.05)。见Fig 3。
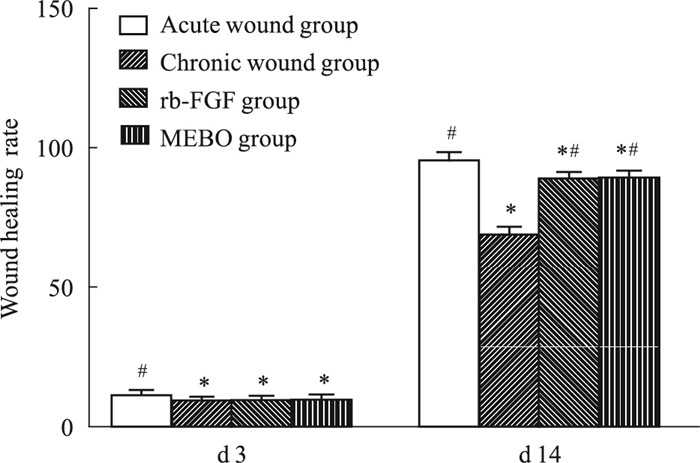
|
| Fig 3 Wound healing rate in each group at each time point(x±s, n=3) *P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |
空白组是正常皮肤,故可见正常的皮肤附件存在,整齐排列的胶原纤维及少量成纤维细胞。
造模d 3,炎性细胞浸润情况:各组均可见大量炎性细胞的浸润;间质水肿情况:慢性组间质水肿情况较急性组、MEBO组和贝复新组严重;新生毛细血管情况:急性组、MEBO组和贝复新组可见排列紊乱的毛细血管分布,而慢性组稀少。
d 14,炎性细胞浸润情况:除慢性组外,急性组、MEBO组和贝复新组几乎不见炎性细胞的浸润。胶原纤维情况:急性组、MEBO组和贝复新组可见到排列整齐的胶原纤维,而慢性组则排列紊乱;皮肤附件生长情况:除慢性组外,急性组、MEBO组和贝复新组均可见正常皮肤附件生长。见Fig 4。

|
| Fig 4 Changes of wound tissue morphology of rats in each group at each time point(HE, ×200) A: Acute wound group; B: Chronic wound group; C: rb-bFGF group; D: MEBO group; E: Blank group.1: d 3; 2: d 14 |
通过ELISA检测结果发现:空白组MMP-2和MMP-9低表达。与慢性组比较,d 3创面组织中,急性组、MEBO组和贝复新组均增高,且有统计学意义(P<0.05);而d 14,急性组、MEBO组和贝复新组MMP-2和MMP-9表达也均降低,差异有统计学意义(P<0.05),(见Fig 5,6)。
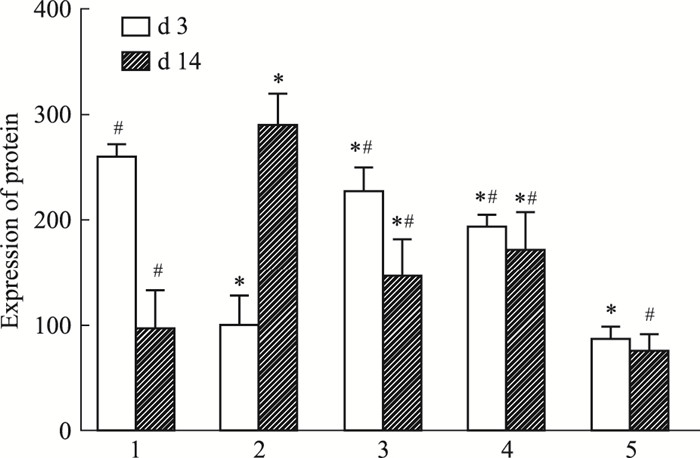
|
| Fig 5 Protein expression of MMP-2 in homogenate rat wound tissue(x±s, n=3) 1: Acute wound group; 2: Chronic wound group; 3: rb-bFGF group; 4: MEBO group; 5: Blank group. *P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |
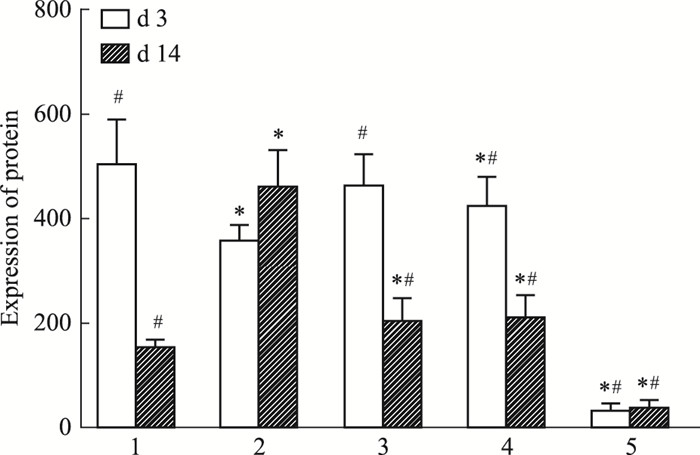
|
| Fig 6 Protein expression of MMP-9 in homogenate rat wound tissue(x±s, n=3) 1: Acute wound group; 2: Chronic wound group; 3: rb-bFGF group; 4: MEBO group; 5: Blank group.*P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |
空白组几乎不表达MMP-2和MMP-9。与慢性组相比,d 3创面组织中,急性组、MEBO组和贝复新组中MMP-2和MMP-9的蛋白表达量增高(均P<0.05);d 14,急性组、MEBO组和贝复新组中MMP-2和MMP-9的蛋白表达量均降低(均P<0.05),(见Fig 7,8)。

|
| Fig 7 Protein expression of MMP-2 in each group(x±s, n=3) 1: Acute wound group; 2: Chronic wound group; 3: rb-bFGF group; 4: MEBO group; 5: Blank group.*P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |
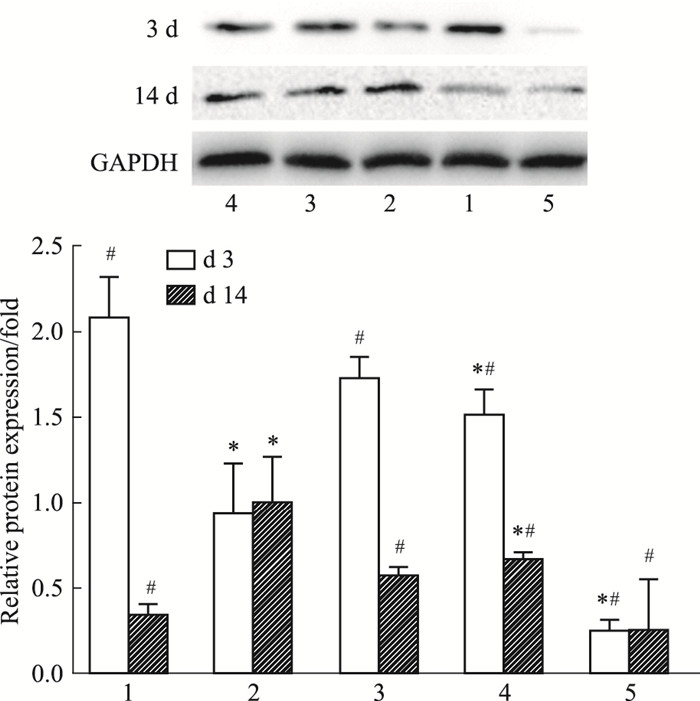
|
| Fig 8 Protein expression of MMP-9 in each group(x±s, n=3) 1: Acute wound group; 2: Chronic wound group; 3: rb-bFGF group; 4: MEBO group; 5: Blank group.*P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |
空白组几乎不转录MMP-2 mRNA和MMP-9 mRNA。与慢性组相比,d 3创面组织中,急性组、MEBO组和贝复新组中MMP-2 mRNA和MMP-9 mRNA转录水平均增高,差异有统计学意义(均P<0.05);在d 14,急性组、MEBO组和贝复新组中MMP-2 mRNA和MMP-9 mRNA转录水平均降低,差异均具有统计学意义(均P<0.05),(见Fig 9,10)。

|
| Fig 9 mRNA expression of MMP-2 in each group(x±s, n=3) 1: Acute wound group; 2: Chronic wound group; 3: rb-bFGF group; 4: MEBO group; 5: Blank group.*P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |

|
| Fig 10 mRNA expression of MMP-9 in each group(x±s, n=3) 1: Acute wound group; 2: Chronic wound group; 3: rb-bFGF group; 4: MEBO group; 5: Blank group. *P < 0.05 vs Acute wound group; #P < 0.05 vs Chronic wound group. |
慢性难愈合创面快速增长的发病率正在威胁着临床医生,其不愈合伤口的增长速度远远快于有效新疗法的出现,故寻求有效治疗慢性难愈合创面的新方法迫在眉睫。本研究通过探讨MEBT/MEBO对慢性难愈合创面组织中MMP-2和MMP-9表达的影响,并进一步探讨MEBT/MEBO可能作用机制,为临床治疗慢性难愈合创面提供理论依据。
MMP-2和MMP-9具有降解ECM蛋白并激活细胞因子、趋化因子的功能,故常参与皮肤伤口愈合的过程,如炎症,基质重塑和上皮的形成。而ECM是广泛的分布于各细胞之间,参与关键细胞的调节作用,如细胞的黏附、迁移、增殖、分化和存活。在正常生理情况下,ECM的稳态平衡是确保正常器官发育和组织稳态的关键,而MMP-2和MMP-9参与这一稳态平衡的维持。已有多项研究证明,当出现基质异常沉积时,MMP-2和MMP-9的表达量就会升高,以降解ECM的含量,来保证稳态的平衡[5, 6, 9-11]。因此,MMP-2和MMP-9在创面愈合中作用不容小觑。
本研究结果显示,急性组中MMP-2和MMP-9的表达呈先升高后降低的趋势,而慢性组中MMP-2和MMP-9表达的升高呈明显的时间依赖性,然而在d 14慢性组表达明显高于急性组。在正常皮肤中能够少量表达MMP-2,而几乎不表达MMP-9。慢性创口在早期炎症阶段状态下,就出现了修复的停滞;而急性组能够进行正常修复的主要原因是由于它能够及时的通过炎症阶段这一进程,进入增殖与重塑阶段。此次实验通过建立大鼠创面模型,发现了慢性创面与急性创面的愈合差异可能与MMP-2和MMP-9表达变化相关。既往研究结果发现,急性创面早期MMP-2和MMP-9表达升高,但是后期将恢复到基础水平;而在炎症持续的情况下,慢性创面组织中的MMP-2和MMP-9表达持续上升并在后期高于急性创面组织的表达,进而导致创面发生延迟愈合。本研究结果与既往发现相契合[12-13]。
同时,在研究过程中发现:MEBO组和贝复新组中MMP-2和MMP-9的表达与慢性组之间的差异是随时间的变化发生改变的;在创伤的早期,MEBO组和贝复新组中的MMP-2和MMP-9的表达量是高于慢性组的,而后期则低于慢性组的表达,且我们通过创面愈合率与创面愈合时间的结果分析发现,MEBO组和贝复新组的创面愈合情况较慢性组好,提示:MEBO组和贝复新组可能通过调控MMP-2和MMP-9的表达来促进创面愈合的。
创面愈合的关键在于血管新生为创面提供足够的营养物质[14]。血管新生的关键在于血管发生侧支生芽,而生芽的关键在于血管基底膜的降解,MMP-2和MMP-9在其中发挥着重要的作用,本研究HE染色结果发现,早期高表达MMP-2和MMP-9的急性组、MEBO组和贝复新组能够观察到大量的毛细血管新生,提示MMP-2和MMP-9促进创面愈合可能是通过降解ECM,进而促进血管新生。这与既往研究结果一致,MMP-2和MMP-9能够降解ECM,调节着ECM的稳态平衡,进而促进创面的愈合[9, 15]。
综上,本研究结果表明,MMP-2和MMP-9与创面愈合结局密切相关,MEBT/MEBO可能通过调控慢性难愈合创面组织中MMP-2和MMP-9表达来影响创面的愈合,这为临床治疗慢性难愈合创面提供了更价廉、效优的治疗方法。全面了解MMP-2和MMP-9的调节,对创面修复和患者预后有着重要的作用,我们在研究中虽证实MEBT/MEBO能够调控慢性创面组织中MMP-2和MMP-9的表达,但是MEBT/MEBO是否可通过调控MMP-2和MMP-9来影响慢性创面组织中ECM表达尚属未知,故仍需进行体内外MMP-2和MMP-9基因位点敲除实验,进一步阐述其具体机制。
| [1] |
唐乾利.慢性难愈合创面的外治研究现状与进展[C].中华中医药学会第十次全国中医外治学术会议贵州省针灸学会2014年学会年会论文集, 2014. Tang Q L. Research status and progress of external treatment of chronic refractory wounds[C].Proceedings of the annual meeting of Guizhou acupuncture and moxibustion society 2014, the 10th national academic conference of Chinese medicine society on external treatment of traditional Chinese medicine, 2014. |
| [2] |
徐荣祥, 萧摩. 烧伤皮肤再生疗法与创面愈合的机制[J]. 中国烧伤创疡杂志, 2003, 15(4): 253-61. Xu R X, Xiao M. Mechanism of burn skin regeneration therapy and wound healing[J]. Chin J Burns Wounds & Surface Ulcers, 2003, 15(4): 253-61. doi:10.3969/j.issn.1001-0726.2003.04.001 |
| [3] |
唐乾利, 郭璐, 王权胜, 等. MEBO/MEBT对血管内皮细胞粗面内质网影响的实验研究[J]. 中国烧伤创疡杂志, 2010, 22(4): 252-7. Tang Q L, Guo L, Wang Q S, et al. Effect of mebo/mebt on vascular endothelial cell coarse endoplasmic reticulum[J]. Chin J Burns Wounds & Surface Ulcers, 2010, 22(4): 252-7. doi:10.3969/j.issn.1001-0726.2010.04.001 |
| [4] |
唐乾利, 黄欣, 王宇, 等. 湿润暴露疗法/湿润烧伤膏治疗慢性难愈合创面的超微病理及丝裂原活化蛋白激酶激酶和c-myc mRNA表达的机制研究[J]. 中国全科医学, 2015, 18(3): 294-9. Tang Q L, Huang X, Wang Y, et al. MEBT/MEBO in the treatment of chronic refractory wounds and the mechanism of mitogen-activated protein kinase and c-myc mrna expression[J]. Chin gen med, 2015, 18(3): 294-9. doi:10.3969/j.issn.1007-9572.2015.03.17 |
| [5] |
Gould L, Abadir P, Brem H, et al. Chronic wound repair and healing in older adults:current status and future research[J]. Wound Repair Regen, 2015, 23(1): 1-13. doi:10.1111/wrr.12245 |
| [6] |
付舒, 李叶丽, 吴雨婷, 等. 淫羊藿次苷Ⅱ通过调节MMP-2、MMP-9和TIMP-1的表达抗自发性高血压大鼠心肌纤维化[J]. 中国药理学通报, 2018, 34(9): 1253-7. Fu S, Li Y L, Wu Y T, et al. Icariside Ⅱ ameliorates myocardial fibrosis in spontaneously hypertensive rats through regulating expression of MMP-2, MMP-9 and TIMP-1[J]. Chin Pharmacol Bul, 2018, 34(9): 1253-7. doi:10.3969/j.issn.1001-1978.2018.09.014 |
| [7] |
赵京禹, 付小兵, 雷永红, 等. 大鼠小面积全层皮肤缺损创面模型的制备[J]. 感染·炎症·修复, 2008, 9(1): 63-4. Zhao J Y, Fu X B, Lei Y H, et al. The preparation of a small-area full-layer skin defect wound model in rats[J]. Infect, Inflammation and Repair, 2008, 9(1): 63-4. |
| [8] |
沈道修, 顾月芳, 任晓英. 一种研究中西药抗炎作用的塑料环肉芽肿定量法[J]. 中西医结合杂志, 1983, 3(1): 49-50, 67, 5. Shen D X, Gu Y F, Ren X Y. A quantitative method of plastic ring granuloma to study the anti-inflammatory effect of Chinese and Western Medicine[J]. J Integr traditional Chin Western Med, 1983, 3(1): 49-50, 67, 5. |
| [9] |
Rastogi A, Kim H, Twomey J D, et al. MMP-2 mediates local degradation and remodeling of collagen by annulus fibrosus cells of the intervertebral disc[J]. Arthritis Res Ther, 2013, 15(2): R57. doi:10.1186/ar4224 |
| [10] |
Huang H. Matrix metalloproteinase-9(MMP-9) as a cancer biomarker and MMP-9 biosensors:recent advances[J]. Sensors (Basel), 2018, 18(10): 3249. doi:10.3390/s18103249 |
| [11] |
da Rocha-Azevedo B, Ho C H, Grinnell F. PDGF stimulated dispersal of cell clusters and disruption of fibronectin matrix on three-dimensional collagen matrices requires matrix metalloproteinase-2[J]. Mol Biol Cell, 2015, 26(6): 1098-105. doi:10.1091/mbc.E14-09-1396 |
| [12] |
Reiss M J, Han Y P, Garcia E, et al. Matrix metalloproteinase-9 delays wound healing in a murine wound model[J]. Surgery, 2010, 147(2): 295-302. doi:10.1016/j.surg.2009.10.016 |
| [13] |
Wu X, Yang L, Zheng Z, et al. Src promotes cutaneous wound healing by regulating MMP-2 through the ERK pathway[J]. Int J Mol Med, 2016, 37(3): 639-48. doi:10.3892/ijmm.2016.2472 |
| [14] |
李静平, 顾雯, 倪艺榕, 等. 人参皂苷Rg3对糖尿病大鼠难愈创面表皮细胞及血管新生的影响[J]. 中国药理学通报, 2019, 35(4): 551-6. Li J P, Gu W, Ni Y R, et al. Effects of ginsenoside Rg3 on epidermal cells and angiogenesis in impaired diabetic wound rats[J]. Chin Pharmacol Bull, 2019, 35(4): 551-6. doi:10.3969/j.issn.1001-1978.2019.04.021 |
| [15] |
LeBert D C, Squirrell J M, Rindy J, et al. Matrix metalloproteinase 9 modulates collagen matrices and wound repair[J]. Development, 2015, 142(12): 2136-46. doi:10.1242/dev.121160 |