


2. 黑龙江中医药大学药学院, 黑龙江 哈尔滨 150040
2. College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China
肝癌是肝脏的一种恶性肿瘤,是世界上最常见的癌症类型之一,也是目前癌症死亡的第三大原因,占癌症导致死亡率的8.2%[1]。90%以上与癌症相关的死亡是由癌细胞转移导致的,肝癌的远处转移也是晚期患者死亡的首要原因[2]。越来越多的研究表明[3-4],上皮间质转化(epithelial-mesenchymal transition,EMT)与肿瘤的发生发展、耐药、侵袭、转移有着密切的联系,EMT主要是指在特定的肿瘤微环境下,极性较强的上皮细胞来源的肿瘤细胞向侵袭性和转移性更强的间质细胞转化的生物学过程,此过程可以促进肿瘤组织中的肿瘤细胞向远处组织浸润和转移。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是目前研究最广泛和最有效的EMT诱导因子之一,其可以消除细胞间黏附作用及改变细胞形态,促进间质表型转化,诱导癌细胞发生EMT[5]。
小檗碱(berberine)属于异喹啉类生物碱,主要存在于小檗科、毛莨科、芸香科、罂粟科和防己科等药用植物中,其毒副作用小, 应用前景极其广阔,临床上广泛用于治疗胃肠炎、细菌性痢疾等疾病,近年来研究发现小檗碱还具有明显的降糖、调血脂、保护心血管、抗肿瘤等药理作用[6]。小檗碱以往的抗肿瘤研究报道主要集中于其抑制肿瘤细胞增殖,以及诱导肿瘤细胞凋亡等方面,但是对于小檗碱能否抑制TGF-β1诱导的肝癌HepG2细胞迁移、侵袭和EMT的作用及其机制仍未见报道。本研究旨在探讨小檗碱对TGF-β1诱导的HepG2细胞EMT的影响,以及TGF-β/Smad信号通路在此过程中的作用。
1 材料 1.1 细胞系人肝癌HepG2细胞,购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 药物与试剂盐酸小檗碱(中国食品药品检定研究院,批号:110713-201814);DMEM高糖培养基、胰蛋白酶、胎牛血清FBS(美国Gibco公司);DMSO、MTT(美国Sigma公司);TGF-β1(美国PeproTech公司);Transwell小室(美国BD公司);DPAI细胞核染色液、RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);兔源一抗E-cadherin、N-cadherin、Vimentin、Snail、MMP-2、Smad2、p-Smad2、Smad3、p-Smad3、GAPDH(美国CST公司);羊抗兔IgG二抗(武汉爱博泰克生物科技有限公司);PVDF膜、ECL化学发光液(美国Millipore公司)。
1.3 仪器FORMA 371型CO2细胞培养箱(美国Thermo Fisher公司);AE2000型显微镜(中国Motic公司);iMark型酶标仪、Powerpac300型电泳仪(美国Bio-Rad公司);Tanon-5200型全自动化学发光图像分析系统(上海天能科技有限公司);激光共聚焦扫描显微镜LCM 880(德国ZISS公司)。
2 方法 2.1 细胞培养与给药人肝癌HepG2细胞培养于含10%胎牛血清、100 U·L-1青霉素、100 mg·L-1链霉素的DMEM高糖培养基中,置37 ℃、5% CO2细胞培养箱中培养。小檗碱用DMSO溶解配置成母液,给药时用DMEM高糖完全培养基稀释成不同浓度。根据文献报道[7],采用10 ng·L-1 TGF-β1孵育HepG2细胞诱导EMT形成。
2.2 MTT实验检测HepG2细胞活力将处于对数生长期的HepG2细胞以每孔约3×103个细胞100 μL接种于96孔板中,培养过夜,在96孔板中加入不同浓度小檗碱,每组6个复孔,培养24 h、48 h后,每孔加入5 g·L-1MTT溶液10 μL,培养4 h后,吸弃上清,每孔加入150 μL DMSO溶液,摇床低速振摇10 min,在酶标仪490 nm处测定各孔吸光度,计算并绘出各组细胞活力柱状图。
2.3 克隆形成实验检测HepG2细胞克隆形成能力将处于对数生长期的HepG2细胞以每孔细胞数约为1×103个接种于6孔板中,待细胞贴壁后,加入10 ng·L-1 TGF-β1和不同浓度的小檗碱,培养大约2周后,每孔加入4%的多聚甲醛固定,然后加入0.1%的结晶紫染色,冲洗干净,拍照,计算各组细胞克隆数量。
2.4 细胞划痕实验检测HepG2细胞迁移能力将处于对数生长期的HepG2细胞以每孔细胞数约为5×105个接种于6孔板中,待细胞融合度达85%左右后,用10 μL的移液枪在每孔划出3道竖线,PBS洗去被划下的细胞,之后在6孔板中加入10 ng·L-1 TGF-β1和不同浓度的小檗碱,记为0 h,放入培养箱继续培养24 h;并用倒置显微镜观察和拍摄各组细胞0 h和24 h细胞划痕的状态。
2.5 Transwell实验检测HepG2细胞侵袭能力将带Matrigel胶的Transwell小室放于24孔板中,取对数生长期的HepG2细胞用含1%胎牛血清的高糖DMEM培养基制成细胞悬液,Transwell小室上室加入3×104个细胞200 μL含不同浓度的小檗碱培养基,Transwell下室中加入含15%胎牛血清和10 ng·L-1 TGF-β1的DMEM高糖培养基800 μL,培养48 h;4%多聚甲醛固定后,用棉签轻轻擦去Transwell上室中的Matrigel胶和细胞,倒置显微镜下观察Transwell下室中各组细胞侵袭情况,随机选择5个视野计算穿膜细胞数。
2.6 免疫荧光实验检测HepG2细胞EMT标记物将细胞爬片置于12孔板中,将处于对数生长期的HepG2细胞以每孔细胞数约为2×104个接种于爬片上,待细胞贴壁后,加入10 ng·L-1 TGF-β1和不同浓度的小檗碱培养48 h后,4%多聚甲醛固定,加入含0.3% TritonX-100的10% BSA封闭1 h,加入一抗,4 ℃孵育过夜,加入荧光二抗室温避光孵育1 h,加入DAPI染色10 min,荧光淬灭封片剂封片,激光共聚焦显微镜观察并采集图像。
2.7 Western blot实验检测目的蛋白的表达将处于对数生长期的HepG2细胞以每孔约为3×105个接种于6孔板中,待细胞贴壁后,加入10 ng·L-1 TGF-β1和不同浓度的小檗碱培养48 h后,用预冷的PBS洗2遍,加入含有蛋白酶抑制剂的RIPA裂解液,冰上裂解30 min,吸至1.5 mL的EP管中,4 ℃离心10 min,采用BCA试剂盒定量蛋白浓度。使用10%的SDS-PAGE分离蛋白样品,湿转膜法转到PVDF膜,5%脱脂牛奶室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育1 h,化学发光法显影,运用全自动化学发光图像分析系统对蛋白条带进行分析,检测蛋白表达情况。
2.8 统计学分析实验数据以x±s表示,采用SPSS 20.0软件进行统计学分析,多组数据均值比较采用完全随机设计的单因素方差(One way-ANOVA)分析,各组间两两比较采用配对t检验。
3 结果 3.1 小檗碱对HepG2细胞活力的影响如MTT结果所示(Fig 1),与正常对照组相比,低浓度(1~4 μmol·L-1)小檗碱处理HepG2细胞24 h、48 h后,HepG2细胞活性没有变化,小檗碱浓度增加至8~64 μmol·L-1时,可以呈浓度-时间依赖性抑制HepG2细胞活性(P<0.05,P<0.01)。为排除小檗碱对TGF-β1诱导的迁移侵袭和EMT的影响是由抑制HepG2细胞活性所造成的,因此,选择杀伤作用较弱的小檗碱浓度(1、2、4 μmol·L-1)开展后续EMT实验研究。

|
| Fig 1 Effect of berberine on viability of HepG2 cells(x±s, n=6) *P < 0.05, **P < 0.01 vs control group |
克隆形成实验结果显示(Fig 2),TGF-β1处理的HepG2细胞的克隆数量明显比正常组多(P<0.01);与TGF-β1模型组对比,给予小檗碱(1、2、4 μmol·L-1)干预后,HepG2细胞的克隆数量明显减少(P<0.01)。实验结果表明了小檗碱可以显著减弱TGF-β1增加的HepG2细胞克隆形成能力。

|
| Fig 2 Effect of berberine on TGF-β1-induced clonogenic potential of HepG2 cells(x±s, n=3) **P < 0.01 vs control group; ##P < 0.01 vs TGF-β1 group |
癌细胞发生EMT进程中,其会获得更强的迁移和侵袭能力,划痕和Transwell小室实验结果所示(Fig 3),与正常组相比,TGF-β1可以明显增加HepG2细胞的迁移和侵袭能力(P<0.01);与TGF-β1模型组对比,给予小檗碱(1、2、4 μmol·L-1)干预后,HepG2细胞的迁移和侵袭能力减弱(P<0.05)。这些结果表明小檗碱能有效抑制TGF-β1增强的HepG2细胞迁移和侵袭能力。
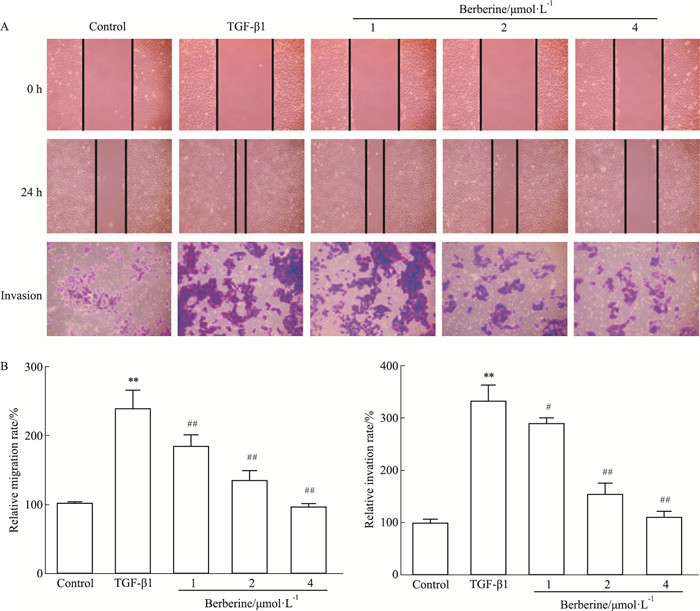
|
| Fig 3 Effect of berberine on TGF-β1-induced migration (A) and invasion (B) of HepG2 cells (x±s, n=3) **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TGF-β1 group |
Western blot检测结果显示(Fig 4),与正常组对比,TGF-β1明显减弱了HepG2细胞中上皮标记物E-cadherin蛋白的表达水平,增加了间质标记物和转录因子N-cadherin、Snail、MMP-2蛋白的表达水平(P<0.01);与TGF-β1模型组对比,给予小檗碱(1、2、4 μmol·L-1)干预后,N-cadherin、Snail、MMP-2蛋白表达水平降低,E-cadherin蛋白的表达水平增加(P<0.01)。如Fig 5激光共聚焦显微镜观察的结果所示,与正常组相比,TGF-β1明显增加了EMT间质标记物Vimentin绿色荧光的表达;而4 μmol·L-1小檗碱则明显降低了TGF-β1增加的Vimentin绿色荧光表达水平。这些结果证实了小檗碱可以有效地逆转TGF-β1诱导的肝癌HepG2细胞EMT的变化。
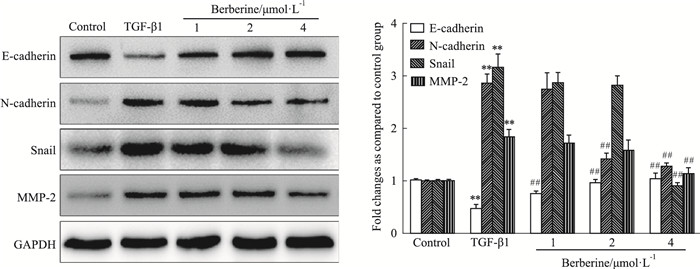
|
| Fig 4 Effect of berberine on protein expression of E-cadherin, N-cadherin, Snail, MMP-2 induced by TGF-β1 in HepG2 cells (x±s, n=3) **P < 0.01 vs control group; ##P < 0.01 vs TGF-β1 group |
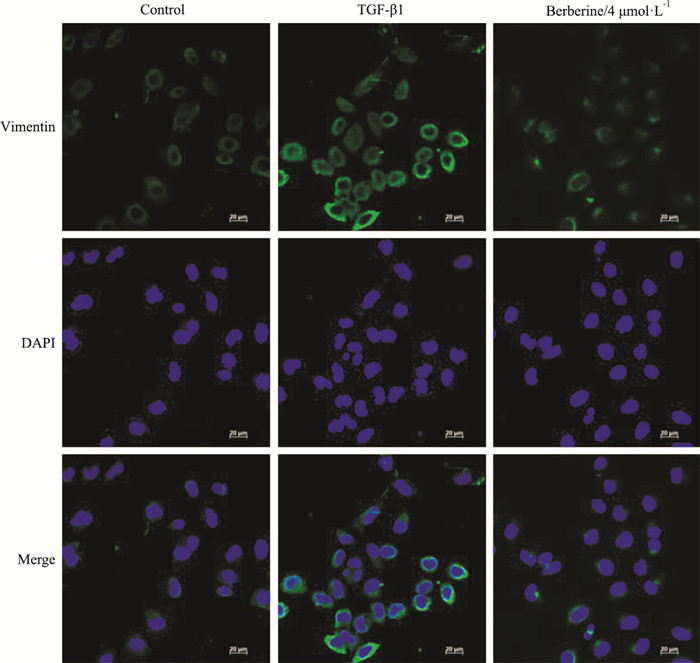
|
| Fig 5 Effect of berberine on Vimentin expression induced by TGF-β1 in HepG2 cells determined by confocal microscopy |
相关研究报道表明,TGF-β1可以激活Smad通路促进癌细胞形成EMT[8]。如Fig 6中Western blot检测结果显示,与正常组比较,TGF-β1增加了HepG2细胞中p-Smad2、p-Smad3蛋白的表达水平(P<0.01),Smad2、Smad3总蛋白水平不变;与TGF-β1模型组比较,给予小檗碱(1、2、4 μmol·L-1)干预后,p-Smad2、p-Smad3蛋白表达水平下降(P<0.05)。实验结果表明了小檗碱可以通过TGF-β/Smad信号通路逆转TGF-β1诱导的EMT转化。
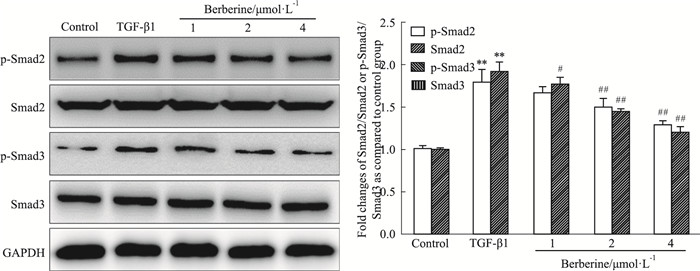
|
| Fig 6 Effect of berberine on TGF-β/ Smad pathway in HepG2 cells (x±s, n=3) **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs TGF-β1 group |
肝癌早期症状通常较为隐匿,多数患者早期几乎没有明显症状,但一旦出现相关症状前往就诊时,多数患者已经是中晚期,此时肝癌细胞已经发生转移,出现多个病灶,转移是癌症患者临床预后不良的重要原因之一,也是大多数患者死亡的重要原因[9]。癌细胞发生转移时,往往会伴随着EMT的过程,即癌细胞的表型发生了明显的变化,在此过程中,其上皮细胞的表型标志物蛋白表达会逐渐丧失,如E-钙黏蛋白(E-cadherin),紧密连接蛋白-1(Zonula Occludens-1)等,同时癌细胞的间质标志物蛋白增加,如N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、纤维连接蛋白(Fibronectin)等,肝癌细胞经过EMT后细胞间黏附能力下调, 迁移侵袭能力上调, 从而使肝癌细胞向局部组织中浸润, 通过血管或者淋巴管转移到远处的、骨组织等, 最终导致肿瘤患者死亡[10-11]。因此,研究肝癌侵袭转移的作用机制,找出一种毒性较低抑制肝癌细胞EMT的天然药物,对临床辅助治疗肝癌及改善临床预后具有重要的意义。相关研究表明[12-13],小檗碱具有较强的抗肿瘤活性,可以诱导多种肿瘤细胞凋亡及抑制癌细胞转移。因此,本实验旨在进一步研究小檗碱是否可以抑制TGF-β1诱导的HepG2细胞EMT,及其相关作用机制。
实验中为了排除较高浓度的小檗碱对HepG2细胞的杀伤作用,干扰到小檗碱抑制TGF-β1诱导的HepG2细胞迁移、侵袭和EMT,可能是由于小檗碱对HepG2细胞本身的杀伤作用,而不是小檗碱作用于TGF-β1所导致的;因此本实验首先通过MTT实验,筛选对HepG2细胞杀伤作用较弱的小檗碱(1、2、4 μmol·L-1)浓度,进行后续EMT相关实验。实验结果表明,低浓度的小檗碱(1、2、4 μmol·L-1)可以明显抑制TGF-β1增强的HepG2细胞的克隆形成能力、迁移和侵袭能力;
TGF-β1作为一种有效的EMT诱导剂,在多种高表达TGF-β的肿瘤中,其可以通过自分泌和旁分泌的方式作用于细胞膜上的Ⅱ型受体(TβRⅡ),并且磷酸化膜上的Ⅰ型受体(TβRⅠ),激活胞质内的Smad通路,磷酸化的Smad 2与Smad 3再与Smad4结合形成复合体进入细胞核中,激活转录因子Snail、ZEB、Twist后,便可抑制上皮标志物E-cadherin蛋白表达,上调间质标志物N-cadherin等蛋白表达,促进EMT的形成[5, 14]。研究表明,10 ng·L-1 TGF-β1可以通过Smad信号通路上调Snail转录因子,促进肝癌细胞的EMT[7];多数肿瘤细胞发生侵袭或者EMT时会伴随分泌基质金属蛋白酶(matrix metalloproteinase,MMP),如MMP-2,其可以溶解细胞外基质、基底膜、血管内壁等,促进肿瘤细胞从原发灶向其他组织部位浸润转移[15]。本研究通过Western blot和激光共聚焦实验首次发现,小檗碱可以降低TGF-β1诱导的Smad信号通路,抑制p-Smad2和p-Smad的表达,以及降低了TGF-β1上调的间质标志物N-cadherin、Vimentin、Snail、MMP-2蛋白表达,并且增加了TGF-β1下调的上皮标志物E-cadherin蛋白表达,实验结果表明,小檗碱逆转了TGF-β1诱导的HepG2细胞EMT,使其发生了MET(mesenchymal-epithelial transition,即间质上皮转化)。
综上所述,小檗碱可抑制TGF-β1诱导的肝癌细胞的迁移和侵袭能力,其机制可能是通过调控TGF-β/Smad信号通路,抑制EMT的形成而实现的,这些初步研究为小檗碱在肝癌分子靶向治疗的开发利用提供新的理论依据。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. Ca Cancer J Clin, 2018, 68(6): 394-24. doi:10.3322/caac.21492 |
| [2] |
Mehlen P, Puisieux A. Metastasis:a question of life or death[J]. Nat Rev Cancer, 2006, 6(6): 449-58. doi:10.1038/nrc1886 |
| [3] |
彭文婷, 孙妩弋, 孙家昌, 等. 人参皂苷CK对人肝癌细胞HepG2迁移及侵袭的影响[J]. 中国药理学通报, 2018, 34(1): 27-32. Peng W T, Sun W Y, Sun J C, et al. Effect of ginsenoside metabolite compound K on migration and invasion of human hepatocellular carcinoma line HepG2[J]. Chin Pharmacol Bull, 2018, 34(1): 27-32. doi:10.3969/j.issn.1001-1978.2018.01.008 |
| [4] |
Pastushenko I, Brisebarre A, Sifrim A, et al. Identification of the tumour transition states occurring during EMT[J]. Nature, 2018, 556(7702): 463-8. doi:10.1038/s41586-018-0040-3 |
| [5] |
David C J, Huang Y H, Chen M, et al. TGF-β tumor suppression through a lethal EMT[J]. Cell, 2016, 164(5): 1015-30. doi:10.1016/j.cell.2016.01.009 |
| [6] |
邢宇, 刘鑫, 林园, 等. 小檗碱药理作用及其临床应用研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(6): 491-502. Xing Y, Liu X, Lin Y, et al. Progress in pharmacological effects and clinical applications of berberine[J]. Chin J Pharmacol Toxicol, 2017, 31(6): 491-502. doi:10.3867/j.issn.1000-3002.2017.06.001 |
| [7] |
Deng G, Zeng S, Ma J, et al. The anti-tumor activities of Neferine on cell invasion and oxaliplatin sensitivity regulated by EMT via Snail signaling in hepatocellular carcinoma[J]. Sci Rep, 2017, 7: 41616. doi:10.1038/srep41616 |
| [8] |
Yeh H W, Hsu E C, Lee S S, et al. PSPC1 mediates TGF-β1 autocrine signaling and Smad2/3 target switching to promote EMT, stemness and metastasis[J]. Nat Cell Biol, 2018, 20(4): 479-91. doi:10.1038/s41556-018-0062-y |
| [9] |
麻勇, 刘连新. 转移性肝癌的早期诊断[J]. 中国实用外科杂志, 2011, 31(11): 1055-7. Ma Y, Liu L X. Early diagnosis of metastatic liver cancer[J]. Chin J Pract Surg, 2011, 31(11): 1055-7. |
| [10] |
李汉清, 可燕. 上皮间质转化的机制研究进展[J]. 中国药理学通报, 2017, 33(10): 1342-4. Li H Q, Ke Y. Mechanism of epithelial-mesenchymal transition[J]. Chin Pharmacol Bull, 2017, 33(10): 1342-4. doi:10.3969/j.issn.1001-1978.2017.10.003 |
| [11] |
白利平, 康向鹏, 林立, 等. 自噬介导的雷公藤甲素提高西妥昔单抗对SW480细胞治疗效果的实验研究[J]. 中国药理学通报, 2019, 35(3): 396-402. Bai L P, Kang X P, Lin L, et al. Autophagy induced synergistic inhibitory effect of cetuximab in combination with triptolide on proliferation and metastasis of colorectal SW480 cells[J]. Chin Pharmacol Bull, 2019, 35(3): 396-402. doi:10.3969/j.issn.1001-1978.2019.03.020 |
| [12] |
Zou K, Li Z, Zhang Y, et al. Advances in the study of berberine and its derivatives:a focus on anti-inflammatory and anti-tumor effects in the digestive system[J]. Acta Pharmacol Sin, 2017, 38(2): 157-67. doi:10.1038/aps.2016.125 |
| [13] |
Kou Y, Li L, Li H, et al. Berberine suppressed epithelial mesenchymal transition through cross-talk regulation of PI3K/AKT and RARα/RARβ in melanoma cells[J]. Biochem Biophys Res Commun, 2016, 479(2): 290-6. doi:10.1016/j.bbrc.2016.09.061 |
| [14] |
Nieto M A, Huang R Y, Jackson R A, et al. EMT:2016[J]. Cell, 2016, 166(1): 21-45. |
| [15] |
程先硕, 杨之斌, 殷正丰. 基质金属蛋白酶与肿瘤上皮间质转化的研究进展[J]. 中国肿瘤生物治疗杂志, 2011, 18(4): 437-40. Cheng X S, Yang Z B, Yin Z F. Matrix metalloproteinases and epithelial-mesenchymal transition in tumor:An advance[J]. Chin J Cancer Biother, 2011, 18(4): 437-40. doi:10.3872/j.issn.1007-385X.2011.04.019 |

