2. 上海大学转化医学研究院, 上海 200444;
3. 第二军医大学药学系, 上海 200433
张立超(1972-), 男, 博士, 主任药师, 研究方向:抗炎免疫药理学, E-mail:changhaiskin@163.com。
2. Translational Medicine Research Institute of Shanghai University, Shanghai 200444, China;
3. Dept of Pharmacy, Second Milltary Medical University, Shanghai 200433, China
免疫炎症反应(immuno-inflammatory response)是通过细胞因子激活机体免疫细胞的活化,从而进一步释放细胞因子的过程。Swiprosin-1又称EF-hand domain-containing protein D2(EFhd2),是一种保守的EF手性卷曲螺旋蛋白,主要在淋巴细胞和免疫系统中发挥作用[1]。目前研究发现,EFhd2参与肥大细胞、巨噬细胞和B淋巴细胞等免疫细胞的炎症因子分泌、迁移和凋亡,以及核转录因子κB(NF-κB)、Janus激酶/信号转导和转录激活因子(JAK-STAT)、丝裂原活化蛋白激酶(MAPK)和钙信号等炎症信号通路的调节,表明EFhd2具有广泛的免疫调节潜能。本文主要综述了EFhd2在调控免疫炎症反应中的研究进展。
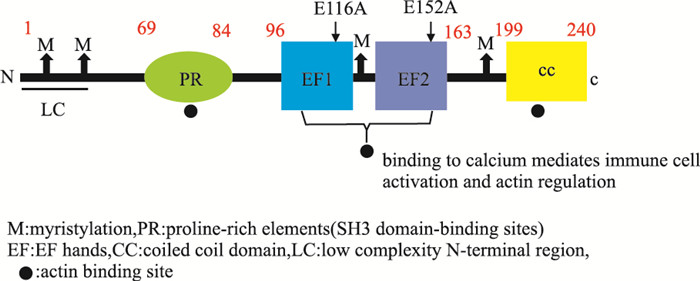
1 EFhd2的结构及表达分布EFhd2是一种由240个氨基酸组成的钙衔接蛋白,分子量为27 ku(预测值)和33 ku(表观值)。通过蛋白质一级结构分析显示,EFhd2由4个推定的豆蔻酰化位点(脂质修饰),3个SH3结构域蛋白的结合位点,2个功能性EF手性结构域和C末端卷曲螺旋结构域组成[1-2]。
EFhd2最初在人的CD8+T淋巴细胞中被发现[1],随后发现其在未成熟的B细胞、肥大细胞、自然杀伤细胞(NK细胞)、人外周血单核细胞(PBMC)等其它免疫细胞中也有表达[2-3]。并且,EFhd2广泛表达于不同物种的组织和细胞中,在脑、肝脏、心脏、脾脏、肺、肾等组织中均有表达。研究还发现,EFhd2在许多病理状态,如炎症(急性-被动皮肤过敏和慢性特异性皮炎)、神经退行性疾病、精神分裂症、脓毒症、糖尿病肾病及肠球菌感染的男性生殖病等情况下均显示表达增高[4],表明EFhd2与免疫和炎症反应具有一定相关性。
2 EFhd2在免疫炎症反应中的调节作用 2.1 EFhd2参与免疫细胞的激活目前研究发现,从果蝇到高等生物,EFhd2在小鼠单核巨噬细胞RAW264、人PBMC、小胶质细胞和NK样细胞中均有表达。并且,EFhd2参与了T细胞晚期活化的蛋白激酶C(PKC)信号通路的表达调节和T细胞诱导的细胞毒性,在肥大细胞活化期间表达上调;促进巨噬细胞凋亡、迁移和炎症因子的分泌;可作为B细胞脂筏(BCR)相关的衔接蛋白参与钙离子信号的传导等,这些结果表明,EFhd2可能作为免疫炎症反应调控中的潜在靶标。
2.1.1 在T细胞中的作用作为免疫反应的核心参与者,T细胞可通过与靶细胞特异性结合,破坏靶细胞膜直接杀伤靶细胞或释放淋巴因子使免疫效应扩大和增强。基质细胞衍生因子-1α(SDF-1α)是T细胞的一般趋化因子,并且SDF-1α受体CXCR4在大多数淋巴细胞均存在表达[5]。过表达EFhd2增强了SDF-1α介导Jurkat T细胞在纤粘蛋白上的细胞迁移[5]。但Kim等[6]发现, EFhd2的过表达不参与T细胞抗原受体(T cell receptor,TCR)刺激或细胞内信号激活诱导的T细胞活化,提示其不参与最初的T细胞活化;而使用抗CD3/28抗体刺激Jurkat T细胞6~12 h后,EFhd2 mRNA在T细胞活化期间表达明显增加,并且其蛋白水平在PMA刺激下以时间依赖方式上调,表明EFhd2可能参与T细胞晚期的PKC信号通路的活化[6]。
程序性细胞死亡蛋白-1(PD-1)是一种典型的共抑制受体,在免疫抑制中通过结合配体PD-LI或PD-L2激活T淋巴细胞。Michael等[7]发现EFhd2与免疫突触中的PD-1共定位并且可作为PD-1信号转导的重要介质。通过小干扰RNA(siRNA)干扰人原代T细胞中的EFhd2,几乎完全消除了PD-1对抗原受体下游IL-2分泌的抑制作用,而敲减EFhd2阻断了PD-1诱导的细胞外调节蛋白激酶(ERK)去磷酸化。此外,将MC38鼠结肠癌细胞植入EFhd2敲除鼠皮下,与同窝野生型小鼠相比,敲除鼠的细胞毒性降低、细胞中溶解颗粒向免疫突触极化受损以及肿瘤生长速率增加,表明EFhd2对于T细胞诱导的细胞毒性也是必需的[7]。
2.1.2 在肥大细胞中的作用在体外培养的人肥大细胞HMC-1中,Kim等[8-9]发现,佛波酯对EFhd2有瞬时诱导作用,过表达EFhd2能增强PKA/A23187刺激HMC-1分泌组胺和IL-8,增加IL-8和IL-3 mRNA的表达,而敲减EFhd2可抑制IL-8和IL-3 mRNA表达。此外,他们还通过IgE和人血清白蛋白(DNP-HAS)刺激的FcεRI交联,以及被动皮肤过敏反应和特应性皮炎的体内组织模型发现RBL-2H3细胞中EFhd2的表达上调。这些结果证明了在炎症反应中,EFhd2可能作为细胞因子表达和肥大细胞活化的调节剂[8]。
2.1.3 在巨噬细胞中的作用巨噬细胞是抵抗入侵病原体的起始防御线之一,是具有诱导初级免疫应答能力的抗原递呈细胞。通过释放各种细胞因子如肿瘤坏死因子-α(TNF-α),巨噬细胞可参与调节适应性免疫应答,在重组牛分枝杆菌株(BCG)对人单核细胞系THP-1细胞的刺激下,EFhd2与TNF-α、CD40等一起被明显上调,增强了免疫刺激活性,改善了THP-1细胞的抗原递呈能力[10]。此外,THP-1细胞在脂多糖(LPS)处理下显示EFhd2的上调,而使用siRNA敲减THP-1中EFhd2的表达则会降低LPS处理后上清液中IL-6和TNF-α的浓度,表明EFhd2的敲除会损害LPS诱导的免疫反应[10]。在脓毒症小鼠中,我们研究发现,与野生小鼠来源的腹腔巨噬细胞相比,EFhd2敲除小鼠来源的巨噬细胞表达更少的HLA-DR,吞噬作用和细菌杀伤能力也受损;并且EFhd2敲除小鼠在LPS或盲肠结扎穿孔术(CLP)诱导的脓毒症中表现出更高的死亡率,严重的器官功能障碍,表明EFhd2参与巨噬细胞免疫应答调控[11]。
当局部损伤或炎症发生时,源自炎症病灶的促炎信号(如促炎细胞因子和微生物)通过诱导单核细胞从骨髓中迁移,循环单核细胞通过滚动、黏附和细胞骨架驱动的局部内皮细胞迁移而靶向炎症位点,参与多种器官和组织的修复[12]。在人骨髓间充质干细胞(BMSCs)到成骨细胞的分化过程中,和使用NF-κB受体激活蛋白配体(RANK-L)刺激小鼠巨噬细胞系RAW264细胞分化为破骨细胞的过程中,EFhd2 mRNA的表达量均表现明显增高[13],表明EFhd2可能与炎症疾病中BMSCs的自噬相关,参与骨代谢的调控。另一方面,在主动脉斑块中的巨噬细胞中EFhd2也呈现高表达,并伴随泡沫化程度的加重而表达增加。EFhd2敲除后巨噬细胞中泡沫化程度明显减弱,促凋亡相关蛋白Bax、caspase-3、caspase-9以及炎症因子IL-1β、TNF-α水平减少,而抑凋亡蛋白Bcl-2表达增加,表明巨噬细胞表达的EFhd2加速动脉粥样硬化的进展[14]。
2.1.4 在B细胞中的作用B细胞最初来源于骨髓的多能干细胞,成熟B细胞经外周血进入脾脏、淋巴结,在抗原刺激后分化增殖为质细胞,继而合成和分泌抗体,参与体液免疫的执行。先前存在的大量研究已证明,EFhd2从祖B细胞到浆母细胞阶段均有表达,并在骨髓未成熟的B细胞中表达最高,但也表达于静息和激活的脾脏B细胞及其他非淋巴组织[2]。
B细胞受体(BCR)与其他因素一起控制着抗原诱导的继发淋巴器官中B淋巴细胞的阳性选择和稳态。值得注意的是,EFhd2在小鼠WEHI231细胞中可作为响应BCR刺激的脾酪氨酸激酶(Syk)活性的正性调节剂[3],并且EFhd2可作为与B细胞脂筏相关的小衔接蛋白参与钙信号的传导,控制B细胞受体信号转导。过表达EFhd2的WEHI231细胞中,抗凋亡蛋白Bcl-2(BH)同源蛋白Bcl-XL大约减少了3倍。相反地,EFhd2沉默细胞中Bcl-XL蛋白与对照组相比平均增加了3倍。这些结果表明EFhd2可通过与Bcl-XL的相互调节控制WEHI231细胞群的净细胞生长和细胞的自发凋亡[2]。
在C57BL/6小鼠中敲除EFhd2并未影响B细胞对胸腺非依赖性抗原,如Nitrophenol-Ficoll和Trinitrophenol-LPS的免疫应答。与野生小鼠相比,EFhd2敲除增加了感染巴西线虫小鼠Th2细胞介导的IgE和IgM的产生。使用绵羊红细胞(SRBC)和蠕虫免疫小鼠7 d后,EFhd2敲除小鼠生发中心B细胞和其它同型抗体明显增加,表明EFhd2在生发中心依赖性的体液免疫中可作为负性调节因子[15]。
2.2 EFhd2参与调节细胞迁移细胞骨架是一种由蛋白亚基组成的纤维网状结构,对于细胞中亚细胞器的空间排布、细胞迁移、细胞分裂及细胞凋亡起着重要作用并最终决定整体细胞形状[16]。细胞迁移的过程可分为前缘板状伪足的形成,新黏附的建立,肌动蛋白、肌球蛋白收缩与基质分离完成。而这些过程均依赖于肌动蛋白骨架的聚合、解聚及重新组装,并受Rho蛋白调节。Rho家族蛋白是细胞骨架重组的主要调节因子之一,在细胞的迁移中起着重要作用。例如Cdc42是细胞极性调节和丝状伪足形成所必需的;Rac1是板状伪足、膜褶皱的形成和细胞迁移所必需的;而RhoA是细胞内信号转导通路的关键分子,参与迁移细胞后缘的缩回。
在富含肌动蛋白细胞骨架的区域如HMC-1细胞的突起和293T细胞的膜顶端脊中EFhd2高度集聚,并呈现出肌动蛋白结合活性[6, 9]。例如,在胚胎成肌细胞融合过程中,果蝇EFhd2经常与F-肌动蛋白灶重叠[17];在PKC激动剂佛波酯和表皮生长因子(EGF)刺激下,EFhd2伴随F-actin在COS-7和B16F10细胞中重新定位[9, 18];此外,在具有肌动蛋白和肌动蛋白结合蛋白(如α-辅肌动蛋白、塑性蛋白和细丝蛋白)的NK样细胞、肥大细胞和黑素瘤细胞的细胞骨架部分中均发现了EFhd2,提示其可通过肌动蛋白重塑调节细胞活化[5, 9, 19]。
我们先前的研究发现,EFhd2可通过直接促进肌动蛋白聚合参与LPS刺激的巨噬细胞迁移[19];过表达EFhd2可增强板状伪足的形成及LPS刺激的巨噬细胞迁移,而敲除EFhd2抑制了LPS诱导的Rac1/Cdc42和磷酸化Rac1/Cdc42的表达变化[19]。虽然,EFhd2不促进由肌动蛋白相关蛋白Arp2/3复合体和WASP蛋白的VCA结构域介导的肌动蛋白聚合,但EFhd2在丝氨酸残基183(Ser183)位点的磷酸化可通过抑制肌动蛋白丝的聚集和调节F-肌动蛋白对cofilin的可及性参与肌动蛋白的解聚[18]。类似的,Huh等[4]发现EFhd2异位表达增强了与肌动蛋白相关的突起如板状伪足和膜褶皱的形成,并激活B16F10细胞中的Rac1和Cdc42活性。
EFhd2位于70~199个氨基酸之间含有3个肌动蛋白结合位点(69~96,96~163和163~199)[19]。在EFhd2的N端区域(氨基酸1~69)和C端卷曲螺旋区域(氨基酸200~240)中鉴定出非常弱或没有肌动蛋白结合位点,然而这些位点对于由EFhd2调节的肌动蛋白亲和力是必不可少的[17, 19]。与对照相比,敲除EFhd2的EF手基序(D97~163,M2)后显示出较少的肌动蛋白成束活性,而卷曲螺旋结构域(1~163,M1)的敲除消除了肌动蛋白成束活性,显示细胞质区域细胞铺展和板状伪足形成明显减少,表明EFhd2的卷曲螺旋结构中富含赖氨酸的区域(218~240)对于肌动蛋白成束活性是必不可缺的[6]。
3 EFhd2调节免疫炎症反应的信号通路已知EFhd2可参与多种信号通路的调节。如HMC-1肥大细胞的PKC-βI/η[8]、Jurkat T细胞的NF-κB和PKC-θ[6]、WEHI231 B细胞的BCR[2]、破骨细胞样细胞的核因子κB受体活化因子配体(RANKL)[10]、巨噬细胞中的JAK2/STAT1/3[11]、肾小球内皮细胞中的PKC-β[20]和肾小球足细胞的MAPK信号通路[21]、Ca2+信号的转导[17]等。其中NF-κB、JAK-STAT和MAPK作为最主要的三条炎症信号通路,EFhd2均被报道参与其中。
3.1 参与NF-κB信号通路转导NF-κB是一种重要的免疫炎症信号通路,参与调控促炎介质如细胞因子、趋化因子和粘附因子等基因的表达。值得注意的是,EFhd2在NF-κB活化中具有双重作用。在BCR信号通路中作为NF-κB活化的负调节剂[2],而在PKC信号通路中作为NF-κB的正调节剂[8]。
Kim等[6]发现在佛波酯PMA/A23187刺激后,Jurkat T细胞中异位表达的EFhd2显著增强了NF-κB的转录活性和IκB-α降解,以及促炎细胞因子的表达;而在特异性NF-κB活化抑制剂咖啡酸苯乙酯(CAPE)的刺激下,阻断了EFhd2表达上调。此外,Nomiyama等[10]通过NF-κB配体的受体激活剂RANKL和TNF-α以及巨噬细胞炎性蛋白-1α(MIP-1α)三者联用处理小鼠巨噬细胞RAW264.7后也发现,EFhd2基因的表达上调,表明NF-κB信号传导对于巨噬细胞中EFhd2的诱导至关重要。
相反,Avramidou等[2]通过BCR刺激未成熟小鼠B淋巴细胞WEHI231,发现沉默EFhd2诱导了强烈的IκB-α磷酸化和降解,但在对照细胞和异位表达EFhd2的细胞中并没有观察到此现象,表明EFhd2在经典NF-κB信号通路的活化中可能起负性调节作用。
3.2 参与JAK-STAT和MAPK信号通路转导JAK-STAT信号通路作为多种细胞因子和生长因子在细胞内传递信号的共同途径,参与炎症和类风湿关节炎、银屑病和炎症性肠病等多种自身免疫疾病。IFN-γ与其细胞表面受体IFN-γR结合后可激活下游的JAK-STAT信号通路,继而激活某些抗炎基因的表达,参与启动和调控免疫炎症[22]。
前期研究中,我们发现EFhd2敲除抑制了由IFN-γ激活的STAT1和STAT3磷酸化[11]。与LPS处理后的野生型相比,EFhd2-/-脓毒症小鼠血清与T细胞中IFNγ水平减少,巨噬细胞中IFN-γR的表达水平和JAK-STAT通路的活化(JAK2,STAT1和STAT3磷酸化)也均明显降低;相反,过表达EFhd2明显增加了JAK2/STAT1/3的磷酸化[11]。另一方面,曹雪涛等[22]发现EFhd2与布鲁顿酪氨酸蛋白激酶(BTK)磷酸化的Ⅰ型IFN受体的β亚基(IFN-γR2Y289)相互作用,促进IFN-γR2的膜转运,并形成功能性IFN-γR以介导IFN-γ信号转导,从而参与启动巨噬细胞对于胞内细菌感染的有效先天性免疫反应。并且,李斯特菌感染的EFhd2敲除鼠与同窝野生型小鼠相比,在腹腔巨噬细胞的细胞膜上显示出IFN-γR2表达显著降低,并且其TNF-α和IL-6 mRNA也远低于野生型[22]。以上结果表明,EFhd2不仅影响IFN-γR1的表达,而且对于驱动IFN-γR2膜转运也是不可或缺的。
另一方面,MAPK信号通路在细胞的增殖、分化和凋亡中也起着非常重要的作用。我们前期研究发现,肾小球足细胞MPC-5表达EFhd2,使用链脲佐菌素和高葡萄糖处理后EFhd2表达增加;虽然敲除EFhd2与野生型对照组之间p38的磷酸化水平并没有明显差异,但p38的磷酸化水平在野生型糖尿病小鼠中却是增加的;EFhd2敲除糖尿病小鼠和高糖处理的EFhd2敲减的MPC-5细胞中p38的磷酸化水平及足细胞凋亡均受到抑制;给予p38抑制剂SB203580减少了高糖诱导的细胞凋亡。这些结果表明EFhd2在糖尿病肾病早期可通过激活p38 MAPK信号通路促进足细胞凋亡[21]。
3.3 参与Ca2+信号转导Ca2+是绝大部分细胞必不可缺的第二信使,持续的Ca2+流入对于淋巴细胞的激活和适应性免疫反应均起着至关重要的作用。Ca2+信号转导通常通过EF手型(EF-hand)家族的Ca2+结合蛋白参与执行,如通过钙调神经磷酸酶激活NFAT的钙调蛋白[17]。
EFhd2作为一种Ca2+衔接蛋白,可将Syk,SLP-65和PLCγ2结合在一起介导BCR诱导的钙离子流动[1-2, 9]。在小鼠B细胞系WEHI213细胞中,过表达EFhd2明显增强了IgM抗体刺激后BCR诱导的游离钙离子浓度,而敲除EFhd2显示低钙离子浓度[2, 23]。并且与野生型EFhd2相比,富含脯氨酸的区域(PR)、N-端无序区域(LC)和EF1缺失的突变体并未恢复BCR诱导的钙离子流动,表明EFhd2的PR、LC和EF1区域对于BCR诱导的钙离子流动是必不可缺的[2]。Kroczek等[3]发现,EFhd2蛋白可通过负性调节NF-κB抗细胞凋亡途径影响细胞存活和内质网储存的钙流出。然而,Morowski等[24]使用经典血小板激动剂如胶原相关肽(4 mg·L-1)和凝血酶(10-5 U·L-1)刺激血小板15 min后,发现EFhd2敲除小鼠的血小板并未改变正常的Ca2+储存和释放,表明EFhd2对于血小板中的Ca2+信号传导是非必需的。
通过构建EFhd2蛋白N-末端聚丙氨酸区域、高度保守的C-末端卷曲螺旋区域和EF-手基序截短突变体并进行钙结合活性测定,Ferrer-Acosta等[25]发现,EFhd2的钙结合活性取决于两个EF-手基序的完整性,N-末端和C-末端敲除增强了EFhd2的钙结合能力。保守的谷氨酸残基即E116和E152分别位于EFhd2的EF1和EF2的-Z位置。Hagen等[23]发现,E116、E152单个突变使得钙结合能力减半,而双突变则钙结合力消失,进一步表明了EF1和EF2的保守残基E116A和E152A是EFhd2钙结合必不可少的。
4 结语目前研究发现,EFhd2与急性-被动皮肤过敏和慢性特异性皮炎、脓毒症、类风湿关节炎、糖尿病肾病等自身免疫疾病相关,并通过NF-κB、JAK-STAT、MAPK和Ca2+等多种信号通路参与炎症细胞因子的激活,敲除EFhd2可抑制炎症的发生,但也有部分报道认为EFhd2可作为免疫炎症的负性调节因子。总之,EFhd2在免疫和炎症性疾病中的作用仍需要进一步的研究,为免疫炎症反应的防治提供新的思路。
| [1] |
Vuadens F, Rufer N, Kress A, et al. Identification of swiprosin-1 in human lymphocytes[J]. Proteomics, 2004, 4(8): 2216-20. doi:10.1002/pmic.200300779 |
| [2] |
Avramidou A, Kroczek C, Lang C, et al. The novel adaptor protein Swiprosin-1 enhances BCR signals and contributes to BCR-induced apoptosis[J]. Cell Death Differ, 2007, 14(11): 1936-47. doi:10.1038/sj.cdd.4402206 |
| [3] |
Kroczek C, Lang C, Brachs S, et al. Swiprosin-1/EFhd2 controls B cell receptor signaling through the assembly of the B cell receptor, Syk, and phospholipase C gamma2 in membrane rafts[J]. J Immunol, 2010, 184(7): 3665-76. doi:10.4049/jimmunol.0903642 |
| [4] |
Huh Y H, Oh S, Yeo Y R, et al. Swiprosin-1 stimulates cancer invasion and metastasis by increasing the Rho family of GTPase signaling[J]. Oncotarget, 2015, 6(15): 13060-71. |
| [5] |
Kwon M S, Park K R, Kim Y D, et al. Swiprosin-1 is a novel actin bundling protein that regulates cell spreading and migration[J]. PLoS One, 2013, 8(8): e71626. doi:10.1371/journal.pone.0071626 |
| [6] |
Kim Y D, Kwon M S, Na B R, et al. Swiprosin-1 expression is up-regulated through protein kinase c-theta and NF-kappaB pathway in T cells[J]. Immune netw, 2013, 13(2): 55-62. doi:10.4110/in.2013.13.2.55 |
| [7] |
Peled M, Dragovich M A, Adam K, et al. EF Hand Domain Family Member D2 is required for T cell cytotoxicity[J]. J Immuno, 2018, 201(9): 2824-31. doi:10.4049/jimmunol.1800839 |
| [8] |
Thylur R P, Kim Y D, Kwon M S, et al. Swiprosin-1 is expressed in mast cells and up-regulated through the protein kinase C beta I/eta pathway[J]. J Cell Biochem, 2009, 108(3): 705-15. doi:10.1002/jcb.22307 |
| [9] |
Ramesh T P, Kim Y D, Kwon M S, et al. Swiprosin-1 regulates cytokine expression of human mast cell line HMC-1 through actin remodeling[J]. Immune netw, 2009, 9(6): 274-84. doi:10.4110/in.2009.9.6.274 |
| [10] |
Xu Y, Liu W, Shen H, et al. Recombinant mycobacterium bovis BCG expressing chimaeric protein of Ag85B and ESAT-6 enhances immunostimulatory activity of human macrophages[J]. Microbes Infect, 2010, 12(8-9): 683-9. doi:10.1016/j.micinf.2010.04.002 |
| [11] |
Zhang S, Tu Y, Sun Y M, et al. Swiprosin-1 deficiency impairs macrophage immune response of septic mice[J]. JCI Insight, 2018, 3(3): pii:95396. doi:10.1172/jci.insight.95396 |
| [12] |
李程豪, 刘永琦, 骆亚莉, 等. 炎性环境与间充质干细胞自噬相互影响关系的研究进展[J]. 中国药理学通报, 2018, 34(5): 597-600. Li C H, Liu Y Q, Luo Y L, et al. Research progress on the interaction between inflammatory environment and autophagy of mesenchymal stem cells[J]. Chin Pharmacol Bull, 2018, 34(5): 597-600. doi:10.3969/j.issn.1001-1978.2018.05.002 |
| [13] |
Nomiyama H, Egami K, Wada N, et al. Identification of genes differentially expressed in osteoclast-like cells[J]. J interferon cytokine res, 2005, 25(4): 227-31. doi:10.1089/jir.2005.25.227 |
| [14] |
仝令畅.巨噬细胞表达的swiprosin-1在动脉粥样硬化中的作用及其机制研究[D].第二军医大学, 2016. Tong L C. The role of swiprosin-1 expressed by macrophages in atherosclerosis and its mechanism[D]. Second Military Medical University, 2016. |
| [15] |
Brachs S, Turqueti-Neves A, Stein M. Swiprosin-1/EFhd2 limits germinal center responses and humoral type 2 immunity[J]. Eur J Immunol, 2014, 44(11): 3206-19. doi:10.1002/eji.201444479 |
| [16] |
McKayed K K, Simpson J C. Actin in action:imaging approaches to study cytoskeleton structure and function[J]. Cells, 2013, 2(4): 715-31. doi:10.3390/cells2040715 |
| [17] |
Thylur R P, Gowda R, Mishra S, et al. Swiprosin-1:Its expression and diverse biological functions[J]. J Cell Biochem, 2018, 119(1): 150-6. doi:10.1002/jcb.26199 |
| [18] |
Huh Y H, Kim S H, Chung K H, et al. Swiprosin-1 modulates actin dynamics by regulating the F-actin accessibility to cofilin[J]. Cell Mol Life Sci, 2013, 70(24): 4841. doi:10.1007/s00018-013-1447-5 |
| [19] |
Tu Y, Zhang L C, Tong L C, et al. EFhd2/swiprosin-1 regulates LPS-induced macrophage recruitment via enhancing actin polymerization and cell migration[J]. Int Immunopharmacol, 2018, 55: 263-71. doi:10.1016/j.intimp.2017.12.030 |
| [20] |
Wang Z B, Zhang S, Li Y, et al. LY333531, a PKCbeta inhibitor, attenuates glomerular endothelial cell apoptosis in the early stage of mouse diabetic nephropathy via down-regulating swiprosin-1[J]. Acta pharmacol Sin, 2017, 38(7): 1009-23. doi:10.1038/aps.2016.172 |
| [21] |
Wang R M, Wang Z B, Wang Y, et al. Swiprosin-1 promotes mitochondria-dependent apoptosis of glomerular podocytes via P38 MAPK pathway in early-stage diabetic nephropathy[J]. Cell Physiol Biochem, 2018, 45(3): 899-916. doi:10.1159/000487285 |
| [22] |
Xu X Q, Xu J, Wu J C, et al. Phosphorylation-mediated IFN-gammaR2 membrane translocation is required to activate macrophage innate response[J]. Cell, 2018, 175(5): 1336-51. doi:10.1016/j.cell.2018.09.011 |
| [23] |
Hagen S, Brachs S, Kroczek C, et al. The B cell receptor-induced calcium flux involves a calcium mediated positive feedback loop[J]. Cell Calcium, 2012, 51(5): 411-7. doi:10.1016/j.ceca.2012.01.004 |
| [24] |
Morowski M, Brachs S, Mielenz D, et al. The adaptor protein Swiprosin-1/EFhd2 is dispensable for platelet function in mice[J]. PLoS One, 2014, 9(9): e107139. doi:10.1371/journal.pone.0107139 |
| [25] |
Ferrer-Acosta Y, Rodriguez C E, Vaquer A C, et al. Functional and structural analysis of the conserved EFhd2 protein[J]. Protein pept lett, 2013, 20(5): 573-83. doi:10.2174/0929866511320050011 |