

G蛋白偶联受体(G protein-coupled receptors,GPCRs)是位于细胞膜上庞大的受体家族,介导多种信号转导通路,参与机体的生理和病理活动。GPCRs具有相同的七次跨膜结构域,一旦细胞外的配体(药物、激素、脂质)在细胞膜上特定的结合位点与GPCRs相互作用,就会转导细胞外的信号到细胞内,发生一系列的级联放大反应,调节许多不同的信号转导途径,从而在机体的神经疾病、脂肪代谢、急性和慢性炎症以及癌症干预和治疗等方面发挥了重要的作用[1],因为不同的GPCRs具有不同的功能,因此成为了许多疾病研究的作用靶点。TGR5受体作为GPCRs一员,也称为M-BAR或GPCBAR1,于2002年在研究代谢方面的实验时首次发现了TGR5受体,也是发现的第二个胆汁酸受体,TGR5受体具有七次螺旋跨膜结构域,属于典型的GPCRs家族成员。TGR5受体在人和动物体内广泛地表达,如胎盘、心脏、脾脏、骨骼肌、肾、肝、小肠、肺和外周血白细胞、神经细胞等,其中TGR5 mRNA的表达在肺、胎盘和脾脏非常高。研究发现,TGR5受体可以被胆汁酸以及TGR5特异性激动剂INT-777激活,发生内陷反应以介导第二信使环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的产生[2];同时,活化的TGR5受体可以介导许多重要的信号转导通路,如转录交换因子-κB(nuclear factor κB,NF-κB)、蛋白激酶B(protein kinase B,AKT),细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和信号转导以转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)。
1 TGR5与AKT信号通路AKT也称作蛋白激酶B,是一种丝氨酸/苏氨酸特异性蛋白激酶,参与细胞凋亡、细胞增殖、细胞周期等生理和生化过程。TGR5受体通过细胞膜上的Gs蛋白将细胞外的信号转移到细胞内,在磷脂酰肌醇3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)催化下,3, 4, 5-三磷酸磷脂酰肌醇[phosphatidylinositol 3, 4, 5-triphosphate,PI(3, 4, 5)P3]生成3, 4-二磷酸磷脂酰肌醇[phosphatidylinositol 3, 4-bisphosphate,PI(3, 4)P2]和4, 5-三磷酸磷脂酰肌醇[phosphatidylinositol 4, 5-triphosphate,PI(4, 5)P3],其中PIP3作为第二信使与AKT蛋白在苏氨酸残基308处发生磷酸化反应,激活AKT蛋白;AKT蛋白也可以在丝氨酸残基473位点处发生磷酸化反应。磷酸化的AKT可以增加泛素蛋白连接酶MDM2蛋白的表达,从而抑制p53蛋白表达,参与DNA损伤修复以及调控细胞周期;此外,磷酸化AKT能够抑制凋亡蛋白Bcl-2的表达(图 1)。在牛主动脉上皮细胞中,牛黄石胆酸(taurine bile acid,TLCA)激活TGR5蛋白介导PIP3-AKT信号通路,磷酸化的AKT蛋白降低了一氧化氮(nitric oxide,NO)的产生[3]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是已知的AKT下游蛋白,参与蛋白质的翻译过程,促进蛋白质的合成。当药物或激素与TGR5受体相结合,细胞外的信号通过AKT向mTORC1传递,有活性的mTOR蛋白复合物1(mTOR complex 1,mTORC1)进一步磷酸化4E-BP1(4E-binding protein 1,4E-BP1)和p70 S6激酶,影响mRNA翻译水平,从而发挥一系列的生物学效应,如激活转录,促进线粒体代谢和脂肪代谢;与对照组小鼠比较,发现mTORC1基因敲除的小鼠的体型变大,许多器官如心脏、胰腺也随之变大且伴有脂肪组织[4];然而,mTOR蛋白复合物2(mTOR complex 2,mTORC2)的磷酸化激活AKT1蛋白的表达,AKT1通过FoxC2抑制脂肪细胞的分化,从而抑制了肥胖[5],这说明mTOR蛋白复合物(mTOR complexs,mTORCs)与代谢有关,且直接参与脂肪代谢。在巨噬细胞中,TGR5受体的激活通过AKT-mTOR信号通路降低趋化因子的表达,从而抑制炎症反应。
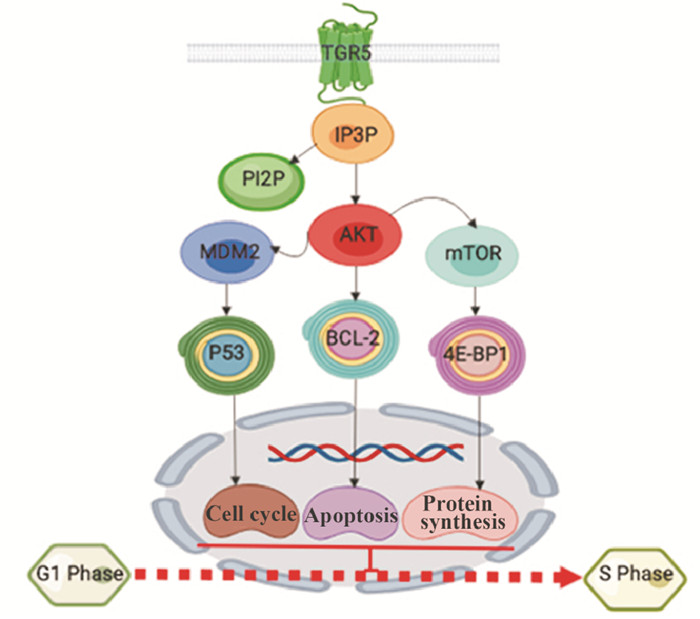
|
| Fig 1 AKT signaling pathway induced by TGR5 |
NF-κB蛋白家族是一种多效性的转录因子,可以与多种细胞启动子上的NF-κB位点相互作用,发生特异性结合从而启动转录的发生。NF-κB家族成员包括:NF-κB1(p50)、NF-κB2(p52)、p65(RelA)、c-Rel(Rel)、RelB等。NF-κB家族蛋白与IκB蛋白(IκBα, 、IκBβ、IκBγ、BCL3、IκBε、P50、P100)相结合在胞浆内处于静息状态,IKK激酶可以特异性的激活IκBα, 、IκBβ,使NF-κB蛋白与IκB蛋白分离,从而激活NF-κB介导的信号通路,参与机体的抗炎免疫活动(图 2)。在小鼠急性神经炎疾病中,牛黄熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)激活TGR5受体介导的抑制小胶质细胞分泌干扰素γ(interferon γ,INF γ)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)等促炎性因子,从而发挥抗炎作用[6];在CD14+巨噬细胞中,石胆酸(lithocholicacid,LCA)和去氧胆酸(eoxycholic acid,DCA)可以通过TGR5激活c-Fos,c-Fos调节NF-κB p65蛋白的激活,抑制TNF-α、白细胞介素-6(interleukin 6,IL-6)的分泌[7]。TGR5通过负反馈调节NF-κB以应答肝脏炎症反应,这主要是TGR5通过抑制IκBα的磷酸化,P65核移位以及NF-κB DNA结合活性以及转录活性,发挥了抗炎调节作用。Plos等[8]研究发现,在巨噬细胞中,TGR5受体被INT-777激活抑制P65的核移位和IκBα的磷酸化发挥抗炎作用。
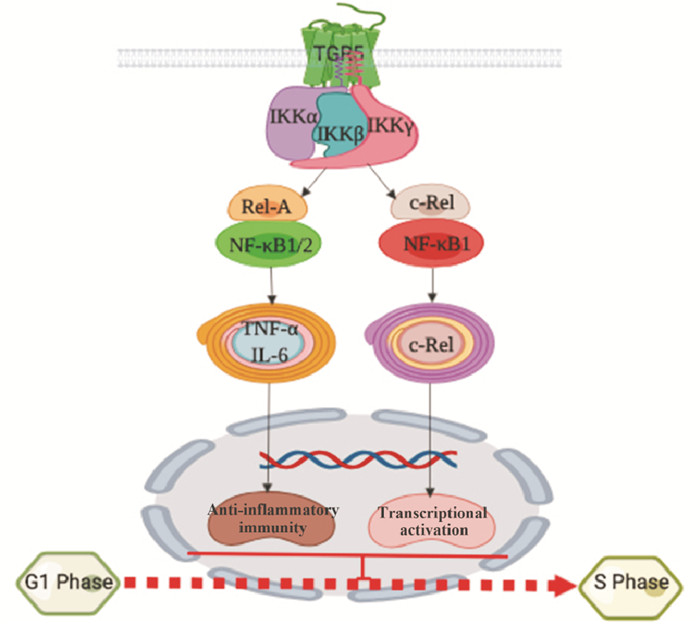
|
| Fig 2 NF-κB signaling pathway induced by TGR5 |
ERK是丝裂原活化蛋白激酶家族成员之一,参与许多机体的生理反应,如细胞生存、细胞分化、细胞凋亡、细胞增殖。最近的研究发现,在野生型小鼠模型中,TGR5激动剂INT-777可以通过增加活性氧和原癌基因的表达介导胆管上皮细胞的增殖,非受体酪氨酸激酶(nonreceptor tyrosine kinase,cSrc)介导表皮生长因子反式激活以及ERK1/2的磷酸化。在非纤毛胆管细胞中,激活的TGR5受体可以显著性抑制ERK1/2蛋白的表达,从而促进细胞的增殖;在纤毛胆管细胞中,TGR5受体的激活显著性的抑制了cAMP的产生,促进ERK1/2蛋白的磷酸化水平[9](图 3),说明在非纤毛胆管细胞中,激动剂与TGR5相互作用,激活了Gs蛋白,增加了cAMP水平;在纤毛胆管细胞中,激动剂与TGR5相互作用,激活了Gi蛋白,从而抑制了cAMP水平的增加,促进了ERK1/2蛋白的表达,从而抑制细胞的增殖[10]。Laura等[11]在TGR5-/-和TGR5+/+的肥胖小鼠中发现,胆汁酸模拟物在TGR5+/+的小鼠中激活AKT蛋白表达促进ERK1/2的磷酸化水平,诱导线粒体的分裂,促进线粒体呼吸,从而增加了白色脂肪的消耗,与TGR5-/-肥胖小鼠相比较,TGR5+/+小鼠体脂含量下降,体型变小,说明TGR5受体可以介导ERK信号通路,参与机体的凋亡、增殖以及分化等生命活动。
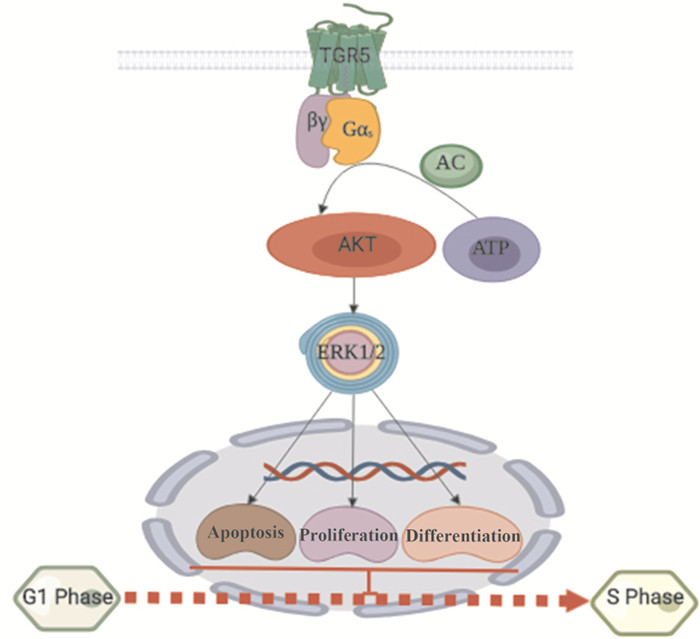
|
| Fig 3 ERK signaling pathway induced by TGR5 |
STAT3是一类由人类基因STAT3编码的转录因子,STAT3是STAT蛋白家族的只要成员之一,受到细胞因子和生长因子双重调节作用,STAT3可以被ERK激酶激活,形成同源或异源二聚体,进一步进入细胞核,启动转录。作为一个转录因子,STAT3参与许多机体的生理活动,如免疫应答、生长、凋亡、新陈代谢、炎症反应等。机体在病原入侵的情况下,STAT3处于过表达水平,如直肠癌、胸腺癌、皮肤癌、肺癌、胃癌、骨癌等[12]。在过表达TGR5基因的A549细胞系中,STAT3活性显著的降低,促进了凋亡基因Bcl-xL的表达以及抑制促血管生成因子(vascular endothelial growth factor,VEGF)的表达,控制了癌细胞的生长与分化[13];同时,在RNA干扰(RNA interfere,RNAi)TGR5的胃癌细胞中,STAT3的磷酸化通过抑制凋亡蛋白体Bcl-xL和Cyclin D1抑制癌细胞的凋亡和促进癌细胞增殖[14],这说明TGR5受体对癌细胞的调节作用与STAT3的表达有关(图 4)。在肺癌细胞中,TGR5受体激活显著性的抑制了STAT3的磷酸化反应,从而降低了TNF-a诱导的炎症基因TNF-α、白细胞介素-8(interleukin 8,IL-8)、环氧合酶-2(cyclooxygenase 2,COX-2)的表达[15],抑制了炎症的发生和发展。所以,在胃癌和肺癌的治疗中,TGR5受体将成为一个药物治疗的潜在靶点。
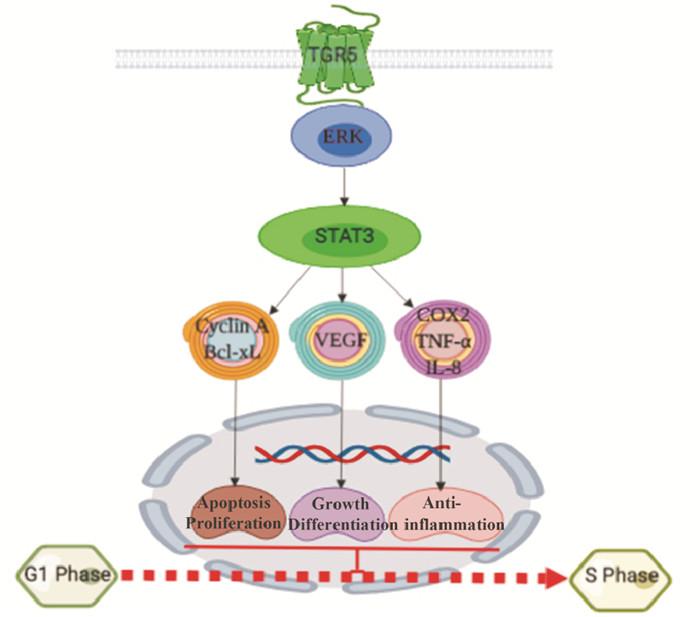
|
| Fig 4 STAT3 signaling pathway induced by TGR5 |
cAMP作为一个经典的第二信使,参与机体的所有生理和病理活动。当细胞受到应激或胞外一些配体的刺激,就会使细胞膜上受体的构象发生变化,是细胞膜受体从无活性状态变为激活状态,进一步激活膜上的Gs蛋白,激活的Gs蛋白进一步激活细胞内的腺苷酸环化酶(adenylate cyclase,AC),催化ATP形成cAMP和焦磷酸(pyrophosphoric acid,PPi),cAMP可以使蛋白激酶A(protein kinase A,PKA)发生磷酸化,磷酸化的PKA进一步激活下游的cAMP反应结合元件(cAMP response binding element,CREB),磷酸化的CREB发生核移位进入细胞核,从而调节细胞的反应(图 5)。我们研究发现,在大鼠肺泡巨噬细胞中,TCDCA可以激活TGR5受体,增加cAMP含量,从而使PKA和CREB蛋白发生磷酸化,极显著的降低由LPS引起的细胞因子TNF-α、IL-1β、IL-6以及COX2的分泌和表达[16]。在TGR5基因敲除小鼠中,cAMP、PKA、CREB的表达显著的低于野生型小鼠[17],说明TGR5受体可以介导cAMP信号通路。Rajagopal等[18]用齐墩果酸(oleanolic acid,OA)研究胃肠道平滑肌时发现,在野生型(wild type,WT)小鼠上,OA通过激活Gαs蛋白,增加cAMP水平,激活PKA激酶磷酸化,抑制RhoA/Roh激酶,从而引起胃肠道平滑肌细胞舒张;然而,OA作用TGR5-/-小鼠不能引起胃肠道平滑肌舒张。说明TGR5受体通过cAMP介导的信号通路参与机体的生理活动。
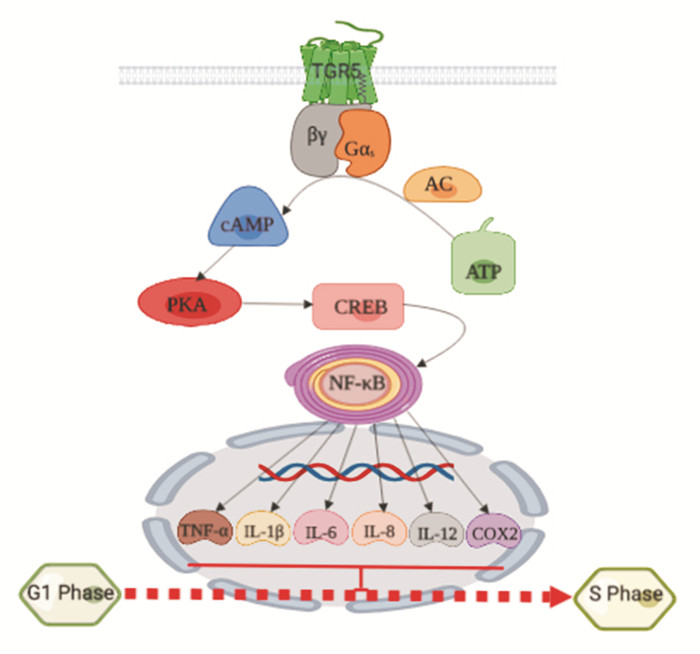
|
| Fig 5 cAMP signaling pathway induced by TGR5 |
胆汁作为一种传统的中药,在《内经》中有记载:“肝之余气,溢入于胆,聚而成精。由内藏精而不泄,外视物而得明为清净之腑,能通于眼目”,说明胆汁对于人体的健康具有治疗作用[19]。胆汁酸作为胆汁的有效成分之一,与西药相比较对肝、肾、肺等器官的毒副作用较小,在生理学和病理学方面发挥了重要的作用,如胆汁酸可以通过胆汁酸受体TGR5介导cAMP-PKA-CREB发挥抗炎免疫调节作用,抑制促炎因子的分泌;在大鼠巨噬细胞中,TCDCA可以通过TGR5受体介导PKC-JNK/p38-p53信号转导通路提高细胞的凋亡率[20],p53作为典型的癌基因,参与癌症的发生和发展,因此,综述TGR5受体介导的信号通路的研究方法,对于胆汁酸在疾病治疗机理方面尤为重要。2003年,日本学者Kawamata等[21]用牛黄石胆酸(taurine-conjugated lithocholic,TLCA)作用于TGR5-GFP载体过表达稳定中国仓鼠卵巢细胞系(Chinese hamster ovary cells,CHO),通过倒置荧光显微镜观察发现TLCA可以使TGR5受体发生内陷反应并且激活Gαs蛋白的表达;同时,用酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测发现,活化的Gαs蛋白可以通过AC的催化作用增加第二信使cAMP的水平。刘倩等[22]用共聚焦显微镜清楚地观察到过表达TGR5的NR8383细胞发生内陷反应,并且用ELISA方法检测到cAMP含量显著性的增加,这一结果与Kawamata等[21]的研究结果相一致,提示胆汁酸可以与TGR5相互作用。cAMP作为第二信使可以介导PKA-CREB信号通路参与抗炎免疫调节以及葡萄糖代谢等。牛黄熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)以剂量依赖性的方式促进胰腺β细胞分泌胰岛素,研究发现这与cAMP-PKA-CREB信号通路介导有关;用G蛋白亚单位受体特异性抑制剂NF449培养胰腺β细胞,再用TUDCA作用细胞,采用Western blot检测发现Gαs蛋白表达降低;然而,在TGR5特异性激动剂INT-777作用的胰腺β细胞中发现Gαs蛋白表达增加,且ELISA检测结果表明cAMP的含量也显著性的增加,提示TUDCA可以激活TGR5受体,增加cAMP含量;进一步的使用PKA特异性抑制剂H89培养胰腺β细胞,再用TUDCA作用细胞,用Western blot检测PKA以及CREB磷酸化水平,发现TCDCA在H89的作用下不能增加PKA以及CREB磷酸化,且胰岛素的分泌也毫无变化,提示TUDCA通过cAMP-PKA-CREB信号通路调节胰腺β细胞分泌胰岛素[23]。同样的,作者也使用抑制剂,研究TCDCA对抗炎免疫体调节作用的影响,发现TCDCA可以通过cAMP-PKA-CREB抑制免疫细胞中TNF-α、IL-1β以及IL-6基因和蛋白的表达,提示TCDCA通过TGR5受体介导cAMP-PKA-CREB信号通路发挥抗炎作用。综上所述,TGR5信号通路的研究方法为TGR5介导的信号通路在疾病的研究提供了理论基础以及治疗靶点。
7 展望目前,世界上各种各样的疾病越来越多,对人类的生命造成了巨大的危害,新药的研发迫在眉睫,尤其是在癌症方面的有效药物非常少;其次,胆汁淤积也会导致动脉粥样硬化以及癌变[24]。TGR5受体作为GPCRs家族中的一员,由于在人类和动物体内广泛的表达,参与机体的许多生理和病理活动。TGR5受体通过介导AKT、NF-κB、ERK、STAT3以及cAMP信号通路调节参与机体的抗炎免疫调节、葡萄糖代谢、能力代谢、脂质代谢等。当今,癌症的免疫治疗研究在当今越来越火热,以程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)抑制剂和嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)疗法为代表的免疫疗法在各种癌症特别是黑色素瘤方面取得了不错的成就[25];然而,事实已经证明,TGR5受体可以通过STAT3信号通路来干预和治疗癌症的发生和发展,在此大胆假设,TGR5受体是否与PD-1和PD-L1之间具有一定的联系,能否对癌症的研究提供新的思路,TGR5受体是否成为新的癌症治疗靶点,期待在未来有更多的研究成果;同时,通过综述TGR5介导的相关信号通路以及研究方法,旨在为胆汁酸以及和胆汁酸具有相同结构的新药研发提供研究思路和方法。
| [1] |
马力, 杨泽平, 母茜, 等. α1-肾上腺素受体结构改变影响其生物学活性及生理功能的研究进展[J]. 中国药理学通报, 2019, 35(6): 748-52. Ma L, Yang Z P, Mu Q, et al. Advances in studies on the structural changes of α1-adrenergic receptors affecting their biological activities and physiological functions[J]. Chin Pharmacol Bull, 2019, 35(6): 748-52. doi:10.3969/j.issn.1001-1978.2019.06.003 |
| [2] |
Huang S K, Wettlaufer S H, Chuang J, et al. prostaglandin E2 inhibits specific lung fibroblast functions via selective actions of PKA and Epac-1[J]. Am J Respir Cell Mol Biol, 2008, 39(4): 482-9. doi:10.1165/rcmb.2008-0080OC |
| [3] |
Perino A, Pols T W, Nomura M, et al. TGR5 reduces macrophage migration through mTOR-induced C/EBPβ differential translation[J]. J Clin Invest, 2014, 124(12): 5424-36. doi:10.1172/JCI76289 |
| [4] |
Yao Y X, Milind S, Bryant G D, et al. BSTA promotes mTORC2 mediated phosphorylation of AKT1 to suppress expression of FoxC2 and stimulate adipocyte differentiation[J]. Sci signal, 2013, 6(257): 1-25. |
| [5] |
Covarrubias A J, Aksoylar H I, Horng T. Control of macrophage metabolism and activation by mTOR and Akt signaling[J]. Semin Immunol, 27(4): 286-96. doi:10.1016/j.smim.2015.08.001 |
| [6] |
Natalia Y C, Manso M A, Manuel N S, et al. TUDCA:an agonist of the bile acid receptor GPBAR1/TGR5 with anti-inflammation effects in microglia cells[J]. Journal of cellular physiology, 2017, 232(8): 2231-45. doi:10.1002/jcp.25742 |
| [7] |
Wang X X, Michal H E, Uzi G, et al. G protein-coupled bile acid receptor TGR5 activation inhibits kidney disease in obesity and diabesity[J]. JASN, 2016, 27(5): 1362-78. doi:10.1681/ASN.2014121271 |
| [8] |
Pols T W, Nomura M, Harach T, et al. TGR5 activation inhibits atherosclerosis by reducing macrophage inflammation and lipid loading[J]. Cell Metab, 2011, 14(6): 747-57. doi:10.1016/j.cmet.2011.11.006 |
| [9] |
Cheng P, Alberts I, Li X. The role of ERK1/2 in the regulation of proliferation and differentiation of astrocytes in developing brain[J]. Int J Dev Neurosci, 2013, 31(8): 783-9. doi:10.1016/j.ijdevneu.2013.09.008 |
| [10] |
Reich M, Deutschmann K, Sommerfeld A, et al. TGR5 is essential for bile acid-dependent cholangiocyte proliferation in vivo and in vitro[J]. Gut, 2016, 65(3): 487-501. doi:10.1136/gutjnl-2015-309458 |
| [11] |
Laura A V, Alessia P, Vera L, et al. TGR5 signalling promotes mitochondrial fission and beige remodeling of white adipose tissue[J]. Nat commun, 2018, 254(9): 1-13. |
| [12] |
Yamanaka Y, Nakajima K, Fukada T, et al. Differentiation and growth arrest signals are generated through the cytoplasmic region of gp130 that is essential for Stat3 activation[J]. EMBO J, 1996, 15(7): 1557-65. doi:10.1002/j.1460-2075.1996.tb00500.x |
| [13] |
Yoshimura A, Naka T, Kubo M. SOCS proteins, cytokine signaling and immune regulation[J]. Nat. Rev Immunol, 2007, 7(6): 454-65. doi:10.1038/nri2093 |
| [14] |
Gloerich M, Bos J L. Epac:defining a new mechanism for cAMP action[J]. Annu Rev Pharmacol Toxicol, 2010, 50: 355-75. doi:10.1146/annurev.pharmtox.010909.105714 |
| [15] |
Jack D T. The cAMP signal transduction pathway[J]. Sciences signaling, 2010, 3(119): 1-6. |
| [16] |
Li S Z, Jesus A A, Charles P N, et al. Role of nuclear of interleukin-37 in the suppression of innate immunity[J]. PNAS, 2019, 3: 1-6. |
| [17] |
Poole D P, Godfrey C, Cattaruzza F, et al. Expression and function of the bile acid receptor GPBRA1/TGR5 in the murine enteric nervous system[J]. Neurogastroenterol Motil, 2010, 22(7): 814. doi:10.1111/j.1365-2982.2010.01487.x |
| [18] |
Rajagopal S, Kumar D P, Mahavadi S, et al. Activation of G protein-coupled bile acid receptor, TGR5, induces smooth muscle relaxation via both Epac-and PKA-mediated inhibition of RhoA/Rho kinase pathway[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 304(5): G527-35. doi:10.1152/ajpgi.00388.2012 |
| [19] |
许浚. 东医宝鉴[M]. 北京: 中国中医药出版社, 1995. Xu J. Dong Yi Bao Jian[M]. Beijing: China Traditional Chinese Medicine Press, 1995. |
| [20] |
王旭. TCDCA对免疫细胞中TGR5介导的凋亡相关信号转导通路的影响[D].呼和浩特: 内蒙古农业大学, 2017. Wang X. Effect of TCDCA on TGR5-mediated apoptosis-related signal transduction pathway in immune cells[D]. Hohhot: Inner Mongolia Agriculture University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10129-1017212354.htm |
| [21] |
Kawamata Y, Fujii R, Hosaya M, et al. A G protein-coupled receptor responsive to bile acids[J]. J Biol Chem, 2003, 278(11): 9435-40. doi:10.1074/jbc.M209706200 |
| [22] |
刘倩. TCDCA对TGR5介导的信号通路中cAMP含量的影响[D].呼和浩特: 内蒙古农业大学, 2014. Liu Q. Effect of TCDCA on cAMP content in TGR5-mediated signaling pathway[D]. Hohhot: Inner Mongolia Agriculture University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10129-1017800848.htm |
| [23] |
Jean F V, Rosane A R, Paticia C B, et al. The bile acid TUDCA increases glucose-induced insulin secretion via the cAMP/PKA/CREB pathway in pancreatic bate cells[J]. Metab clin exp, 2016, 65(3): 1-10. doi:10.1016/j.metabol.2015.10.016 |
| [24] |
赵晶, 陈曼玉, 李磊. 胆酸盐外排泵研究的最新进展[J]. 中国药理学通报, 2017, 33(1): 18-22. Zhao J, Chen M Y, Li L. Recent advances in research on cholate efflux pumps[J]. Chin Pharmacol Bull, 2017, 33(1): 18-22. doi:10.3969/j.issn.1001-1978.2017.01.004 |
| [25] |
Shin D S, Ribas A. The evolution of checkpoint blockade as a cancer therapy:what's here, what's next[J]. Curr opin immunol, 2015, 33: 23-35. doi:10.1016/j.coi.2015.01.006 |

