

2. 厦门医学院机能与临床转化福建省 高校重点实验室,福建 厦门 361023;
3. 福建医科大学附属口腔医院,福建 福州 351004
2. Fujian Provincial Key Lab of Functional and Clinical Translational Medicine, Xiamen Medical College, Xiamen Fujian 361023, China;
3. Fujian Medical University Affiliated Stomatological Hospital, Fuzhou 351004, China
黏附调节分子1(adhesion regulating molecule 1,ADRM1)亦被称为hRpnl3(human Rpn13),是26S蛋白酶体亚单位19S调节颗粒上的主要泛素受体之一,决定26S蛋白酶体结构不对称性。ADRM1介导的蛋白酶体泛素化路径介导NF-κB、TGF-βI型受体、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等底物蛋白降解[1]。研究表明[2-5],ADRM1在结肠癌、肺癌、肾癌、肝癌等多种实体瘤和急性白血病中均处于过表达状态,下调ADRM1蛋白表达可明显促进癌细胞凋亡。因此,ADRM1可能成为肿瘤治疗靶点。有研究表明[2, 6-11],双亚苄基哌啶RA190可与ADRM1的半胱氨酸88共价结合,快速触发多泛素蛋白累积,诱导对硼替佐米耐药的多发性骨髓瘤细胞凋亡,也抑制卵巢癌、肝癌、肝内胆管癌等多种肿瘤细胞增殖;也有大量研究报道蛋白酶体抑制剂MG132通过抑制泛素蛋白酶体途径活性,诱导肺癌[12]、Burkitt淋巴瘤[13]、急性髓系白血病[4]、肝癌、结直肠癌[14]等癌细胞凋亡;协同全反式维甲酸诱导GTF2I-RARA融合基因阳性的HL60细胞分化[15]。
那么,RA190与MG132在舌癌细胞中作用效果如何呢?本实验拟通过观察舌癌细胞株CAL27和TCA8113在RA190或MG132药物作用下存活率变化及周期与凋亡情况,比较这两种药物对舌癌细胞的毒性作用及作用机制,为临床治疗舌癌药物选择提供参考。
1 材料与方法 1.1 材料 1.1.1 细胞株舌癌细胞株CAL27、TCA8113为福建医科大学口腔医学院馈赠。
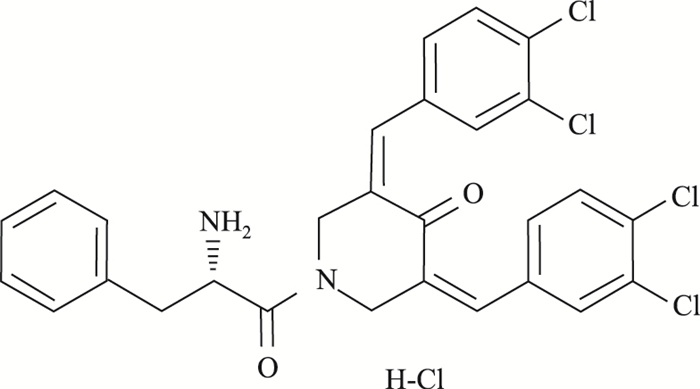
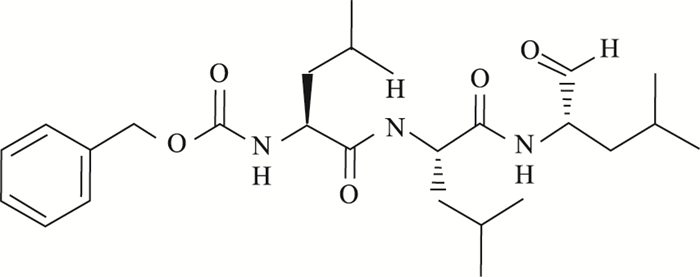
1.1.2 试剂MG132(Cat. No. HY-13259)结构见Fig 1、RA190(Cat. No. HY-100739)结构见Fig 2、CCK8(Cat. No. MA0218)(MCE,中国),ADRM1(Cat. No.12019)、Cyclin B1(Cat. No.12231)、Bak(Cat. No.6947)、Bax(Cat. No. 5023)蛋白Western blot用一抗体(CST,美国),DMEM、D-hanks、PBS(Corning,美国),胰酶(Gibigo,美国),胎牛血清(Cat. No.900-108,Gemini,南美),PI(KeyGEN Biotech,中国);Annexin V FLUOS Staining Kit(Cat. No. 11858777001,Roche,德国)。
|
| Fig 1 Chemical structure of RA190 |
|
| Fig 2 Chemical structure of MG132 |
二氧化碳细胞培养箱2323-2(SHELLAB公司);倒置显微镜37XA(上海光学仪器厂);酶标仪(Bio-rad公司);流式细胞仪EPICSXL(贝克曼库尔特公司);电泳仪PowerPac HC(Bio-Rad公司);快速Western blot仪器MA01821(Millipore);垂直电泳槽VE-180(上海天能科技有限公司)。
1.2 方法 1.2.1 细胞增殖/毒性实验设(0.1、0.2、0.4、0.8、1.6、3.2、6.4 μmol·L-1)不同浓度RA190或MG132实验组、对照组(无药)和空白组(不含细胞)。在96孔板中接种100 μL细胞悬液(细胞浓度2×108·L-1),于37℃、5% CO2培养箱预培养24 h;吸弃培养基,向每孔加入100 μL含不同浓度RA190或MG132的完全培养基,孵育24h;每孔加入10 μL CCK-8,在培养箱内孵育3 h;用酶标仪测定在450/630 nm处的吸光度。绘制曲线。
1.2.2 流式细胞术检测细胞周期6孔板中接种2 mL细胞悬液(细胞浓度5×108·L-1),于37℃、5% CO2培养箱预培养24 h;吸弃培养基,向每孔加入2 mL含不同浓度RA190或MG132的完全培养基,孵育24h后,收集细胞于5 mL PBS中,800 r·min-1离心5 min,弃上清,预冷的PBS洗2次,300 μL预冷的PBS重悬沉淀后,吸取700 μL预冷的无水乙醇逐滴滴入重悬液中,置-20℃固定过夜,之后按PI说明书操作。
1.2.3 Annexin V FLUOS Staining Kit流式细胞术检测细胞凋亡用Annexin V FLUOS Staining Kit检测细胞凋亡率。细胞加药及收集步骤同“1.2.2”,之后按说明书操作。
1.2.4 Western blot检测细胞内蛋白表达细胞加药培养步骤同“1.2.2”,收集各组细胞,PBS洗2次,加入RIPA细胞裂解液(含1 mmol·L-1 PMSF、1 mmol·L-1正钒酸钠、10 mg·L-1抑肽酶)提取总蛋白,BCA法测定蛋白质浓度,取40 μg总蛋白进行Western blot实验。10% SDS-PAGE电泳后,行转膜印迹,分别用β-actin、ADRM1、Cyclin B1、Bax、Bak一抗体与膜上的抗原结合,然后用HRP偶联的二抗与其反应,用ECL化学发光试剂检测,经压片曝光后,显影和定影。比较各组蛋白表达情况。设2个复孔,不同时间独立重复3次。
1.2.5 统计学分析数据应用GraphPad Prism 5软件处理,计量资料的描述采用x±s表示,多个样本均数间比较采用方差分析。
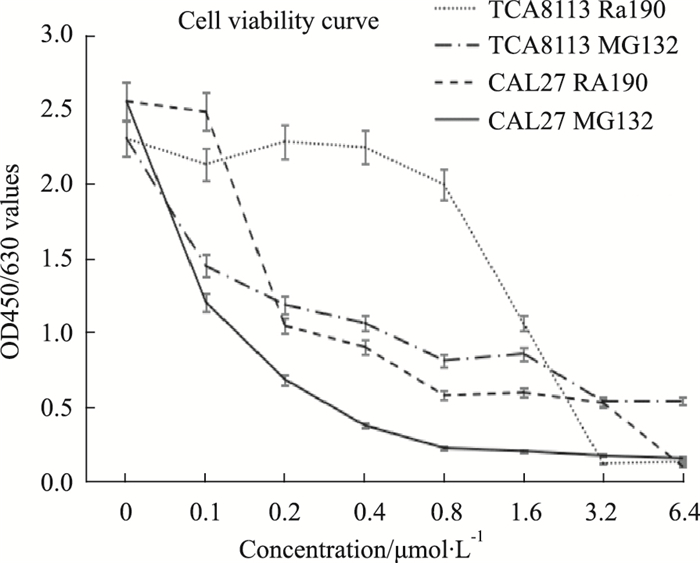
2 结果 2.1 RA190或MG132对舌癌细胞存活率的影响以细胞浓度2×108·L-1种板,CCK-8法酶标仪检测RA190或MG132 (0、0.1、0.2、0.4、0.8、1.6、3.2、6.4 μmol·L-1)作用24 h后舌癌细胞CAL27、TCA8113的OD450/630值。设3个复孔,不同时间独立重复3次。如Fig 3所示,随着MG132浓度提高,CAL27、TCA8113细胞活力下降,半抑制浓度IC50分别约为0.1和0.3 μmol·L-1;其中,当MG132浓度在0.2~1.6 μmol·L-1期间TCA8113细胞活力曲线处在平缓阶段,说明这期间MG132对TCA8113细胞毒性作用变化不大。RA190对CAL27、TCA8113细胞的IC50分别约为0.18和1.6 μmol·L-1;RA190浓度在0.2~0.8 μmol·L-1期间CAL27细胞活力曲线平缓,在0.8 μmol·L-1之后活力曲线处于平台阶段,说明部分CAL27细胞对RA190耐药;RA190浓度为0.8 μmol·L-1左右TCA8113细胞活力才开始下降,说明RA190需要在较大的浓度下才对TCA8113细胞产生毒性作用。
|
| Fig 3 Cell viability of CAL27 and TCA8113 cells treated with different RA190 or MG132 concentrations for 24 h |
细胞以5×108·L-1接种6孔板2 mL,设0.5、1 μmol·L-1 RA190或MG132实验组和对照组,各组2个复孔,流式细胞术检测各组细胞周期变化,独立重复实验3次。如Fig 4、Tab 1所示,0.5、1 μmol·L-1 RA190(R0.5,R1)均诱导CAL27细胞G1/G0期停滞,对TCA8113周期无影响;1 μmol·L-1 RA190也诱导CAL27细胞G2/M期停滞;0.5、1 μmol·L-1 MG132(M0.5,M1)均诱导CAL27细胞G2/M期停滞,对TCA8113周期无影响。

|
| Fig 4 Cycle of CAL27 and TCA8113 cells treated with different concentrations of RA190 or MG132 for 24 h (x±s, n=3) R0.5: 0.5 μmol·L-1 RA190; R1: 1 μmol·L-1 RA190; M0.5: 0.5 μmol·L-1 MG132; M1: 1 μmol·L-1 MG132. *P < 0.05 vs CAL27 0 group. |
| CAL27 | TCA8113 | ||||||||
| 0 | R0.5 | R1 | M0.5 | M1 | 0 | R1 | M1 | ||
| G0/G1 | 80.63±1.53 | 76.23±1.08 | 73.51±2.64 | 74.8±1.25 | 73.63±0.78 | 11.35±1.01 | 11.16±1.65 | 9.64±1.60 | |
| G2/M | 9.22±0.90 | 11.92±0.45 | 14.51±2.28 | 16.84±0.86 | 15.06±0.74 | 77.40±1.47 | 75.7±0.78 | 78.69±2.52 | |
| R0.5:0.5 μmol·L-1 RA190; R1:1 μmol·L-1 RA190; M0.5:0.5 μmol·L-1 MG132; M1:1 μmol·L-1 MG132. | |||||||||
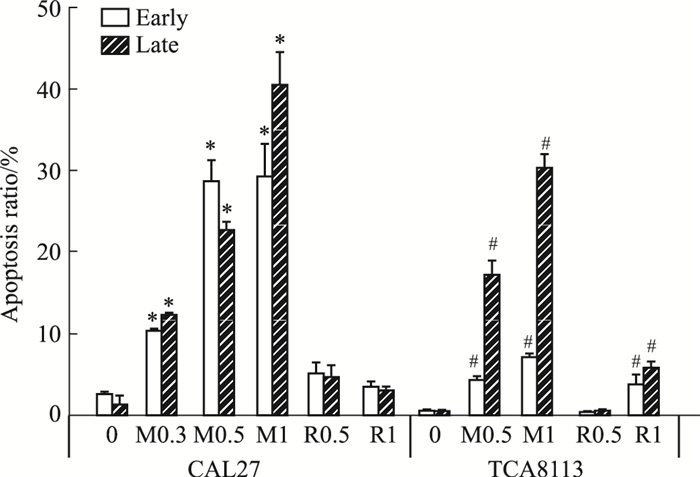
细胞以5×108·L-1接种6孔板2 mL,设0.5、1 μmol·L-1 RA190或MG132实验组和对照组,各组2个复孔,流式细胞术检测各组细胞凋亡,独立重复实验2次。如Fig 5、Tab 2所示,在0.3、0.5、1 μmol·L-1MG132作用下,CAL27与TCA8113细胞早期与晚期凋亡率均提高(P < 0.05),并与剂量呈线性关系;0.5、1 μmol·L-1 RA190均对CAL27凋亡无影响,1 μmol·L-1 RA190提高TCA8113细胞早期与晚期凋亡率[(4±1)%,(5.97±0.86)%;P < 0.05)]。
|
| Fig 5 Apoptosis of TCA8113 cells treated with 1 μmol·L-1 RA190 or MG132 for 24 h(x±s, n=3) R0.5: 0.5 μmol·L-1 RA190; R1: 1 μmol·L-1 RA190; M0.3: 0.3 μmol·L-1 MG132; M0.5: 0.5 μmol·L-1 MG132; M1: 1 μmol·L-1 MG132; *P < 05 vs CAL27 0 group, #P < 0.05 vs TCA8113 0 group. |
| CAL27 | TCA8113 | |||||||||||
| 0 | M0.3 | M0.5 | M1 | R0.5 | R1 | 0 | M0.5 | M1 | R0.5 | R1 | ||
| Early | 2.68±0.24 | 10.29±0.24 | 28.85±2.50 | 29.17±3.91 | 5.4±1.03 | 3.73±0.511 | 0.49±0.3 | 4.58±0.46 | 7.28±0.36 | 0.25±0.19 | 4±1 | |
| Late | 1.63±0.92 | 12.36±0.10 | 22.78±0.96 | 40.33±3.90 | 5.01±1.18 | 3.25±0.49 | 0.4±0.32 | 17.25±1.86 | 30.28±1.71 | 0.59±0.28 | 5.97±0.86 | |
| R0.5:0.5 μmol·L-1 RA190; R1:1 μmol·L-1 RA190; M0.3:0.3 μmol·L-1 MG132; M0.5:0.5 μmol·L-1 MG132; M1:1 μmol·L-1 MG132. | ||||||||||||
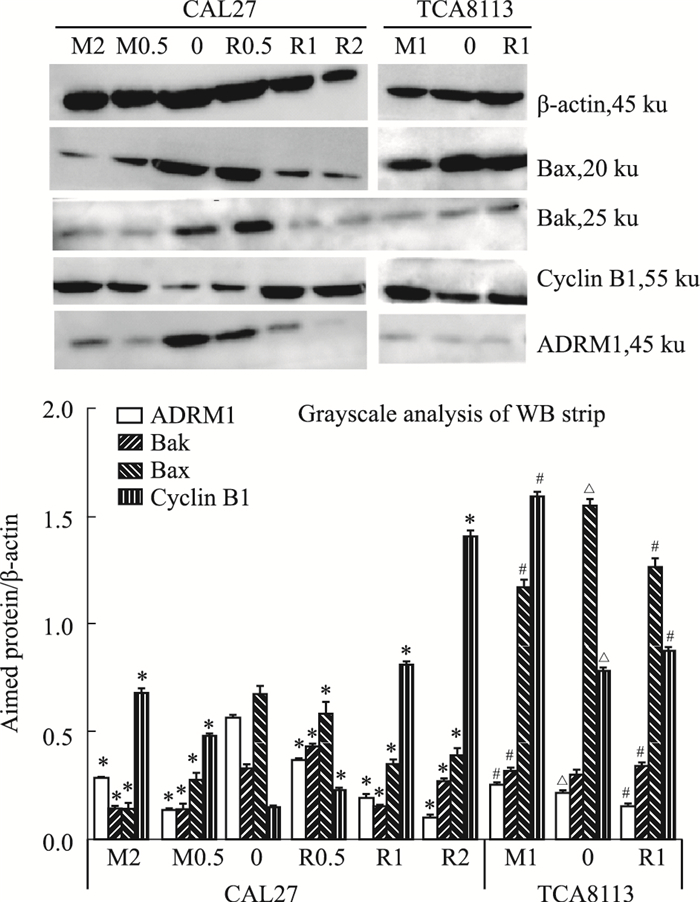
为探讨RA190与MG132对舌癌细胞的毒性作用与ADRM1的相关性及两药作用机制差异性,本实验采用Western blot检测0.5、1、2 μmol·L-1 RA190或MG132(R0.5,R1,R2;M0.5,M1,M2)作用24 h后,舌癌细胞内ADRM1、Cyclin B1、Bax、Bak蛋白表达变化。如Fig 6所示,TCA8113细胞内ADRM1蛋白水平显著低于CAL27细胞(P < 0.05);随着RA190或MG132药物浓度提高,Cyclin B1蛋白表达上调(P < 0.05),ADRM1、Bax、Bak蛋白表达下调(P < 0.05);TCA8113细胞在1 μmol·L-1 RA190作用下ADRM1、Bak、Cyclin B1蛋白表达差异不大,而在相同浓度MG132作用下,Bax表达下调、Cyclin B1表达上调。
|
| Fig 6 Expression of ADRM1, Cyclin B1, Bax and Bak protein in CAL27 and TCA8113 cells treated with different concentrations of RA190 or MG132 for 24 h (x±s, n=3) R0.5: 0.5 μmol·L-1 RA190, R1: 1 μmol·L-1 RA190, R2: 2 μmol·L-1 RA190, M0.5: 0.5 μmol·L-1 MG132, M1: 1 μmol·L-1 MG132, M2: 2 μmol·L-1 MG132; *P < 0.05 vs CAL27 0 group, #P < 0.05 vs TCA8113 0 group, △P < 0.05 vs CAL27 0 group |
实验中,本课题组发现,TCA8113细胞种板24 h后,有大量悬浮细胞,这些细胞经台盼蓝染色观察,活率达75%;吸取悬浮细胞种板,大量细胞仍可贴壁。因此,药物对舌癌细胞的毒性观察应包含这部分悬浮细胞。综合Fig 3~5结果:①RA190组:RA190引起CAL27细胞活力下降,对CAL27细胞凋亡无作用,提示RA190可能主要通过阻滞CAL27细胞于G0/G1或G2/M期引起细胞活力下降;相反,RA190对TCA8113周期无显著影响,但在0.8 μmol·L-1之后通过促凋亡作用对TCA8113细胞产生毒性作用;RA190作用下舌癌细胞活力曲线中间部分较为平缓,可能是贴壁细胞对RA190较不敏感。这提示RA190在舌癌中作用具有很大的选择性和局限性。② MG132组:MG132诱导CAL27细胞G2/M期停滞,对TCA8113细胞无影响;MG132明显提高CAL27与TCA8113细胞早期与晚期凋亡率,说明MG132主要通过促进细胞凋亡引起舌癌细胞活力下降;MG132可影响CAL27周期和凋亡,这导致MG132对CAL27细胞毒性作用强于TCA8113细胞。
在哺乳动物细胞中,Cyclin B从G1期晚期开始表达并逐渐积累,到G2期后期阶段达到最大值并一直维持到M期的中期阶段,然后迅速降解。CAL27细胞在RA190或MG132作用下G2期阻滞,此时细胞内Cyclin B1蛋白表达上调,两者结果一致。
Bak、Bax是人体重要促凋亡分子,下调Bax、Bak蛋白表达,可能抑制细胞凋亡,从而提高细胞存活率。但本实验中MG132明显促进CAL27细胞凋亡,此时Bax、Bak蛋白表达减少,两者存在矛盾。这可能是MG132促CAL27细胞凋亡时,细胞内存在负反馈调节;也可能提示MG132对CAL27细胞促凋亡作用存在其他机制,具体有待进一步研究。这为后续实验提供新思考。
MG132与RA190明显下调CAL27内ADRM1蛋白表达,但RA190对该细胞凋亡无明显作用,提示ADRM1不是影响舌癌发生发展的癌基因。同时,RA190下调CAL27内ADRM1蛋白表达,与其浓度呈线性关系,而MG132则不存在这种线性关系,这说明ADRM1介导的蛋白酶体泛素化路径不是MG132在舌癌细胞中的主要作用途径;MG132在舌癌中存在其他重要作用通路,具体有待进一步研究。另外,MG132明显促进CAL27细胞凋亡,具有明显毒性作用,可能用于舌癌治疗,但由于其作用靶点不单一,因此可能存在较多的副作用。
综上,本研究认为靶向ADRM1药物RA190仅适用于ADRM1高表达舌癌治疗,但其IC50浓度相对MG132较高,用于舌癌治疗可能并不理想;本研究同时也为舌癌临床采用蛋白酶体抑制剂策略奠定基础。
| [1] |
Randles L, Anchoori R K, Roden R B, et al. The proteasome ubiquitin receptor hRpn13 and its interacting deubiquitinating enzyme Uch37 are required for proper cell cycle progression[J]. J Biol Chem, 2016, 291(16): 8773-83. doi:10.1074/jbc.M115.694588 |
| [2] |
Jiang R T, Yemelyanova A, Xing D, et al. Early and consistent overexpression of ADRM1 in ovarian high-grade serous carcinoma[J]. J Ovarian Res, 2017, 10(1): 53. doi:10.1186/s13048-017-0347-y |
| [3] |
Zheng X H, Guo Y F, Chen Y J, et al. Knockdown of adhesion-regulating molecule 1 inhibits proliferation in HL60 cells[J]. Acta Haematol, 2015, 134(2): 88-100. doi:10.1159/000369916 |
| [4] |
郑晓辉, 黄家福, 徐淑娟, 等. 蛋白酶体抑制剂MG132对急性髓系白血病细胞增殖与凋亡的影响[J]. 中国药理学通报, 2019, 3(35): 327-34. Zheng X H, Huang J F, Xu S J, et al. Effect of MG132 on acute myeloid leukemia cell proliferation and apoptosis[J]. Chin Pharmacol Bull, 2019, 3(35): 327-34. |
| [5] |
Chen H, Gao F, He M, et al. Long-read RNA sequencing identifies alternative splice variants in hepatocellular carcinoma and tumor-specific isoforms[J]. Hepatology, 2019, 70(3): 1011-25. doi:10.1002/hep.30500 |
| [6] |
Anchoori RK, Karanam B, Peng S, et al. A bis-benzylidine piperidone targeting proteasome ubiquitin receptor RPN13/ADRM1 as a therapy for cancer[J]. Cancer Cell, 2013, 24: 791-805. doi:10.1016/j.ccr.2013.11.001 |
| [7] |
Lu X, Zhou C, Li R, et al. Long Noncoding RNA AFAP1-AS1 Promoted Tumor Growth and Invasion in Cholangiocarcinoma[J]. Cell Physiol Biochem, 2017, 42(1): 222-30. |
| [8] |
Song Y, Park PMC, Wu L, et al. Development and preclinical validation of a novel covalent ubiquitin receptor Rpn13 degrader in multiple myeloma[J]. Leukemia, 2019, 33(11): 2658-94. |
| [9] |
Anchoori R K, Jiang R, Peng S, et al. Covalent Rpn13-Binding inhibitors for the treatment of ovarian cancer[J]. ACS Omega, 2018, 3(9): 11917-29. doi:10.1021/acsomega.8b01479 |
| [10] |
Yu G Y, Wang X, Zheng S S, et al. RA190, a Proteasome subunit ADRM1 inhibitor, suppresses intrahepatic cholangiocarcinoma by inducing NF-KB-mediated cell apoptosis[J]. Cell Physiol Biochem, 2018, 47(3): 1152-66. |
| [11] |
Lu X, Nowicka U, Sridharan V, et al. Structure of the Rpn13-Rpn2 complex provides insights for Rpn13 and Uch37 as anticancer targets[J]. Nat Commun, 2017, 8: 15540. doi:10.1038/ncomms15540 |
| [12] |
Lee K H, Lee J, Woo J, et al. Proteasome inhibitor-induced IκB/NF-κB activation is mediated by Nrf2-dependent light chain 3B induction in lung cancer cells[J]. Mol Cells, 2018, 41(12): 1008-15. |
| [13] |
Wang L, Howell M E A, Sparks-Wallace A, et al. p62-mediated Selective autophagy endows virus-transformed cells with insusceptibility to DNA damage under oxidative stress[J]. PLoS Pathog, 2019, 15(4): e1007541. doi:10.1371/journal.ppat.1007541 |
| [14] |
Kim H N, Park G H, Park S B, et al. Extracts from Sageretia thea reduce cell viability through inducing cyclin D1 proteasomal degradation and HO-1 expression in human colorectal cancer cells[J]. J Proteomics, 2019, 10(192): 334-45. |
| [15] |
Yan W, Li J, Zhang Y, et al. RNF8 is responsible for ATRA resistance in variant acute promyelocytic leukemia with GTF2I/RARA fusion, and inhibition of the ubiquitin-proteasome pathway contributes to the reversion of ATRA resistance[J]. Cancer Cell Int, 2019, 19: 84. doi:10.1186/s12935-019-0803-4 |

