

2. 滨州医学院 滨州医学院生理学教研室, 山东 烟台 264003
2. Dept of Physiology, School of Basic Medical Sciences, Binzhou Medical University, Yantai Shandong 264003, China
创伤后应激障碍(posttraumatic stress disorder,PTSD)是指异乎寻常的威胁性或灾难性心理创伤导致的延迟出现和(或)长期持续存在的精神障碍。PTSD发病机制复杂多样[1],其神经机制的研究发现,内侧前额叶皮层(medial prefrontal cortex,mPFC)的边缘下区(infralimbic,IL)、海马和杏仁核在PTSD相关症状的发生机制中有重要作用,其中边缘下区与恐惧记忆的消退密切相关[2-3]。研究显示,神经系统存在的硫化氢(hydrogen sulfide, H2S)主要由胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)催化产生,小脑、海马、皮质等脑组织部位有大量CBS分布[4]。生理浓度的H2S易化海马长时程增强[5],参与学习记忆和情绪调节[6]。本研究旨在观察大鼠条件性恐惧训练和消退训练后边缘下区CBS/H2S体系含量变化,外源性补充H2S对大鼠恐惧消退行为影响以及H2S对边缘下区神经元放电影响。为进一步揭示PTSD的发病机制及寻找治疗靶点提供实验依据。
1 材料与方法 1.1 实验动物健康成年♂ Wistar大鼠,体质量(200~300) g,由青岛市药检所动物中心提供(合格证号:SCXK(鲁)2014 0007)。动物饲养于专用动物房(湿度60%,温度24 ℃,照度220 lux),保持光照/黑暗12 h恒定循环,自由活动、进食、饮水。实验前将大鼠置于条件恐惧箱或高架十字迷宫中10 min,记录其僵立行为基础值和焦虑水平的基础值,选择各项行为学得分相近大鼠随机分组并进行后续实验。实验前每只大鼠每天在条件恐惧箱中适应5 min,共6 d,所有行为实验均在8 :30~17 :30进行。
1.2 主要药品和仪器条件恐惧箱(型号:MED-VFC-OPTO-M/R)购自美国Med Associates公司,Micro1401数据采集系统(Micro1401)和Spike2数据分析系统(Spike2)购自英国CED公司,CBS抗体(sc-67154)购自Sant Cruz公司,NaHS(161527)和滂胺天蓝(C8679)购自美国Sigma公司。
1.3 分组及给药正常对照组(Naive),大鼠置于条件恐惧箱中,不给予任何处理; 恐惧对照组(Control),给予条件恐惧不给予消退训练,腹腔注射等量生理盐水; 恐惧消退组(Extinction),给予条件恐惧和消退训练,在消退训练前后腹腔注射等量生理盐水; NaHS组,给予条件恐惧和消退训练,在消退训练前30 min和消退训练后4 h分别腹腔注射NaHS(5.6 mg·kg-1)各1次。
1.4 行为学实验 1.4.1 条件性恐惧模型实验系统由测试盒、电击刺激控制系统、声音刺激控制系统、红外视频跟踪和记录系统以及动物行为分析系统5部分组成。大鼠置于条件恐惧箱中熟悉环境3 min,之后给予声音信号(4.5 kHz,80 dB,30 s)提示的不可逃避足底电击(0.6 mA,5 s)10次,使大鼠产生条件恐惧,两次间隔1~4 min。条件刺激结束后继续在该箱中停留3 min,然后放回日常饲养笼。
1.4.2 条件性恐惧消退训练将已建立条件性恐惧的大鼠(条件恐惧建立24 h后)重新置于条件恐惧箱,仅给予连续30次与建模时同样的声音条件刺激,而不再给予非条件刺激(足底电击)。两次间隔1~2 min,连续4次声音信号后无僵立行为出现则视为完全消退。
1.4.3 消退保持测试各组大鼠消退训练后当日(extinction-0d)、消退训练后d 1、3、7进行僵立行为测定。大鼠置于条件恐惧箱中,仅给予5次建模时的声音信号,两次间隔1~2 min,记录大鼠连续10 min内僵立时间百分比。
1.5 亚甲蓝法[7]检测脑组织H2S含量为防止玻璃与H2S结合,整个检测过程容器均采用高质量的聚丙烯塑料管。消退训练24 h后,大鼠麻醉后断头取脑,冰上分离双侧内侧前额叶,匀浆裂解时每mg脑组织加10 μL磷酸氢钾缓冲液。取上清(200 μL)与10 g·L-1醋酸锌混合,生成硫化锌沉淀后,20 000×g高速离心15 min,用溶于7.2 mol·L-1盐酸的N, N-二甲基-对苯二胺硫酸盐(20 mmol·L-1)150 μL和溶于1.2 mol·L-1盐酸的FeCl3(30 mmol·L-1)100 μL液体溶解沉淀。静置15 min后,取200 μL液体至96孔板,用670 nm波长进行吸光度检测。根据NaHS标准曲线计算样品中H2S含量。
1.6 Western blot方法检测脑组织CBS蛋白的表达消退训练24 h后,大鼠麻醉后断头取脑,于冰上分离双侧内侧前额叶,匀浆时每10 mg脑组织加入100 μL裂解液,4 ℃,12 000 r·min-1离心10 min,取上清,BCA法行蛋白定量。常规方法电泳转膜,加一抗(CBS polyclonal Antibody) 1 :2 000和二抗(goat anti-rabbit IgG, HRP conjugate)1 :2 000。用Image J软件进行分析各条带的灰度值。
1.7 电生理学方法大鼠腹腔注射20%氨基甲酸乙酯(1 g·kg-1)进行麻醉,脑立体定位仪俯卧位固定后,定位内侧前额叶区(参照大鼠脑图谱(Paxinos and Watson,2005)。颅骨硬脑膜打开后,微电极(记录电极管内注入2%滂胺天蓝,其余两管注入相应药物)尖端用液压推进器缓慢送至内侧前额叶区,观察细胞平稳放电至少5 min,利用PM2000B压力注射仪将药物注射到神经元表面,用Micro1401数据采集系统显示细胞放电曲线,用Spike2数据分析系统对细胞放电频率进行分析。以加药前120 s内平均每秒放电频率为对照,将加药后反应高峰50 s内平均每秒放电频率作为药物的效应,放电频率超过2倍标准差认为具有统计学意义。
1.8 数据处理和统计方法计量数据采用均数±标准差(x±s),采用SPSS18.0软件进行统计学处理。采用t检验或单因素方差分析(两两比较行Bonferroni检验)来比较不同组间的差别。SigmaPlot 10.0用于作图。
2 结果 2.1 消退训练对条件恐惧大鼠僵立行为的影响取消退训练后第1天测定的僵立行为数据进行分析,与正常对照组(Naive)相比较,恐惧对照组(Control)大鼠的僵立行为明显加重(P<0.01);与恐惧对照组(Control)相比,恐惧消退组(Extinction)大鼠的僵立行为有所减轻(P<0.01),但较正常对照组(Naive)大鼠的僵立行为严重(P<0.01)。见Fig 1。

|
| Fig 1 Freezing behavior in conditioned fear experiment(x±s, n=8) **P < 0.01 vs naive group; ##P < 0.01 vs control group. |
亚甲基蓝法检测结果如Fig 2所示,与正常对照组(Naive)相比,条件恐惧大鼠(Control)内侧前额叶脑区H2S含量明显降低(P<0.01),与恐惧对照组相比,恐惧消退组大鼠(Extinction)内侧前额叶脑区H2S含量有所回升(P<0.01),但较正常对照组(Naive)相比仍有所降低(P<0.01)。

|
| Fig 2 H2S level of medial prefrontal cortex tissues in naïve, control and extinction group(x±s, n=10) **P < 0.01 vs naive group; ##P < 0.01 vs control group. |
大鼠与人的脑组织中H2S主要依赖CBS产生,Fig 2实验结果显示各组大鼠内侧前额叶脑区脑组织H2S水平发生变化,我们用Western blot方法检测CBS蛋白表达情况以明确CBS蛋白变化趋势是否与H2S变化趋势一致。如Fig 3所示,与正常对照组(Naive)相比,条件恐惧大鼠(Control)内侧前额叶脑区脑组织CBS含量明显降低(P<0.01),与恐惧对照组相比,消退训练大鼠(Extinction)内侧前额叶脑区CBS含量有所回升(P<0.05),但较正常对照组(Naive)相比仍有所降低(P<0.01)。
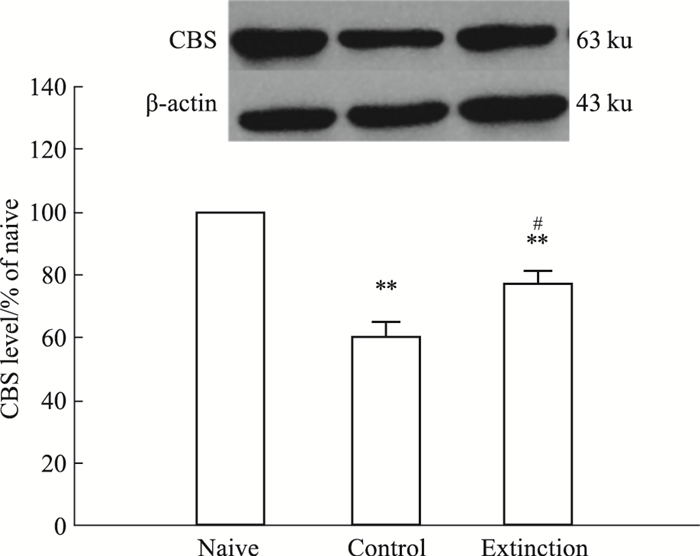
|
| Fig 3 CBS level of medial prefrontal cortex tissues in naïve, control and extinction group(x±s, n=4) **P < 0.01 vs naive group; #P < 0.05 vs control group. |
上述结果显示条件恐惧大鼠内侧前额叶脑区CBS/H2S体系减少,消退训练大鼠内侧前额叶脑区CBS/H2S有所回升,所以我们考虑补充外源性H2S有可能改善消退训练大鼠的僵立行为。如Fig 4结果显示,与恐惧消退组(Extinction)相比,NaHS组大鼠消退训练后0、1、3、7 d的僵立行为明显低于恐惧消退组(Extinction)大鼠在相同时间点的僵立行为(P<0.01)。
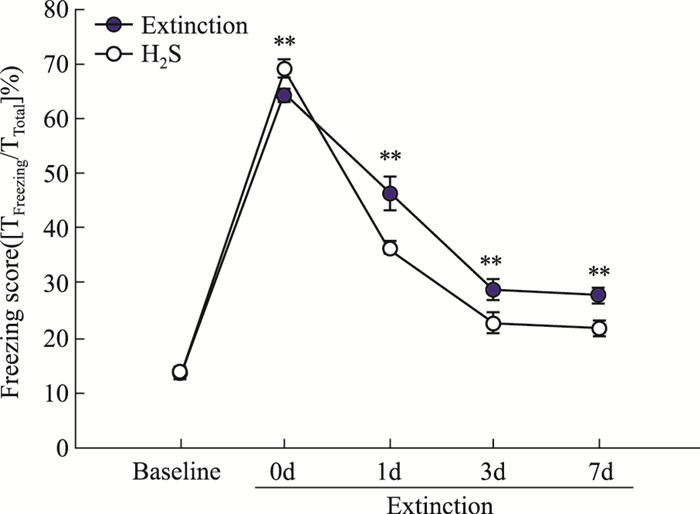
|
| Fig 4 Interference of H2S on freezing behavior at different time points in conditioned fear experiment(x±s, n=8) **P < 0.01 vs extinction group. |
为了探讨L-cysteine对整体状态下大鼠内侧前额叶神经元的电生理效应,我们利用多管微电极进行细胞外电生理记录,观察L-cysteine对神经元放电频率的影响。如Fig 5所示,微量压力注射无菌生理盐水前后内侧前额叶脑区神经元的放电频率差别无统计学意义(P>0.05);微量压力注射L-cysteine使内侧前额叶脑区神经元自发放电频率升高(P<0.01)。
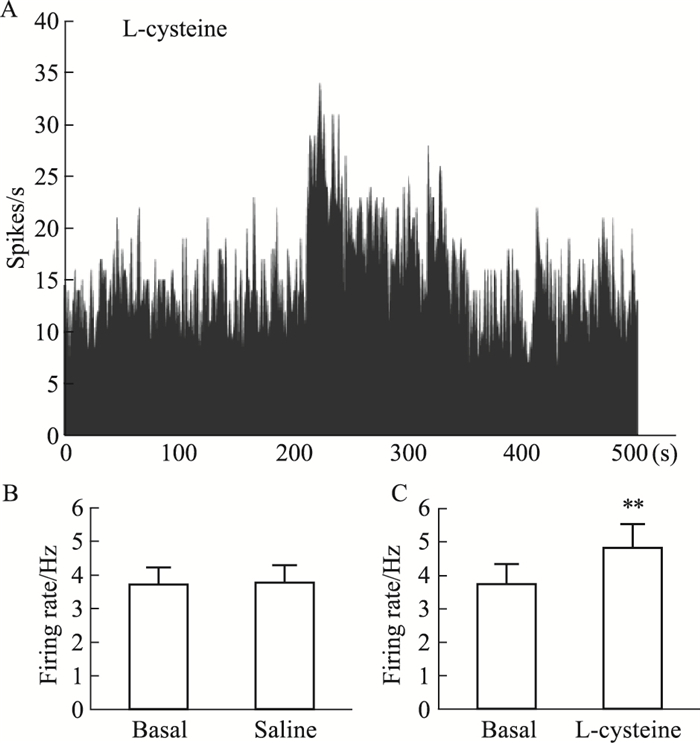
|
| Fig 5 Effect of H2S system on frequency of spontaneous discharges of medial prefrontal cortex neurons(x±s, n=10) A:Initial graph of the frequency of spontaneous discharges of medial prefrontal cortex neurons. B, C: Histogram of the frequency of spontaneous discharges of medial prefrontal cortex neurons before and after administration.**P < 0.01 vs basal. |
本研究观察到大鼠条件性恐惧训练后内侧前额叶皮层的边缘下区CBS/H2S体系含量减少,僵立行为加重; 而消退训练后边缘下区CBS/H2S体系含量有所回升,僵立行为有所减轻; 且外源性补充H2S后可改善消退训练大鼠的僵立行为,这些结果表明,内侧前额叶皮层的边缘下区CBS/H2S调节恐惧记忆的消退过程。为了探讨边缘下区H2S调节恐惧记忆消退过程的机制,我们又观察了外源性补充H2S对整体状态下大鼠边缘下区神经元的自发放电的影响,结果显示,外源性补充H2S能明显升高神经元自发放电频率,表明边缘下区CBS/H2S调节恐惧记忆的消退过程与其能增高该区神经元自发放电频率有关。
内侧前额叶皮层边缘下区与恐惧记忆的消退密切相关[2-3]。杏仁体在条件恐惧的形成和表达中起关键作用,在解剖学上,边缘下区有密集的纤维投射到杏仁核外侧部; 当条件刺激呈现时,mPFC对杏仁体中央核的抑制可使动物表现出恐惧记忆的抑制或者恐惧消退[2]; 丘脑内侧背部-mPFC通路和海马-mPFC通路诱发的长时程增强与恐惧记忆消退的保持有关[8]; vmPFC损毁只损害恐惧记忆的消退过程[9]; PTSD患者内侧前额叶皮层活动下降[10]。可见,mPFC完整的结构和功能,以及mPFC对杏仁核的正常抑制在创伤性记忆消退的过程中至关重要。神经系统内H2S主要由CBS催化产生,小脑、海马、皮质等部位有大量CBS分布,H2S在大脑内含量相对较高(50~160 μM)[2]。H2S通过抗炎、抗氧化和抗凋亡等多途径调节神经系统功能并保护神经元[4],其中生理浓度的H2S易化海马神经元长时程增强[5],调节突触可塑性,参与学习记忆和情绪调节[6]。我们既往研究也表明海马杏仁核CBS/H2S通过调节神经元自发放电频率调控创伤后应激障碍模型大鼠学习记忆及情绪行为[11-12]。本研究进一步检测了条件恐惧训练及消退训练大鼠内侧前额叶皮层边缘下区CBS/H2S水平以及外源性补充H2S对恐惧消退的影响。结果显示条件性恐惧训练后内侧前额叶皮层的边缘下区CBS/H2S体系含量减少,消退训练后边缘下区CBS/H2S体系含量有所回升; 且外源性补充H2S后可改善消退训练大鼠的僵立行为。这些结果表明内侧前额叶皮层的边缘下区CBS/H2S调节恐惧记忆的消退过程。这与我们以往研究[11-12]及侯晓怡[13]报道的外源性补充H2S可改善不同应激模型大鼠学习记忆能力和抑郁样行为相一致。
脑内H2S可抑制兴奋性氨基酸的释放,易化海马神经元长时程增强[5],并促进星形胶质细胞摄取谷氨酸,清除突触间隙中过多的谷氨酸,维持正常的突触传递功能。研究进一步证实,H2S选择性增强海马区和杏仁核区N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)受体的电流并影响NMDA受体依赖的动物学习记忆能力和大鼠情感记忆[14]。以上研究表明,硫化氢可以调节神经元的电生理特性进而影响大鼠的学习记忆和情感记忆。研究还发现,丘脑内侧背部-mPFC通路在消退训练后1~7 d的长时程增强有所增加; 海马-mPFC通路上诱发的长时程增强也是在消退训练后发生的[8]。Milad和Quirk发现vmPFC的IL区神经元在条件恐惧消退训练24h后的消退回忆时可记录到神经元放电和短时间放电增强现象,这说明IL区放电变化参与消退回忆的调节,并且Anthony等[15]采用多导电生理记录方法证明了NMDA受体依赖的IL区神经元的簇状放电是消退巩固所必需的。以上研究揭示了mPFC产生的突触可塑性以及放电情况与消退的保持有关。本研究利用在体细胞外电生理记录法,观察外源性H2S供体L-cysteine对大鼠边缘下区神经元电生理特性的影响。与以上文献[8, 14, 15]报道一致,L-cysteine可以影响神经元的电生理特性,主要表现为L-cysteine对边缘下区神经元产生兴奋效应,使边缘下区神经元放电频率升高。这与我们以往的研究[11-12]相似。综合文献及实验结果我们分析,H2S增强条件恐惧消退行为的机制之一可能是增加了边缘下区神经元放电频率和兴奋性。
PTSD发病机制多样,至今不是十分清楚,本研究证实边缘下区CBS/H2S体系的含量参与调节恐惧记忆的消退过程,外源性增加H2S含量可增强条件恐惧消退行为,该作用可能与其增加边缘下区神经元放电频率和兴奋性有关。该研究对揭示PTSD神经生物学机制,寻找防治创伤后应激障碍靶点提供新思路和实验依据。本研究仅针对边缘下区H2S含量变化及对恐惧消退和神经元的影响进行了研究,关于H2S增加边缘下区神经元放电频率和兴奋性的分子机制、信号通路有待于进一步研究阐明。
| [1] |
张黎明, 张有志, 李云峰. 创伤后应激障碍的神经生物学研究进展[J]. 中国药理学通报, 2010(06): 704-7. Zhang L M, Zhang Y Z, Li Y F. The progress of neurobiological mechanisms on PTSD[J]. Chin Pharmacol Bull, 2010(06): 704-7. |
| [2] |
Fitzgerald J M, DiGangi J A, Phan K L. Functional neuroanatomy of emotion and its regulation in PTSD[J]. Harv Rev Psychiatry, 2018, 26(3): 116-28. doi:10.1097/HRP.0000000000000185 |
| [3] |
Adamec R E, Blundell J, Burton P. Neural circuit changes mediating lasting brain and behavioral response to predator stress[J]. Neurosci Biobehav Rev, 2005, 29(8): 1225-41. doi:10.1016/j.neubiorev.2005.05.007 |
| [4] |
Shefa U, Kim M S, Jeong N Y, Jung J. Antioxidant and cell-signaling functions of hydrogen sulfide in the central nervous system[J]. Oxid Med Cell Longev, 2018, 1873962. |
| [5] |
Kimura H. Hydrogen sulfide induces cyclic AMP and modulates the NMDA receptor[J]. Biochem Biophys Res Commun, 2000, 267(1): 129-33. doi:10.1006/bbrc.1999.1915 |
| [6] |
Hu L F, Lu M, Hon Wong P T, Bian J S. Hydrogen sulfide: neurophysiology and neuropathology[J]. Antioxid Redox Signal, 2011, 15(2): 405-19. doi:10.1089/ars.2010.3517 |
| [7] |
Nagpure B V, Bian J S. Brain, learning, and memory: role of H2S in neurodegenerative diseases[J]. Handb Exp Pharmacol, 2015, 230: 193-215. |
| [8] |
Herry C, Garcia R. Behavioral and paired-pulse facilitation analyses of long-lasting depression at excitatory synapses in the medial prefrontal cortex in mice[J]. J Behav Brain Res, 2003, 146: 89-96. doi:10.1016/j.bbr.2003.09.017 |
| [9] |
Milad M R, Rauch S L, Quirk G J, et al. Fear extinction in rats: Implications for human brain imaging and anxiety disorders[J]. J Biological Psychology, 2006, 73(1): 61-71. doi:10.1016/j.biopsycho.2006.01.008 |
| [10] |
Rauch S L, Shin L M, Phelps E A. Neurocircuitry models of posttraumatic stress disorder and extinction: human neuroimaging research-past, present, and future[J]. J Biological Psychiatry, 2006, 60(3): 376-82. |
| [11] |
刘红霞, 潘虹, 王华, 等. 杏仁核脑区硫化氢对创伤后应激障碍模型大鼠抑郁样行为的影响[J]. 中国病理生理杂志, 2017, 33(6): 988-92. Liu H X, Pan H, Wang H, et al. Effect of H2S system on space learning and memory ability in PTSD model rat and on the frequency of spontaneous discharges of hippocampus neurons[J]. Chin J Pathophys, 2017, 33(6): 988-92. doi:10.3969/j.issn.1000-4718.2017.06.005 |
| [12] |
刘红霞, 于腊梅, 黄瑾, 等. 硫化氢对创伤后应激障碍大鼠空间学习记忆能力及海马神经元放电的影响[J]. 中国药理学通报, 2017, 33(2): 206-11. Liu H X, Yu L M, Huang J, et al. Effect of amygdala H2S system on depression-like behavior in posttraumatic stress disorder rats[J]. Chin Pharmacol Bull, 2017, 33(2): 206-11. doi:10.3969/j.issn.1001-1978.2017.02.013 |
| [13] |
侯晓怡.气体信号分子硫化氢对慢性不可预知性应激所致大鼠抑郁样行为的作用及机制[D].武汉: 华中科技大学.2014: 1-103 Hou X Y. Effects and mechanism of gaseous signal moleculehydrogen sulfide on the depressive-like behaviorinduced by chronic unpredictable stress of rats [D]. Wu han: Huazhong University of Science and Technology.2014: 1-103 http://cdmd.cnki.com.cn/Article/CDMD-10487-1014231954.htm |
| [14] |
杨远坚.气体信号分子对边缘系统介导的大鼠记忆功能的影响及机制[D].武汉: 华中科技大学.2012: 1-144. Yang Y J.Regulation of limbic system-mediated memory and behavior by gaseous signal molecule[D]. Wu han: Huazhong University of Science and Technology.2012: 1-144 http://cdmd.cnki.com.cn/article/cdmd-10487-1012361800.htm |
| [15] |
Anthony B R, Quirk G J, Santini E. Consolidation of fear extinction requires NMDA receptor-dependent bursting in the ventromedial prefrontal cortex[J]. J Neuron, 2007, 53: 871-80. doi:10.1016/j.neuron.2007.02.021 |

