

2. 安徽医科大学 药学院,安徽 合肥 230022;
3. 安徽医科大学 肝病研究所,安徽 合肥 230022
王华(1978-),男,博士,教授,博士生导师,研究方向:酒精性肝病、炎症与肿瘤,通讯作者,E-mail:wanghua@ahmu.edu.cn
2. School of Pharmacy, Anhui Medical University, Hefei 230022, China;
3. Institute of Liver Diseases, Anhui Medical University, Hefei 230022, China
黏膜相关恒定T细胞(mucosal-associated invariant T,MAIT)是最近发现的一种固有的T细胞子集。它表达一种恒定的T细胞受体(T cell receptor,TCR)α链[1],人类MAIT细胞含量丰富,占外周血和肠黏膜T细胞的10%,占肝脏T细胞的20%~45%[2]。MAIT细胞不仅具有抗菌和免疫调节活性[3],同时还影响着肿瘤的发生、发展。近几年,对MAIT细胞的研究逐渐成为人们关注的热点,然而,对其在临床疾病中的作用研究甚少,且机制尚未完全阐明。故本文将对MAIT细胞的生物学特性及其在肿瘤中的研究进展作如下综述。
1 MAIT细胞的发现与表型MAIT细胞的初次命名是在肠道固有层中发现之后,Porcelli等[4]首先提出MAIT细胞这一概念。1993年,两个不同的αβ TCR的T细胞群被发现表达半恒定的α链。进一步的分析发现,两个天生的人类T细胞群: NKT细胞和MAIT细胞[5]。MAIT细胞最早被描述是通过纯化CD8α+富集和CD8α+枯竭的人外周血淋巴细胞,并测序它们的TCRs来完成,类似这样的细胞在小鼠和牛的体内也被发现。
关于MAIT细胞的表型,MAIT细胞通过其自身的多种表型来定义,如半恒定的TCR,在人外周血的进一步区分是通过其表面高表达的NK细胞受体CD161和特有的TCR Vα7.2片段。另外,MAIT细胞表面还表达多种受体(Fig 1),如细胞因子受体IL-7R、IL-12R和IL-18R;多样性的组织导向趋化因子受体,如CCR6、CXCR6、CCR5等。除此之外,MAIT细胞还表达各种转录因子,如PLZF、RORγt和Tbet。已知PLZF编排MAIT细胞发展,而RORγt和Tbet参与这些细胞分化程序, 控制他们产生IL-17或IFN-γ的能力[6]。
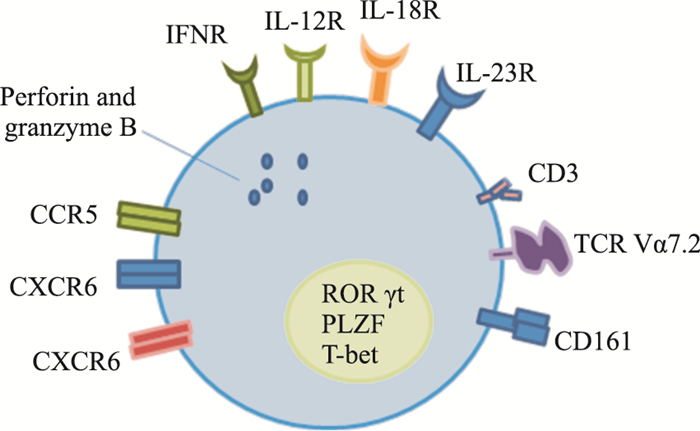
|
| Fig 1 Phenotypic characteristics of MAIT cells It includes a variety of characteristic molecules, cytokine receptors and chemokine receptors. |
MAIT细胞的TCR为一种半恒定模式[7],由恒定的α链和一条或几条β链组成,α链在人类中是Va7.2-Ja33,在小鼠中是Va19-Ja33组成[8]。β链半恒定,在人类中是Vβ13和Vβ2,小鼠中是Vβ8和Vβ6[9]。另外,MAIT细胞表面可特异性表达Vα7.2片段,以及高表达CD161,外周血和组织内浸润的MAIT细胞可以通过Vα7.2和CD161或IL-18Rα两者之一共同定义。且在正常人群中,MAIT细胞还可以通过其表达的CD8+、CD4+抗原进行分群,主要为CD8+和CD4-CD8-亚群,很少一部分是CD4+。
2 MAIT细胞的激活与功能MAIT细胞可识别细菌(包括大肠杆菌、分支杆菌和结核杆菌)及一些真菌的维生素代谢产物和嘧啶,并被这些抗原所激活。
如抗原是细菌,抗原提呈细胞吞噬细菌后,有两条途径激活MAIT细胞,一条是依赖MR1的方式,通过MR1呈现特定的核黄素(维生素B2)代谢产物[10][包括非活性叶酸代谢物、6-甲酰基喋呤(6-FP)和强效核黄素代谢产物]激活;另一条是通过分泌细胞因子的途径,即MR1-非依赖性方式激活,活化的MAIT细胞可以增殖,并产生细胞因子(包括IFN-γ、TNF-α、IL-17)和表达细胞毒性分子(如颗粒素酶、颗粒溶素、穿孔素等)[11]。细胞毒性分子的表达使MAIT细胞能够通过裂解或凋亡,直接杀死病原感染的抗原提呈细胞[12],从而达到消灭和清除细菌抗原的作用。但如抗原是病毒,则可不需要依赖MR1,直接通过细胞因子依赖的方式,激活MAIT细胞,并启动免疫过程(Fig 2)。
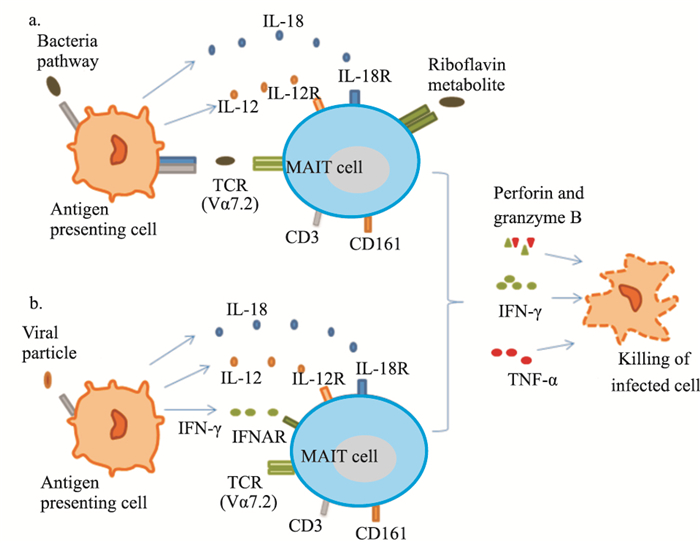
|
| Fig 2 Interaction between MAIT cells and antigen presentingcells(APCs) in anti-infection and activation of MAIT cells The figure was modified from the reference[13].A: Two activation modes of MAIT cells caused by bacterial infection(TCR-dependent and non-TCR-dependent); B: Viral infection leads to cytokine-dependent activation of MAIT cells. |
尽管MAIT细胞可以通过两种途径激活,但这些途径的相对贡献还没有明确的定义,并且很可能取决于病原体引起的反应。据报道,TCR依赖性MAIT细胞的激活在刺激早期出现,是短暂的,而效应物MAIT细胞的长期激活依赖于细胞因子(即TCR非依赖性)[14]。与其他T细胞亚群相比,MAIT细胞在激活时和在活动性结核病患者中,主要显示一种效应记忆表型(CCR7-CD45RA+)[15]。
最近的报告表明,与抗菌特性形成对比的是,MAIT细胞还可以在对抗超抗原的应答上,诱导免疫病理和免疫抑制。如SEB超抗原,可以诱导MAIT细胞,与其他细胞(如CD4+、CD8+、γδ及iNKT细胞)相比, 产生一种夸大的快速的细胞因子效应,并上调PD-1、TIM3等分子。MAIT细胞对SEB的这些反应独立于MR1,但高度依赖于SEB诱导的IL-12和IL-18的产生[16]。
3 MAIT细胞在肿瘤微环境中的作用MAIT细胞在肿瘤微环境中的作用,目前有两个方面:一是MAIT细胞在特定位置和特定环境下产生IL-17A,进而促进新血管生成、免疫抑制细胞群瘤内积累和癌症进展(促进);另一方面, 他们可以表达强有力的细胞毒性效应分子NKG2D和IFN-γ, 所有这些都建立了MAIT在癌症免疫监视的角色(抑制)[17](Fig 3)。
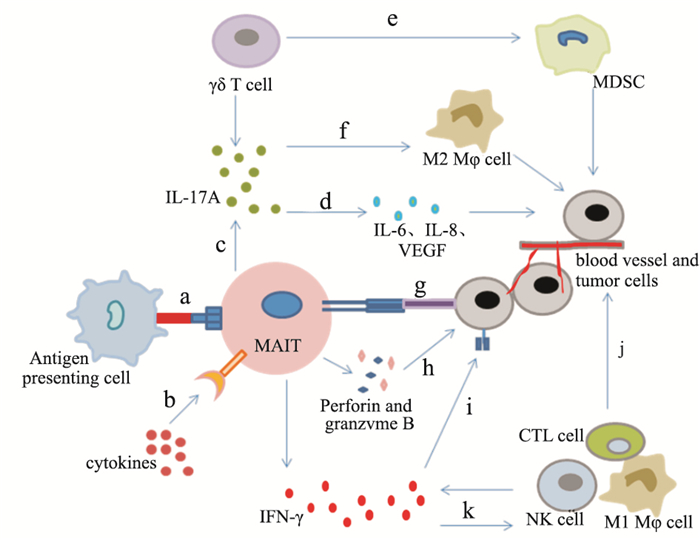
|
| Fig 3 Role of MAIT cells in tumor microenvironment The figure was modified from the reference[17]. a: MAIT cells recognize antigens presented by antigen presenting cells(APCs) by MR1; b: MAIT cells respond to cytokines, such as IL-7, IL-12, and IL-18; c: Once activated, MAIT cells can release IL-17A; d: IL-17A can promote the production of tumor angiogenic factors such as IL-6, IL-8 and/or VEGF; e: MAIT can also interact with other IL-17A-producing cells(including γδT17 cells and FoxP3+γδT cells) to promote intramedullary accumulation of myelogenic immunosuppressive cells(MDSCs); f: IL-17A also promotes the differentiation of M2 macrophages and tumor progression; g: Anti-cancer effect: MAIT cells can express NKG2D, which detect corresponding molecules on malignant cells and play a recognition role; h: Activated MAIT cells can release cytotoxic effector molecules, such as perforin and granzyme; i: Activated MAIT cells also produce a large amount of IFN-γ(up-regulating the apoptosis mechanism of Fas); j: Finally tumor cells are killed and dissolved; k: IFN-γ can also trans-activate secondary effector cell types, such as NK cells, CD8+ cytotoxic T lymphocytes(CTLs) and M1 macrophages, thus accelerating the death of tumor cells. |
另外,关于MAIT细胞在体内外肿瘤研究中采用的实验方法,以及功能的检测。由于MAIT细胞在小鼠和人的外周血及组织器官的分布有较大的差异[18],故一般很少应用小鼠研究MAIT细胞,多采用人的外周血及肿瘤组织,并行细胞染色结合流式细胞术对其频率加以检测[19]。功能性研究则多采用离子霉素+佛波脂酸刺激[20],并行流式检测。仍有少部分研究加入免疫组化的方法行进一步探索[21]。
4 MAIT细胞与肿瘤近年来,肿瘤的发病率和死亡率不断上升。而恶性肿瘤,即癌症,更是严重威胁着人类的健康与生命。了解癌症的发生、发展,对于寻找预防及治疗癌症的可能途径至关重要。研究发现,MAIT细胞可诱发肿瘤细胞G2期阻滞现象,具有潜在的肿瘤免疫监视作用[20]。肿瘤患者外周血循环MAIT细胞数量明显减少,而在肿瘤部位明显富集[19]。提示MAIT细胞可能参与肿瘤的免疫监视。
在癌症患者中,MAIT细胞产生的细胞因子减少,或者保持与健康个体相似。研究表明,在癌症患者和健康对照组中,MAIT细胞产生细胞因子的能力没有较大的差异。但是还有一些研究表明,与未受影响的黏膜相比,肿瘤相关的MAIT细胞IFN-γ和TNF-α的生成水平较低。与健康对照组相比,MAIT细胞产生的IL-17在癌症患者中升高[22],或者近似[20]。
4.1 结直肠癌MAIT细胞在结直肠癌中被认为是一种有吸引力的免疫治疗靶点。有研究表明,在结肠癌中,MAIT细胞分泌IL-17诱导的炎症可促进肿瘤的进展,而IFN-γ的产生对于抗肿瘤免疫至关重要。Sundstrom等[20]用流式细胞术分析了在结肠癌和未受影响的固有层中MAIT细胞的频率、表型和功能,发现无论肿瘤的分期或定位,MAIT细胞在肿瘤组织中均有明显的积累。未受影响的结肠组织中的大多数MAIT细胞产生IFN-γ,而只有少数产生IL-17。结肠MAIT细胞也产生了TNF-α、IL-2和颗粒素酶B,在肿瘤中可产生IFN-γ的MAIT细胞的频率明显降低,而其他细胞因子分析结果无差异。体外研究显示,肿瘤组织分泌因子降低了MAIT细胞IFN-γ的生成。总之,MAIT细胞富集于结肠肿瘤组织中,但其产生IFN-γ的能力大大降低。猜想认为MAIT细胞有促进肿瘤局部免疫应答的能力,但是肿瘤微环境中的因素会减少MAIT细胞IFN-γ的产生。
仍有研究显示,MAIT细胞可能存在抗肿瘤作用。为了评估其功能,Ling等[19]使用HCT116(人结肠癌细胞系)和K562(人红细胞系)细胞联合培养了MAIT细胞,发现活化的MAIT细胞产生细胞因子(TNF-α、IFN-γ和IL-17),在共培养过程中,随着细胞毒性标志物(穿孔素和颗粒酶B)的上调,CD107a表达增加,并以细胞接触依赖的方式在G2/M周期引起HCT116细胞周期阻滞,导致HCT116细胞和K562细胞活力降低。表明MAIT细胞可能对癌细胞有直接的细胞毒性作用。
4.2 其他癌症MAIT细胞在其他肿瘤中的研究较结直肠癌要少很多,但是仍有部分文献支撑。MAIT细胞在不同种类的癌症中都有报道[19-22]。与健康对照组的MAIT细胞相比,在结直肠癌、胃癌、肺癌等黏膜相关肿瘤患者中,外周血循环MAIT细胞的频率趋于下降[22]。相反,对于非黏膜相关癌症,如肝癌和甲状腺癌,外周血循环MAIT细胞的频率和数量与健康对照组相似,并高于黏膜相关癌症患者[22]。
关于MAIT细胞在肝癌内的研究,Won等[22]指出,肝癌患者外周血MAIT细胞明显减少,且与淋巴细胞计数、肿瘤N分期以及癌胚抗原水平、肿瘤直径有关,不与年龄、肿瘤T分期等有关。近期一份关于MAIT细胞与肝癌的前沿报道,Duan等[23]通过流式细胞术和体外生物测定法对肝细胞肝癌患者的外周血和组织中MAIT细胞的分布、表型和功能进行了评价,并对其进行了转录组分析。发现受肿瘤影响的MAIT细胞显著上调抑制性分子(如PD-1、CTLA-4及TIM-3),分泌显著减少的IFN-γ和IL-17,以及产生较少的颗粒素-B和穿孔素,转而产生肿瘤促进细胞因子(如IL-18);肿瘤来源的MAIT细胞向肿瘤促进方向重新编程基因。提示肝细胞肝癌浸润的MAIT细胞功能受损,甚至被重新编程,从抗肿瘤免疫转向肿瘤促进方向。
其次,膀胱癌、肾癌等,都是泌尿系最常见的恶性肿瘤,严重威胁着人类的生命健康。Peterfalvi等[24]通过单链构象多态性分析、免疫杂交以及流式细胞术,研究了肾癌和脑肿瘤的患者中其肿瘤组织内的Vα7.2-Jα33的转录水平,发现其相对于对照组的组织和外周血是明显升高的,这是MAIT细胞在肿瘤方面最初的研究。
乳腺癌中,Zumwalde等[25]从原发性人乳腺组织标本中分离出导管上皮,用流式细胞术分析其相关T淋巴细胞,用功能检测方法测定T细胞在人乳腺癌细胞中细胞因子的分泌量。发现了来自人乳腺导管的MAIT细胞对暴露于大肠杆菌的人乳腺癌细胞具有选择性辅助T17细胞的应答作用。因此,来自乳腺微生物组的线索和乳腺肿瘤导管上皮细胞应激相关配体的表达,可能形成乳腺癌变过程中的MAIT细胞反应。这些发现强调了MAIT细胞、乳腺导管上皮细胞和乳腺微生物组3部分之间可能存在相互作用的关系,这些相互作用可能在乳腺癌变或已建立的肿瘤进展过程中发挥作用。
5 结语综上所述,MAIT细胞是天然免疫细胞,不仅具有抗菌能力,还有一定的抗癌作用。活化后分泌IFN-γ、TNF-α和IL-17,参与抗感染、自身免疫及抗肿瘤的反应,是目前免疫细胞界越来越关注的焦点。但MAIT细胞在肿瘤中还没有得到充分的研究,迄今为止,人类恶性肿瘤的模型只有几个(实体肿瘤和血液恶性肿瘤)已被研究[20-21],仍需要更深层次的探讨。如进行以下几个方面研究:MAIT细胞的具体结构、功能及抗癌机制; MAIT细胞在癌症治疗中功能和数量变化的临床意义; MAIT细胞表面及内部分泌的因子对癌症预后的影响等。进一步研究MAIT细胞可为研发新的免疫疗法提供基础支撑。
| [1] |
Chandra S, Kronenberg M. Activation and function of iNKT and MAIT cells[J]. Adv Immunol, 2015, 127: 145-201. doi:10.1016/bs.ai.2015.03.003 |
| [2] |
Dusseaux M, Martin E, Serriari N, et al. Human MAIT cells are xenobiotic-resistant, tissue-targeted, CD161hi IL-17-secreting T cells[J]. Blood, 2011, 117(4): 1250-9. doi:10.1182/blood-2010-08-303339 |
| [3] |
Beudeker B J B, Van Oord G W, Arends J E, et al. Mucosal-associated invariant T-cell frequency and function in blood and liver of HCV mono- and HCV/HIV co-infected patients with advanced fibrosis[J]. Liver Int, 2018, 38(3): 458-468. doi:10.1111/liv.13544 |
| [4] |
Porcelli S. Analysis of T cell antigen receptor(TCR) expression by human peripheral blood CD4-8- alpha/beta T cells demonstrates preferential use of several V beta genes and an invariant TCR alpha chain[J]. J Exp Med, 1993, 178(1): 1-16. |
| [5] |
Payen D, Asehnoune K, Volk H D. Mucosal associated invariant T(MAIT) cell: a novel cellular mechanism participating in post-aggressive immunodepression[J]. Intensive Care Med, 2014, 40(2): 275-7. doi:10.1007/s00134-013-3169-4 |
| [6] |
Keller A N, Corbett A J, Wubben J M, et al. MAIT cells and MR1-antigen recognition[J]. Curr Opin Immunol, 2017, 46: 66-74. doi:10.1016/j.coi.2017.04.002 |
| [7] |
Riva A, Patel V, Kurioka A, et al. Mucosa-associated invariant T cells link intestinal immunity with antibacterial immune defects in alcoholic liver disease[J]. Gut, 2018, 67(5): 918-30. doi:10.1136/gutjnl-2017-314458 |
| [8] |
Treiner E, Duban L, Bahram S, et al. Selection of evolutionarily conserved mucosal-associated invariant T cells by MR1[J]. Nature, 2003, 422(6928): 164-9. doi:10.1038/nature01433 |
| [9] |
Martin E, Treiner E, Duban L, et al. Stepwise development of MAIT cells in mouse and human[J]. PLoS Biol, 2009, 7(3): e54. |
| [10] |
Kjer-Nielsen L, Patel O, Corbett A J, et al. MR1 presents microbial vitamin B metabolites to MAIT cells[J]. Nature, 2012, 491(7426): 717-23. doi:10.1038/nature11605 |
| [11] |
Kurioka A, Ussher J E, Cosgrove C, et al. MAIT cells are licensed through granzyme exchange to kill bacterially sensitized targets[J]. Mucosal Immunol, 2015, 8(2): 429-40. doi:10.1038/mi.2014.81 |
| [12] |
Edwin L, Jenny S, Joana D, et al. Arming of MAIT cell cytolytic antimicrobial activity is induced by IL-7 and defective in HIV-1 infection[J]. PLoS Pathog, 2015, 11(8): e1005072. doi:10.1371/journal.ppat.1005072 |
| [13] |
Shey M S, Balfour A, Wilkinson K A, et al. Contribution of APCs to mucosal-associated invariant T cell activation in infectious disease and cancer[J]. Innate Immun, 2018, 24(4): 192-202. doi:10.1177/1753425918768695 |
| [14] |
Ussher J E, Bilton M, Attwod E, et al. CD161++ CD8+ T cells, including the MAIT cell subset, are specifically activated by IL-12+IL-18 in a TCR-independent manner[J]. Eur J Immunol, 2014, 44(1): 195-203. doi:10.1002/eji.201343509 |
| [15] |
Jiang J, Wang X, An H, et al. Mucosal-associated invariant T-cell function is modulated by programmed death-1 signaling in patients with active tuberculosis[J]. Am J Respir Crit Care Med, 2014, 190(3): 329-39. |
| [16] |
Shaler C R, Choi J, Rudak P T, et al. MAIT cells launch a rapid, robust and distinct hyperinflammatory response to bacterial superantigens and quickly acquire an anergic phenotype that impedes their cognate antimicrobial function: Defining a novel mechanism of superantigen-induced immunopathology and immunosuppression[J]. PLoS Biol, 2017, 15(6): e2001930. doi:10.1371/journal.pbio.2001930 |
| [17] |
Haeryfar S M M, Shaler C R, Rudak P T. Mucosa-associated invariant T cells in malignancies: a faithful friend or formidable foe[J]. ? Cancer Immunol Immunother, 2018, 67(12): 1885-96. doi:10.1007/s00262-018-2132-1 |
| [18] |
Kurioka A, Walker L J, Klenerman P, et al. MAIT cells: new guardians of the liver[J]. Clin Transl Immunology, 2016, 5(8): e98. doi:10.1038/cti.2016.51 |
| [19] |
Ling L, Lin Y, Zheng W, et al. Circulating and tumor-infiltrating mucosal associated invariant T (MAIT) cells in colorectal cancer patients[J]. Sci Rep, 2016, 6: 20358. doi:10.1038/srep20358 |
| [20] |
Sundstrom P, Ahlmanner F, Akeus P, et al. Human mucosa-associated invariant T cells accumulate in colon adenocarcinomas but produce reduced amounts of IFN-γ[J]. J Immunol, 2015, 195(7): 3472-81. doi:10.4049/jimmunol.1500258 |
| [21] |
Zabijak L, Attencourt C, Guignant C, et al. Increased tumor infiltration by mucosal-associated invariant T cells correlates with poor survival in colorectal cancer patients[J]. Cancer Immunol Immunother, 2015, 64(12): 1601-8. doi:10.1007/s00262-015-1764-7 |
| [22] |
Won E J, Ju J K, Cho Y N, et al. Clinical relevance of circulating mucosal-associated invariant T cell levels and their anti-cancer activity in patients with mucosal-associated cancer[J]. Oncotarget, 2016, 7(46): 76274-90. |
| [23] |
Duan M, Goswami S, Shi J Y, et al. Activated and exhausted MAIT cells foster disease progression and indicate poor outcome in hepatocellular carcinoma[J]. Clin Cancer Res, 2019, 25(11): 3304-16. doi:10.1158/1078-0432.CCR-18-3040 |
| [24] |
Peterfalvi A, Gomori E, Magyarlaki T, et al. Invariant Valpha7.2-Jalpha33 TCR is expressed in human kidney and brain tumors indicating infiltration by mucosal-associated invariant T(MAIT) cells[J]. Int Immunol, 2008, 20(12): 1517-25. doi:10.1093/intimm/dxn111 |
| [25] |
Zumwalde N A, Haag J D, Gould M N, et al. Mucosal associated invariant T cells from human breast ducts mediate a Th17-skewed response to bacterially exposed breast carcinoma cells[J]. Breast Cancer Res, 2018, 20(1): 111. |

