


2. 河北中医学院,河北省心脑血管病中医药防治研究重点实验室,河北 石家庄 050091
2. Hebei Key Lab of Chinese Medicine Research on Cardio-cerebrovascular Disease, Hebei University of Chinese Medicine, Shjiazhuang 050091, China
阿尔茨海默病(Alzheimer’s disease,AD)是老年痴呆的主要原因,是以进行性痴呆为主要特征的神经退行性疾病,主要临床表现为进行性认知功能障碍和记忆力衰退,性格和行为改变,判断力下降,生活自理能力丧失。AD是一种多病因介导的疾病,其发病机制学说有很多,目前仍不明确。研究发现,AD患者的脑铁水平异常升高[1-2],异常增高的脑铁启动机体级联放大机制,最终导致神经元死亡[3]。临床研究发现可以应用去铁剂来改善患者的临床症状及生活自理能力[4],但因其毒副作用强、口服效果差等缺点限制了临床应用[5]。
铁调素(hepcidin)是近年来发现的重要的铁调节激素,能够精确调控铁的吸收、储存和释放过程。因此,检测海马区hepcidin的表达水平对探讨药物治疗疗效有一定的意义。
中医认为AD发病以肾虚精亏,气血不足为本,痰瘀互结,浊毒内生为标的本虚标实之证。根据中医“标本兼治”的治疗原则,治疗AD应补肾健脾,益气养血以培其本,化痰、祛瘀、解毒以治其标。因此,我们课题组以APPswe/PS1dE9双转基因小鼠为动物模型,将淫羊霍、黄芪、葛根素活性成分组方,采用免疫荧光、Real-time PCR、Western blot的实验方法分析淫羊藿、黄芪、葛根有效组分复方对APPswe/PS1dE9双转基因AD模型小鼠海马CA3区hepcidin表达的影响,以期为AD的治疗提供新的思路和策略。
1 材料与方法 1.1 实验动物分组10月龄雄性APPswe/PS1dE9双转基因模型小鼠30只,体质量(26±4)g,分别为复方组、模型组和DFX组,每组10只。10月龄雄性C57BL/6J小鼠10只作为正常对照组。APPswe/PS1dE9双转基因模型小组许可证号为SCXK(鲁)2016-0001,由山东斯科贝斯生物科技股份有限公司提供。C57BL/6J小鼠购自北京维通利华实验动物技术有限公司,单笼喂养动物饲料及饮水,保持12 h的明暗周期,室温25 ℃,湿度50%。
1.2 主要药品和试剂南京泽朗医药科技有限公司提供的黄芪甲苷、淫羊藿苷和葛根素; 大连美仑生物技术有限公司的DFX; hepcidin兔多克隆抗体NBP1-59337:novus公司; Anti -beta actin rabbit polyclonalGB11001:武汉赛维尔生物科技有限公司; 江苏碧云天公司的Western一抗稀释液P0023A;Thermo Scientific的蛋白Marker #26616;HRP标记山羊抗兔IgG GB23303:武汉赛维尔生物科技有限公司; TB GreenTM Premix Ex TaqTMⅡ (TliRNaseH Plus) RR820A:TaKaRa公司; PrimeScriptTMRT reagent Kit with gDNA Eraser(PerfectReal Time) RR047A:TaKaRa公司; Hepcidin25 BS8870R:博奥森生物有限公司。
1.3 仪器DM5000B型光学显微镜、EG11508型组织包埋机、RM2255型全自动轮转切片机均购于Leica公司; 实时荧光定量PCR仪CFX Connectgou型、蛋白电泳和转膜转移仪购于美国Biorad; 制冰机BF320AS型购于意大利斯科茨曼公司; 多功能成像系统Fusion FX5 Spectra型购自于法国Vilber。
1.4 给药方案实验动物从10月龄开始用药,给药1个月至小鼠11月龄。以黄芪、淫羊藿、葛根有效组分复方给予复方组小鼠灌胃,黄芪甲苷、淫羊藿苷和葛根素的临床用量分别为80 mg·kg-1、120 mg·kg-1和80 mg·kg-1。正常对照组和模型组小鼠以等量生理盐水灌胃,DFX组以DFX灌胃,剂量为100 mg·kg-1。所有动物每次灌胃药液的量均以0.1 ml/10 g计,每日1次。
1.5 取材每组取3只小鼠麻醉后断头取脑。然后用4%多聚甲醛体外固定24 h,乙醇脱水,二甲苯透明,石蜡包埋,切片,免疫荧光染色。各组剩余的7只小鼠断头取脑后取小鼠海马组织,将海马组织分为左侧和右侧两部分,其中左侧海马组织用来做Real-time PCR检测,右侧海马组织用来做Western blot检测。
1.6 免疫荧光检测小鼠海马CA3区hepcidin蛋白的表达在切片上滴加PBS按照1 :50稀释的一抗,4 ℃的湿盒内过夜。将处理好的切片放入pH 7.4的PBS中充分漂洗后,以1 :300比例加入山羊抗兔二抗并于室温下培养50 min。漂洗后用抗荧光淬灭封片剂封片。切片于TG全景组织细胞定量分析系统观察海马CA3区hepcidin蛋白的表达情况。
1.7 Western blot检测小鼠海马CA3区hepcidin蛋白的表达提取各组小鼠海马区蛋白,BCA蛋白定量。各组上样量为40 μg,电泳。转移到0.45 μm的PVDF膜上,5%牛奶封闭2 h,兔抗β-actin,兔抗hepcidin 4 ℃孵育过夜,洗膜。滴加相应二抗,室温孵育1 h,洗膜。采用ImageJ软件分析测量灰度值。
1.8 Real-time PCR检测小鼠海马CA3区hepcidin mRNA的表达试剂盒提取各组RNA,A260/A280进行紫外分光光度计检测,以吸光度值为基础进行RNA浓度检测。按照PrimeScriptTM reagent Kit with gDNA Eraser(Perfect Real Time)取1μg的总RNA样本进行反转录。引物由上海生工生物工程股份有限公司合成,目的基因hepcidin引物(上游:5′-AGCAGCACCACCTATCTCCA-3′,下游:5′-TATC GCAATGTCTGCCCTGC-3′),内参基因β-actin引物(上游:5′-ACAGCTTCTTTGCAGCTCCTTC-3′,下游:5′-CCACGATGGAGGGGAATACAG-3′),应用TaKaRa公司TB GreenTM Premix Ex TaqTMⅡ (TliRNaseH Plus)进行以下操作; 以5倍梯度稀释5个浓度的cDNA样本,确定目的基因与β-actin基因扩增标准曲线并确定扩增效率。上下游各取0.8 μL引物,取12.5 μL TB Green Premix Ex TaqⅡ (TliRNaseH Plus)(2×),1 μLPCR Reverse Primer (10 μmol·L-1)和PCR Forward Primer (10 μmol·L-1),另取8.5μL灭菌用水和2 μL DNA模板(<100 ng),反应物总体积25 μL,于Real time PCR仪进行PCR扩增。待测样品的目的基因表达相对数量用2-△△CT 表示。
1.9 统计学分析所有实验数据均采用SPSS 22.0软件进行分析。数据以(x±s)来表示,组间比较采用One way ANOVA单因素方差分析。
2 结果 2.1 免疫荧光结果应用免疫荧光单标和TG全景组织细胞定量分析系统观察小鼠海马CA3区hepcidin阳性表达水平,hepcidin蛋白阳性表达为绿色。Fig 1结果显示,APPswe/PS1dE9双转基因AD模型小鼠海马CA3区hepcidin阳性表达明显降低(P<0.05),淫羊藿、黄芪、葛根有效组分复方和DFX灌胃干预后,hepcidin阳性表达水平较APPswe/PS1dE9双转基因AD模型小鼠海马CA3区明显升高(P<0.05)。复方组和DFX组相比,hepcidin阳性表达水平差异无显著性(P>0.05)。
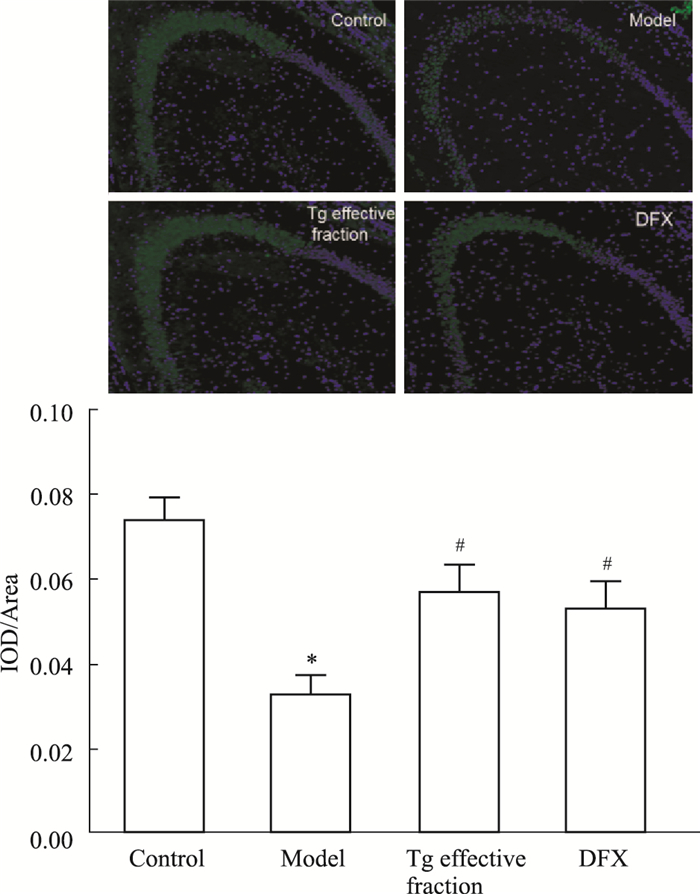
|
| Fig 1 Effects of active components of Epimedium, Astragalus and Radix Puerariae on expression of hepcidin in hippocampus CA3 in APPswe/PS1dE9 double transgenic Alzheimer's disease model mice (50×)(x±s, n=10) Control: C57BL/6J; Model: APPswe/PS1dE9 double transgenic AD model mice; Tg effective fraction: After Tg effective fraction treatment; DFX: After deferox treatment.*P < 0.05 vs control group; #P < 0.05 vs model group |
Real-time PCR(Fig 2)及Western blot(Fig 3)结果显示,APPswe/PS1dE9双转基因AD模型小鼠海马CA3区hepcidin在mRNA水平和蛋白水平均较正常对照组明显降低(P<0.05),给予淫羊藿、黄芪、葛根有效组分复方和DFX灌胃处理后,hepcidin表达水平较APPswe/PS1dE9双转基因AD模型小鼠海马CA3区明显升高(P<0.05)。复方组和DFX组相比,hepcidin在mRNA水平和蛋白水平差异无显著性(P>0.05)。
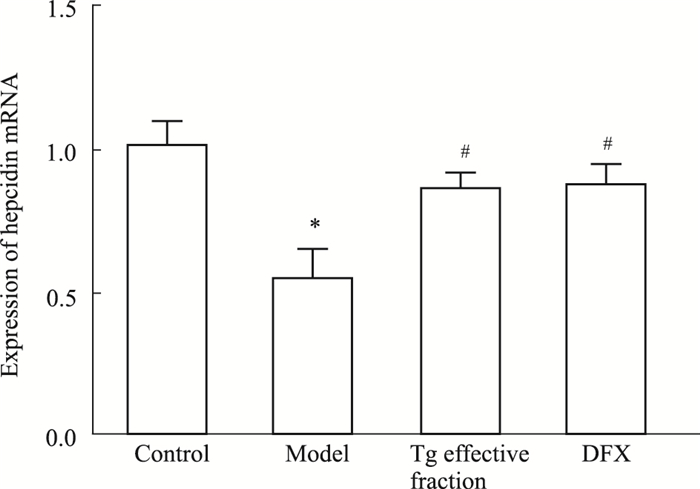
|
| Fig 2 Effects of active components of Epimedium, Astragalus and Radix Puerariae on expression of hepcidin mRNA in hippocampus CA3 in APPswe/PS1dE9 double transgenic Alzheimer's disease model mice(x±s, n=10) *P < 0.05 vs control group; #P < 0.05 vs model group |
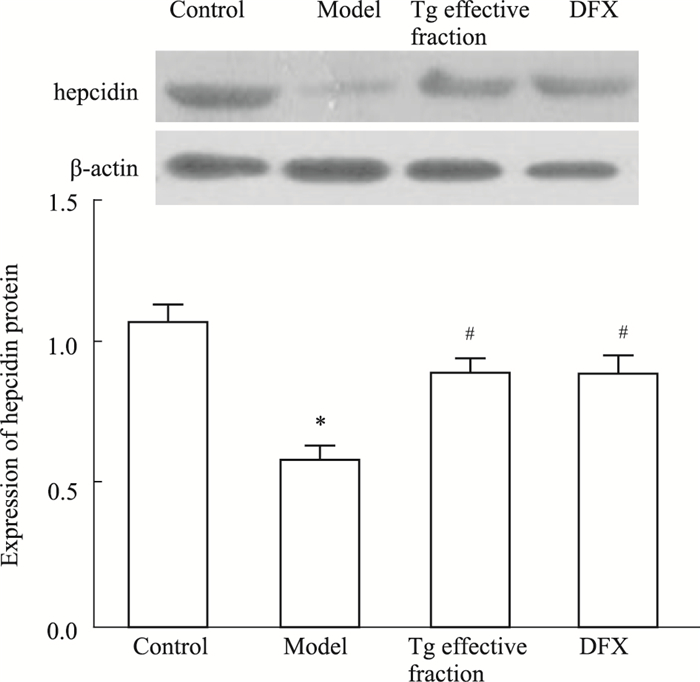
|
| Fig 3 Effects of active components of Epimedium, Astragalus and Radix Puerariae on expression of hepcidin protein in hippocampus CA3 in APPswe/PS1dE9 double transgenic Alzheimer's disease model mice(x±s, n=10) *P < 0.05 vs control group; #P < 0.05 vs model group |
AD已成为威胁老年人生活质量并导致死亡的最严重疾病之一[6],AD的患病率随着年龄的增长呈逐步上升趋势,在65岁以上人群中发病率为5%,而在85岁以上人群中发病率已高达20%。AD是一种多病因介导的疾病,其发病机制学说有很多,其中包括以Aβ毒性学说为核心的Tau蛋白异常学说、氧化应激学说、基因突变学说、金属离子代谢紊乱学说等,其中金属离子代谢紊乱学说是目前研究的一个重点。铁是人体内必不可少的微量元素,对脑的正常发育和生理功能的维持是十分重要的。当脑内缺乏铁时会导致中枢神经递质合成障碍和语言、运动平衡等行为学功能延迟发育[7]。当脑内铁超载时,异常增高的脑铁会通过以下几个方面促进AD的发生:①促进Aβ分泌; ②和Aβ结合,促进Aβ的聚集及纤维化; ③和过磷酸化的Tau蛋白结合,促进神经元纤维缠结形成; ④通过Fenton反应产生自由基,加剧神经元损伤。大量的临床和基础研究均显示,在AD时脑组织铁含量增高,且脑铁升高的部位与病变累及部位一致,如海马、皮层等铁水平出现异常的升高[8]。同时已有研究表明脑组织内铁含量升高程度与痴呆程度呈明显相关性[9]。以上研究证据表明,异常增高的脑铁参与了AD的病理过程,可能在AD发病机制中具有重要作用。因此,近些年铁转运相关蛋白与AD的关系是AD研究的热点问题,铁转运相关蛋白包括二价金属离子转运体1、膜铁转运蛋白1、膜铁转运辅助蛋白、肠细胞色素b、转铁蛋白受体2、铜蓝蛋白、血幼素、hepcidin等,其中hepcidin是近年来发现的重要铁调节激素,是维持细胞内正常铁代谢的重要金属转运蛋白,它精确调控铁吸收、铁储存和铁释放过程[10]。hepcidin是由25个氨基酸组成的多肽,主要在肝脏合成并成熟,随后分泌到血液中,转运到其主要靶器官,包括小肠、肝脏、骨髓细胞和巨噬细胞,控制这些器官的铁代谢活动[11-12]。血液中hepcidin浓度增加,将抑制小肠上皮细胞铁吸收蛋白的表达、进而抑制小肠铁吸收; 同时增加肝脏细胞,骨髓细胞和巨噬细胞对铁的摄取,进而增加铁储存和铁利用。通过这一hepcidin介导的途径,可有效缓解铁超载[13]。反之,hepcidin敲除或者浓度降低,铁的吸收会增加,而铁的储存和利用减少,造成铁超载[14]。因此,hepcidin是维持细胞内正常铁代谢的重要金属转运蛋白,在维持机体铁稳态中发挥着中心作用。
AD患者脑铁的异常积聚作为“内毒”的一种,在AD的发生发展中发挥重要作用,但目前AD患者脑铁升高的原因还不是十分清楚[15]。中医认为脑铁的异常积聚是由于肾虚精亏,导致元神受抑,不能驱毒外出,兼心肝脾衰弱,致使气血运行失常,不能使铁毒及时、有效地清除并停留于脑内,蕴积过多而致神机受损。这与现代医学发现的AD患者脑内某些铁代谢相关蛋白表达失控是相一致的。再者,AD患者肾功能衰退,促红细胞生成素(EPO)分泌不足,红细胞生成减少,以至于铁利用降低,造成机体储铁增加也是导致外周铁代谢失衡的关键。因此,淫羊藿、黄芪、葛根三药组方,具补肾健脾、生精养髓、益气养血、涤痰化瘀、调畅气机之功效,可扶正祛邪,使铁毒得以清除。
因此,淫羊藿、黄芪、葛粉有效组分复方可以有效上调APPswe/PS1dE9双转基因AD模型小鼠海马CA3区hepcidin的表达,从而减少APPswe/PS1dE9双转基因AD模型小鼠脑铁超载,该结果提示,淫羊藿、黄芪、葛根有效组分复方可以减少铁超载而对神经元起保护作用。
| [1] |
Guo C, Zhang Y X, Wang T, et al. Intranasal deferoxamine attenuates synapse loss via up-regulating the P38/HIF-1 pathway on the brain of APP/PS1 transgenic mice[J]. Front Aging Neurosci, 2015, 7(1): 104. |
| [2] |
Hadzhieva M, Kirches E, Mawrin C. Review: iron metabolism and the role of iron in neurodegenerative disorders[J]. Neuropathol Appl Neurobiol, 2014, 40(3): 240-57. doi:10.1111/nan.12096 |
| [3] |
Meadowcroft M D, Peters D G, Dewal R P, et al. The effect of iron in MRI and transverse relaxation of amyloid-beta plaques in Alzheimer's disease[J]. NMR Biomed, 2015, 28(3): 297-305. doi:10.1002/nbm.3247 |
| [4] |
Zhang Y, He M L. Deferoxamine enhances alternative activation of microglia and inhibits amyloid beta deposits in APP/PS1 mice[J]. Brain Res, 2017, 1677(1): 86-92. |
| [5] |
Dong X H, Gao W J, Kong W N, et al. Neuroprotective effect of the active components of three Chinese herbs on brain iron load in a mouse model of Alzheimer's disease[J]. Exp Ther Med, 2015, 9(4): 1319-27. doi:10.3892/etm.2015.2234 |
| [6] |
Xu J, Wang J, Wimo A, et al. The economic burden of dementia in china, 1990-2030: Implications for health policy[J]. Bull World Health Organ, 2017, 95(1): 18-26. doi:10.2471/BLT.15.167726 |
| [7] |
姜懿纳, 阳松威, 张欣, 等. 铁死亡的机制及其在神经疾病中的作用[J]. 中国药理学通报, 2018, 34(2): 166-70. Jiang Y N, Yang S W, Zhang X, et al. Mechanism of ferroptosis and its role in neurological diseases[J]. Chin Pharmacol Bull, 2018, 34(2): 166-70. doi:10.3969/j.issn.1001-1978.2018.02.005 |
| [8] |
Guo C, Wang P, Zhong M L, et al. Deferoxamine inhibits iron induced hippocampal tau phosphorylation in the Alzheimer transgenic mouse brain[J]. Neurochem Int, 2013, 62(2): 165-72. doi:10.1016/j.neuint.2012.12.005 |
| [9] |
Zhu W Z, Zhong W D, Wang W, et al. Quantitative MR phase-corrected imaging to investigate increased brain iron deposition of patients with Alzheimer disease[J]. Radiology, 2009, 253(2): 497-504. doi:10.1148/radiol.2532082324 |
| [10] |
Vela D. Hepcidin, an emerging and important player in brain iron homeostasis[J]. J Transl Med, 2018, 16(1): 25. |
| [11] |
Tajima S, Ikeda Y, Enomoto H, et al. Angiotensin II alters the expression of duodenal iron transporters, hepatic hepcidin, and body iron distribution in mice[J]. Eur J Nutr, 2015, 54(5): 709-19. doi:10.1007/s00394-014-0749-1 |
| [12] |
Pigeon C, Ilyin G, Courselaud B, et al. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload[J]. J Biol Chem, 2001, 276(11): 7811-9. doi:10.1074/jbc.M008923200 |
| [13] |
Ren F, Qian X H, Qian X L. Astragalus polysaccharide upregulates hepcidin and reduces iron overload in mice via activation of p38 mitogen-activated protein kinase[J]. Biochem Biophys Res Commun, 2016, 472(1): 163-8. doi:10.1016/j.bbrc.2016.02.088 |
| [14] |
Keel S B, Doty R, Liu L, et al. Evidence that the expression of transferrin receptor 1 on erythroid marrow cells mediates hepcidin suppression in the liver[J]. Exp Hematol, 2015, 43(6): 469-78.e6. doi:10.1016/j.exphem.2015.03.001 |
| [15] |
张瑜.淫羊藿、黄芪、葛根有效成分组方对阿尔茨海默病脑铁超载的干预作用及其机制研究[D].河北医科大学, 2016. Zhang Y. Effects of compound of Icariin, Astragalus, Radix Puerariaeon brain iron load of Alzheimer's disease and itsmechanisms[D]. Hebei Medical University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10089-1016146454.htm |

