

2. 湖北省咸宁市中心医院药学部, 湖北 咸宁 437100
2. Department of pharmacy, The central Hospital of Xianning, Xianning Hubei 437100, China
人胶质母细胞瘤是一种Ⅳ级星形细胞瘤,是最常见、最具侵袭性的脑肿瘤[1]。胶质母细胞瘤在40~70岁之间发生率较高,中位生存期为诊断后的12~16个月。胶质母细胞瘤是脑肿瘤死亡率最高的肿瘤,虽然有手术、放疗、化疗、基因治疗等多种治疗方法, 但因其侵袭性强、复发率高、位置特殊、预后差, 具有很高的病死率和致残率, 严重威胁着人类健康[2]。肿瘤细胞从原发肿瘤逃逸到转移部位是一个多步骤的过程,需要细胞黏附的丧失,并获得细胞的迁移和侵袭能力[3]。目前,治疗恶性胶质瘤成为肿瘤领域的重大挑战之一[4],因此,寻找有效的生物靶点,研发理想的治疗药物尤为迫切。
山楂叶总黄酮(hawthorn leaves flavonoids,HLF)是一种存在山楂叶中的黄酮类化合物,山楂叶为蔷薇科山楂属植物山里红或山楂的干燥叶[5],由于其资源丰富、价格低廉,具有广泛的药理作用,且低毒安全的特性,近年来倍受医药研究者的关注。目前,从山楂叶中分离出的黄酮类化合物已有60余种,黄酮类化合物具有抗炎、抗氧化、抗衰老、抗癌防癌等功效[6],具有重要的药用价值,成为近年来研究热点之一。现已明确HLF在降压降脂、抗动脉粥样硬化方面具有明显疗效,已应用于冠心病、心绞痛、高血压等心血管疾病的治疗[7],但HLF对恶性胶质瘤治疗作用的相关研究报道较少。因此,本实验以胶质瘤U87细胞为研究对象,探讨HLF对U87细胞增殖、黏附、迁移和侵袭的影响,期望可以更好地利用山楂叶这一丰富低廉的药用资源,为今后HLF的抗肿瘤临床应用及进一步合理开发其药用价值提供依据。
1 材料与方法 1.1 药物与试剂HLF(含量93.5%),购于山东临沂爱康药业。DMEM高糖培养基、Transwell小室,购自HyClone公司;胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶,购自Gibco公司;Matrigel胶,购自Corning公司;二甲基亚砜(dimethyl-sulfoxid, DMSO),购自Sigma公司;CCK-8试剂盒,购自大连美仑生物技术有限公司。
1.2 仪器CO2培养箱(ESCO公司);超净工作台、高温灭菌锅(Biobase公司);酶标仪(基因有限公司);倒置显微镜(Olympus公司);Western电泳仪(Bio-Rad公司);水平摇床(海门市其林贝尔仪器制造有限公司);低温高速离心机(湘仪离心机仪器有限公司)。
1.3 细胞培养U87细胞购自中科院细胞库。将U87细胞复苏后,接种于T25细胞培养瓶中,使用DMEM高糖培养基培养,置37 ℃、5% CO2的培养箱中,待细胞长至90%以上,使用0.25%胰酶消化后传代培养,取对数生长期细胞进行实验。
1.4 药物配制及分组称取HLF 100 mg,溶于1 mL DMSO溶液中,配成浓度为100 g·L-1的母液备用,采用DMEM培养基将药物母液稀释成相应浓度。
1.5 CCK-8法检测细胞增殖能力将已消化的细胞计数,并调整细胞浓度为5×107个·L-1,然后将细胞悬液加入相对应的96孔板内,每孔100 μL细胞悬液,每个浓度设5个复孔。将96孔板在培养箱培养过夜,弃去原培养基,加入含有相对应药物浓度的培养基100 μL于96孔板内,放置培养箱内培养24 h。每孔分别加入10 μL CCK-8溶液,置于培养箱内2 h后,使用酶标仪在450 nm处测定吸光度。细胞存活率/%=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.6 划痕实验检测细胞迁移能力将U87细胞消化后均匀铺在6孔板内,待细胞长至95%左右时,用黄枪头沿每孔的顶端和底部画一条直线,将原培养基更换为含不同HLF浓度的培养基,并放置培养箱内8 h。之后弃去培养基,PBS洗3次,4%多聚甲醛固定7 min,PBS洗3次,洗去除残留固定液,使用光学显微镜拍照。细胞迁移率=(初始细胞间隙-实验组细胞间隙)/(初始细胞间隙-对照组细胞间隙)×100%,设定对照组迁移率为1。
1.7 Transwell法检测细胞侵袭能力细胞饥饿24 h,将Matrigel胶与培养基按照1 :2的比例混合,每个小室加入30 μL,铺平且无气泡,放置培养箱内40 min,使其凝固。使用无血清培养基调整U87细胞密度为6×108个·L-1,并取100 μL加入上室,继续加入100 μL含不同浓度HLF的无血清培养基,下室加入600 μL相应浓度HLF的含血清培养基。放置培养箱内培养24 h后取出,使用PBS清洗后,加入4%多聚甲醛使其固定10 min,使用棉签擦去未穿过小室的细胞,加入0.5%结晶紫溶液染色10 min,使用PBS洗去多余培养基,待干燥后拍照。细胞侵袭率=实验组细胞数/对照组细胞数×100%,设定对照组侵袭率为1。
1.8 黏附实验检测细胞黏附能力使用培养基按2 :1稀释Matrigel,并以40 μL每孔加入96孔板内,放置培养箱内1 h,吸取未凝固的基质胶。将不同浓度的HLF预处理24 h的U87细胞消化,并调整密度为108个·L-1,以100 μL每孔加至96孔板内,放入培养箱90 min。弃去培养基,PBS洗3次,4%多聚甲醛固定7 min,0.1%结晶紫染色10 min,PBS洗3次洗去残留结晶紫,使用光学显微镜拍照。每组拍照结果进行细胞计数,细胞黏附率=实验组细胞数/对照组细胞数×100%,设定对照组黏附率为1。
1.9 克隆形成实验检测细胞克隆形成能力细胞消化后,调整细胞密度为1.8×107个·L-1,将U87细胞按100 μL每孔加至6孔板内,放入培养箱内过夜。将原培养基更换为含不同浓度HLF的培养基,放置培养箱内7 d。弃去培养基,PBS洗3次,4%多聚甲醛固定7 min,0.1%结晶紫染色10 min,PBS洗3次去除残留结晶紫,使用光学显微镜拍照。
1.10 统计学方法所有数据均用SPSS 17.0软件进行统计分析,用x ± s表示,组间比较多用F检验,两组比较用LSD法。
2 结果 2.1 HLF对U87细胞的增殖抑制作用Fig 1结果显示,U87细胞在不同浓度的HLF作用24 h后,细胞增殖能力明显下降,与对照组相比,HLF(25、50、100 mg·L-1)组的细胞存活率分别为75.3%、63.9%(P < 0.01)、50.5%(P < 0.01),并随着药物浓度的增加,细胞活力明显降低。
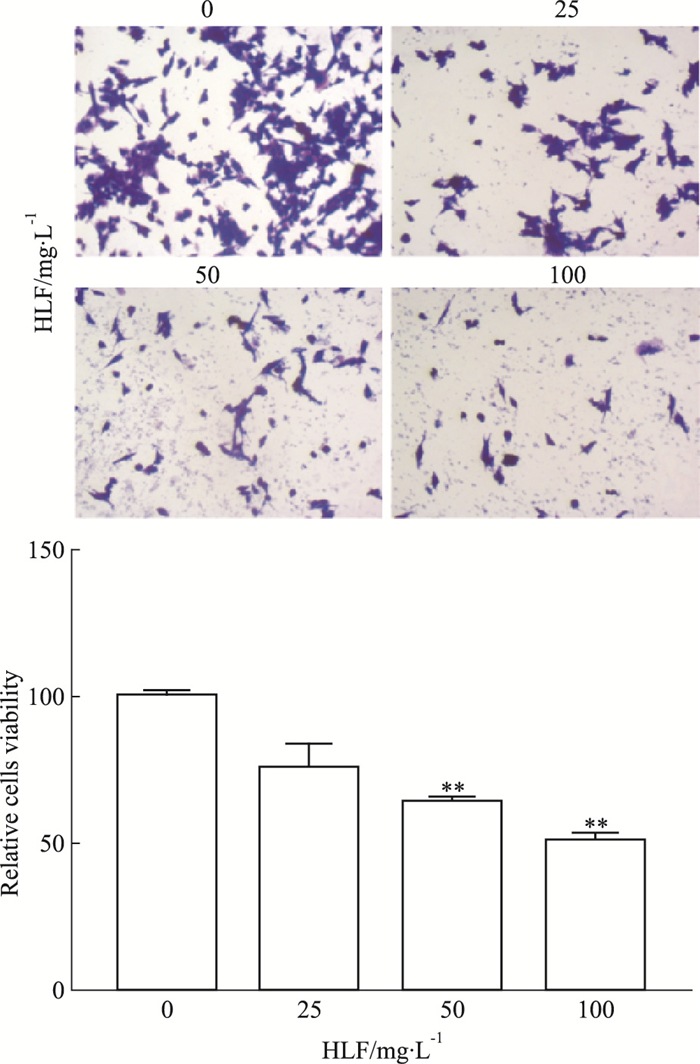
|
| Fig 1 Effects of different concentrations of HLF on proliferation of U87 cells(x ± s, n=3) **P < 0.01 vs control(0 mg·L-1) |
Fig 2的划痕实验结果显示,HLF处理8 h后,U87细胞的迁移能力明显减弱,与对照组相比,HLF(25、50、100 mg·L-1)组的迁移细胞比率分别为73.3%、62.0%、52.7%(P<0.05,P<0.01)。提示HLF能明显降低U87细胞的迁移能力,且HLF对其迁移能力的抑制具有一定的浓度依赖性。

|
| Fig 2 Effect of HLF on migration ability of U87 cells(x ± s, n=3) *P < 0.05, **P < 0.01 vs control(0 mg·L-1) |
Fig 3结果显示,HLF处理24 h后,U87细胞侵袭能力明显减弱,与对照组相比,HLF(25、50 mg·L-1)组的侵袭细胞比率分别为72.4%、48.9%(P<0.01)。提示HLF能明显降低U87细胞的侵袭能力。
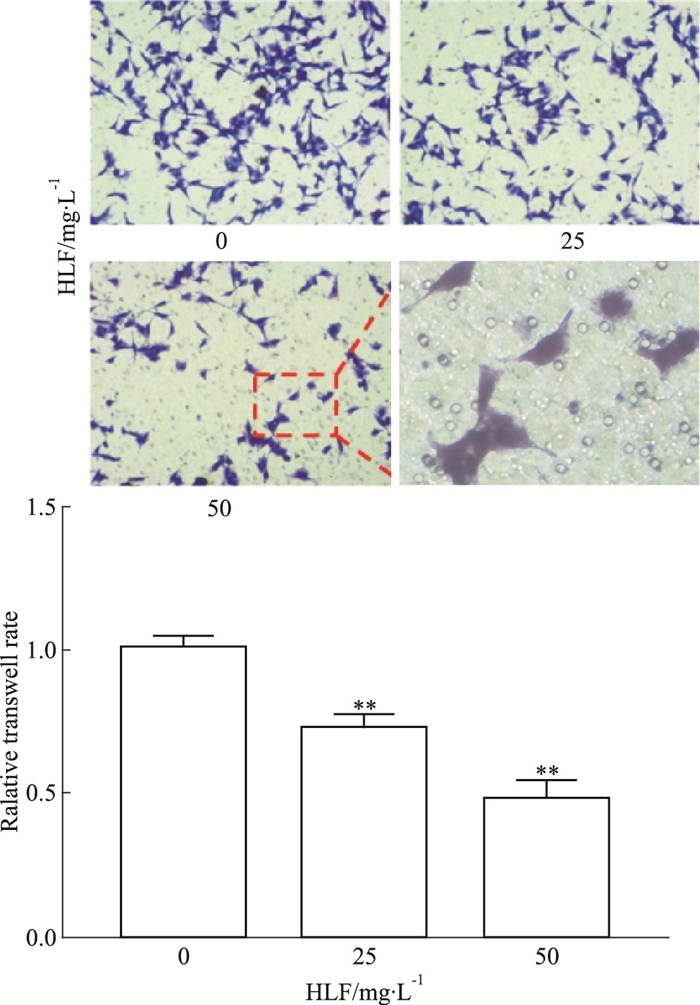
|
| Fig 3 Effect of HLF on invasion ability of U87(x ± s, n=3) **P < 0.01 vs control(0 mg·L-1) |
Fig 4结果显示,HLF处理24 h后,U87细胞黏附能力明显减弱,与对照组相比,HLF(25、50、100 mg·L-1)组均明显抑制了U87细胞与基质黏附的能力,抑制率分别为19.5%、40.9%、63.6%(P<0.05,P<0.01)。
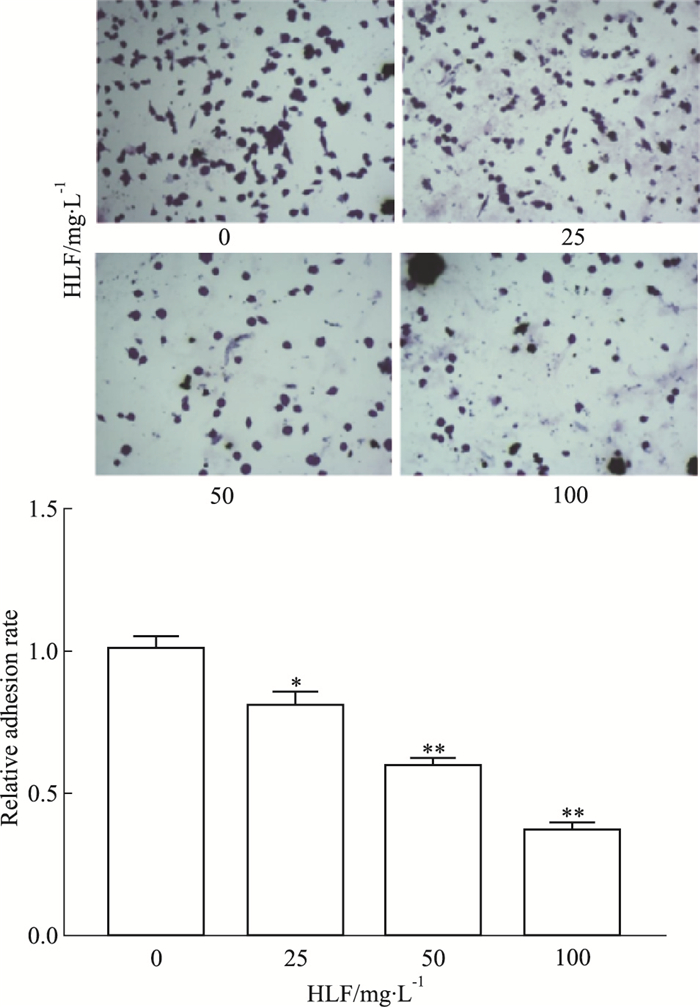
|
| Fig 4 Effect of HLF on adhesion ability of U87(x ± s, n=3) *P < 0.05, **P < 0.01 vs control(0 mg·L-1) |
Fig 5的克隆形成实验结果显示,HLF处理7 d后,细胞克隆能力明显减弱,与对照组比较, 随着HLF浓度的升高,U87细胞的克隆形成率逐渐降低,呈浓度依赖性。
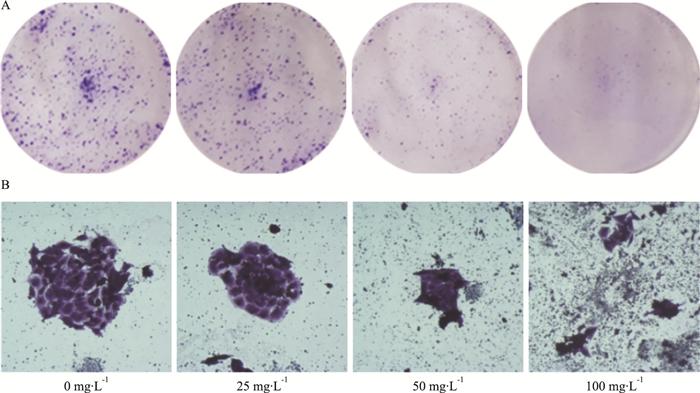
|
| Fig 5 Effect of HLF on cell clonality of U87 cells(x ± s, n=3) A: U87 plate clone macrograph; B: U87 plate clone micrograph. |
山楂叶在我国资源丰富,具有易得、低毒性的特点。HLF是山楂叶提取物中一系列黄酮类化合物的总称,如芦丁、槲皮素、金丝桃苷、葡荆牡黄酮等[8-9],其具有抗动脉粥样硬化、降血压、降血脂、抗氧化应激、抗炎、抗心肌缺血缺氧、抗血管性痴呆、抗细胞凋亡、抗肿瘤等药理作用[10]。胶质瘤细胞U87细胞是人类最常见、最具侵袭性的脑肿瘤,如何有效抑制恶性脑胶质瘤的复发、黏附、侵袭及迁移已成为目前研究的热点,HLF抑制肿瘤细胞的研究,将为中药抗肿瘤研究及进一步开发提供新的思路。
本研究CCK-8法检测HLF作用后U87细胞存活率的结果显示,HLF(25、50、100 mg·L-1)组细胞存活率均降低,当HLF浓度>50 mg·L-1时具有统计学意义,且这种作用随着其浓度的增加而增强。倒置显微镜观察结果显示,正常对照组细胞大而饱满,轮廓清楚,细胞间接触紧密。药物作用U87细胞24 h时,随着HLF浓度增加,细胞数量明显减少,细胞的体积变小,细胞间距变大,细胞出现皱缩、脱落,贴壁细胞轮廓模糊。CCK-8实验结果证明,HLF可以抑制U87细胞的增殖。迁移是肿瘤细胞转移过程中必不可少的环节之一,划痕实验结果显示,HLF作用U87细胞后,随着HLF浓度的增加,与对照组相比,U87细胞迁移比率明显下降,提示HLF可以抑制U87细胞的迁移能力,具有一定的浓度依赖性。肿瘤细胞与母体瘤分离,穿越血管壁,侵袭周边正常组织时,需要一定的侵袭能力,高侵袭的肿瘤细胞通常具有较强的运动性。Transwell体外侵袭迁移模型模拟在体外U87细胞的侵袭状况,结果显示,随着HLF浓度的增加,与对照组相比,U87细胞侵袭数目均明显下降,提示HLF能够有效抑制U87细胞的侵袭。细胞的黏附性在维持细胞外形、调节细胞分裂、运动等功能中起十分重要的作用,黏附是肿瘤细胞侵袭的始动步骤。黏附实验结果显示,HLF作用U87细胞24 h后,随着HLF浓度的增加,与对照组相比,U87细胞黏附能力明显减弱,提示HLF可以抑制U87细胞与基质黏附的能力。
综上所述,HLF对胶质瘤U87细胞的生长增殖、迁移、侵袭及黏附能力有一定的抑制作用,但其作用机制尚不清楚。现已公认,可以通过ERK和Akt信号通路抑制肿瘤细胞的增殖、迁移、侵袭等功能[11-12],但HLF是否通过该信号通路对U87细胞产生抑制作用,还有待我们进一步探讨和研究。
| [1] |
González-Orozco J C, Hansberg-Pastor V, Valadez-Cosmes P, et al. Activation of membrane progesterone receptor-alpha increases proliferation, migration, and invasion of human glioblastoma cells[J]. Mol Cell Endocrinol, 2018, 477: 81-9. doi:10.1016/j.mce.2018.06.004 |
| [2] |
王艳华, 楚建杰, 李子敏, 等. 人U87-MG脑胶质瘤细胞裸鼠原位移植模型的建立[J]. 中国药理学通报, 2018, 34(5): 735-9. Wang Y H, Chu J J, Li Z M, et al. Establishment of orthotopic implantation model of human U87-MG brain glioma cell line in nude mice[J]. Chin Pharmacol Bull, 2018, 34(5): 735-9. doi:10.3969/j.issn.1001-1978.2018.05.028 |
| [3] |
Zhang T, Chen Y, Li J, et al. Antitumor action of a novel histone deacetylase inhibitor, YF479, in breast cancer[J]. Neoplasia, 2014, 16(8): 665-77. doi:10.1016/j.neo.2014.07.009 |
| [4] |
杨秀伟, 谢靖, 钟凤, 等. 左卡尼汀抑制NF-κB敏化TRAIL诱导神经胶质瘤细胞凋亡[J]. 中国药理学通报, 2016, 32(5): 664-70. Yang X W, Xie J, Zhong F, et al. L-carnitine sensitizes human glioblastoma cells to TRAIL-induced apoptosis[J]. Chin Pharmacol Bull, 2016, 32(5): 664-70. doi:10.3969/j.issn.1001-1978.2016.05.014 |
| [5] |
黎运呈, 王艳, 王秋景, 等. 山楂叶总黄酮对非酒精性脂肪性肝病细胞病理及血脂影响的实验研究[J]. 中西医结合肝病杂志, 2018, 28(2): 108-10. Li Y C, Wang Y, Wang Q J, et al. Experimental study on the effects of Hawthorn leaves flavonoids on the pathology and blood lipid of NAFLD cells[J]. Chin J Integr Tradit West Med Liver Dis, 2018, 28(2): 108-10. |
| [6] |
徐学君, 张秀芳, 徐德琴, 等. 黄酮类化合物调节血脂作用的研究进展[J]. 中国药房, 2016, 27(1): 114-7. Xu X J, Zhang X F, Xu D Q, et al. Progress of flavonoids in regulating lipids[J]. Chin Pharm, 2016, 27(1): 114-7. |
| [7] |
闵清, 白育庭, 刘晶, 等. 山楂叶总黄酮对大鼠血管环的作用及其机制探讨[J]. 中国药理学通报, 2011, 27(4): 585-6. Min Q, Bai Y T, Liu J, et al. Effects and mechanisms of hawthorn leaf flavonoids on isolated rat thoracic aorta[J]. Chin Pharmacol Bull, 2011, 27(4): 585-6. doi:10.3969/j.issn.1001-1978.2011.04.035 |
| [8] |
李劲松, 徐颖, 孙涛. 山楂叶总黄酮药理作用研究进展[J]. 中药与临床, 2017, 8(6): 64-5. Li J S, Xu Y, Sun T. Advances in studies of pharmacological effects of Hawthorn leaves flavonoids[J]. Pharm Clin Chin Mater Med, 2017, 8(6): 64-5. |
| [9] |
杨群, 徐英楠, 张锴, 等. 基于相似性分析山楂叶总黄酮组分平衡溶解度和油水分配系数的研究[J]. 中草药, 2017, 48(14): 2883-8. Yang Q, Xu Y N, Zhang K, et al. Research on equilibrium solubility and apparent oil/water partition coefficient of flavonoids components in Hawthorn leaves by similarity analysis[J]. Chin Tradit Herb Drugs, 2017, 48(14): 2883-8. |
| [10] |
张敏丽, 闵清. 山楂叶总黄酮的药理作用研究进展[J]. 湖北科技学院学报(医学版), 2015, 29(2): 182-4. Zhang M L, Min Q. Progress in pharmacological action of total flavonoids from Hawthorn leaves[J]. J Hubei Univ Sci Technol(Med Sci), 2015, 29(2): 182-4. |
| [11] |
Lim W, Song G. Inhibitory effects of delphinidin on the proliferation of ovarian cancer cells via PI3K/AKT and ERK 1/2 MAPK signal transduction[J]. Oncol Lett, 2017, 14(1): 810-8. doi:10.3892/ol.2017.6232 |
| [12] |
Du Z D, Hu L T, Zhao G Q, et al. Protein tyrosine phosphatase 1B regulates migration of ARPE-19 cells through EGFR/ERK signaling pathway[J]. Int J Ophthalmol, 2015, 8(5): 891. |

