


2. 北京大学药学院化学生物学系,北京 100191;
3. 北京大学医药卫生分析中心,北京 100191
 ,
WANG Xin2,
LIU Qin1,
WANG Ding1,
DU Xiao-lei2,
LI Run-tao2,
JIANG Yi-min3,
YE Jia1
,
WANG Xin2,
LIU Qin1,
WANG Ding1,
DU Xiao-lei2,
LI Run-tao2,
JIANG Yi-min3,
YE Jia1

2. Dept of Chemical Biology, School of Pharmaceutical Sciences, Beijing 100191, China;
3. Dept of Medical and Healthy Analysis Center, Peking University, Beijing 100191, China
神经病理性疼痛是由躯体感觉神经系统的损伤或疾病直接造成的疼痛,其基本特征为自发性疼痛、触摸痛及痛觉过敏。流行病学研究显示,神经病理性疼痛的患病率约在6.9%~10%[1]。全世界数以百万计的患者遭受神经病理性疼痛的痛苦,严重影响患者的生活质量。
螺环哌嗪季铵盐化合物是以季铵盐类烟碱受体激动剂1,1二甲基4苯基哌嗪碘化物(1,1-dimethy1-4-phenylpiperazineiodide, DMPP)和抗肿瘤药物环磷酰胺为基础,进行结构改造而成的一类具有知识产权的新型化合物,研究显示[2-3],其有明显的缓解急性疼痛和炎症作用。在此基础上,对有效化合物的结构进一步优化、改进,得到螺环哌嗪季铵盐化合物DXL-A-22(Fig 1)。目前尚未有关于螺环哌嗪季铵盐化合物DXL-A-22抗神经病理性疼痛作用及机制的报道。本文拟研究化合物DXL-A-22抗神经病理性疼痛作用,探讨其可能的抗神经病理性疼痛作用机制,为研发高效低毒的抗神经病理性疼痛药物提供实验依据。
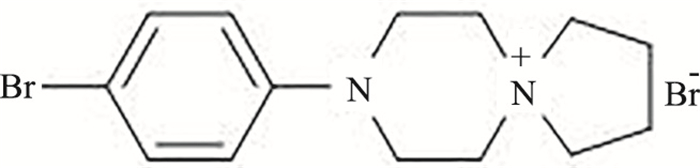
|
| Fig 1 Chemical structure of spirocyclopiperazinium salt compound DXL-A-22 |
SD大鼠,体质量(200~250) g,♀♂各半,由北京大学实验动物部提供,许可证号:SCXK(京)2016-0010;动物饲养于标准环境:温度(22±0.5)℃,相对湿度(55±5)%,人工光照,12 h明暗周期,自由饮食、饮水。所有实验符合国际疼痛研究协会研究与伦理问题委员会的标准,均采用盲法测定。
1.2 药物与试剂螺环哌嗪季铵盐化合物DXL-A-22(纯度95%以上,由李润涛教授课题组合成提供);加巴喷丁(江苏恒瑞医药股份有限公司,批号:20141028);RIPA裂解液(P0013B,北京碧云天生物科技有限公司);蛋白酶抑制剂(P1265-1)、蛋白磷酸酶抑制剂(P1260-1)、BCA蛋白检测试剂盒(P1511-1),均购自北京普利莱基因技术有限公司;ECL发光液(ZS-20480)、β-actin抗体(TA-09),购自北京中杉金桥生物科技有限公司;磷酸化钙调蛋白激酶Ⅱα(phospho-calcium/calmodulin-dependent protein kinase Ⅱα,p-CaMKⅡα),(ab124880)、CaMKⅡα(ab92332),购自美国Abcam公司;抗体磷酸化环磷酸腺苷反应元件结合蛋白(phospho-cAMP response element-binding protein,p-CREB,9198S)、CREB(9197S)、磷酸化JAK2(phospho-Janus kinase 2,p-JAK2,3776S)、JAK2(3230S)、磷酸化信号传导及转录激活因子3(phospho-signal transducer and activator of transcription 3,p-STAT3,9145S)、STAT3(4904S),均购自美国Cell Signaling Technology;TRIzol试剂(MN012)、cDNA反转录试剂盒(4368814)、SYBR Select Master Mix(4472908),均购自美国Invitrogen公司;Go Taq qPCR Master Mix(A6001,美国Promega)。
1.3 仪器IITC 2390型Von Frey电子测痛仪(美国IITC公司);LE 7406热痛反应测量仪(西班牙Panlab公司);3K15离心机(美国Sigma公司);电泳仪、电转仪、iMark酶标仪、ChemiDoc XRS System高灵敏化学发光凝胶成像分析系统(美国Bio-Rad公司);9700 PCR扩增仪(美国Applied Biosystem公司);MX3005P荧光实时定量分析系统(美国安捷伦公司)。
1.4 坐骨神经慢性压迫性损伤(chronic constriction injury,CCI)模型坐骨神经CCI模型参考Bennett等[4]1988年描述的模型稍作改动。具体操作如下:大鼠用戊巴比妥钠(60 mg·kg-1,i.p.)麻醉后,大腿右边手术部位去毛,俯卧位固定,沿大鼠右后肢股骨中部纵向切口,钝性分离肌肉,暴露坐骨神经,在坐骨神经分叉处近端用4-0丝线松结扎4次,每次间隔约1 mm,松紧程度以观察到右后腿稍微抖动为宜。结扎后依次缝合肌肉和皮肤,假手术组只暴露坐骨神经,但不结扎。通过观察术后大鼠术侧后肢是否出现足趾并拢,轻微外翻,经常处于腾空状态,是否有舔、咬或激烈抖动手术侧足跖,以及测定大鼠机械刺激缩足反应阈值(mechanical withdrawal threshold,MWT)和热刺激缩足潜伏期(paw withdrawal latency,PWL),判断造模是否成功。
术前测定大鼠机械刺激缩足反应阈值和热刺激缩足潜伏期,以此分组,每组8只:假手术组(双蒸水,distilled water,DDW,i.g),溶媒组(DDW,i.g.),DXL-A-22组(2、1、0.5 mg·kg-1,i.g.)和加巴喷丁组(gabapetin,100 mg·kg-1,i.g.),术后d 1给药前测痛阈,剔除模型异常的动物,确认造模成功后开始给药[5]。从术后d 1开始每天灌胃给予大鼠DDW,DXL-A-22或加巴喷丁。阳性对照加巴喷丁是目前临床常用的治疗神经病理性疼痛的药物,同时也是国内外文献常用的阳性对照药物,剂量参考国内外相关文献,并通过预实验确认[6]。
1.4.1 大鼠MWT的测定大鼠MWT用Von Frey电子测痛仪测定。术前1 d和术后1、3、5、7、9、11、14 d灌胃给予DDW、DXL-A-22或加巴喷丁后2 h测定。将大鼠置于透明有机玻璃箱(底部是空隙20 mm2的铁丝网)中适应环境30 min,待大鼠无探索动作后,用Von Frey电子测痛仪探针刺激大鼠术侧足跖位置,测痛仪自动记录引起大鼠缩足反应的最大作用力即MWT。大鼠机械刺激痛阈提高率%(the percentage of pain threshold elevation,PTE%)用下列公式计算:PTE/%=[(实验组MWT-溶媒组MWT)/溶媒组MWT]×100。
1.4.2 大鼠PWL的测定用热板法测定大鼠PWL。术前1 d和术后1、3、5、7、9、11、14 d灌胃给予DDW、DXL-A-22或加巴喷丁后2 h测定。热板温度为50.5 ℃,从大鼠置于热板仪开始计时,到大鼠出现抖、舔足反应停止计时,此时间即为大鼠PWL。热板切断时间为14 s,最大镇痛百分率%(the percentage of maximal possible effect,MPE%)用下列公式计算:MPE/%=[(实验组PWL-溶媒组PWL)/(切断时间-溶媒组PWL)]×100。
1.5 Western blot大鼠随机分为3组:假手术组(DDW,i.g)、溶媒组(DDW,i.g.)和DXL-A-22组(2 mg·kg-1,i.g.),每组6只。坐骨神经结扎后,每天给予DDW或化合物DXL-A-22。CCI术后d 7,给予DDW或化合物DXL-A-22 2 h后,大鼠用乙醚麻醉,脱颈处死,提取损伤侧L4、L5背根神经节(dorsal root ganglion,DRG)。提取的DRG组织用9倍体积的RIPA裂解液裂解,研磨后的溶解产物于4 ℃、12 000×g离心5 min,取上清。用BCA蛋白检测试剂盒测定蛋白浓度。上清加loading buffer,95 ℃高温变性5 min,分装保存于-80 ℃备用。采用SDS-PAGE胶分离蛋白样品,恒压电泳。以湿转法将蛋白转至PVDF膜,恒流电转。转膜后将目的蛋白条带用50 g·L-1脱脂奶粉封闭,摇床室温1 h,然后孵育一抗p-CaMKⅡα、CaMKⅡα、p-CREB、CREB、p-JAK2、JAK2、p-STAT3、STAT3、β-actin,摇床4 ℃孵育过夜。PVDF膜在TBST封闭洗涤液中洗3次,每次10 min。用辣根过氧化酶标记的二抗室温孵育1 h,TBST封闭洗涤液洗3次,每次10 min。加ECL发光剂,用高灵敏化学发光凝胶成像分析系统检测。以Quantity One软件计算目的蛋白条带的灰度值。化合物DXL-A-22对蛋白表达的抑制率%用下式计算:抑制率/%=[(溶媒组蛋白表达量-实验组蛋白表达量)/溶媒组蛋白表达量]×100。
1.6 qPCR动物分组与组织提取同“1.5”。取DRG和脊髓加TRIzol试剂,充分研磨,匀浆后转至EP管,室温5 min。加氯仿,震荡15 s,颠倒混匀10下,充分混匀后,室温放置3 min,4 ℃、12 000 r·min-1离心15 min。取上层水相于EP管中,加异丙醇,颠倒混匀,室温10 min,4 ℃、12 000 r·min-1离心10 min。弃上清,得白色沉淀。加乙醇,吹打混匀,4 ℃、7 500×g离心5 min。弃上清,重复上一步骤。得白色沉淀,干燥10 min,加无核酸酶的水,金属浴,60 ℃,15 min,即得mRNA溶液。用紫外分光光度计法测溶液在260 nm处的吸光度,得mRNA溶液浓度。根据mRNA浓度,取2 μg mRNA。cDNA的合成使用cDNA反转录试剂盒,通过PCR扩增仪完成。反转录条件:25 ℃,10 min;37 ℃,120 min;85 ℃,5 min。得cDNA分装保存于-20 ℃备用。实时定量PCR通过荧光实时定量分析系统完成反应过程。实时定量PCR反应条件为:50 ℃,2 min;95 ℃,2 min;(95 ℃,15 s;58 ℃,15 s;72 ℃,1 min)40个循环。引物序列见Tab 1。通过循环扩增数(2-ΔΔCT)方法计算。化合物DXL-A-22对TNF-α、c-Fos mRNA表达的抑制率按下式计算:抑制率/%=[(溶媒组2-ΔΔCT值-实验组2-ΔΔCT值)/溶媒组2-ΔΔCT值]×100。
| Gene | Primer |
| TNF-α | Forward:5’- GCATGATCCGAGATGTGGAA-3’ |
| Reverse:5’- AGACACCGCCTGGAGTTCTG-3’ | |
| c-Fos | Forward:5’-CCCGTAGACCTAGGGAGGAC-3; |
| Reverse:5’-CAATACACTCCATGCGGTTG-3’ | |
| GAPDH | Forward:5’- AATGGGAGTTGCTGTTGAAG-3’ |
| Reverse:5’- CTGGAGAAACCTGCCAAGTA-3’ |
急性毒性试验根据经济合作和发展组织(Organization for Economic Cooperation and Development,OECD)指导方案第423条建立[7]。小鼠(n=10)灌胃给予化合物DXL-A-22(1 000 mg·kg-1,i.g.),观察小鼠在72 h内(每3 h观察1次)的行为,自主活动,任何致命性,杀伤力的状态或死亡现象,共观察14 d。
1.8 统计学处理实验结果均以x±s表示。用SPSS 22.0软件进行分析,MWT和PWL测定实验采用重复测量的方差分析;实验中各组间因子的比较采用单因素方差分析。
2 结果 2.1 化合物DXL-A-22抗大鼠神经病理性疼痛作用 2.1.1 化合物DXL-A-22对CCI大鼠MWT的影响如Fig 2所示,坐骨神经结扎术后1~14 d,溶媒组大鼠术侧MWT与假手术组比较明显降低(P < 0.01)。化合物DXL-A-22(2、1、0.5 mg·kg-1,i.g.)剂量依赖性提高MWT,与溶媒组比较差异有显著性(P < 0.05,P < 0.01)。术后1、3、5、7、9、11、14 d,DXL-A-22大剂量组痛阈提高率(PTE%)分别为58%、80%、95%、108%、91%、95%和97%,中剂量组PTE%分别为40%、59%、69%、86%、63%、60%和68%,小剂量组PTE%分别为35%、41%、57%、71%、54%、53%和58%,阳性对照加巴喷丁(100 mg·kg-1,i.g.)PTE%分别为66%、83%、98%、118%、95%、96%和103%。大剂量化合物DXL-A-22的痛阈提高率与加巴喷丁(100 mg·kg-1,i.g.)比较差异无显著性(P>0.05)。
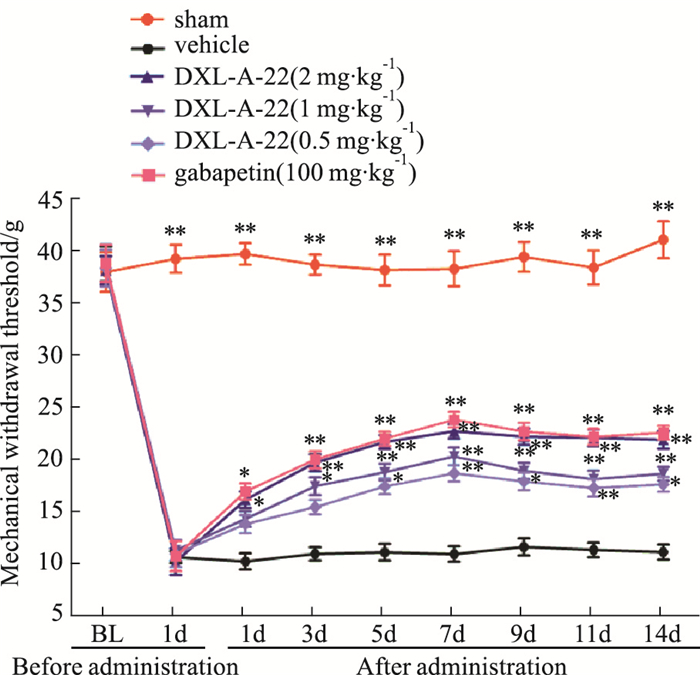
|
| Fig 2 Effect of DXL-A-22 on mechanical withdrawal threshold(x±s, n=8) *P < 0.05, **P < 0.01 vs vehicle group |
如Fig 3所示,坐骨神经结扎术后1~14 d,溶媒组大鼠热刺激缩足潜伏期(PWL)与假手术组比较明显降低(P < 0.01)。化合物DXL-A-22(2,1,0.5 mg·kg-1,i.g.)剂量依赖性提高大鼠PWL,与溶媒组比较有显著性差异(P < 0.05,P < 0.01)。术后1、3、5、7、9、11、14 d,DXL-A-22大剂量组最大镇痛百分率(MPE%)分别为38%、57%、62%、77%、68%、63%和65%,中剂量组MPE%分别为29%、44%、47%、56%、54%、53%和50%,小剂量组MPE%分别为24%、38%、40%、43%、42%、39%和38%,阳性对照加巴喷丁(100 mg·kg-1,i.g.)最大镇痛百分率分别为41%、59%、65%、82%、75%、78%和79%。大剂量化合物DXL-A-22的最大镇痛百分率与加巴喷丁(100 mg·kg-1,i.g.)比较差异无显著性(P>0.05)。
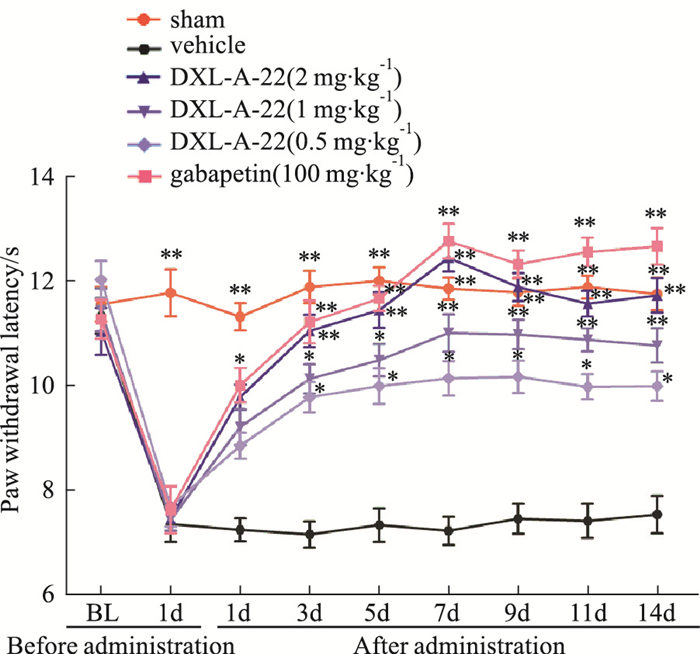
|
| Fig 3 Effect of DXL-A-22 on paw withdrawal latency(x±s, n=8) *P < 0.05, **P < 0.01 vs vehicle group |
如Fig 4所示,坐骨神经结扎术引起溶媒组大鼠DRG中p-CaMKⅡα和p-CREB蛋白表达明显增加,与假手术组比较差异有显著性(P < 0.05,P < 0.01)。术后次日连续给予化合物DXL-A-22(2 mg·kg-1,i.g.)7 d,p-CaMKⅡα和p-CREB蛋白表达与溶媒组比较明显降低(P < 0.05),抑制率分别为37%和48%,与假手术组比较差异无显著性(P>0.05)。各组间CaMKⅡα、CREB蛋白表达差异无显著性(P>0.05)。
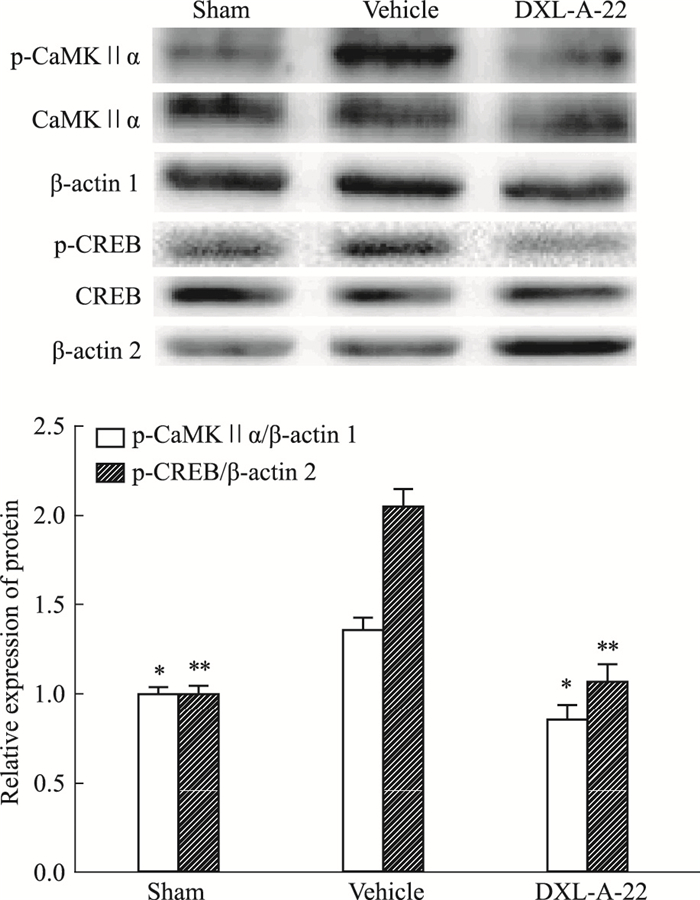
|
| Fig 4 Effect of DXL-A-22 on expression of pCaMKⅡα and pCREB in DRG(x±s, n=8) *P < 0.05, **P < 0.01 vs vehicle group |
如Fig 5所示,坐骨神经结扎术后,溶媒组大鼠DRG中p-JAK2和p-STAT3蛋白表达明显升高,与假手术组比较差异有显著性(P < 0.05, P < 0.01)。连续给予化合物DXL-A-22(2 mg·kg-1,i.g.)7 d,明显降低DRG中p-JAK2和p-STAT3蛋白表达(P < 0.05),抑制率分别为35%和58%, 与假手术组比较差异无显著性(P < 0.05)。各组间JAK2、STAT3蛋白表达保持稳定(P < 0.05)。
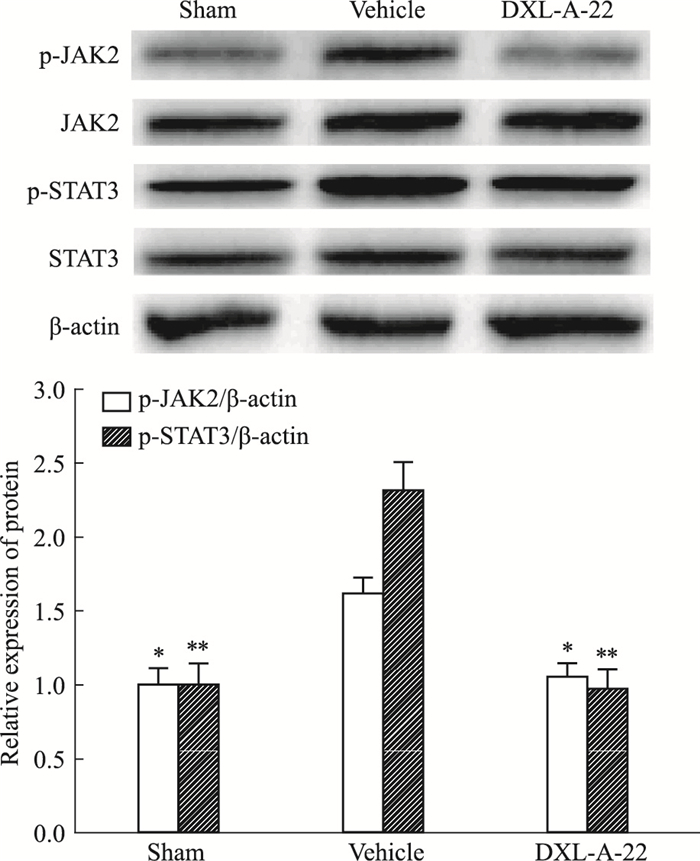
|
| Fig 5 Effect of DXL-A-22 on expression of pJAK2 and pSTAT3 in DRG(x±s, n=8) *P < 0.05, **P < 0.01 vs vehicle group |
如Fig 6所示,CCI术后,溶媒组大鼠DRG和脊髓TNF-α、c-Fos mRNA表达明显增加,与假手术组比较差异有显著性(P < 0.01)。给予化合物DXL-A-22(2 mg·kg-1,i.g.)7 d可明显降低TNF-α、c-Fos mRNA表达(P < 0.01),在DRG的抑制率分别为39%和32%,在脊髓的抑制率分别为47%和72%,与假手术组比较差异无显著性(P>0.05)。
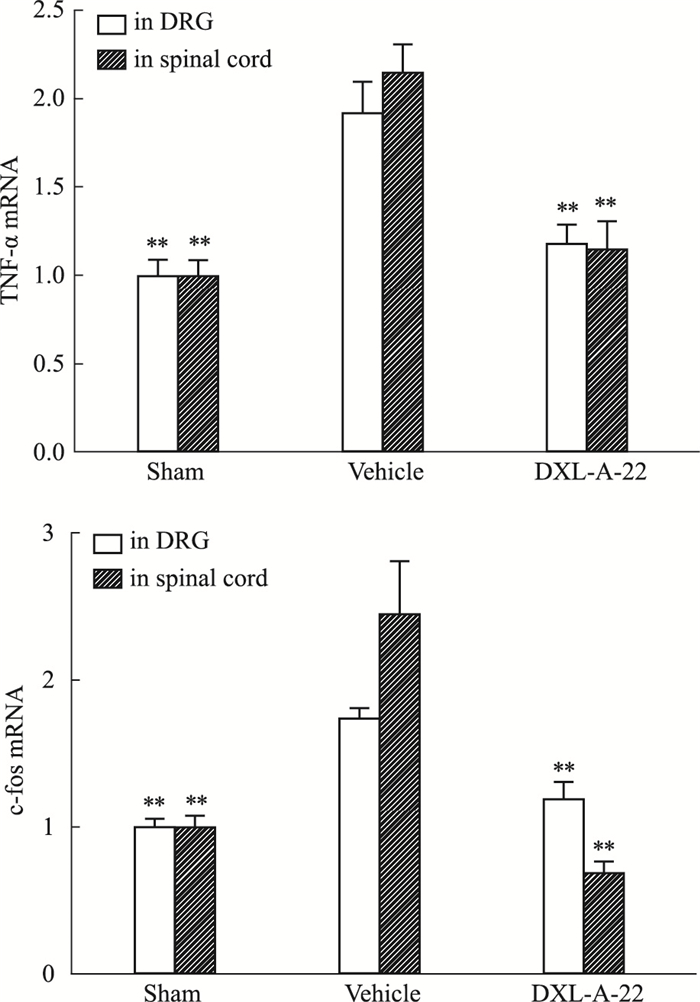
|
| Fig 6 Effect of DXL-A-22 on expression of TNF-α and c-fos mRNA in DRG and spinal cord(x±s, n=8) **P < 0.01 vs vehicle group |
小鼠灌胃给予化合物DXL-A-22(1 000 mg·kg-1,相当于小鼠剂量的1 000倍)后,72 h内,其行为和自主活动正常,观察的14 d内没有任何死亡或其他致命性损伤现象。
3 讨论神经病理性疼痛是临床上最常见的慢性疼痛,由疾病或躯体感觉系统的损伤引起。神经病理性疼痛的治疗是医学上公认的难题。治疗神经病理性疼痛的药物主要包括抗惊厥药(加巴喷丁、普瑞巴林)、抗抑郁药(阿米替林)、阿片类镇痛药(吗啡)、NMDA受体拮抗剂(氯胺酮)及非甾体抗炎镇痛药物(氟比洛芬酯)等,这些药物治疗效果并不明显,临床上仅有不超过一半的病人得到有意义的缓解,且长期服用这些药物会引起一系列的不良反应,如骨髓抑制、内分泌改变、心脏毒性、呼吸抑制、成瘾性、耐药性等[8]。因此,有效治疗神经病理性疼痛且无明显毒副作用的药物有待进一步研发。
前期研究显示,螺环哌嗪季铵盐化合物有明显的镇痛和抗炎作用,对动物的自主活动、体温、心率等无明显影响[3]。DXL-A-22为螺环哌嗪季铵盐化合物,本研究采用坐骨神经慢性压迫性损伤模型,评价其抗神经病理性疼痛作用。实验结果显示,化合物DXL-A-22可抑制坐骨神经损伤引发的机械刺激过敏和热刺激痛觉过敏,表明DXL-A-22有明显的抗神经病理性疼痛作用。DXL-A-22对CCI大鼠的机械刺激痛阈提高率和热刺激最大镇痛百分率与阳性对照加巴喷丁相当,而剂量小50倍,安全性提高。
CaMKⅡ为丝氨酸/苏氨酸激酶,由α、β、γ、δ四种基因编码,分布于外周和中枢神经元。CaMKⅡα主要分布于疼痛产生区背根神经节和脊髓。当受到伤害性刺激时,Ca2+流增加,CaMKⅡα通过与增加的Ca2+结合而在Thr286位点自动磷酸化。磷酸化的CaMKⅡα促使CREB在Ser133位点自动磷酸化,从而活化CREB。p-CREB与启动子结合,使TNF-α、c-Fos表达增加,从而引发疼痛反应[9]。CaMKⅡα/CREB信号通路在神经病理性疼痛中发挥重要作用。神经损伤后脊髓中p-CaMKⅡα与p-CREB表达明显增加,阻断p-CaMKⅡα能抑制p-CREB表达,明显减轻小鼠痛觉过敏[10]。JAK2是酪氨酸激酶,当受到特定刺激时,JAK2被活化,磷酸化后的JAK2活化转录因子STAT3,STAT3磷酸化后进入细胞核,引发转录反应,促使炎症细胞因子TNF-α的产生[11]。c-Fos为STAT3的靶基因,STAT3通过磷酸化活化后, 引起靶基因c-Fos的激活和表达[12]。JAK2/STAT3信号通路与神经痛相关,神经损伤后,脊髓p-JAK2和p-STAT3表达增加,引起神经炎症反应[13]。本研究结果显示,化合物DXL-A-22明显抑制CCI大鼠DRG中p-CaMKⅡα、p-CREB、p-JAK2和p-STAT3蛋白表达,提示DXL-A-22的抗神经病理性疼痛作用与抑制CaMKⅡα/CREB和JAK2/STAT3信号通路相关。
在外周神经伤害中,前炎症细胞因子TNF-α是早期退行性变化的主要调节者,在神经病理性疼痛中扮演重要角色。神经伤害可使DRG和脊髓中TNF-α表达增加,抑制TNF-α可以减轻神经伤害引起的机械刺激[14]。c-Fos,即刻早期基因,常作为激活疼痛神经元的标志。当机体接受外界刺激时,c-Fos被快速诱导转录,翻译出的Fos迅速进入核内,组成二聚体,与蛋白激活子结合,刺激转录。抑制神经系统c-Fos表达,可减轻神经病理性痛大鼠的疼痛行为[15]。本研究结果显示,化合物DXL-A-22明显抑制CCI大鼠DRG和脊髓TNF-α、c-Fos mRNA的表达,表明DXL-A-22通过抑制TNF-α、c-Fos mRNA表达,缓解神经病理性疼痛。
本文首次研究螺环哌嗪季铵盐化合物DXL-A-22的抗神经病理性疼痛作用,探讨其抗神经病理性疼痛的机制与抑制背根神经节CaMKⅡα/CREB、JAK2/STAT3信号通路,降低背根神经节及脊髓中TNF-α和c-Fos表达相关。该研究为螺环哌嗪季铵盐化合物的结构改造和研发高效低毒的抗神经病理性疼痛药物提供实验依据。
( 致谢: 本实验在北京大学药学院分子与细胞药理学实验室和天然药物及仿生药物国家重点实验室完成,对所有提供技术平台和技术协作的老师同学表示感谢。)
| [1] |
van Hecke O, Austin S K, Khan R A, et al. Neuropathic pain in the general population:a systematic review of epidemiological studies[J]. Pain, 2014, 155(4): 654-62. doi:10.1016/j.pain.2013.11.013 |
| [2] |
Xiong Y, Ye J, Sun Q, et al. Anti-inflammatory effect of the spirocyclopiperazinium compound LXM-10 in mice and rats[J]. Eur J Pharmacol, 2010, 626(2-3): 290-6. doi:10.1016/j.ejphar.2009.10.003 |
| [3] |
Zhao X, Ye J, Sun Q, et al. Antinociceptive effect of spirocyclopiperazinium salt compound LXM-15 via activating peripheral alpha7 nAChR and M4 mAChR in mice[J]. Neuropharmacology, 2011, 60(2-3): 446-52. doi:10.1016/j.neuropharm.2010.10.019 |
| [4] |
Bennett G J, Xie Y K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain, 1988, 33(1): 87-107. doi:10.1016/0304-3959(88)90209-6 |
| [5] |
Starnowska J, Costante R, Guillemyn K, et al. Analgesic properties of opioid/NK1 multitarget ligands with distinct in vitro profiles in naive and chronic constriction injury mice[J]. ACS Chem Neurosci, 2017, 8(10): 2315-24. doi:10.1021/acschemneuro.7b00226 |
| [6] |
Alles S R A, Bandet M V, Eppler K, et al. Acute anti-allodynic action of gabapentin in dorsal horn and primary somatosensory cortex:Correlation of behavioural and physiological data[J]. Neuropharmacology, 2017, 113(Pt A): 576-90. |
| [7] |
Paviaya U S, Kumar P, Wanjari M M, et al. Analgesic and anti-inflammatory activity of root bark of Grewia asiatica Linn. in rodents[J]. . Anc Sci Life, 2013, 32(3): 150-5. doi:10.4103/0257-7941.122998 |
| [8] |
Vranken J H. Elucidation of pathophysiology and treatment of neuropathic pain[J]. Cent Nerv Syst Agents Med Chem, 2012, 12(4): 304-14. doi:10.2174/187152412803760645 |
| [9] |
Wang D, Noda Y, Zhou Y, et al. Effects of sodium houttuyfonate on phosphorylation of CaMK Ⅱ, CREB and ERK 1/2 and expression of c-Fos in macrophages[J]. Int Immunopharmacol, 2004, 4(8): 1083-8. doi:10.1016/j.intimp.2004.05.008 |
| [10] |
Yao C Y, Weng Z L, Zhang J C, et al. Interleukin-17A acts to maintain neuropathic pain through activation of CaMKII/CREB signaling in spinal neurons[J]. Mol Neurobiol, 2016, 53(6): 3914-26. doi:10.1007/s12035-015-9322-z |
| [11] |
Hui L, Yao Y, Wang S, et al. Inhibition of Janus kinase 2 and signal transduction and activator of transcription 3 protect against cecal ligation and puncture-induced multiple organ damage and mortality[J]. J Trauma, 2009, 66(3): 859-65. doi:10.1097/TA.0b013e318164d05f |
| [12] |
Wang L, Li Z, Tan Y, et al. PARP1 interacts with STAT3 and retains active phosphorylated-STAT3 in nucleus during pathological myocardial hypertrophy[J]. Mol Cell Endocrinol, 2018, 474: 137-50. doi:10.1016/j.mce.2018.02.020 |
| [13] |
葛安琪, 殷红, 李登峰, 等. 二甲双胍通过减少STAT3磷酸化缓解大鼠骨癌痛[J]. 中国药理学通报, 2017, 33(6): 844-8. Ge A Q, Yin H, Li D F, et al. Metformin alleviates bone cancer pain by reducing phosphorylation of STAT3 in rats[J]. Chin Pharmacol Bull, 2017, 33(6): 844-8. doi:10.3969/j.issn.1001-1978.2017.06.019 |
| [14] |
金少举, 王蓉, 李海龙, 等. 槐果碱对SNI致神经病理性疼痛小鼠脊髓组织TLR4/p38 MAPK的影响[J]. 中国药理学通报, 2017, 33(9): 1266-71. Jin S J, Wang R, Li H R, et al. The effect of sohpocarpine on TLR4/p38 MAPK in spinal cord of SNI induced neuropathic pain[J]. Chin Pharmacol Bull, 2017, 33(9): 1266-71. doi:10.3969/j.issn.1001-1978.2017.09.016 |
| [15] |
da Silva J T, Evangelista B G, Venega R A G, et al. Anti-NGF treatment can reduce chronic neuropathic pain by changing peripheral mediators and brain activity in rats[J]. Behav Pharmacol, 2019, 30(1): 79-88. |