

Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)-核转录因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)-抗氧化反应元件(antioxidant response element,ARE)信号通路是一个综合的氧化还原反应体系,有多个激活途径维持细胞的氧化还原平衡及代谢,它能调节机体1%~10%的基因[1]。机体内的一些酶和蛋白质,如NAD(P)H:醌氧化还原酶1、谷胱甘肽过氧化物酶、谷胱甘肽S-转移酶、超氧化物歧化酶、血红素氧合酶-1、过氧化氢酶、硫氧还蛋白还原酶等,都具有解毒和抗氧化防御功能,这些蛋白及酶的表达和转录调控都依赖于Nrf2信号通路的激活。Keap1-Nrf2-ARE信号通路与氧化应激相关的多种疾病,包括癌症、阿尔茨海默病、帕金森病、糖尿病等都有相关性[1]。因此,发现及研究Keap1-Nrf2-ARE信号通路的激活剂,对于预防和治疗氧化应激诱导的疾病具有重要意义。
1 Keap1-Nrf2-ARE信号通路的结构 1.1 Keap1Keap1是分子质量为69 ku的蛋白,它是Nrf2的负调节器。人类Keap1的蛋白质序列中包含5个区域,由627个氨基酸组成,如Fig 1所示,包括N端区域(N-terminal region,NTR)、BTB区域(broad complex,Tramtrack,and Bric-a-Brac,BTB)、中间连接区域(linker intervening region,IVR)、Kelch区域以及C端区域(C-terminal region,CTR)[2]。BTB区域附于actin结合蛋白上,负责同源二聚化Cul3与Nrf2泛素化过程。IVR含有半胱氨酸残基,对氧化和核输出信号敏感。Kelch区域拥有介导Keap1与Nrf2连接的多个蛋白接触位点。人类Keap1蛋白共包含27个半胱氨酸残基(Cys),其中7个Cys(Cys151、Cys257、Cys273、Cys288、Cys297、Cys434和Cys613)对活性氧(reactive oxygen species, ROS)和亲电试剂具有较高的活性,可参与氧化还原信号传导[2-3]。

|
| Fig 1 Organization of structure domains in Keap1 The redox sensitive cysteine residues are marked with(*) |
Nrf2是bZip转录因子和CNC转录因子家族中的一员,人类Nrf2蛋白含有605个氨基酸残基,组成从Neh1到Neh6的6个保守结构域,如Fig 2所示[4]。Neh1具有bZip序列,负责与Maf蛋白的异源二聚化,Nrf2-Maf二聚体可以结合在ARE上,诱导基因的表达。在N末端,Neh2区域包含DLG和ETGE序列,可以结合在Keap1的Kelch区域上,负性调控Nrf2的转录活性。Neh3区域位于C末端,Neh4和Neh5可以通过结合到组蛋白乙酰转移酶上,调解Nrf2的反式激活。Neh6对Nrf2具有不依赖于Keap1的负性调控作用[4]。人类Nrf2蛋白上含有6种半胱氨酸残基,半胱氨酸(Cys183、Cys506)和另外2个关键氨基酸残基(Ser40、Tyr568)也可以通过氧化磷酸化,调控Nrf2的定位和目标基因的转录。所以,Nrf2是抗氧化反应的主要调控器[5]。
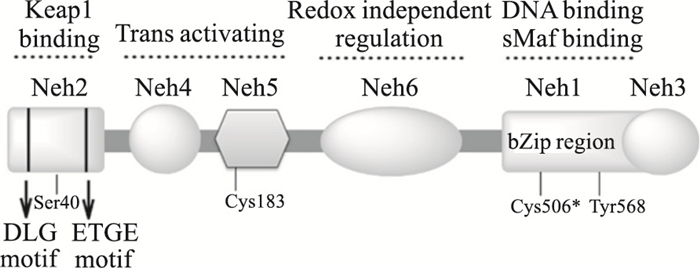
|
| Fig 2 Organization of structure domains in Nrf2 The reactive key cysteine residues are marked with(*) |
ARE也被称为亲电效应元件,是一种包含特定DNA序列的顺式调节元件,位于具有细胞保护作用蛋白质及二相代谢酶基因编码的上游。在氧化应激条件下,稳态化的Nrf2转位进入细胞核内,与Maf形成异二聚体,激活ARE依赖的基因表达。Bach1是一个依赖ARE基因的负调节器,它与ARE和Maf蛋白二聚体的形成相关,阻止Nrf2在正常生理条件下与DNA的结合[6]。
2 Keap1-Nrf2-ARE信号通路的小分子激活剂目前已知的ARE激活剂基本都是Keap1-Nrf2相互作用的间接抑制剂,它们可与Keap1半胱氨酸上的巯基通过氧化或烷基化形成共价加合物。亲电性是大多数已知诱导剂的共同特征[7],但是并非所有的亲电试剂都能调控ARE的活性。亲电试剂的生物效应取决于其与亲核试剂相互作用的速率和选择性。加合物的形成不仅依赖于亲电试剂的性质,还取决于亲核中心的蛋白微环境。不同类型的亲电试剂可以在Keap1-Nrf2与蛋白质半胱氨酸残基中显示不同的反应模式,从而导致不同的生物学效应[8]。亲电试剂修饰Keap1的半胱氨酸残基后,诱导Keap1和Nrf2解离,抑制Nrf2通过泛素化降解,进而促进Nrf2核转位。
基于与Keap1-Nrf2相互作用的小分子抑制剂的化学结构,以及与半胱氨酸巯基作用的性质,目前公认的可与Keap1-Nrf2相互作用的抑制剂有以下几类。
2.1 具有氧化性的酚和醌类多酚化合物在作用于Keap1-Nrf2-ARE信号通路前,就可以作为抗氧化剂直接清除自由基。在20世纪70年代,研究发现酚类抗氧化剂BHA可诱导细胞保护酶的表达。结构修饰BHA得到BHT和tBHQ,发现结构变化对ARE诱导活性的影响非常小。迈克尔受体是ARE的诱导基团,因此,可以推测酚类ARE诱导剂可在氧化后形成类似迈克尔受体,能诱导ARE的相应亲电性醌类。这一假设得到3个异构体二酚的支持,通过测定儿茶酚(1, 2-二酚)、间苯二酚(1, 3-二酚)和对苯二酚(1, 4-二酚)的氧化电势和诱导ARE的能力发现,儿茶酚和对苯二酚可诱导ARE的活性,而间苯二酚无活性[9]。在氧和过渡金属存在情况下,tBHQ被氧化为tBQ,并迅速地与Keap1蛋白进行迈克尔加成反应,激活ARE相关的转录。也有人认为,双酚经过细胞色素P450介导的氧化反应,在体内形成醌,促进了最终的诱导作用[10]。内源对位及邻位氢醌,如儿茶酚雌激素、多巴胺和L-DOPA也可以诱导ARE依赖的防御反应[10]。
槲皮素存在于许多植物中,是一种来自植物的黄酮类抗氧化剂。槲皮素可以抑制Nrf2的降解,促进Nrf2转位入核,以增加细胞核内Nrf2的水平。白藜芦醇是主要存在于红葡萄皮和其他水果中的二苯乙烯类和非黄酮多酚类化合物,研究发现,白藜芦醇类似槲皮素,可诱导Nrf2介导ARE基因的表达[11]。绿茶富含儿茶素多酚,其中含量最丰富的是表儿茶素没食子酸酯(EGCG),它是绿茶发挥抗氧化作用的主要活性成分。研究表明,EGCG可增加细胞核中Nrf2的水平,也可诱导ARE荧光素酶报告基因转录。鼠尾草酚和它的酸衍生物鼠尾草酸,是从迷迭香中得到的儿茶酚型松香烷二萜,它们被用作食品的防腐剂和抗氧化剂,并能提高Nrf2的水平,减少脂质过氧化作用和ROS的生成[12]。相对于鼠尾草酚,鼠尾草酸的保护作用更为明显,可能是由于其具有较高的溶解性或较低的毒性。黄芩素是中药黄芩中的主要成分,研究表明,黄芩素能明显提高Nrf2的转录活化[13]。
2.2 迈克尔反应受体分子迈克尔反应受体分子是一类效果较好的ARE通路激活剂,迈克尔反应受体分子被认为是温和的路易斯酸,诱导效力与它们的迈克尔加成反应性呈正比。迈克尔反应受体分子可以与Keap1上的半胱氨酸硫醇盐基团反应,进而抑制Nrf2的泛素化,诱导抗氧化和细胞保护酶的表达[14]。迈克尔反应受体分子通常在低浓度下表现为有益的细胞应答,高浓度下不会激活Nrf2信号通路,并有细胞毒性。通常在各种植物中存在许多结构上与迈克尔反应受体分子有关的诱导剂,如姜黄素、肉桂酸衍生物、查耳酮、黄酮、萜类化合物等。
姜黄素是印度咖喱的主要成分,结构上有两个酚官能团和β-二酮结构,姜黄素能直接清除ROS。姜黄素含有两个易与半胱氨酸巯基反应的迈克尔受体基团,它能通过修饰Keap1上的半胱氨酸巯基,激活Keap1-Nrf2-ARE信号通路[15]。姜黄素还可间接通过刺激上游激酶途径,激活ARE系统。使用姜黄素作为预防和治疗氧化应激相关疾病的药物,主要弊端是其代谢和化学性质不稳定,膜通透性差,口服生物利用度极低。
肉桂酸类衍生物咖啡酸苯乙酯(caffeic acid phenethyl ester,CAPE)是蜜蜂蜂胶中的一种活性成分,它具有抗有丝分裂、抗炎和免疫调节功能。阿魏酸及其衍生物如阿魏酸乙基酯(ferulic acid ethyl este,EFE),多存在于水果和蔬菜中,对蛋白质和脂质的氧化有较强的保护作用。CAPE和EFE都含有α, β-不饱和酮结构,诱导ARE的能力与姜黄素的效果相当[15]。
查尔酮是一类存在于多种植物中的开链黄酮类化合物,结构主链由两个苯环通过3个碳原子的α, β-不饱和羰基连接。查耳酮具有许多生物学性质,如抗增殖、抗炎和抗感染活性。两个典型的查耳酮化合物索法酮和异甘草素可以通过激活Keap1-Nrf2-ARE途径,诱导细胞保护蛋白的表达。索法酮是中药苦参中广豆根酮的衍生物,异甘草素存在于光果甘草的根中。一些天然存在的香豆素衍生物,如欧前胡素和橙皮油素,都具有经Keap1-Nrf2-ARE信号通路诱导ARE相关酶活性的作用。
黄酮广泛存在于果蔬及茶等人们日常的饮食中,其在结构上含有α, β-不饱和酮。许多黄酮具有诱导ARE的特性,这些黄酮包括4-溴黄酮和β-萘黄酮,天然异黄酮sappanone A[16]等。
倍半萜烯如异土木香内酯,萜类如紫苏醛和柠檬醛,都含α, β-不饱和香醛,能诱导Nrf2介导解毒酶的表达。穿心莲叶中提取的穿心莲内酯具有通过Keap1-Nrf2-ARE途径,诱导ARE的作用[17]。
黄腐酚是啤酒花中的特有产物,从生姜中可以分离得到6-脱氢姜二酮,黄腐酚和6-脱氢姜二酮可以通过促进Nrf2核转位,激活ARE系统,其机制与结构中的α, β-不饱和酮结构密切相关。
2.3 异硫氰酸酯类天然异硫氰酸酯(isothiocyanates,ITCs)以惰性芥子油苷前体形式大量存在于十字花科蔬菜中,如西兰花和卷心菜。一旦食入,芥子油苷由胃肠道微生物菌群的作用转化为ITCs。异硫氰酸酯基(-N=C=S)的中心碳原子高度亲电,容易与巯基反应,形成二硫代氨基甲酸酯。ITCs与Keap1半胱氨酸残基中的巯基反应,被认为是破坏Keap1-Nrf2的相互作用和最终诱导ARE基因的机制。异硫氰酸酯类化合物中,天然异硫氰酸酯莱菔硫烷(isothiocyanates sulforaphane,SFN)和苯乙基异硫氰酸酯(phenethyl isothiocyanate,PEITC)的研究最充分[18]。亚砜硫代氨基甲酸酯(sulfoxythiocarbamate,STCA)保留了诱导ARE活性的结构特征。STCA类似物的亲电性远高于莱菔硫烷,异硫氰酸酯与巯基可形成可逆的结合物,而STCA与巯基的反应是不可逆的。
2.4 二硫醚和二烯丙基硫化物二硫醚是一种具有抗癌及细胞保护作用的五元环状含硫化合物。3H-1, 2-二硫-3-硫酮(D3T)是最简单的二硫醚化合物,可从十字花科蔬菜(如卷心菜、甘蓝)中提取得到,它五元环内的二硫键可与巯基反应。D3T的异构体1, 3-二硫-2-硫酮在高浓度下无上述效果,表明1, 2-二硫化物结构的重要性。烯丙基硫化物是一类在葱属蔬菜(如大蒜、洋葱)中发现的有机硫化合物,具有抑制多种癌细胞生长的作用。一些亲脂性硫醚,如二烯丙基硫化物(DAS)、二烯丙基二硫化物(DADS)、二烯丙基三硫化物(DATS)具有上调解毒酶表达的作用,活性强度顺序为DATS> DADS> DAS,但是潜在诱导ARE活性的机制还知之甚少[19]。
2.5 邻二硫醇类邻二硫醇可在体内转化成亲电性质的二硫键。研究表明,1, 2-乙二硫醇[1]和2, 3-二巯基琥珀酸[16]可以激活Nrf2。另一种二硫醇的变体(R)-硫辛酸或α-硫辛酸几乎存在于所有的食品中,且在菠菜和花椰菜中的含量略多于其他食物,可通过内源性生成。(R)-硫辛酸是一种分子营养素和抗氧化剂,现已证明,它能通过激活Nrf2诱导各种抗氧化酶的表达[20]。
2.6 三价砷类化合物砷(Ⅲ)对硫醇较高的亲和性被认为是急性和慢性砷化合物中毒的起因之一。但研究表明,低剂量的砷可降低癌症的发病率。砷类化合物,如亚砷酸钠、三氧化二砷(ATO)和单甲基砷酸(MMA)可调节Keap1-Cul3 E3泛素连接酶复合物,以激活Nrf2。双砷硫醇标记的荧光素试剂(FLASH-EDT2)和氧化苯砷(PAO)也可激活依赖Keap1的Nrf2[21]。
2.7 含硒化合物硫和硒具有类似的负电性,各种有机硒化合物具有细胞保护活性。萝卜硫素的硒异位体化合物SFN-isoSe对Nrf2的诱导活性比萝卜硫素(SFN)更为优异。依布硒啉是一种有效的多功能抗氧化剂和抗炎剂,能调节Keap1-Nrf2介导的解毒酶基因的表达[22]。有机硒化合物3-selena-1-dethiacephem也是Nrf2-ARE的活化剂和ROS的直接清除剂。
2.8 氢过氧化物当机体内生成的自由基和过氧化物超出了生物系统的清除或修复能力时,将会诱发氧化应激。过氧化物的O—O键可以很容易破裂并释放氧自由基,进而与巯基反应,以形成磺酸酯(RSO-)。含量较低的过氧化氢和有机过氧化物,如叔丁基过氧化氢可以通过氧化Keap1的巯基,作为诱导剂,激活依赖Nrf2及ARE的基因[23]。
2.9 多烯类多烯类化合物包含1个或多个序列交替的不饱和单双碳-碳键。由于不饱和程度高,这些化合物较易通过生物转化为亲电子代谢物,可与游离巯基反应。类胡萝卜素是一类多烯化合物,具有癌症预防作用,类胡萝卜素可以激活ARE转录系统,并诱导抗氧化和细胞保护酶的表达。番茄红素是一种主要存在于番茄中的红色类胡萝卜素色素,番茄红素及其潜在的氧化代谢产物10, 10’-diapocarotene-10, 10’-dial包含迈克尔受体基团,可以共价修饰Keap1,活化Nrf2,并提高ARE介导基因的表达[24]。
2.10 重金属和金属配合人类生存需要微量的重金属,如铁、钴、铜和锌,但过量的重金属是有危害的,一些重金属如汞、镉、金、铅有剧毒。部分重金属(如汞、镉、锌)可以诱导ARE基因的表达。氯化镉是一种已知的人体致癌物,它能通过多种机制诱导癌症,这些机制包括诱导异常的基因表达、抑制DNA损伤修复、诱导氧化应激和抑制细胞凋亡。镉具有诱导ARE基因表达的能力,这可以看作是一种生物防御机制,以对抗镉诱导氧化应激的影响[25]。金诺芬(Auranofin)是一个含金的抗风湿药物,它也可以通过激活Keap1-Nrf2-ARE信号通路,发挥抗炎作用。
3 总结与展望Keap1-Nrf2-ARE信号通路对抗氧化防御机制非常重要,它可以激活细胞的适应性反应,以应对各种氧化应激损伤。Keap1是Nrf2的负性调节器,Nrf2是ARE系统的主要效应器。通过负调节Keap1蛋白激活ARE系统可以诱导一系列抗氧化基因的表达,这对预防氧化损伤、炎症和肿瘤的发生非常关键。因此,激活Keap1-Nrf2-ARE系统,对开发抗氧化、抗炎和抗癌药物具有很大价值。在过去的几十年中,许多Nrf2的激活剂已经被开发,部分已进入临床试验阶段。而且在体外和体内由遗传或化学试剂诱导二相代谢酶基因表达增高,都可以起到细胞保护的作用。目前,一些天然及合成的小分子已被认定为ARE系统的诱导剂,如萝卜硫素、甲基多巴索隆、奥替普拉和依布硒林,这些药物目前已用于多种病症的临床试验,如乳腺癌、前列腺癌、哮喘、慢性阻塞性肺病、慢性肾脏病、2型糖尿病、非酒精性脂肪肝病等。大多数已知的Keap1抑制剂具有亲电性的共同特征,修饰和改变Keap1上的半胱氨酸巯基,可以活化ARE。Keap1-Nrf2的连接处已经演变为直接活化和可逆诱导ARE的分子靶点,这为寻找及研究Keap1-Nrf2-ARE信号通路的激活剂提供了研究方向。
| [1] |
Tkachev V O, Menshchikova E B, Zenkov N K. Mechanism of the Nrf2/Keap1/ARE signaling system[J]. Biochemistry (Mosc), 2011, 76(4): 407-22. doi:10.1134/S0006297911040031 |
| [2] |
Zhang D D. Mechanistic studies of the Nrf2-Keap1 signaling pathway[J]. Drug Metab Rev, 2006, 38(4): 769-89. doi:10.1080/03602530600971974 |
| [3] |
Luo Y, Eggler A L, Liu D, et al. Sites of alkylation of human Keap1 by natural chemoprevention agents[J]. J Am Soc Mass Spectrom, 2007, 18(12): 2226-32. doi:10.1016/j.jasms.2007.09.015 |
| [4] |
McMahon M, Thomas N, Itoh K, et al. Redox-regulated turnover of Nrf2 is determined by at least two separate protein domains, the redox-sensitive Neh2 degron and the redox-insensitive Neh6 degron[J]. J Biol Chem, 2004, 279(30): 31556-67. doi:10.1074/jbc.M403061200 |
| [5] |
Li W, Kong A N. Molecular mechanisms of Nrf2-mediated antioxidant response[J]. Mol Carcinog, 2009, 48(2): 91-104. doi:10.1002/mc.20465 |
| [6] |
Wasserman W W, Fahl W E. Functional antioxidant responsive elements[J]. Proc Natl Acad Sci USA, 1997, 94(10): 5361-6. doi:10.1073/pnas.94.10.5361 |
| [7] |
Hong F, Sekhar K R, Freeman M L, et al. Specific patterns of electrophile adduction trigger Keap1 ubiquitination and Nrf2 activation[J]. J Biol Chem, 2005, 280(36): 31768-75. doi:10.1074/jbc.M503346200 |
| [8] |
Kobayashi M, Li L, Iwamoto N, et al. The antioxidant defense system Keap1-Nrf2 comprises a multiple sensing mechanism for responding to a wide range of chemical compounds[J]. Mol Cell Biol, 2009, 29(2): 493-502. doi:10.1128/MCB.01080-08 |
| [9] |
Dinkova-Kostova A T, Wang X J. Induction of the Keap1/Nrf2/ARE pathway by oxidizable diphenols[J]. Chem Biol Interact, 2011, 192(1-2): 101-6. doi:10.1016/j.cbi.2010.09.010 |
| [10] |
Wang X J, Hayes J D, Higgins L G, et al. Activation of the NRF2 signaling pathway by copper-mediated redox cycling of para- and ortho-hydroquinones[J]. Chem Biol, 2010, 17(1): 75-85. |
| [11] |
黄新宇, 刘永林. 白藜芦醇激活Nrf2/ARE信号通路降低心肌缺血再灌注损伤大鼠炎症和氧化应激[J]. 中华中医药学刊, 2017, 35(6): 1516-20. Huang X Y, Liu Y L. Resveratrol reduces inflammatory response and oxidative stress in myocardial ischemia-reperfusion injury rats through activating Nrf2/ARE signaling pathway[J]. Chin Arch Tradit Chin Med, 2017, 35(6): 1516-20. |
| [12] |
Martin D, Rojo A I, Salinas M, et al. Regulation of heme oxygenase-1 expression through the phosphatidylinositol 3-kinase/Akt pathway and the Nrf2 transcription factor in response to the antioxidant phytochemical carnosol[J]. J Biol Chem, 2004, 279(10): 8919-29. doi:10.1074/jbc.M309660200 |
| [13] |
庞纯, 蒋萍, 季莉莉. 黄芩素激活核转录因子Nrf2拮抗肝毒性的研究[J]. 中国药理学通报, 2014, 30(4): 546-9. Pang C, Jiang P, Ji L L. Baicalein induced Nrf2 activation and its protection against hepatotoxicity[J]. Chin Pharmacol Bull, 2014, 30(4): 546-9. doi:10.3969/j.issn.1001-1978.2014.04.023 |
| [14] |
Nakamura Y, Miyoshi N. Electrophiles in foods: the current status of isothiocyanates and their chemical biology[J]. Biosci Biotechnol Biochem, 2010, 74(2): 242-55. doi:10.1271/bbb.90731 |
| [15] |
Balogun E, Hoque M, Gong P, et al. Curcumin activates the haem oxygenase-1 gene via regulation of Nrf2 and the antioxidant-responsive element[J]. Biochem J, 2003, 371(3): 887-95. doi:10.1042/bj20021619 |
| [16] |
Smirnova N A, Haskew-Layton R E, Basso M, et al. Development of Neh2-luciferase reporter and its application for high throughput screening and real-time monitoring of Nrf2 activators[J]. Chem Biol, 2011, 18(6): 752-65. doi:10.1016/j.chembiol.2011.03.013 |
| [17] |
Yu A L, Lu C Y, Wang T S, et al. Induction of heme oxygenase 1 and inhibition of tumor necrosis factor alpha-induced intercellular adhesion molecule expression by andrographolide in EA.hy926 cells[J]. J Agric Food Chem, 2010, 58(13): 7641-8. doi:10.1021/jf101353c |
| [18] |
Cheung K L, Kong A N. Molecular targets of dietary phenethyl isothiocyanate and sulforaphane for cancer chemoprevention[J]. AAPS J, 2010, 12(1): 87-97. doi:10.1208/s12248-009-9162-8 |
| [19] |
Fisher C D, Augustine L M, Maher J M, et al. Induction of drug-metabolizing enzymes by garlic and allyl sulfide compoundsvia activation of constitutive androstane receptor and nuclear factor E2-related factor 2[J]. Drug Metab Dispos, 2007, 35(6): 995-1000. doi:10.1124/dmd.106.014340 |
| [20] |
Shay K P, Moreau R F, Smith E J, et al. Alpha-lipoic acid as a dietary supplement: molecular mechanisms and therapeutic potential[J]. Biochim Biophys Acta, 2009, 1790(10): 1149-60. doi:10.1016/j.bbagen.2009.07.026 |
| [21] |
He X, Ma Q. NRF2 cysteine residues are critical for oxidant/electrophile-sensing, Kelch-like ECH-associated protein-1-dependent ubiquitination-proteasomal degradation, and transcription activation[J]. Mol Pharmacol, 2009, 76(6): 1265-78. doi:10.1124/mol.109.058453 |
| [22] |
Sakurai T, Kanayama M, Shibata T, et al. Ebselen, a seleno-organic antioxidant, as an electrophile[J]. Chem Res Toxicol, 2006, 19(9): 1196-204. doi:10.1021/tx0601105 |
| [23] |
Fourquet S, Guerois R, Biard D, et al. Activation of NRF2 by nitrosative agents and H2O2 involves KEAP1 disulfide formation[J]. J Biol Chem, 2010, 285(11): 8463-71. doi:10.1074/jbc.M109.051714 |
| [24] |
Linnewiel K, Ernst H, Caris-Veyrat C, et al. Structure activity relationship of carotenoid derivatives in activation of the electrophile/antioxidant response element transcription system[J]. Free Radic Biol Med, 2009, 47(5): 659-67. doi:10.1016/j.freeradbiomed.2009.06.008 |
| [25] |
Joseph P. Mechanisms of cadmium carcinogenesis[J]. Toxicol Appl Pharmacol, 2009, 238(3): 272-9. doi:10.1016/j.taap.2009.01.011 |

