

2. 江南大学 无锡医学院,江苏 无锡 214122
2. Wuxi School of Medicine, Jiangnan University, Wuxi Jiangsu 214122, China
目前研究认为,瞬时受体电位(transient receptor potential,TRP)离子通道是一类在细胞膜上分布的非选择性阳离子通道,参与内皮细胞功能稳态的调控[1]。瞬时受体电位香草素4(transient receptor potential vanilloid 4,TRPV4)通道是TRP通道家族香草素亚家族(TRPV)成员,其在内皮细胞中参与调节多种血管功能,包括应答血流剪切力、调节血管张力、机械信号传导及血管新生等[2]。高盐摄取是许多常见疾病的诱导因素,降低高盐的摄入可降低血压并改善心血管功能[3]。已有研究表明,通过喂食Wistar大鼠高盐饲料,发现当高盐饮食导致血压大幅升高时,内皮细胞中由TRPV4介导的血管舒张功能下调,甚至被全面抑制[4]。这些研究表明,TRPV4通道在高盐摄入所引起的内皮功能失调中发挥重要的作用。
一氧化氮(nitric oxide,NO)是健康的内皮细胞产生的气体递质。研究表明,在冠状动脉中,NO可以抑制其异常收缩;在血管内皮细胞中,NO可以起到松驰血管平滑肌和舒张血管的作用[5-7]。内皮细胞中的NO主要由内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)催化L-精氨酸产生,该酶活性对Ca2+浓度有依赖性[8]。Ca2+是细胞内重要的第二信使,其浓度调节主要受胞内钙库Ca2+释放和胞外Ca2+内流控制,钙库释放速度快,但维持时间短;而钙内流可以使细胞内钙持续增高,调节长期的细胞效应,如细胞内NO合成等[9-10]。这些研究表明,Ca2+通过影响eNOS的活性,对NO的生成产生重要的作用,从而调节血管内皮的功能。
TRPV4与NO均参与血管功能调节,然而,对于高盐模型下,TRPV4对NO的具体影响目前尚未完全清楚。我们猜测高盐模型下,内皮细胞中的TRPV4通道受到影响,对NO存在一定的作用,从而影响到血管的功能。因此,我们在细胞水平上诱导高盐模型,发现胸主动脉内皮细胞中TRPV4介导的Ca2+内流下降,NO的生成减弱,进而在血管内皮功能失调过程中产生影响。
1 材料与方法 1.1 材料 1.1.1 实验动物健康野生型C57BL6/J小鼠30只,♂,4~8周龄,体质量(20~25) g,购自南京模式动物研究所,许可证编号:SYXK(苏)2016-0012。小鼠饲养在江南大学无锡医学院动物中心的SPF级动物饲养屏障环境中,环境湿度维持在50%,温度保持在25 ℃左右,自由进食饮水,通过灯光控制系统,使其在每天50%光照时间与50%黑夜时间交替中生活。将30只小鼠随机均分成两组,各3笼,每笼5只。
1.1.2 试剂NaCl(10019318),购自沪试公司;甘露醇(BL-SJ-0243),购自上海博光生物科技有限公司;ECM培养基(1001),购自Lonza公司;HBSS(C0218),购自碧云天公司;胶原蛋白酶(C9891)、TRPV4激动剂GSK1016790A(G0798)、TRPV4抑制剂HC067047(4100/50),购自Sigma公司;Fluo-4(F14201)、DAF-FM DA(D23844),购自Invitrogen公司。
1.1.3 仪器低速离心机、生物安全柜、细胞培养箱(美国Thermo公司);倒置显微镜(日本Nikon公司);激光共聚焦显微镜(德国Leica公司);纯水仪(美国Millipore公司)。
1.2 方法 1.2.1 原代胸主动脉内皮细胞的分离及培养利用颈椎脱臼法使小鼠迅速死亡,分离小鼠胸主动脉血管于无菌PBS中。将胸主动脉血管于生物安全柜中剪成3 cm左右的小片段,然后将其转移至10 mL无菌离心管中,离心管中含5 mL消化液(PBS :胶原酶=500 :1)。在37 ℃震荡水浴锅中快速消化15~20 min。然后将液体转移至10 mL无菌离心管中,1 200 r·min-1离心5 min,小心吸出上清并弃之,加入1 mL ECM完全培养基重悬,将混悬液转移至6孔板中,补加1 mL ECM完全培养基,轻轻摇晃混匀,置于37 ℃、5% CO2细胞培养箱中培养。1 h后待胸主动脉内皮细胞贴壁后,用无菌PBS洗涤3~5次,并加入2 mL ECM完全培养基继续培养。
1.2.2 高盐细胞模型的诱导称取NaCl粉末溶于ECM完全培养基中,使其浓度为60 mmol·L-1,用0.22 μm的无菌滤头过滤。将6孔板中的胸主动脉血管原代内皮细胞胰酶消化,1 200 r·min-1离心5 min,用60 mmol·L-1 NaCl培养基重悬于激光共聚焦小皿中培养48 h。
1.2.3 Ca2+标记将分离得到的细胞铺于共聚焦小皿中培养48 h,HBSS洗涤3遍。用HBSS配制Fluo-4(母液:625 μmol·L-1),按1 :200稀释,每皿加入200 μL于培养箱中避光孵育30 min,然后将工作液弃去,HBSS洗涤3遍,加入800 μL HBSS并在共聚焦显微镜下观察。配制GSK1016790A(TRPV4激动剂)为1 :200(工作浓度为1 μmol·L-1),待调好焦距拍摄1 min左右后,加入200 μL工作液观察荧光的变化。
1.2.4 NO标记将分离得到的细胞铺于共聚焦小皿中,用HBSS配制DAF-FM DA工作液为1 μmol·L-1,将共聚焦小皿用HBSS溶液洗涤3遍,每皿加入200 μL DAF-FM DA工作液,于培养箱中避光孵育10 min,然后将工作液弃去,HBSS洗涤3遍,加入1 mL HBSS在共聚焦显微镜下观察荧光。
1.2.5 数据分析采用GraphPad Prism5软件对数据进行统计分析,结果用x±s表示,组间比较采用t检验。
2 结果 2.1 抑制TRPV4后胸主动脉内皮细胞Ca2+内流下降用TRPV4的抑制剂HC067047(10 μmol·L-1)预孵育胸主动脉内皮细胞1 h后,Fluo-4钙离子荧光探针标记30 min,于共聚焦显微镜下观察,待拍摄1 min后加入TRPV4的激动剂GSK1016790A,发现对照组钙离子浓度明显增加,180 s时对照组钙离子浓度达到最大值,而HC067047组钙离子浓度无明显变化(Fig 1A)。统计结果显示,对照组相对最大荧光值强度明显高于HC067047组,差异有统计学意义(Fig 1B)。表明抑制TRPV4后,胸主动脉内皮细胞Ca2+内流下降。
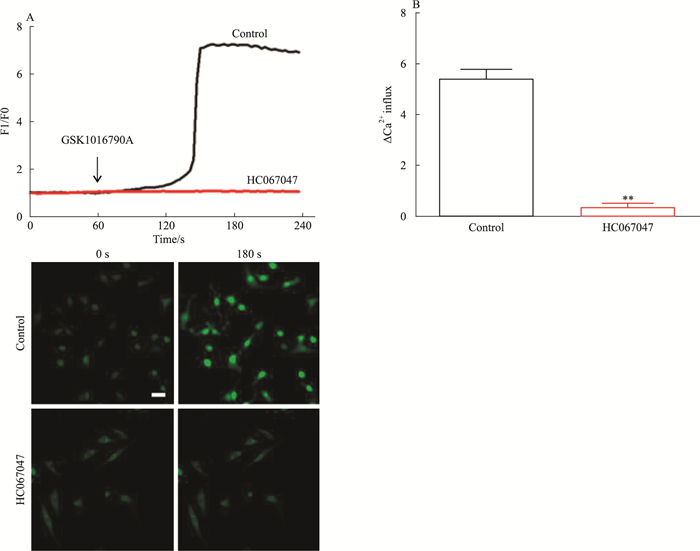
|
| Fig 1 Decreased Ca2+ influx in thoracic aortic endothelial cells after TRPV4 inhibition A: Upper: Both the control group and the HC067047 group were labeled with Fluo-4 calcium ion fluorescent probe for 30 min, and GSK1016790A(TRPV4 agonist) was added after 60 s. At 180 s, the calcium concentration of the control group reached the maximum, while the HC067047 group showed almost no change. Bottom: representative maps of the control group and the HC067047 group at 0 s and 180 s(scale bar=100 μm). B: The graph shows the relative maximum fluorescence intensity of calcium ions in the control group and the HC067047 group and the control group was significantly higher than the HC067047 group. The HC067047 group was preincubated with 10 μmol·L-1 HC067047(TRPV4 inhibitor) for 1 h(x±s, n=9).**P < 0.01 vs control. |
通过Fluo-4钙离子荧光探针对胸主动脉内皮细胞进行标记,在共聚焦显微镜下拍摄1 min后,加入TRPV4的激动剂GSK1016790A,发现180 s左右时对照组与高盐诱导组钙离子浓度均达到最大值,但高盐组上升幅度明显低于对照组(Fig 2A)。统计结果显示,高盐组的相对最大荧光值明显低于对照组,且差异有统计学意义(Fig 2B)。同渗透压甘露醇组(120 mmol·L-1)与对照组差异无统计学意义,表明高盐导致TRPV4介导的Ca2+内流减少,并且其作用与渗透压无关。

|
| Fig 2 TRPV4-mediated Ca2+ influx inhibited by high salt in thoracic aortic endothelial cells A:Upper: Both the control group and the high salt group were labeled with Fluo-4 calcium ion fluorescent probe for 30 min, and GSK1016790A(TRPV4 agonist) was added after 60 s. The calcium concentration in the control group and the high salt induction group reached the maximum at about 180 s, but the increase in the high salt group was significantly lower than that in the control group. Bottom: Representative maps of the control group and the high salt group at 0s and 180 s(scale bar=100 μm). B: The graph shows the relative maximum fluorescence intensity of calcium ions in the control and high salt groups and the control group was significantly higher than the high salt group. The high salt group was cultured in 60 mmol·L-1 NaCl medium for 48 h. The mannitol group(120 mmol·L-1) had the same osmotic pressure as the high salt group(x±s, n=10).**P < 0.01 vs control. |
用TRPV4的抑制剂HC067047(10 μmol·L-1)预孵育胸主动脉内皮细胞1h后,DAF-FM DA一氧化氮荧光探针对胸主动脉内皮细胞标记10 min,在共聚焦显微镜下观察,控制荧光强度相同的情况下,HC067047组明显比对照组暗(Fig 3A)。结果统计显示,HC067047组的荧光值明显低于对照组,且差异具有统计学意义(Fig 3B)。表明抑制TRPV4后,胸主动脉内皮细胞NO的生成减弱。

|
| Fig 3 Decreased production of NO in thoracic aortic endothelial cells after inhibition of TRPV4 A: The control group and the HC067047 group were labeled with DAF-FM DA nitric oxide fluorescent probe for 10 min, and the representative images taken under the same fluorescence intensity were controlled(scale bar=100 μm). B: The graph shows the fluorescence values of the control group and the HC067047 group. The control group was significantly higher than the HC067047 group. The HC067047 group was preincubated with 10 μmol·L-1 of HC067047(TRPV4 inhibitor) for 1 h(x±s, n=15).**P < 0.01 vs control. |
通过DAF-FM DA NO荧光探针对胸主动脉内皮细胞进行标记,于共聚焦显微镜下进行观察,在相同的荧光强度下,对照组明显比高盐组亮(Fig 4A)。统计显示,高盐组的荧光值明显低于对照组,且差异具有统计学意义(Fig 4B)。同渗透压甘露醇组与对照组差异无统计学意义,表明高盐导致NO的生成减少,并且其作用与渗透压无关。
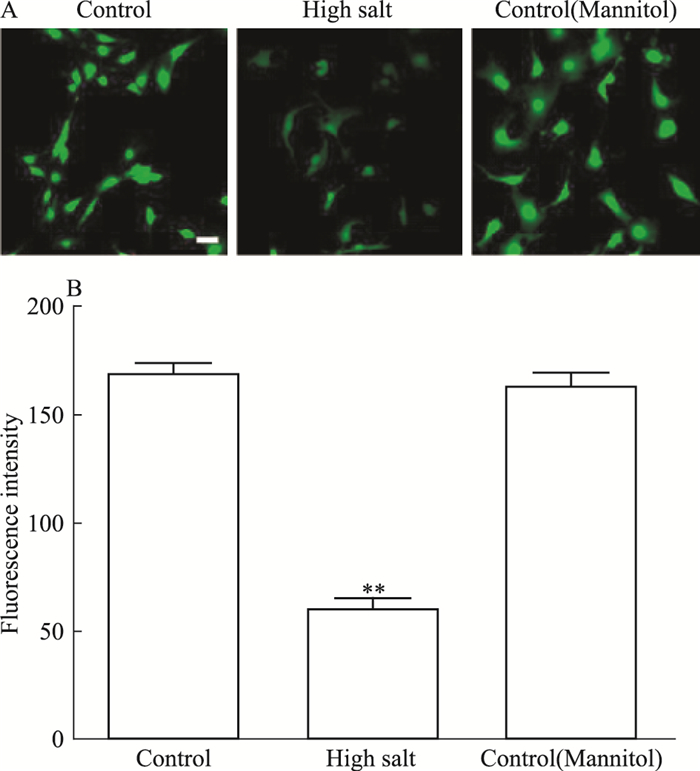
|
| Fig 4 NO production inhibited by high salt in thoracic aortic endothelial cells A: The control group and the high-salt group were labeled with DAF-FM DA nitric oxide fluorescent probe for 10 min, and the representative images taken under the same fluorescence intensity were controlled(scale bar=100 μm). B: The graph shows the fluorescence values of the control group and the high salt group. The control group was significantly higher than the high salt group. The high salt group was cultured in 60 mmol·L-1 NaCl medium for 48 h. The mannitol group(120 mmol·L-1) had the same osmotic pressure as the high salt group(x±s, n=12).**P < 0.01 vs control. |
研究发现,在内皮细胞中,TRPV4对调节血管内皮细胞的功能稳态非常重要。TRPV4与TRPC1形成复合体是小动脉内皮细胞应答血流剪切力的关键分子[11]。NO通过cGMP/PKG负反馈调控通路,抑制TPRV4-TRPC1复合体的功能,进而维持内皮细胞的功能稳态[12]。猪冠状动脉平滑肌细胞和人内乳动脉平滑肌细胞中,TRPV4-TRPC1-KCa1.1功能复合体在维持血管功能稳态中具有重要作用[13-14]。最近的研究发现,在高血压病理状态下,内皮细胞中TPRV4-KCa2.3复合体解偶联,其调节的血管内皮舒张功能减弱是高血压发生的起始因素。NOS的活性对于NO的生成以及在血管中的作用具有巨大的影响[15]。TRPV4与NO均参与血管功能的调节,但TRPV4对NO的影响还不够详细,因此,本实验探究在高盐模型下,TRPV4对NO产生的影响。本实验研究结果表明,抑制TRPV4后,钙离子内流基本被废除,NO的生成大大降低。高盐诱导的胸主动脉内皮细胞模型中,TRPV4介导的Ca2+内流减少,从而抑制NOS的活性,进一步引起NO生成的减少。NO是一种有效的血管扩张剂以及重要的信号分子,其在血液循环中充当着重要的角色,高盐下通过抑制TRPV4通道引起的NO生成的减少,在某种程度上为揭示高血压形成原因提供了一个新的假想,为研究血管功能失衡提供了一个新的研究思路。
我们通过在ECM培养基中添加NaCl,使其浓度为60 mmol·L-1,将内皮细胞的培养基换成该含盐培养基培养48 h后,诱导形成高盐模型模拟病理状态。在该浓度下,细胞的形态与正常细胞类似,不会引起其形态的改变以及死亡。通过钙离子荧光探针Fluo-4对钙内流研究发现,加入TRPV4激动剂GSK1016790A后可以增加钙内流,但高盐组的幅度明显低于对照组,从而导致NOS活性降低,进一步导致NO的生成减少。通过DAF-FM DA对NO进行标记,发现相同荧光强度下,高盐组的荧光明显比对照组弱,进一步佐证高盐诱导会导致NO的生成减少。上述实验结果与抑制TRPV4所得到的结果一致,因此,可以推断高盐诱导抑制TRPV4的功能,从而导致内皮细胞钙内流减少,NOS活性降低,NO的生成降低。但该研究还有待于深入,此研究着眼于高盐模型下内皮细胞中的TRPV4对NO生成的影响及其机制,为血管功能稳态的失衡提供了新的研究思路及方向。
( 致谢: 本文实验在江南大学无锡医学院心血管研究室完成,感谢所有实验参与人员的大力帮助!)
| [1] |
郭晶晶, 李桂林. TRP离子通道在瘙痒中的作用及机制研究进展[J]. 中国药理学通报, 2019, 35(3): 301-5. Guo J J, Li G L. Role and mechanism of TRP ion channels in pruritus[J]. Chin Pharmacol Bull, 2019, 35(3): 301-5. doi:10.3969/j.issn.1001-1978.2019.03.002 |
| [2] |
Garcia-Elias A, Mrkonjiĉ S, Jung C, et al. The TRPV4 channel[J]. Handb Exp Pharmacol, 2014, 222(1): 293-319. |
| [3] |
仲元, 王娟, 施林领, 等. 去氧肾上腺素介导的孕期母体高盐饮食对子代肾血管功能影响的研究[J]. 中国药理学通报, 2017, 33(4): 492-7. Zhong Y, Wang J, Shi L L, et al. Effect of response to phenylephrine-mediated signal pathway in renal arteries of offspring rats induced by maternal high-salt diet[J]. Chin Pharmacol Bull, 2017, 33(4): 492-7. doi:10.3969/j.issn.1001-1978.2017.04.010 |
| [4] |
孙春原, 谢茗旭, 刘愈颖, 等. 高盐饮食增强内皮细胞TRPV4与cPLA2的空间耦联作用[J]. 中国药理学通报, 2016, 32(12): 1718-23. Sun C Y, Xie M X, Liu Y Y, et al. High salt diet enhances the physical coupling between TRPV4 and cPLA2[J]. Chin Pharmacol Bull, 2016, 32(12): 1718-23. doi:10.3969/j.issn.1001-1978.2016.12.016 |
| [5] |
Vanhoutte P M, Shimokawa H, Feletou M, Tang E H. Endothelial dysfunction and vascular disease-a 30th anniversary update[J]. Acta Physiol(Oxf), 2017, 219(1): 22-96. doi:10.1111/apha.12646 |
| [6] |
Vanhoutte P M, Zhao Y, Xu A, Leung S W. Thirty years of saying NO: sources, fate, actions, and misfortunes of the endothelium-derived vasodilator mediator[J]. Circ Res, 2016, 119(2): 375-96. doi:10.1161/CIRCRESAHA.116.306531 |
| [7] |
Knowles R G, Moncada S. Nitric oxide synthases in mammol[J]. Biochem J, 1994, 298(2): 249-58. doi:10.1042/bj2980249 |
| [8] |
Iyengar R, Stuehr D J, Marletta M A. Macrophage synthesis of nitrite, nitrate, and N-nitrosamines: precursors and role of the respiratory burst[J]. Proc Natl Acad Sci USA, 1987, 84(18): 6369-73. doi:10.1073/pnas.84.18.6369 |
| [9] |
Berridge M J. Inositol trisphosphate and calcium signalling mechanisms[J]. Biochim Biophys Acta, 2009, 1793(6): 933-40. doi:10.1016/j.bbamcr.2008.10.005 |
| [10] |
Berridge M J, Bootman M D, Roderick H L. Calcium signaling:dynamics, homeostasis and remodeling[J]. Nat Rev Mol Cell Biol, 2003, 4(7): 517-29. |
| [11] |
Ma X, Qiu S, Luo J, et al. Functional role of vanilloid transient receptor potential 4-canonical transient receptor potential 1 complex in flow-induced Ca2+ influx[J]. Arterioscler Thromb Vasc Biol, 2010, 30(4): 851-8. doi:10.1161/ATVBAHA.109.196584 |
| [12] |
Zhang P, Mao A Q, Sun C Y, et al. Translocation of PKG1α acts on TRPV4-C1 heteromeric channels to inhibit endothelial Ca2+ entry[J]. Acta Pharmacol Sin, 2016, 37(9): 1199-207. doi:10.1038/aps.2016.43 |
| [13] |
Zhang P, Ma Y, Wang Y, et al. Nitric oxide and protein kinase G act on TRPC1 to inhibit 11, 12-EET-induced vascular relaxation[J]. Cardiovasc Res, 2014, 104(1): 138-46. doi:10.1093/cvr/cvu190 |
| [14] |
Ma Y, Zhang P, Li J, et al. Epoxyeicosatrienoic acids act through TRPV4-TRPC1-KCa1.1 complex to induce smooth muscle membrane hyperpolarization and relaxation in human internal mammol arteries[J]. Biochim Biophys Acta, 2015, 1852(3): 552-9. doi:10.1016/j.bbadis.2014.12.010 |
| [15] |
Zhang P, Sun C, Li H, et al. TRPV4(transient receptor potential vanilloid 4) mediates endothelium-dependent contractions in the aortas of hypertensive mice[J]. Hypertension, 2018, 71(1): 134-42. doi:10.1161/HYPERTENSIONAHA.117.09767 |

