

肝细胞性肝癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤,由于其恶性程度高,治疗方法有限,多数患者就诊时已属晚期,其预后较差[1]。随着分子生物学和肿瘤基因组学的研究进步,越来越多的与肝癌发展相关的分子生物学机制被证实[2-4],因此,作用于相关靶点药物的研究具有重要意义。研究表明,细胞内mRNA翻译的失衡在肿瘤的发展中具有重要作用[5],EIF4A1作为真核起始因子4F(eukaryotic initiation factor 4F,EIF4F)复合物中含量最丰富的亚基,在翻译起始阶段调控着蛋白质的合成过程[6-7]。已有文献报道,EIF4A1的表达与某些肿瘤的发生、发展相关,如肺癌、乳腺癌、宫颈癌等[8-10],但是EIF4A1与HCC的发展是否存在联系,并没有相关研究。
七叶皂苷钠(sodium aescinate)是来源于中药婆罗子的提取物之一,作为提取成分中含量最高的提取物,七叶皂苷钠具有较高的临床应用价值,包括抗炎、抗氧化、保护血管、纠正脑功能失常等生物学作用[11],但是其是否具有抗肿瘤作用却鲜有研究。本课题组在前期研究中证实,七叶皂苷钠具有抑制肝癌细胞系生长增殖的作用,但其作用机制尚不完善。本研究中,我们将在HCC患者的组织标本中检测EIF4A1的表达情况,并结合临床数据及随访信息分析其相关性;再进一步探索七叶皂苷钠抑制肝癌细胞系的分子生物学机制。
1 材料与方法 1.1 材料 1.1.1 组织标本与临床信息收集安徽医科大学第二附属医院普外科2008年至2015年间,以及安徽医科大学第一附属医院2000年至2015年间HCC患者的肿瘤标本及每位患者的病例信息,共100例。期间对100名患者进行间隔为3个月1次的随访,随访内容包括病人生存情况、血清AFP、肝功能、HBV-DNA以及超声检查。最后随访日期为2018年7月30日。上述所有标本在收集及运输过程中均有低温保护措施,并于标本库-80 ℃长期保存。通过术前诊断,所有纳入患者均未进行任何抗癌治疗,病人的CT、磁共振等影像学检查结果显示肿瘤未发生远处器官的转移,所有病人的手术治疗均满足根治性切除的标准。最终由于失访及临床资料缺失等原因,共有80例纳入研究。80例标本组织交由武汉艾薇儿公司进行组织切片的制作,每例4张。本研究已通过安徽医科大学附属医院伦理审查委员会的批准。
1.1.2 药物与试剂七叶皂苷钠(CFN99509,ChemFaces);超灵敏两步免疫组织化学套盒PV-9001(北京中杉金桥生物技术有限公司);兔抗EIF4E单克隆抗体(ab76256)、兔抗EIF4A1多克隆抗体(ab31217),均购自Abcam公司;凋亡试剂盒(556547,BD公司);Trizon Reagent(美国Invitrogen Life Technologies公司);PrimeScriptTMRT Master Mix(TaKaRa公司);免疫荧光染色试剂盒-抗兔Cy3(碧云天公司)。
1.1.3 细胞系肝癌细胞株HepG2、人正常肝细胞株L02,均购自上海生命科学院细胞典藏库。
1.1.4 仪器Western blot显影仪(天能公司);精密恒温二氧化碳细胞培养箱、qPCR仪(Thermo Fisher公司);酶标仪(上海科华生物工程股份有限公司);荧光显微镜(奥林巴斯公司);流式细胞仪(美国贝克曼库尔特公司)。
1.2 方法 1.2.1 免疫组化按步骤进行免疫组织化学染色:先将切片置于70 ℃温箱中30 min进行脱蜡,再于二甲苯中进一步脱蜡,接着依次用无水乙醇、95%乙醇、70%乙醇、50%乙醇进行脱水处理,在高温压力锅中放置装有枸橼酸钠缓冲液的切片盒,切片于其中进行抗原修复3 min。用3%过氧化氢进行内源性过氧化物酶阻断后,用牛血清白蛋白(BSA)封闭1 h。接着4 ℃冰箱中孵育一抗(1 :100)过夜。d 2常温孵育二抗1 h后,进行DAB染色。显微镜下观察结果。
1.2.2 细胞培养DMEM高糖培养基加入10%血清和1%双抗用于细胞系的培养,培养条件为37 ℃,CO2浓度为5%。每3 d进行培养基更换,每5 d用含有EDTA的胰酶消化后进行传代,细胞离心速度1 500 r·min-1×5 min。
1.2.3 Western blot检测用七叶皂苷钠(40 μmol·L-1)处理6孔板种植的细胞72 h后,在6孔板中加入RIPA和蛋白酶抑制剂混合液(100 :10),30 min后离心提取蛋白。BCA试剂盒测定蛋白浓度。在10% SDS聚丙烯酰胺凝胶孔中加入等体积、等浓度的蛋白样品,进行凝胶电泳,浓缩胶电泳条件80 V、30 min,分离胶电泳条件120 V、60 min。200 mA恒定电流转膜1 h后用BSA封闭,4 ℃过夜孵育一抗(1 :1 000),次日TBST清洗10 min×3次后,室温孵育二抗(1 :10 000)1 h,显影拍照,运用ImageJ测量灰度值分析。
1.2.4 qPCR检测在6孔板中种植细胞后,加药组经七叶皂苷钠(40 μmol·L-1)处理72 h后,每孔加800 μL Trizon,冰上消化10 min后,按5 :1的比例加氯仿,置于冰上待其分层后离心,取上清液,再加入与上清液等体积的异丙醇,于-20 ℃冰箱助沉30 min后离心,用无酶水配制的75%乙醇洗涤后离心、干燥,加入20 μL无酶水,震荡离心。RNA提取完成后测浓度,定量;在10 μL体系下进行逆转录,于八连管中进行qPCR。引物序列见Tab 1。
| Gene | Sequences(5′-3′) |
| EIF4A1 | F:CTGGCCGTGTGTTTGATATG |
| R:TGTCCAGCTTCCACTCCTCT | |
| GAPDH | F:GGAGCGAGATCCCTCCAAAAT |
| R:GGCTGTTGTCATACTTCTCATGG |
采用细胞爬片技术将细胞种植于6孔板中,七叶皂苷钠(40 μmol·L-1)处理72 h结束后,用4%的多聚甲醛固定15 min,0.03% Triton X-100穿孔、封闭,再于4 ℃冰箱中过夜孵育一抗(1 :1 000)。次日室温下避光孵育荧光二抗1 h,DAPI染色2 min后,用PBS清洗干净,DAKO封片后避光干燥,荧光显微镜下拍摄结果。
1.2.6 流式细胞术检测细胞凋亡细胞种于6孔板中,在七叶皂苷钠(40 μmol·L-1)处理72 h后消化计数,预冷的PBS洗涤。将离心后的细胞用1×PBS缓冲液重悬并计数,将浓度稀释为1×109·L-1,取100 μL细胞悬液加入流式管中,再用5 μL Annexin V和5 μL PI进行细胞标记,于室温下避光孵育15 min。完成后用缓冲液将流式管中细胞悬液补充至500 μL,1 h内用流式细胞仪检测凋亡。
1.2.7 Transwell实验检测细胞迁移能力细胞接种6孔板,七叶皂苷钠(40 μmol·L-1)处理72 h后消化细胞,用未加血清的DMEM重悬细胞并计数。将细胞浓度稀释为每毫升2×104个细胞,于Transwell小室加入200 μL稀释后的细胞悬液。培养24 h后甲醇固定,结晶紫染色。纯水洗净染液后,用棉签将小室内的细胞擦拭干净,于倒置显微镜下观察并拍摄结果。
1.2.8 MTT实验取对数生长期的HepG2细胞,以每孔3×103个细胞接种96孔板,用1、2、4、6、8、10 μmol·L-1的索拉非尼处理细胞72 h,每个浓度设两个复孔,每组设置1个对照组。72 h后每孔加入10 μL MTT溶液(2.5 g·L-1),37 ℃孵育4 h后,每孔加入150 μL异丙醇,震荡溶解10 min,使用酶标仪在570 nm测量吸光度值,计算细胞存活率。
1.2.9 统计学分析采用SPSS 17.0软件进行数据分析。临床指标与蛋白表达相关性分析采用卡方检验。通过ImageJ软件进行蛋白灰度值的测量及迁移实验细胞的计数,结果通过T检验分析;Gehan-Breslow-Wilcoxon test用于生存曲线差异性检验。
2 结果 2.1 EIF4A1在肝癌组织中高表达,且其与肿瘤组织分化、直径及病人生存期相关80名患者的各项临床指标及EIF4A1的表达情况见Tab 2。免疫组织化学染色结果显示(Fig 1A),在44例高表达患者中,肿瘤组织细胞质中EIF4A1的表达量相较于癌旁组织明显增高。结合临床数据提示,EIF4A1的高表达与肿瘤病理学分化及肿瘤大小两项临床指标呈正相关,且差异具有统计学意义(P < 0.01)。而在性别、年龄、血清AFP、HBV-DNA、Child分级等指标中的表达,差异无统计学意义。生存分析显示(Fig 1B),EIF4A1低表达的病人生存期明显偏高,较EIF4A1高表达病人的生存期差异有统计学意义(P < 0.05)。
| Clinical characteristics | All samples (n=80) |
High expression (n=44) |
Low expression (n=36) |
P |
| Gender(Male/Female) | 0.499 | |||
| Male | 71 | 40 | 31 | |
| Female | 9 | 4 | 5 | |
| Age(years) | 0.628 | |||
| <52 | 49 | 28 | 21 | |
| >52 | 31 | 16 | 15 | |
| AFP/μg·L-1 | 0.716 | |||
| Positive(>20) | 55 | 31 | 24 | |
| Negative(<20) | 25 | 13 | 12 | |
| Cirrhosis | 0.624 | |||
| Yes | 51 | 27 | 24 | |
| No | 29 | 17 | 12 | |
| HBV-DNA | 0.964 | |||
| Yes | 38 | 21 | 17 | |
| No | 42 | 23 | 19 | |
| Child-Pugh | 0.442 | |||
| A | 77 | 43 | 34 | |
| B | 3 | 1 | 2 | |
| Differentiation | 0.009 | |||
| Poorly | 23 | 18 | 5 | |
| Moderately | 38 | 20 | 18 | |
| Well | 19 | 6 | 13 | |
| Tumor number | 0.974 | |||
| Single | 69 | 38 | 31 | |
| Multiple | 11 | 6 | 5 | |
| Tumor size | 0.009 | |||
| <5 cm | 36 | 14 | 22 | |
| >5 cm | 44 | 30 | 14 |

|
| Fig 1 Expression of EIF4A1 in tumor tissues and adjacent paracancerous tissues and its subsistence analysis A:Expression of EIF4A1 in tumor tissues was significantly higher than that in paracancerrous tissues; B:Patients with low expression of EIF4A1 had a relatively long survival period, with significant statistical differences(P=0.0056). |
本课题组在前期研究中通过MTT实验,已获得七叶皂苷钠抑制肝癌细胞系增殖的IC50结果[12](IC50=46 μmol·L-1)。本研究延用40 μmol·L-1七叶皂苷钠处理HepG2和L02细胞系72 h后,通过Transwell实验发现(Fig 2A),加药后的HepG2细胞迁移能力明显降低(P < 0.01), 正常肝细胞系L02经七叶皂苷钠处理后,迁移能力与对照组比较差异无统计学意义。

|
| Fig 2 Changes in apoptotic rate and migration ability of two cell lines after sodium aescinate treatment(x±s,n=3) A:Transwell was used to detect the change of migration ability of two cell lines after sodium aescinate treatment; B:After sodium aescinate treatment, the apoptosis rate of HepG2 significantly increased; however, sodium aescinate had little effect on the apoptotic rate of L02. **P < 0.01 vs control. |
流式细胞仪检测结果显示(Fig 2B),40 μmol·L-1七叶皂苷钠处理后,HepG2细胞的凋亡率明显增高,而正常肝细胞的凋亡率无明显变化。
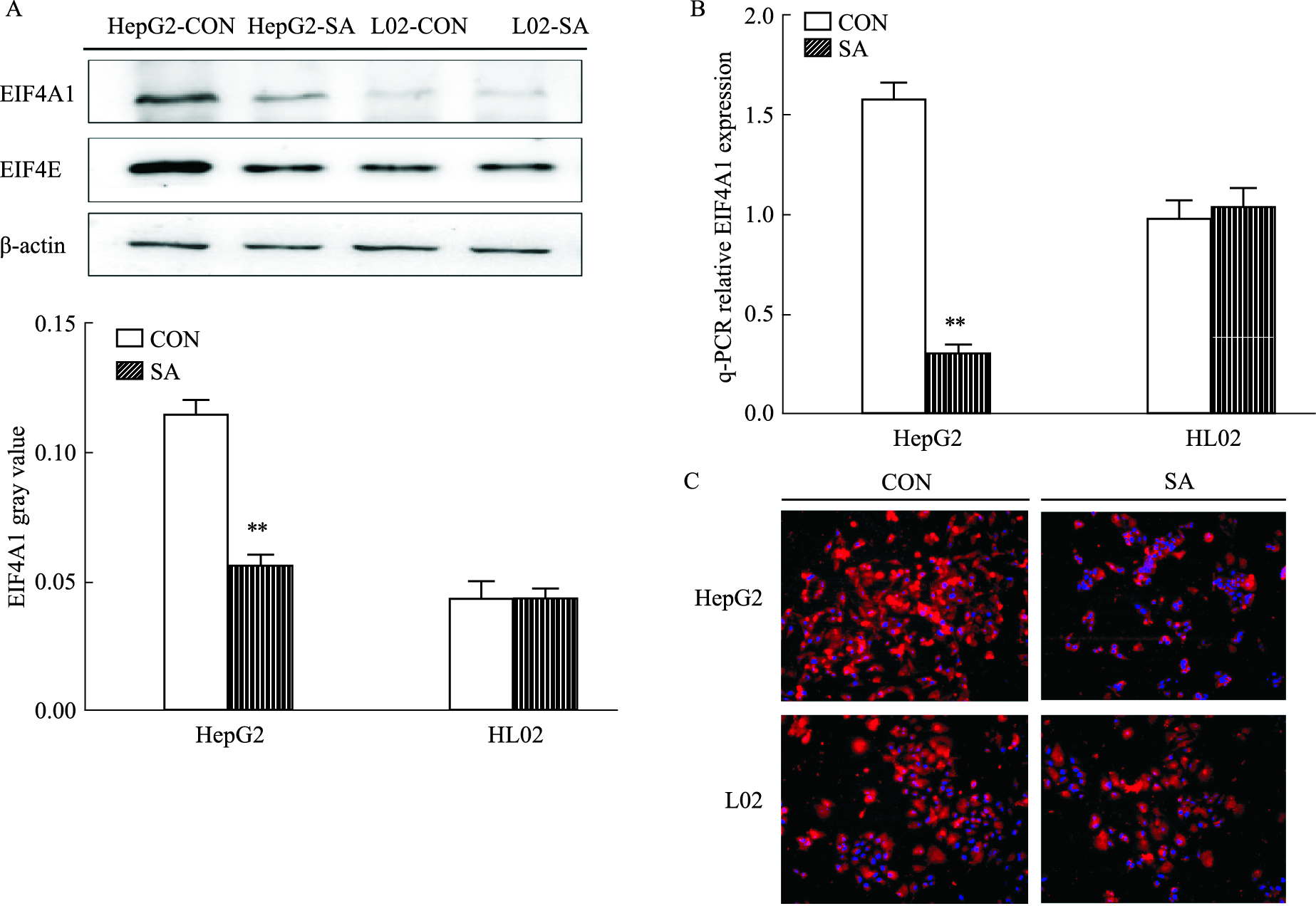
2.4 七叶皂苷钠下调HepG2细胞EIF4A1的表达Western blot实验发现(Fig 3A),40 μmol·L-1七叶皂苷钠处理HepG2及L02细胞后,HepG2细胞中EIF4A1的表达量明显下调,作为EIF4A1首要激活物,EIF4E的表达量也同时降低(P < 0.01),而正常肝细胞系中EIF4A1的表达组间差异无统计学意义。细胞免疫荧光实验也发现(Fig 3C),七叶皂苷钠可明显下调HepG2中EIF4A1的表达,结果与Western blot一致。qPCR结果显示(Fig 3B),七叶皂苷钠明显下调HepG2细胞中EIF4A1 mRNA水平,差异具有统计学意义(P < 0.01)。
|
| Fig 3 Expression of EIF4A1 in two cell lines after sodium aescinate treatment(x±s,n=3) A:Western blot was used to detect the expression of EIF4A1 and EIF4E; B:qPCR in HepG2 decreased after sodium aescinate treatment; C:Immunofluorescence was used to detect the expression of EIF4A1 in two cell lines. **P < 0.01 vs control. |
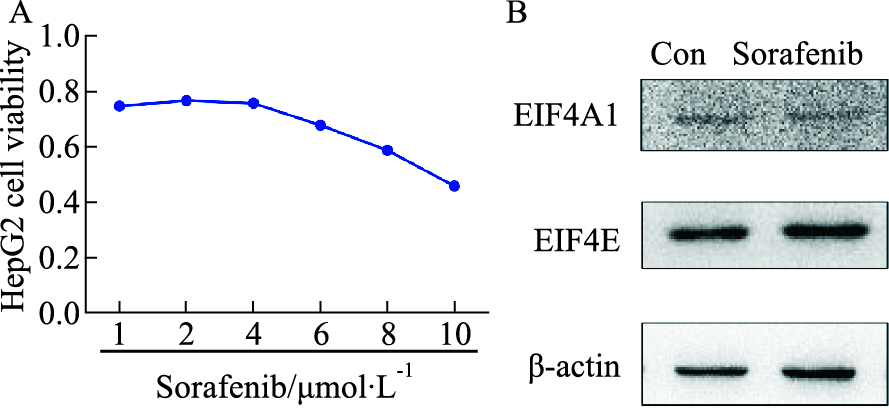
MTT实验发现(Fig 4A),索拉非尼对HepG2细胞的增殖具有抑制作用, 且有浓度依赖性。用10 μmol·L-1的索拉非尼处理HepG2细胞72 h后提取蛋白,Western blot实验发现(Fig 4B),索拉非尼抑制HepG2细胞生长的同时,不影响EIF4A1及EIF4E的表达。
|
| Fig 4 Effect of sorafenib on HepG2 cell line(x±s,n=3) A:Effect of different concentrations of sorafenib on HepG2 for 72 h; B:Western blot was used to detect the expression of EIF4A1 and EIF4E in HepG2 at a concentration of 10 μmol·L-1 for 72 h. |
七叶皂苷钠作为临床常用的消炎驱肿药物,在肿瘤治疗方面的相关研究较少,有研究提示七叶皂苷钠在乳腺癌中具有一定的抗肿瘤作用[13],但其在肝癌中是否具有抑制作用及其分子机制并不清楚。我们前期的研究结果证明,七叶皂苷钠可通过NF-κB信号通路,抑制肝癌细胞系的增殖,并且对正常肝细胞系(HL-02)无毒副作用[12]。此外,七叶皂苷钠与目前HCC一线治疗药物索拉菲尼相比,能达到相似的肝癌细胞系抑制作用。这些研究均证实了七叶皂苷钠在抗肿瘤方面具有一定的潜在价值。
在本研究中,我们进一步从mRNA翻译的调控方面,探索七叶皂苷钠抑制HCC更深入的分子生物学机制。EIF4A1作为真核起始因子复合物EIF4F的重要组成部分,在mRNA翻译调控进程中起着解螺旋酶的功能[14],因此,EIF4A1的表达对mRNA翻译的调控起着重要的调节作用。本课题通过高通量组织切片分析发现,EIF4A1的表达对肝癌组织的分化及大小有重要影响,EIF4A1高表达的患者,肿瘤趋向低分化且肿瘤体积偏大;并且通过生存分析发现,EIF4A1高表达的患者的术后生存时间明显降低。这些结果提示翻译起始因子EIF4A1在肝癌的发生、发展中具有一定的作用。通过体外实验发现,七叶皂苷钠抑制肝癌细胞系增殖的同时,可下调EIF4A1的表达,而且诱导肝癌细胞系凋亡及抑制其迁移能力。这些作用可能是七叶皂苷钠作用于EIF4A1得到的综合结果。而在正常肝细胞系中,这种现象却不明显。通过索拉非尼对照实验发现,作为唯一批准用于HCC的一线分子靶向药物,索拉非尼在抑制肝癌细胞系增殖的基础上,并不会对EIF4A1及EIF4E产生影响。这进一步证明了七叶皂苷钠的独特作用机制。目前,临床上用于肝癌治疗的主要一线药物只有索拉非尼,但是由于其耐药情况,加之较高的价格,并不能为多数患者所接受,所以发现一种新的有效药物迫在眉睫。在后期的研究中,我们将进一步完善七叶皂苷钠在HCC中的作用机制,并为其临床应用提供研究基础。
| [1] |
中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 中华消化外科杂志, 2017, 16(7): 705-20. Health and Family Planning Commission of the People's Republic of China. Primary liver cancer diagnosis and treatment specification (2017 edition)[J]. Chin J Digestive Surgery, 2017, 16(7): 705-20. |
| [2] |
Cui S X, Shi W N, Song Z Y, et al. Des-gamma-carboxy prothrombin antagonizes the effects of Sorafenib on human hepatocellular carcinoma through activation of the Raf/MEK/ERK and PI3K/Akt/mTOR signaling pathways[J]. Oncotarget, 2016, 7(24): 36767-82. |
| [3] |
Yang S, Luo C, Gu Q, et al. Activating JAK1 mutation may predict the sensitivity of JAK-STAT inhibition in hepatocellular carcinoma[J]. Oncotarget, 2016, 7(5): 5461-9. |
| [4] |
Wang R, Sun Q, Wang P, et al. Notch and Wnt/beta-catenin signaling pathway play important roles in activating liver cancer stem cells[J]. Oncotarget, 2016, 7(5): 5754-68. |
| [5] |
Le Quesne J P, Spriggs K A, Bushell M. Dysregulation of protein synthesis and disease[J]. J Pathol, 2010, 220(2): 140-51. |
| [6] |
Boussemart L, Malka-Mahieu H, Girault I, et al. eIF4F is a nexus of resistance to anti-BRAF and anti-MEK cancer therapies[J]. Nature, 2014, 513(7516): 105-9. doi:10.1038/nature13572 |
| [7] |
Svitkin Y V, Pause A, Haghighat A, et al. The requirement for eukaryotic initiation factor 4A (elF4A) in translation is in direct proportion to the degree of mRNA 5' secondary structure[J]. RNA, 2001, 7(3): 382-94. doi:10.1017/S135583820100108X |
| [8] |
Ji P, Diederichs S, Wang W, et al. MALAT-1, a novel noncoding RNA, and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer[J]. Oncogene, 2003, 22(39): 8031-41. doi:10.1038/sj.onc.1206928 |
| [9] |
Liang S, Zhou Y, Chen Y. Decreased expression of EIF4A1 after preoperative brachytherapy predicts better tumor-specific survival in cervical cancer[J]. Int J Gynecol Cancer, 2014, 24(5): 908-15. doi:10.1097/IGC.0000000000000152 |
| [10] |
Modelska A, Turro E, Russell R, et al. The malignant phenotype in breast cancer is driven by eIF4A1-mediated changes in the translational landscape[J]. Cell Death Dis, 2015, 6: e1603. |
| [11] |
李珊, 马玲云, 李向日, 等. 中药娑罗子的现代研究进展[J]. 亚太传统医药, 2012, 08(8): 178-81. Li S, Ma L Y, Li X R, et al. Advances in modern research on Chinese medicine Semen Aesculi[J]. Asia-Pacific Tradit Med, 2012, 08(8): 178-81. doi:10.3969/j.issn.1673-2197.2012.08.100 |
| [12] |
李未祥, 周大臣, 王石, 等. 七叶皂苷钠通过CARMA3/NF-κB信号通路抑制肝癌细胞的增殖[J]. 中国药理学通报, 2018, 34(9): 1243-8. Li W X, Zhou D C, Wang S, et al. Sodium aescinate inhibits the proliferation of hepatocellular carcinoma through the CARMA3/NF-κB signaling pathway[J]. Chin Pharmacol Bull, 2018, 34(9): 1243-8. |
| [13] |
齐世美, 吕俊, 孟宇, 等. 七叶皂苷钠通过抑制AKT, ERK上游信号SRC活性诱导人乳腺癌MCF-7细胞凋亡[J]. 中国中药杂志, 2015, 40(16): 3267-72. Qi S M, Lyu J, Meng Y, et al. Effect of sodium aescinate in inducing human breast cancer MCF-7 cells apoptosis by inhibiting AKT, ERK and upstream signal SRC activity[J]. Chin J Chin Mater Med, 2015, 40(16): 3267-72. |
| [14] |
Feoktistova K, Tuvshintogs E, Do A, Fraser C S. Human eIF4E promotes mRNA restructuring by stimulating eIF4A helicase activity[J]. Proc Natl Acad Sci USA, 2013, 110(33): 13339-44. doi:10.1073/pnas.1303781110 |

