

2. 哈尔滨商业大学,黑龙江 哈尔滨 150000
孙晓波(1958-),男,博士,教授,博士生导师,研究方向:中药及复方药效物质基础及分子机制,通讯作者,E-mail: sun-xiaobo@163.com
2. Harbin University of Commerce, Harbin 150000, China
免疫系统在决定中风后患者大脑状况和生存状态时发挥重要作用[1]。小胶质细胞/巨噬细胞是机体免疫系统中的主要细胞,对中枢神经系统(central nervous system,CNS)的修复和再生起重要作用。除了对神经系统的保护作用外,小胶质细胞/巨噬细胞也是促炎细胞因子的主要产生者[2],其可以极大地抑制脑修复和神经发生。因此,小胶质细胞/巨噬细胞的双重作用也可阻碍脑卒中后大脑的修复。炎症微环境极大地影响小胶质细胞/巨噬细胞的表型变化,从而使同一脑组织在受损的不同阶段具有不同的基因表达模式和生物功能。大量文献报道发现,由脂多糖(lipopolysaccharide,LPS)和干扰素γ(interferon-γ)诱导的小胶质细胞/巨噬细胞的M1表型主要表现出对大脑的破坏性作用,而由白介素4(interleukin 4,IL-4)和白介素10(interleukin 10,IL-10)诱导的M2表型对大脑具有神经保护作用[3]。因此,促进M2表型和抑制M1表型可能有益于脑卒中后的神经恢复。本文将近年来国内外小胶质细胞/巨噬细胞的极化及在脑卒中修复中的作用进行综述。
1 脑卒中后小胶质细胞/巨噬细胞的极化小胶质细胞/巨噬细胞的极化使它们成为神经修复过程中的双刃剑,并使大脑恢复正常功能变得复杂。小胶质细胞/巨噬细胞表型改变的复杂性受多种因素的影响,例如损伤、衰老和其它不同的病理生理条件。另外,Schwartz等[4]认为,在特定环境中获得的小胶质细胞表型可能导致特异性功能,从而使其更具破坏性或更具保护性。与此相符,小胶质细胞/巨噬细胞的双刃剑角色可以解释如下:经典激活途径极化成M1亚型的小胶质细胞/巨噬细胞通常被认为促进脑损伤,而选择性激活途径极化成M2亚型的小胶质细胞/巨噬细胞具有神经保护特性,其机制包括产生抗炎细胞因子,增强吞噬作用以清除细胞碎片等。
小胶质细胞/巨噬细胞的不同表型代表其激活状态的两个极端动态变化。小胶质细胞/巨噬细胞的M1型极化导致抑制CNS恢复的促炎介质释放,而M2型极化引起抗炎细胞因子的释放可促进组织的再生和修复。在缺血性脑卒中后,脑内皮质和纹状体中出现动态小胶质细胞的极化,M1型极化的典型特征包括高表达促炎细胞因子,如TNF-α、IL-6、IL-1、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、CD11b和CD16等;相反,M2型极化的特征在于高表达精氨酸酶-1、CD206、IL-10、TGF-β、IL-4等[3]。最近,越来越多的证据表明,小胶质细胞/巨噬细胞群体的M1-M2极化在中风引起的脑损伤中起关键作用,尤其是M2亚型的小胶质细胞/巨噬细胞在促进脑修复过程中起重要作用,包括神经发生、血管生成、轴突重塑及髓鞘再生等[3, 5]。因此,阐明M1向M2亚型过渡的机制可能为脑卒中提供新的和有针对性的治疗方法(Fig 1)。
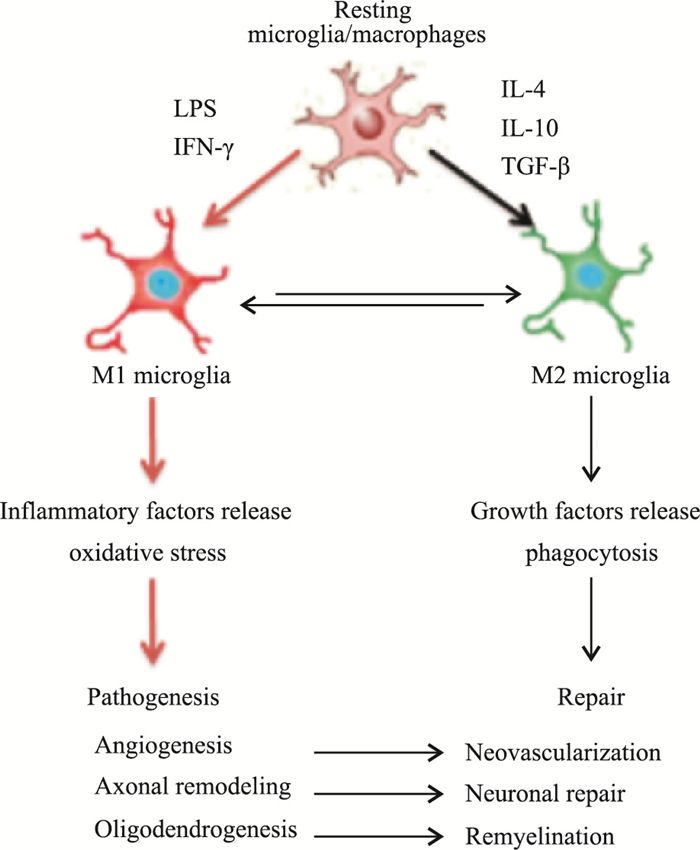
|
| Fig 1 Microglia polarization after ischemic stroke |
小胶质细胞/巨噬细胞对特定的局部信号进行M1/M2极化反应。中枢神经系统损伤后,损伤部位被激活的小胶质细胞和巨噬细胞大部分表达M2型标记基因,而在受损后约1周时,它们主要表达M1型标记基因[3, 6]。此外,小胶质细胞/巨噬细胞表型在缺血核心区到半影区有不同的表达模式。随着时间的推移,梗死区域的局部小胶质细胞和新募集的巨噬细胞从M2表型逐渐转变为M1表型。而最近的一项研究表明,在卒中后的2周内,单核细胞衍生的巨噬细胞逐渐发展为抗炎症表型,这有助于小鼠自发的长期功能恢复。在围产期动脉缺血性脑卒中中,小胶质细胞在3 d时高表达M2型标记物CD206,在7 d时高表达M1型标记物MHC Ⅱ。然而,在12 h时观察到脑出血(intracerebral hemorrhage, ICH)诱导的具有高表达M1型标记基因的小胶质细胞被激活,而M2型标记基因的表达在前2周逐渐增加[7]。这些结果表明,小胶质细胞/巨噬细胞极化的空间和时间动态特征可能与损伤严重程度和不同疾病模型有关。另外,性别对小胶质细胞/巨噬细胞的极化同样有影响。例如,缺血性脑卒中后,♀小鼠中小胶质细胞M2型标记基因的表达高于♂小鼠[8]。除了损伤的严重程度和性别之外,年龄是影响小胶质细胞/巨噬细胞表型的另一个关键因素。缺血性脑卒中后,老年小鼠M2型标记基因比成年小鼠明显减少[5],表明缺血性脑卒中后老年小鼠身体机能的退化与M2型小胶质细胞/巨噬细胞极化的减少相关。
1.2 脑卒中后M1/M2极化的功能改变作为中枢神经系统中最重要的用于感知危险信号的免疫细胞,脑卒中发生后,小胶质细胞/巨噬细胞迅速作出反应,通过获得不同的功能表型:M1和M2极化表型来防止脑损伤。然而,激活的小胶质细胞和巨噬细胞在大脑炎症环境中有不同的作用。例如,在巨噬细胞吞噬和炎症反应中,巨噬细胞可以不依赖于它们的M1或M2表型产生细胞毒性,而天然小胶质细胞似乎可以优先清除碎片,从而发挥保护作用[9]。这些结果表明,M2型小胶质细胞似乎比M2型巨噬细胞更具保护性,其中一部分原因可能是由其天然基因表达特征来决定。
在体外脑缺血模型中,糖氧剥夺引起的神经元损伤可诱导小胶质细胞向M1表型极化,从而加剧了糖氧剥夺(oxygen glucose deprivation,OGD)诱导的神经元死亡,而M2型小胶质细胞保护神经元,以抵抗OGD诱导的神经元死亡。这可能与M2表型可以促进脑缺血后碎片的吞噬及促进受伤组织的修复有关。另外,研究人员将M1或M2型小胶质细胞加入OGD处理后的脑组织切片中,发现M1型小胶质细胞对神经元的存活有害,而M2型小胶质细胞在OGD处理后,对海马CA1和CA3区的神经元具有保护作用。这些结果表明,小胶质细胞极化在缺血性脑卒中病理中发挥着不同的功能。因此,减少脑卒中后M1型小胶质细胞数量,并促进其向M2型过渡可能会获得更好的治疗效果。
此外,M2型极化小胶质细胞的长期累积也意味着脑卒中后持续神经发生的支持作用,并且M2型极化对CNS再生中的高效髓鞘再生至关重要。M2型的激活伴随着损伤病灶周围的血管形成,加速组织重塑和功能恢复的改善。因此,M2型巨噬细胞似乎是减少神经元细胞丢失更好的治疗选择。然而,在大脑中动脉栓塞法(middle cerebral artery occlusion,MCAO)模型中,静脉注射M2型巨噬细胞并不能明显改善预后[10]。细胞治疗脑卒中的失败表明,只有天然单核细胞激活以增加M2型巨噬细胞数量,才对脑卒中的预后具有有益的治疗效果。
总之,阐明在脑卒中后不同时间点切换M1/M2表型的调节机制可以提供更好的治疗策略,在正确的时间靶向调节小胶质细胞/巨噬细胞表型,以获得治疗脑卒中的最佳方案。
1.3 脑卒中后小胶质细胞/巨噬细胞M1/M2极化的分子路径越来越多的研究涉及脑卒中损伤引起的M1/M2转变的调节机制,并且确定细胞外到细胞内信号转导的途径将为发现脑卒中治疗的潜在靶点提供新的见解。通常,LPS和IL-4分别被认为是M1和M2表型的经典诱导物。例如,在LPS诱导的小鼠神经炎症模型中,小胶质细胞中脂质运载蛋白2的表达明显增加,表现出M1型相关基因表达的明显增加[11]。针对局部脑缺血,坏死神经元释放的IL-4有助于卒中后脑组织修复,这种效应归因于IL-4引起M1表型细胞的减少和M2表型细胞的诱导。因此,作为表型介质的IL-4通过促进M2表型转变而作为缺血性脑卒中治疗的潜在靶标。
此外,我们发现调节性T淋巴细胞通过IL-10/GSK-3β/PTEN轴调节小胶质细胞/巨噬细胞向M2表型极化,来改善ICH诱导的炎症损伤,在肌萎缩侧索硬化症小鼠模型中发现了类似的结果[12]。相应地,Ly6Chi单核细胞也显示在缺血性中风后发挥急性保护作用,并通过促进M2型巨噬细胞极化的机制来降低脑损伤风险[13]。
之前研究报道,IL-4诱导的M2型转换促进与脑卒中后小胶质细胞中过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated-receptor gamma,PPARγ)的激活相关[14],这与PPARγ激活引发单核细胞分化成M2型巨噬细胞的结果一致。微小核糖核酸(microRNA,miRNA)调节小胶质细胞/巨噬细胞极化的研究进一步说明了调控M1或M2型基因表达细胞内分子机制的复杂性。因为不同的miRNA分布会影响小胶质细胞/巨噬细胞的极化。此外,信号转导和转录激活子(signal transducers and activators of transcription,STAT)家族成员,例如STAT1、STAT3和STAT6在调节M1或M2基因表达和小胶质细胞/巨噬细胞的表型转换中具有关键作用[3]。例如,缺乏STAT6导致无法建立响应于IL-4和高密度脂蛋白(high density lipoprotein,HDL)刺激的M2表型。脑出血后,CX3CR1缺失阻碍了小胶质细胞向M2表型的转换[15]。
目前关于调控小胶质细胞和巨噬细胞极化的证据主要集中在细胞内分子机制上,而控制细胞外信号传导机制的有限信息主要来自对外周巨噬细胞的研究,这些复杂的细胞内调控分子网络将大大影响开发脑卒中后干预的有效靶标能力。因此,找出关键的上游控制分子或促进M2型极化或抑制M1型转换的调节网络的关键点,将产生更有效的治疗脑卒中的方法。
2 参与调节小胶质细胞/巨噬细胞极化的物质 2.1 受体和小分子最近的研究表明,A类清道夫受体(class A scavenger receptor,SR-A)和大麻素2型受体(cannabinoid 2 receptor,CB2R)参与调节缺血性脑卒中的小胶质细胞/巨噬细胞极化。在SR-A敲除小鼠中,与对照小鼠相比,缺血脑中F4/80+和CD11b+巨噬细胞和CD16/32+ M1型小胶质细胞的数目减少,而F4/80+ CD206+ M2型小胶质细胞的数目增加。SR-A的缺失能够减少缺血引起的炎症聚集和梗死体积,伴随M1型小胶质细胞/巨噬细胞相关基因TNF-α、iNOS、人单核趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)和IL-1β的较低表达,以及M2型小胶质细胞/巨噬细胞相关基因IL-10的较高表达[16]。在CB2R敲除小鼠中,脑梗死体积增加,并且神经损伤更严重。在MCAO后10 min或3 h腹腔注射CB2R激动剂JWH-133可逆转该现象。WH-133治疗也降低了Iba1+小胶质细胞的激活,同时伴有M1和M2型小胶质细胞/巨噬细胞标志物的低表达。
IL-10敲除小鼠的研究表明,IL-10缺乏加剧了脑缺血损伤,并减少了M2型小胶质细胞/巨噬细胞标志物的表达,表明IL-10在调节小胶质细胞/巨噬细胞向M2型的极化过程中至关重要。在自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型中,慢病毒介导的IL-25基因的传递,促进了小胶质细胞/巨噬细胞向M2型的极化,体现在M2型标记精氨酸酶1,CD206和Ym1的高表达[17]。研究表明,TGF-β可以诱导小胶质细胞/巨噬细胞极化为M2表型。另一方面,小胶质细胞/巨噬细胞的M2型极化可以产生TGF-β,并参与促进IL-4介导的小胶质细胞/巨噬细胞M2型极化,增强小胶质细胞对IL-4反应的敏感性。
总之,小胶质细胞/巨噬细胞极化是一个多分子调节的复杂过程。了解这些分子在缺血环境下如何调节小胶质细胞/巨噬细胞极化,可以帮助我们将小胶质细胞/巨噬细胞转化到保护型表型,从而保护大脑免受缺血性损伤。
2.2 miRNAs越来越多的证据表明,miRNAs在CNS疾病的病理生理中发挥重要作用,包括阿尔茨海默病(Alzheimer′s disease,AD)、帕金森病(Parkinson′s disease,PD)、EAE、多发性硬化症(multiple sclerosis,MS)、肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)和脑卒中。现已发现几种miRNAs与CNS疾病中的小胶质细胞活化或小胶质细胞极化有关。miRNAs的差异表达可影响小胶质细胞极化,并影响小胶质细胞在脑损伤或组织修复中的功能。
miR-124在miRNAs中是独特的,在CNS中能够选择性表达,并且在神经元中高表达[18]。在斑马鱼模型中,miR-124特异性地在小胶质细胞中过度表达。miR-926过表达不会引起小胶质细胞的形态变化,但会降低小胶质细胞活性和清除凋亡细胞的能力。相反,斑马鱼中miR-124的消耗增强了小胶质细胞的运动性和吞噬作用。这些结果表明,miR-124的稳定表达对小胶质细胞的成熟很重要[19]。
在正常生理条件下,未活化的小胶质细胞表达高水平的miR-124,主要表达M2型标记物,例如Fizz1、Ym1、IL-10和IL-4。在病理条件下,通过促炎细胞因子刺激或在EAE模型中,活化的小胶质细胞显示出上调的M1型标志物(如MHC Ⅱ)和下调的miR-124。在EAE的不同阶段转染miR-124,减少小胶质细胞激活和白细胞浸润,改善临床症状,并促进神经功能恢复。相反,使用miR-124反义寡核苷酸抑制miR-124,导致小胶质细胞激活。该研究表明,miR-124对于维持小胶质细胞的静息表型和促进M2表型的发生是必需的。
miR-155被广泛认为是促炎型miRNA[20],与M1表型有直接联系。在由促炎细胞因子如LPS、IFN-α和TNF-α刺激后,小胶质细胞中miR-155的表达增加。LPS刺激的小胶质细胞可以抑制神经干细胞(neural stem cells,NSCs)的分化,这可以通过减少小胶质细胞中的miR-155来逆转。当miR-155在炎症环境中诱导的LPS耗尽时,NSCs增殖恢复,并且小鼠齿状回中变形虫形态小胶质细胞的数量增加。因此,小胶质细胞中的miR-155在炎症诱导的神经源性神经病中起重要作用。另一项研究表明,小胶质细胞中的miR-155在短暂性MCAO后增加,并在小胶质细胞中诱导促炎性反应[21]。结合这些结果,miR-155抑制剂是否能够恢复炎症反应,调节小胶质细胞极化,以及有益于缺血性卒中后的组织修复和功能恢复,都需要在未来探索。
2.3 临床药物米诺环素是小胶质细胞M1型极化的选择性抑制剂,用于缺血性脑卒中的慢性治疗,能够促进局灶性脑缺血后的神经发生和功能恢复。最近的研究表明,米诺环素治疗可以通过改善局部脑缺血后血脑屏障(blood brain barrier,BBB)通透性,以及促进小胶质细胞向M2型极化,发挥长期保护作用[22]。研究还表明,米诺环素可以通过调节小胶质细胞的极化,改善ALS的早期发病症状,尽早控制疾病的发展[23]。这些结果表明,米诺环素可能是一种有希望的用于抑制小胶质细胞激活介导的炎症反应和组织损伤的治疗药物。
垂体腺苷酸环化酶激活多肽(pituitary adenylate cyclase activated polypeptide,PACAP)是一种具有神经保护功能的肽类。最近的一项研究使用干细胞移植将PACAP传送到小鼠脑中,发现MCAO后3 d传送的PACAP可以减少脑梗死面积,改善功能恢复,并在缺血后d 7和d 14诱导小胶质细胞向M2型极化[24]。该研究证明,我们可以通过调节小胶质细胞极化来预防延迟的组织损伤。
广泛用于治疗2型糖尿病的二甲双胍已被证明能够在体内和体外降低脑卒中的发生率,并促进巨噬细胞的M2型极化。MCAO 24 h后,每天给予二甲双胍治疗,能够增强M2型极化相关基因的表达,促进血管生成和神经发生,并改善功能恢复。同一组进行的体外研究表明,小胶质细胞的M2型极化对于二甲双胍诱导的血管生成是必需的。
3 针对小胶质细胞反应的潜在疗法迄今为止,还没有针对脑卒中后免疫反应的特定治疗方法。所有在脑卒中背景下靶向小胶质细胞激活的有希望的药物,仅用于实验研究或临床前实验。尽管其中一些已用于治疗自身免疫性疾病(如TNF-α拮抗剂),但对调节缺血性小胶质细胞激活的有效药物的探索性研究仍处于初期阶段。脑卒中后小胶质细胞激活的双重功能,使得必须对任何针对小胶质细胞的治疗策略进行微调,以选择性地抑制促炎反应和/或促进抗炎活化。
实验研究发现,二甲双胍是一种腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)激活剂,可通过促进小胶质细胞向M2型的极化,来促进脑卒中小鼠的神经功能恢复和组织修复。给予二甲双胍后,小胶质细胞/巨噬细胞通过抑制NF-κB介导的炎症信号传导而趋向于M2型。普罗布考是另一种降脂药,通过下调LPS刺激的原代小鼠和BV2小胶质细胞中的NF-κB、MAPK和AP-1信号通路,抑制小胶质细胞释放NO、PGE2、IL-1β和IL-6。普罗布考的体内预先给药,减少了促炎介质(iNOS、COX-2、IL-1、IL-6)的产生,并改善MCAO后造成的损伤。他汀类药物是一类降胆固醇药物,已被发现在缺血性脑卒中中具有抗炎和保护作用。用辛伐他汀治疗可以胆固醇依赖性方式,改变小胶质细胞分泌细胞因子(IL-1β和TNF-α)和脑源性神经营养因子。相反,辛伐他汀以不依赖胆固醇的方式,抑制小胶质细胞的吞噬作用。吡咯喹啉醌(pyrrolidine quinoline quinone,PQQ)是一种天然存在的氧化还原辅助因子,可作为必需的营养素和抗氧化剂。在LPS处理的原代小胶质细胞培养物中,PQQ预处理通过抑制NF-κB的核转位和p65的磷酸化,明显降低了NO和PGE2的产生以及促炎介质的表达(iNOS、COX-2、TNF-α、IL-1b、IL-6、MCP-1和MIP-1α),这种作用在体内研究中得到进一步验证[25]。IL-13免疫基因疗法是一种潜在的治疗方法,用于在神经炎症期间调节小胶质细胞激活。在MS的小鼠模型中,慢病毒载体介导的IL-13调节小胶质细胞/巨噬细胞向M2型极化。此外,IL-13免疫基因治疗可以减缓先前存在的炎症环境中MS病变的进展。
4 结论总之,小胶质细胞/巨噬细胞激活在由各种CNS疾病(包括缺血性脑卒中)诱导的神经炎症的病理生理中起重要作用。M1型小胶质细胞/巨噬细胞产生促炎介质,加剧神经元的损伤; 相反,M2型小胶质细胞/巨噬细胞产生抗炎介质,以减轻神经元损伤并有利于组织修复。这些小胶质细胞/巨噬细胞表型的特征在于不同的生物标志物,并且两种表型的平衡由多种途径调节。了解小胶质细胞/巨噬细胞激活的机制,可能有助于为脑卒中的治疗提供新的治疗途径。
| [1] |
Iadecola C, Anrather J. The immunology of stroke: from mechanisms to translation[J]. Nat Med, 2011, 17(7): 796-808. doi:10.1038/nm.2399 |
| [2] |
吴建良, 沈敏敏, 杨水新, 等. 阿魏酸对小胶质细胞炎性反应的抑制作用[J]. 中国药理学通报, 2015, 31(1): 97-102. Wu J L, Shen M M, Yang S X, et al. Inhibition effect of ferulic acid on neuroinflammation in LPS-activated microglia[J]. Chin Pharmacol Bull, 2015, 31(1): 97-102. doi:10.3969/j.issn.1001-1978.2015.01.021 |
| [3] |
Hu X, Leak R K, Shi Y, et al. Microglial and macrophage polarization-new prospects for brain repair[J]. Nat Rev Neurol, 2015, 11(1): 56-64. doi:10.1038/nrneurol.2014.207 |
| [4] |
Schwartz M, Butovsky O, Brück W, et al. Microglial phenotype: is the commitment reversible?[J]. Trends Neurosci, 2006, 29(2): 68-74. doi:10.1016/j.tins.2005.12.005 |
| [5] |
Suenaga J, Hu X, Pu H, et al. White matter injury and microglia/macrophage polarization are strongly linked with age-related long-term deficits in neurological function after stroke[J]. Exp Neurol, 2015, 272: 109-19. doi:10.1016/j.expneurol.2015.03.021 |
| [6] |
Hu X, Li P, Guo Y, et al. Microglia/macrophage polarization dynamics reveal novel mechanism of injury expansion after focal cerebral ischemia[J]. Stroke, 2012, 43(11): 3063-70. doi:10.1161/STROKEAHA.112.659656 |
| [7] |
Tang B, Chen G X, Liang M Y, et al. Ellagic acid prevents monocrotaline-induced pulmonary artery hypertension via inhibiting NLRP3 inflammasome activation in rats[J]. Int J Cardiol, 2015, 180: 134-41. doi:10.1016/j.ijcard.2014.11.161 |
| [8] |
Bodhankar S, Lapato A, Chen Y, et al. Role for microglia in sex differences after ischemic stroke: importance of M2[J]. Metab Brain Dis, 2015, 30(6): 1515-29. doi:10.1007/s11011-015-9714-9 |
| [9] |
Girard S, Brough D, Lopez-Castejon G, et al. Microglia and macrophages differentially modulate cell death after brain injury caused by oxygen-glucose deprivation in organotypic brain slices[J]. Glia, 2013, 61(5): 813-24. doi:10.1002/glia.22478 |
| [10] |
Desestret V, Riou A, Chauveau F, et al. In vitro and in vivo models of cerebral ischemia show discrepancy in therapeutic effects of M2 macrophages[J]. PLoS One, 2013, 8(6): e67063. doi:10.1371/journal.pone.0067063 |
| [11] |
Jang E, Lee S, Kim J H, et al. Secreted protein lipocalin-2 promotes microglial M1 polarization[J]. FASEB J, 2013, 27(3): 1176-90. doi:10.1096/fj.12-222257 |
| [12] |
Zhou K, Zhong Q, Wang Y C, et al. Regulatory T cells ameliorate intracerebral hemorrhage-induced inflammatory injury by modulating microglia/macrophage polarization through the IL-10/GSK3beta/PTEN axis[J]. J Cereb Blood Flow Metab, 2017, 37(3): 967-79. doi:10.1177/0271678X16648712 |
| [13] |
Chu H X, Broughton B R, Kim H A, et al. Evidence that Ly6C(hi) monocytes are protective in acute ischemic stroke by promoting M2 macrophage polarization[J]. Stroke, 2015, 46(7): 1929-37. doi:10.1161/STROKEAHA.115.009426 |
| [14] |
Zhao X, Wang H, Sun G, et al. Neuronal interleukin-4 as a modulator of microglial pathways and ischemic brain damage[J]. J Neurosci, 2015, 35(32): 11281-91. doi:10.1523/JNEUROSCI.1685-15.2015 |
| [15] |
Sanson M, Distel E, Fisher E A. HDL induces the expression of the M2 macrophage markers arginase 1 and Fizz-1 in a STAT6-dependent process[J]. PLoS One, 2013, 8(8): e74676. doi:10.1371/journal.pone.0074676 |
| [16] |
Xu Y, Qian L, Zong G, et al. Class A scavenger receptor promotes cerebral ischemic injury by pivoting microglia/macrophage polarization[J]. Neuroscience, 2012, 218: 35-48. doi:10.1016/j.neuroscience.2012.05.036 |
| [17] |
Maiorino C, Khorooshi R, Ruffini F, et al. Lentiviral-mediated administration of IL-25 in the CNS induces alternative activation of microglia[J]. Gene Ther, 2013, 20(5): 487-96. doi:10.1038/gt.2012.58 |
| [18] |
江明金, 曹端文, 周健, 等. miR-124抑制GluR2参与甲基苯丙胺PC12细胞成瘾[J]. 中国药理学通报, 2017, 33(7): 982-6. Jiang M J, Cao D W, Zhou J, et al. MiR-124 involves in methamphetamine addiction in PC12 cells by inhibiting Glu R2[J]. Chin Pharmacol Bull, 2017, 33(7): 982-6. doi:10.3969/j.issn.1001-1978.2017.07.019 |
| [19] |
Svahn A J, Giacomotto J, Graeber M B, et al. miR-124 contributes to the functional maturity of microglia[J]. Dev Neurobiol, 2016, 76(5): 507-18. doi:10.1002/dneu.22328 |
| [20] |
吕峰, 王伟, 艾麦提·牙森, 等. MicroRNA-155在肝细胞癌对索拉非尼抗药中的作用研究[J]. 中国药理学通报, 2017, 33(5): 657-62. Lyu F, Wang W, Ai Mai Ti·Y S, et al. Effect of micro RNA-155 on sorafenib resistance in hepatocellular carcinoma[J]. Chin Pharmacol Bull, 2017, 33(5): 657-62. doi:10.3969/j.issn.1001-1978.2017.05.014 |
| [21] |
Su W, Hopkins S, Nesser N K, et al. The p53 transcription factor modulates microglia behavior through microRNA-dependent regulation of c-Maf[J]. J Immunol, 2014, 192(1): 358-66. doi:10.4049/jimmunol.1301397 |
| [22] |
Yang Y, Salayandia V M, Thompson J F, et al. Attenuation of acute stroke injury in rat brain by minocycline promotes blood-brain barrier remodeling and alternative microglia/macrophage activation during recovery[J]. J Neuroinflammation, 2015, 12: 26. doi:10.1186/s12974-015-0245-4 |
| [23] |
Kobayashi K, Imagama S, Ohgomori T, et al. Minocycline selectively inhibits M1 polarization of microglia[J]. Cell Death Dis, 2013, 4: e525. doi:10.1038/cddis.2013.54 |
| [24] |
Brifault C, Gras M, Liot D, et al. Delayed pituitary adenylate cyclase-activating polypeptide delivery after brain stroke improves functional recovery by inducing m2 microglia/macrophage polarization[J]. Stroke, 2015, 46(2): 520-8. doi:10.1161/STROKEAHA.114.006864 |
| [25] |
Yang C, Yu L, Kong L, et al. Pyrroloquinoline quinone(PQQ) inhibits lipopolysaccharide induced inflammation in part via downregulated NF-kappaB and p38/JNK activation in microglial and attenuates microglia activation in lipopolysaccharide treatment mice[J]. PLoS One, 2014, 9(10): e109502. doi:10.1371/journal.pone.0109502 |

