


 ,
FANG Chen,
DING Shao-zhen,
LIU Xiao-chang,
XU Zhang-wei,
HU Jing,
XU Jian-ming,
MEI Qiao
,
FANG Chen,
DING Shao-zhen,
LIU Xiao-chang,
XU Zhang-wei,
HU Jing,
XU Jian-ming,
MEI Qiao

炎症性肠病(inflammatory bowel disease,IBD)是由免疫调节功能紊乱介导的慢性肠道炎症性病变,发病机制尚不十分清楚,可能与肠道环境因素、肠上皮屏障和免疫调节反应之间的异常相互作用有关[1]。在免疫调节紊乱的过程中,巨噬细胞分泌大量炎症细胞因子和趋化因子,包括IL-1、IL-6、TNF-α等,进一步加剧结肠的炎性损伤程度。巨噬细胞是机体重要的固有免疫细胞,通过模式识别受体,识别病原相关分子模式和损伤相关分子模式,引发固有免疫反应,快速有效对抗病原体[2]。IBD患者肠道中巨噬细胞数量明显增加,研究表明,自噬在固有免疫反应中起着重要作用,可以有效减轻结肠炎中过度炎症和免疫反应[3]。自噬是一种细胞内稳态机制,包括形成吞噬泡,延长并吞噬细胞溶质成分(包括细胞器、错误折叠的蛋白质聚集体和病原体),形成具有双层膜结构的自噬体,与溶酶体融合后溶质成分降解和再循环[4]。自噬受损被认为参与IBD发生机制。自噬缺陷导致肠壁内固有免疫反应增强和促炎细胞因子产生明显增加,提示IBD中固有免疫反应与巨噬细胞自噬密切相关[5]。
Kv1.3通道通过调节Ca2+信号传导,控制巨噬细胞的活化和增殖过程。同时,Ishii等[6]研究表明,Kv1.3与p62密切相关。p62是一种重要的自噬相关蛋白,在自噬中发挥重要调节作用。特异性Kv1.3阻滞剂对巨噬细胞的调控作用可能发挥治疗免疫功能紊乱有关的炎症性疾病。5-(4-苯氧基丁氧基)补骨脂素[5-(4-phenoxybutoxy)psoralen,PAP-1]是一种新型特异性小分子Kv1.3通道阻滞剂[7]。本实验通过探讨Kv1.3阻滞剂PAP-1对葡聚糖硫酸钠(dextran sodium sulphate,DSS)结肠炎的作用及相关机制, 为IBD治疗药物研究提供实验依据。
1 材料 1.1 实验动物C57BL/6小鼠, ♂, 体质量(20±2)g, 购于安徽省实验动物中心, 动物质量合格证编号:34000200001278。
1.2 试剂DSS(分子质量40 000)、PAP-1(P6124),均购自Sigma公司;髓过氧化物酶(myeloperoxidase,MPO)试剂盒、粪便隐血试剂盒,购自南京建成生物工程研究所;cDNA合成试剂盒,购自美国Thermo Scientific公司;QuantiNova SYBR Green PCR试剂盒,购自德国Hilden Qiagen公司;IL-1、IL-6、IL-10、TNF-α ELISA试剂盒,均购自武汉新启迪生物科技有限公司;抗p62、诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、IL-1β抗体,均购于北京博奥森生物有限公司;抗Beclin-1、LC3-Ⅱ、Kv1.3、F4/80抗体,均购于Abcam公司。
1.3 仪器高速台式冷冻离心机(安徽嘉文仪器装备有限公司);Elx800型酶标仪(美国Bio-Tek公司);EPS 300型电泳仪(上海天能科技有限公司);K960型PCR仪(杭州晶格科学仪器有限公司);PikoReal 96型荧光定量PCR仪(Thermo Scientific公司)。
2 方法 2.1 模型的制备与实验分组将40只小鼠随机分成4组。A组:正常对照组,正常饮水和腹腔注射等体积溶剂(含3% DMSO的生理盐水);B组:正常对照+PAP-1注射组,正常饮水和腹腔注射PAP-1(3 μg·g-1, 每天3次);C组:DSS模型组,饮用含5% DSS的水和腹腔注射等体积溶剂(含3% DMSO的生理盐水);D组:DSS模型+PAP-1注射组,饮用含5% DSS的水和腹腔注射PAP-1(3 μg·g-1, 每天3次)。实验造模连续7 d。实验结束时处死所有小鼠,按文献方法制备小鼠腹腔巨噬细胞及脾脏巨噬细胞,同时收集小鼠结肠组织待测。
2.2 结肠炎严重程度评价实验每日记录小鼠体质量、便血情况和粪便性状。采用隐血试剂盒测定粪便潜血。计算小鼠疾病活动指数(disease activity index,DAI)评分[8]。实验结束时,取出小鼠结肠组织,10%福尔马林溶液固定, 石蜡包埋,切片厚约4 μm,HE染色,进行病理组织学指数(histological index,HI)评分[9]。
2.3 结肠匀浆MPO活性及细胞因子水平检测用生理盐水制备10%结肠组织匀浆。按说明书操作, 检测小鼠结肠组织匀浆MPO活性,以及IL-1、IL-6、IL-10、TNF-α水平。
2.4 免疫荧光染色检测结肠巨噬细胞的渗出石蜡切片经脱蜡及水化,2%过氧化氢抗原修复,3% BSA封闭,F4/80一抗(1:100)4 ℃温育过夜,与二抗室温避光孵育1 h,DAPI浸染细胞核,封片。共聚焦激光扫描显微镜观察图像并进行分析。
2.5 腹腔和脾脏巨噬细胞的分离提取参照文献方法[10],收集小鼠腹膜巨噬细胞。用8 mL冷PBS溶液冲洗小鼠腹腔5 min, 收集腹腔灌洗液。离心获取细胞,接种在含有RPMI 1640完全培养基(含10% FBS和1%青-链霉素)的12孔培养皿中,培养2 h。用PBS充分洗涤,除去非贴壁细胞,收集黏附细胞即为腹腔巨噬细胞。
将小鼠脾脏组织切成小块,轻研磨通过200目的钢丝网,获得脾细胞悬浮液。按上述方法,从脾细胞悬浮液中获取脾脏巨噬细胞。
2.6 透射电镜观察巨噬细胞内自噬体将小鼠腹腔和脾脏巨噬细胞制备成细胞团块。2.5%戊二醛4 ℃固定过夜。用1%锇酸固定,并用不同浓度的乙醇脱水,环氧树脂固定,70 nm切片,JEM-1230F电子显微镜观察巨噬细胞内自噬体。
2.7 qPCR检测小鼠结肠组织和巨噬细胞中iNOS、IL-1β及自噬相关基因mRNA的表达取小鼠腹腔和脾脏巨噬细胞和结肠组织,采用TRIzol试剂提取RNA。按RevertAidTM第一链cDNA合成试剂盒说明,将RNA逆转录成cDNA。采用QuantiNova SYBR Green PCR试剂盒,扩增获得cDNA用于定量PCR。反应条件如下:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 20 s, 共35个循环。绘制扩增曲线及熔解曲线,以β-actin基因为内参,用2-ΔΔCt方法计算相对表达量。引物序列见Tab 1。
| Gene | Upstream primer(5′-3′) | Downstream primer(5′-3′) |
| iNOS | CCTTGTTCAGCTACGCCTTC | CTTCAGAGTCTGCCCATTGC |
| IL-1β | GAAGAAGAGCCCATCCTCTG | TCATCTCGGAGCCTGTAGTG |
| p62 | AGGGAACTGCAGCACACACT | TGCCTGCCACCTTTCACTCA |
| Beclin-1 | GCACCATGCAGGTGAGCTTC | TTTCGCCTGGGCTGTGGTAA |
| LC3-Ⅱ | CATGCCGTCCGAGAAGACCT | GTGGTCAGGCACCAGGAACT |
| β-actin | AGTGTGACGTTGACATCCGT | TGCTAGGAGCCAGAGCAGTA |
取小鼠腹腔和脾脏巨噬细胞和结肠组织,采用细胞裂解液提取蛋白质, SDS-PAGE分离蛋白,转移至PVDF膜。脱脂乳室温封闭2 h。将膜与一抗IL-1β、iNOS、p62、Beclin-1、LC3-Ⅱ、β-actin 4 ℃孵育过夜。加入TBST洗涤3次,辣根过氧化物酶标记二抗室温孵育2 h。再次加入TBST洗涤3次,以β-actin为内参,采用ECL发光试剂盒检测蛋白,Image J软件分析蛋白条带的灰度值。
2.9 统计学分析采用SPSS 17.0统计软件进行统计结果分析,数据资料以x±s表示。采用单因素方差分析和最小显著差异(LSD)t检验来评估组间差异显著性。
3 结果 3.1 PAP-1减轻结肠炎小鼠的结肠炎症与正常组比较,模型组结肠炎小鼠体质量逐渐减轻,PAP-1降低结肠炎小鼠体质量减轻趋势(Fig 1A)。模型组DAI评分明显高于正常组, PAP-1组DAI评分低于模型组(Fig 1B)。Fig 1C、1D结果显示,与正常组比较,模型组结肠黏膜病理显示结肠损伤明显,有明显上皮细胞破坏,大量的炎细胞浸润,杯状细胞丢失和黏膜下层水肿,HI评分及结肠匀浆MPO活性增高(P<0.05);与模型组比较,PAP-1组结肠黏膜病理损伤减轻,HI评分和结肠匀浆MPO活性降低(P<0.05)。
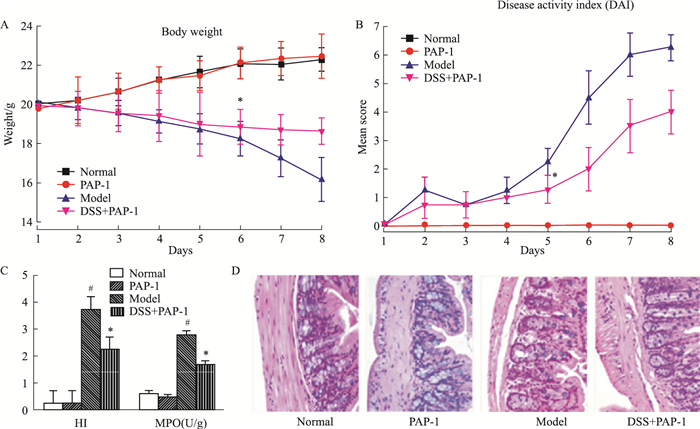
|
| Fig 1 Effects of PAP-1 on DSS-induced colitic mice(x±s, n=8) A: The daily mean weight change in each group; B: The changes of DAI in each group daily; C: The colonic HI scoring and MPO activity in each group; D: Histopathological features of the colon in each group (HE×400).#P < 0.05 vs normal; *P < 0.05 vs model. |
如Fig 2所示,与正常组比较,模型组小鼠结肠组织中IL-1、IL-6和TNF-α含量上升(P<0.05), IL-10含量下降(P<0.05),IL-1β mRNA和蛋白的表达增强(P<0.05)。与模型组比较,PAP-1组小鼠结肠组织中IL-1、IL-6和TNF-α含量均下降(P<0.05), IL-10含量上升(P<0.05),IL-1β mRNA和蛋白的表达减弱(P<0.05)。
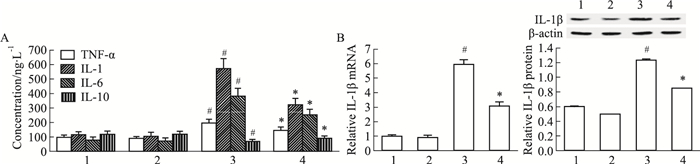
|
| Fig 2 Effects of PAP-1 on inflammatory cytokine production of colon tissues in DSS-induced colitic mice A: Effect of PAP-1 on the levels of TNF-α, IL-1, IL-6 and IL-10 in colitic mice (x±s, n=8); B: Effect of PAP-1 on colonic IL-1β mRNA and protein levels in colitic mice (x±s, n=6). 1: Normal; 2: PAP-1; 3: Model; 4: DSS+PAP-1. #P < 0.05 vs normal; *P < 0.05 vs model. |
Fig 3A的免疫荧光染色显示,与正常组比较,模型组小鼠结肠组织中总巨噬细胞标记物F4/80的表达增加,经PAP-1处理后,结肠炎小鼠结肠组织中F4/80的表达少于模型组,表明PAP-1可减少小鼠结肠组织中巨噬细胞的渗出。采用iNOS作为巨噬细胞激活的标志,Fig 3B结果显示,模型组小鼠结肠组织中iNOS mRNA和蛋白的表达较正常组明显增强, PAP-1组小鼠结肠组织中iNOS mRNA和蛋白的表达较模型组减弱, 差异均有统计学意义(P<0.05)。提示PAP-1可能减少结肠炎小鼠结肠组织中巨噬细胞的激活。
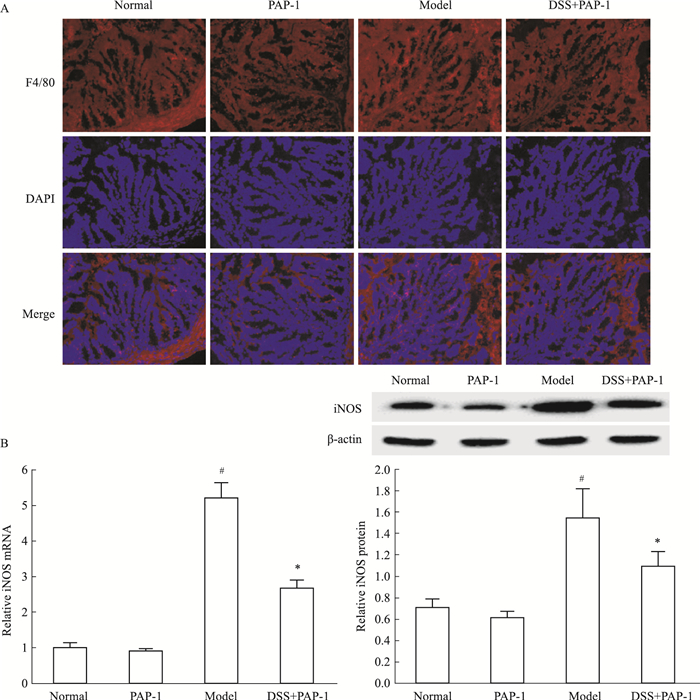
|
| Fig 3 Colonic macrophage infiltration and activation in colitic mice reduced by PAP-1 A:Effect of PAP-1 on colonic macrophage infiltration in colitic mice was observed by immunofluorescence microscopy (×200); B: Effect of PAP-1 on colonic iNOS mRNA and protein levels in colitic mice(x±s, n=6). #P < 0.05 vs normal; *P < 0.05 vs model. |
Fig 4结果显示,与正常组比较,模型组小鼠结肠组织LC3-Ⅱ、Beclin-1 mRNA和蛋白表达降低, p62 mRNA和蛋白表达增加;经PAP-1处理后,结肠炎小鼠结肠组织LC3-Ⅱ、Beclin-1 mRNA和蛋白表达增加,p62 mRNA和蛋白表达降低,差异均有统计学意义(P<0.05)。
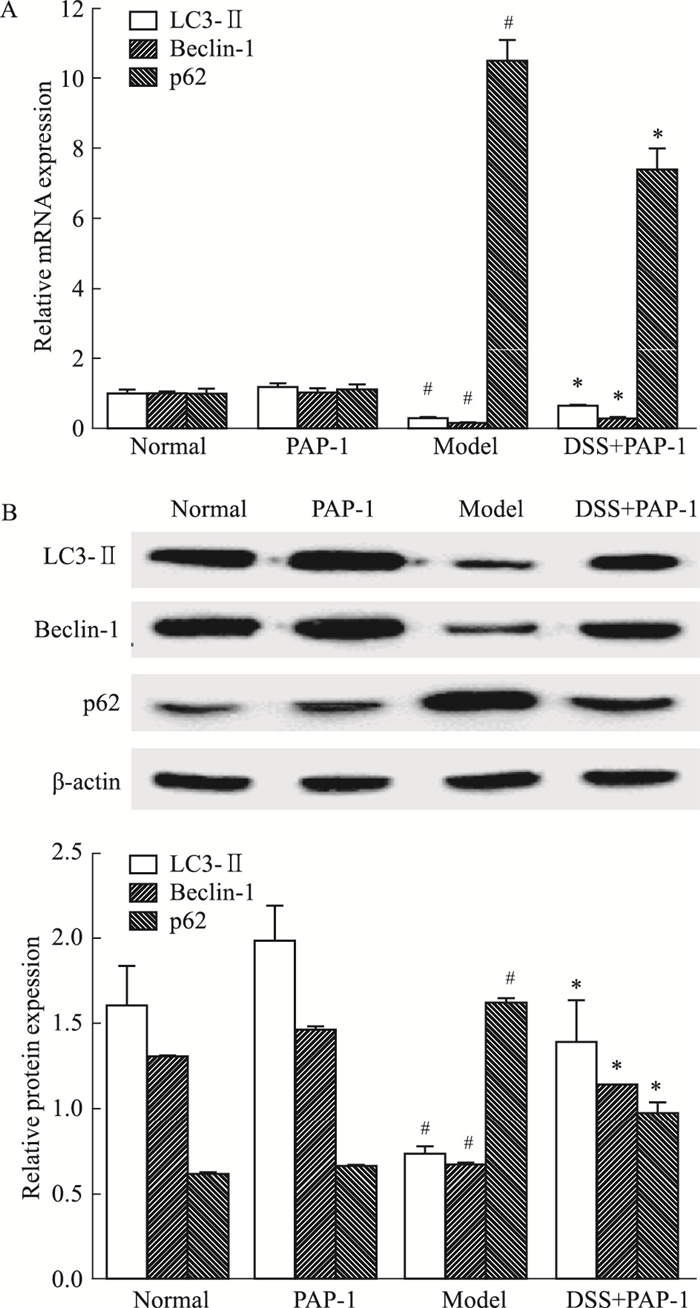
|
| Fig 4 Effect of PAP-1 on colon autophagy in colitis mice(x±s, n=6) A: Effect of PAP-1 on the expression levels of colonic LC3-Ⅱ, Beclin-1 and p62 mRNA in colitic mice; B: Effect of PAP-1 on the expression levels of colonic LC3-Ⅱ, Beclin-1 and p62 proteins in colitic mice. #P < 0.05 vs normal; *P < 0.05 vs model. |
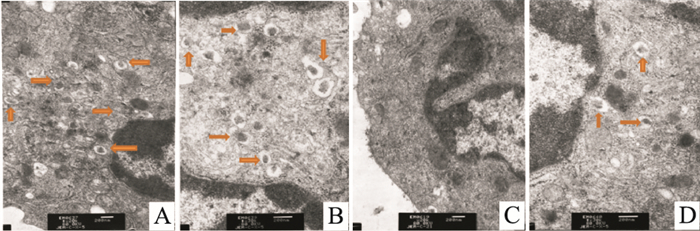
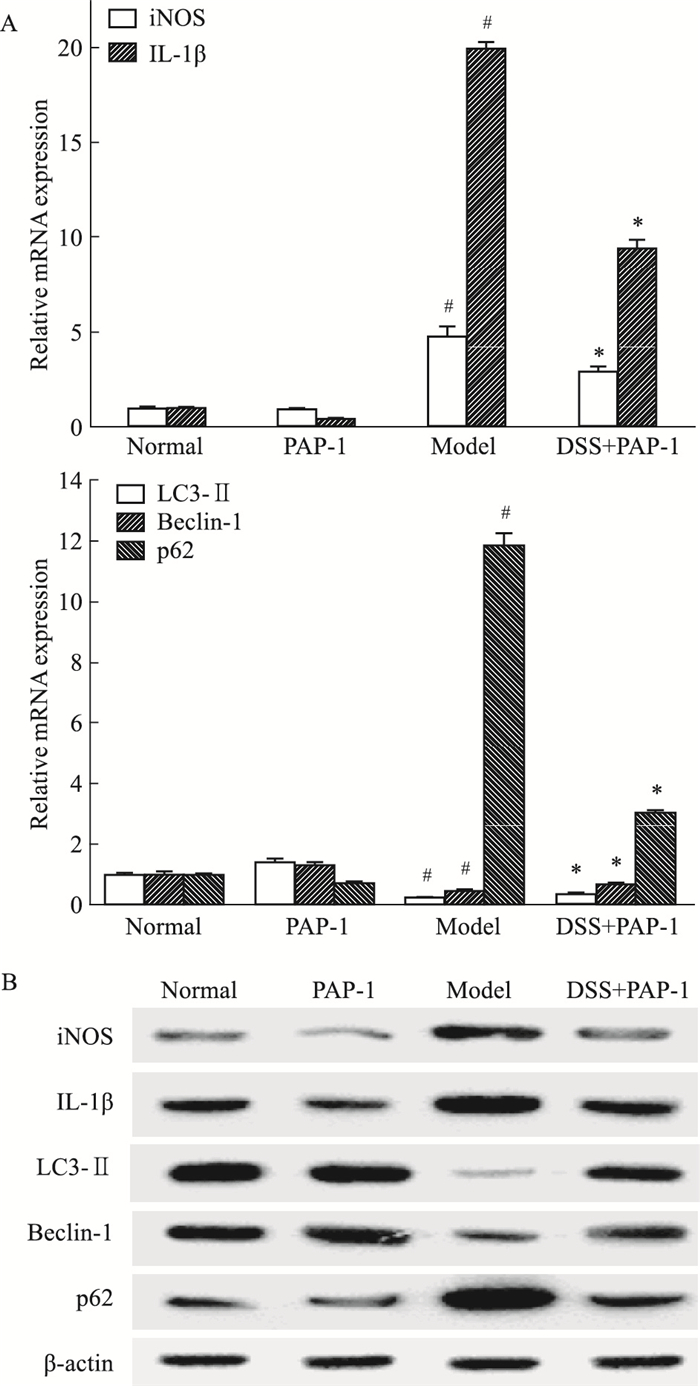
Fig 5的透射电镜观察结果显示,与正常组比较,模型组小鼠腹腔巨噬细胞内自噬体减少,PAP-1组小鼠腹腔巨噬细胞内自噬体较模型组增多。Fig 6结果表明,与正常组比较,模型组小鼠腹腔巨噬细胞LC3-Ⅱ、Beclin-1 mRNA和蛋白表达降低, iNOS、IL-1β、p62 mRNA和蛋白表达增加;经PAP-1处理后,结肠炎小鼠腹腔巨噬细胞LC3-Ⅱ、Beclin-1 mRNA和蛋白表达增加,iNOS、IL-1β、p62 mRNA和蛋白表达降低,差异均有统计学意义(P<0.05)。
|
| Fig 5 Effect of PAP-1 on autophagy-related structure of peritoneal macrophages observed by electron microscopy A: Normal; B: PAP-1; C: Model; D: DSS+PAP-1. The yellow arrows represent autophagic vacuoles. |
|
| Fig 6 Effect of PAP-1 on iNOS, IL-1β and autophagy in peritoneal macrophages of colitic mice(x±s, n=6) A: Effect of PAP-1 on the expression levels of iNOS, IL-1β, LC3-Ⅱ, Beclin-1 and p62 mRNA in peritoneal macrophages of colitic mice; B: Effect of PAP-1 on the expression levels of iNOS, IL-1β, LC3-Ⅱ, Beclin-1 and p62 proteins in peritoneal macrophages of colitic mice. #P < 0.05 vs normal; *P < 0.05 vs model. |
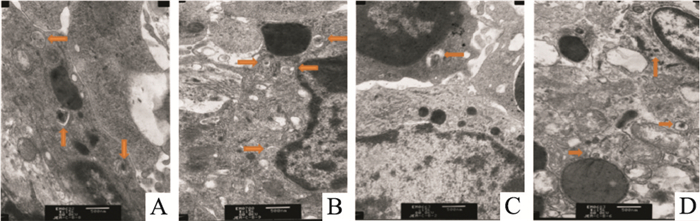
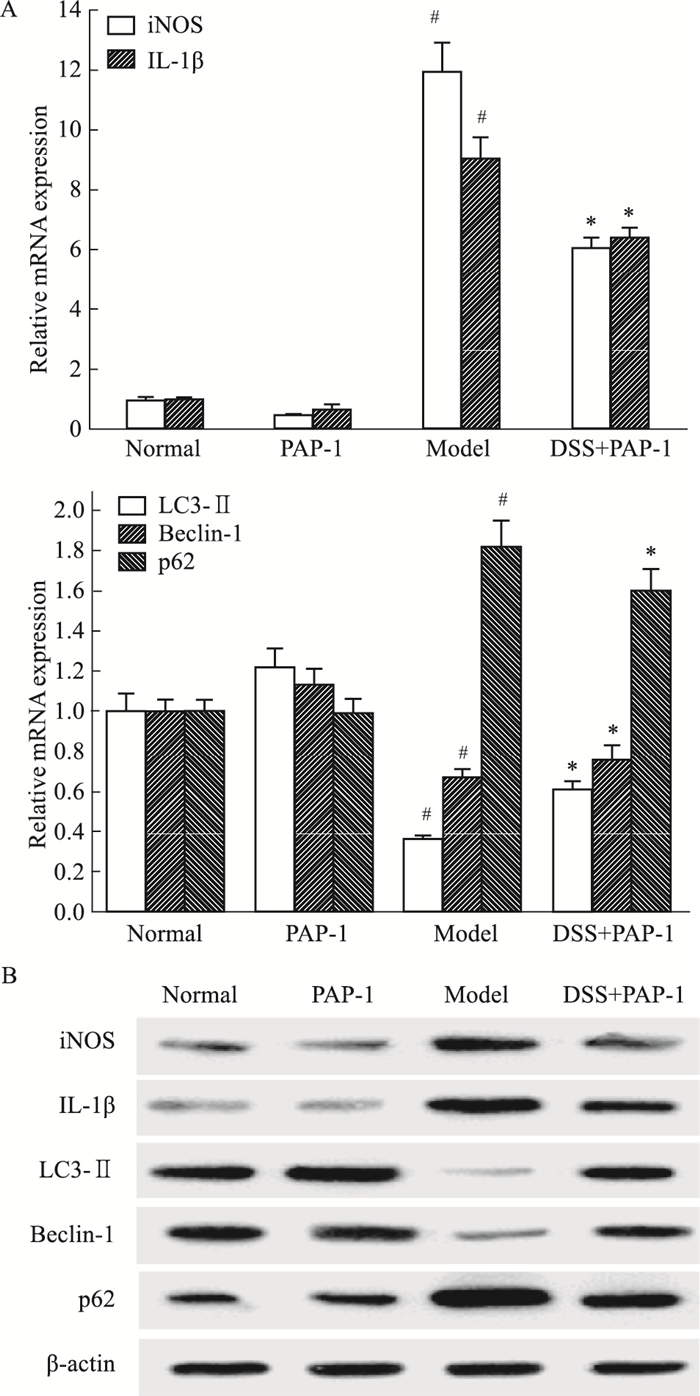
Fig 7的透射电镜观察结果显示,与正常组比较,模型组小鼠脾脏巨噬细胞内自噬体减少,PAP-1组小鼠脾脏巨噬细胞内自噬体较模型组增多。Fig 8结果显示,与正常组比较,模型组小鼠脾脏巨噬细胞LC3-Ⅱ、Beclin-1 mRNA和蛋白表达降低, iNOS、IL-1β、p62 mRNA和蛋白表达增加;经PAP-1处理后,结肠炎小鼠脾巨噬细胞LC3-Ⅱ、Beclin-1 mRNA和蛋白表达增加,iNOS、IL-1β、p62 mRNA和蛋白表达降低,差异均有统计学意义(P<0.05)。
|
| Fig 7 Effect of PAP-1 on autophagy-related structure of spleen macrophages observed by electron microscopy A: Normal; B: PAP-1; C: Model; D: DSS+PAP-1. The yellow arrows represent the autophagic vacuoles. |
|
| Fig 8 Effect of PAP-1 on iNOS, IL-1β and autophagy in spleen macrophages of colitic mice(x±s, n=6) A: Effect of PAP-1 on the expression levels of iNOS, IL-1β, LC3-Ⅱ, Beclin-1 and p62 mRNA in spleen macrophages of colitic mice; B: Effect of PAP-1 on the expression levels of iNOS, IL-1β, LC3-Ⅱ, Beclin-1 and p62 proteins in spleen macrophages of colitic mice. #P < 0.05 vs normal; *P < 0.05 vs model. |
IBD是一种以免疫功能紊乱为特征的肠道难治性炎性疾病。研究发现,肠道炎症黏膜中有大量活化的巨噬细胞浸润,巨噬细胞可分泌大量促炎细胞因子和趋化因子,包括IL-1β、IL-6、TNF-α等,促进肠道炎症反应的发生, 部分药物通过调节巨噬细胞功能可以减轻小鼠结肠炎[2]。本研究显示,DSS结肠炎小鼠中结肠巨噬细胞渗出增加。iNOS是巨噬细胞活化的主要标志物。结肠炎小鼠结肠和巨噬细胞中iNOS表达明显增加,表明结肠炎小鼠体内巨噬细胞明显活化。同时发现结肠炎小鼠结肠和巨噬细胞中IL-1β表达均明显增加,提示巨噬细胞在结肠炎发病机制中起重要作用。
研究表明,Kv通道通过调节巨噬细胞增殖和活化过程,在疾病免疫功能调控中起关键作用。Kv1.3通道是巨噬细胞中重要的离子通道, 活化的巨噬细胞中Kv1.3表达明显增加[9]。因此,阻断Kv1.3通道,降低巨噬细胞活化,可能是调控结肠炎炎症的有效方法。研究表明,抑制淋巴细胞和巨噬细胞中过表达的Kv1.3通道,可以抑制炎性细胞因子的合成,减缓晚期慢性肾衰竭中肾纤维化过程,改善类风湿性关节炎等具有巨噬细胞免疫功能紊乱的自身免疫炎症性疾病[11]。Schmitz等[7]发现,PAP-1是一种特异性小分子Kv1.3阻断剂,EC50为2 nmol·L-1,比Kv1.5选择性高23倍, 腹腔注射或口服PAP-1可预防迟发型过敏反应。本研究发现,PAP-1可降低DSS结肠炎小鼠DAI评分、HI评分、MPO活性及促炎细胞因子水平,升高抗炎细胞因子水平,减低结肠组织中巨噬细胞渗出及活化。提示PAP-1可降低巨噬细胞活化,减轻结肠炎小鼠的炎症损伤。
研究表明,自噬与IBD发病机制相关,自噬相关基因如Atg1611、IRGM与IBD易感性有关,表明自噬可能影响IBD病理生理过程[12]。Hugot等[13]发现,巨噬细胞自噬与肠道的固有免疫调节相关。Lapaquette等[14]发现,黏附侵袭性大肠杆菌(AIEC)刺激,可引起自噬受损的巨噬细胞内IL-6、TNF-α水平增加。Cabrera等[5]研究表明,Atg4b缺乏引起的自噬抑制,可增加DSS结肠炎的易感性, 主要原因是促进结肠炎小鼠结肠组织和腹腔巨噬细胞中促炎细胞因子的产生。提示IBD中巨噬细胞与自噬密切关系。Ke等[9]发现,在LPS/DSS刺激的腹腔巨噬细胞以及DSS结肠炎小鼠中,自噬可抑制NLRP3炎性体活化。因此,PAP-1阻断Kv1.3通道,减轻结肠炎的相关机制可能与巨噬细胞自噬有关。
与有关研究结果相似[15],本研究结果显示,DSS结肠炎小鼠巨噬细胞和结肠组织中p62表达增加,Beclin-1、LC3-Ⅱ表达降低,同时巨噬细胞内自噬泡减少,表明DSS结肠炎小鼠巨噬细胞和结肠组织自噬受到抑制。p62与LC3结合,将靶底物送至自噬体以降解, 自噬受损时p62水平升高。Beclin-1是Ⅲ类磷脂酰肌醇3-激酶复合物的重要组成部分,参与自噬体形成。LC3-Ⅱ参与自噬体膜的延伸及闭合, 是监测自噬水平的重要标准,其表达量与自噬体数量相关[4]。PAP-1可降低结肠炎小鼠巨噬细胞和结肠组织中p62表达,增加Beclin-1和LC3-Ⅱ表达, 同时增加巨噬细胞内自噬泡形成,表明PAP-1可降低DSS结肠炎小鼠巨噬细胞和结肠组织的自噬抑制,减轻巨噬细胞调节的结肠固有免疫炎症反应。
综上所述,PAP-1可减轻DSS结肠炎小鼠肠道炎症损伤,减轻巨噬细胞和结肠组织自噬抑制,提示PAP-1促进自噬通路修复,调节巨噬细胞固有免疫功能。
| [1] |
王晶, 丁少桢, 胡翠, 等. 同型半胱氨酸对实验性结肠炎模型中COX-2及5-LOX表达的影响[J]. 中国药理学通报, 2017, 34(11): 1627-8. Wang J, Ding S Z, H C, et al. Effect of homocysteine on the expression of COX-2 and 5-LOX in experimental colitis model[J]. Chin Pharmacol Bull, 2017, 34(11): 1627-8. doi:10.3969/j.issn.1001-1978.2017.11.029 |
| [2] |
Shin S K, Cho J H, Kim E J, et al. Anti-inflammatory and anti-apoptotic effects of rosuvastatin by regulation of oxidative stress in a dextran sulfate sodium-induced colitis model[J]. World J Gastroenterol, 2017, 23(25): 4559-68. doi:10.3748/wjg.v23.i25.4559 |
| [3] |
Lee H Y, Kim J, Quan W, et al. Autophagy deficiency in myeloid cells increases susceptibility to obesity-induced diabetes and experimental colitis[J]. Autophagy, 2016, 12: 1390-403. doi:10.1080/15548627.2016.1184799 |
| [4] |
Klionsky D J. Ancient autophagy[J]. Autophagy, 2013, 9(4): 445-6. doi:10.4161/auto.23907 |
| [5] |
Cabrera S, Fernandez A F, Marino G, et al. ATG4B/autophagin-1 regulates intestinal homeostasis and protects mice from experimental colitis[J]. Autophagy, 2013, 9(8): 1188-200. doi:10.4161/auto.24797 |
| [6] |
Ishii T, Warabi E, Siow R C, et al. Sequestosome1/p62: a regulator of redox-sensitive voltage-activated potassium channels, arterial remodeling, inflammation, and neurite outgrowth[J]. Free Radic Biol Med, 2013, 65: 102-16. doi:10.1016/j.freeradbiomed.2013.06.019 |
| [7] |
Schmitz A. Design of PAP-1, a selective small molecule Kv1.3 blocker, for the suppression of effector memory T cells in autoimmune diseases[J]. Mol Pharmacol, 2005, 68(5): 1254-70. doi:10.1124/mol.105.015669 |
| [8] |
Sann H, Erichsen J, Hessmann M, et al. Efficacy of drugs used in the treatment of IBD and combinations thereof in acute DSS-induced colitis in mice[J]. Life Sci, 2013, 92(12): 708-18. doi:10.1016/j.lfs.2013.01.028 |
| [9] |
Ke P, Shao B Z, Xu Z Q, et al. Activation of cannabinoid receptor 2 ameliorates DSS-induced colitis through inhibiting NLRP3 inflammasome in macrophages[J]. PLoS One, 2016, 11(9): e0155076. doi:10.1371/journal.pone.0155076 |
| [10] |
Menon D, Coll R, O'Neill L A, et al. Glutathione transferase omega 1 is required for the lipopolysaccharide-stimulated induction of NADPH oxidase 1 and the production of reactive oxygen species in macrophages[J]. Free Radic Biol Med, 2014, 73: 318-27. doi:10.1016/j.freeradbiomed.2014.05.020 |
| [11] |
Kazama I, Baba A, Matsubara M, et al. Benidipine suppresses in situ proliferation of leukocytes and slows the progression of renal fibrosis in rat kidneys with advanced chronic renal failure[J]. Nephron Exp Nephrol, 2014, 128(1-2): 67-79. doi:10.1159/000368080 |
| [12] |
Parkes M, Barrett J C, Prescott N J, et al. Sequence variants in the autophagy gene IRGM and multiple other replicating loci contribute to Crohn's disease susceptibility[J]. Nat Genet, 2007, 39(7): 830-2. doi:10.1038/ng2061 |
| [13] |
Hugot J P, Chamaillard M, Zouali H, et al. Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn's disease[J]. Nature, 2001, 411(6837): 599-603. doi:10.1038/35079107 |
| [14] |
Lapaquette P, Bringer M A, Darfeuille-Michaud A. Defects in autophagy favour adherent-invasive Escherichia coli persistence within macrophages leading to increased pro-inflammatory response[J]. Cell Microbiol, 2012, 14(6): 791-807. doi:10.1111/j.1462-5822.2012.01768.x |
| [15] |
Cosin-Roger J, Simmen S, Melhem H, et al. Hypoxia ameliorates intestinal inflammation through NLRP3/mTOR downregulation and autophagy activation[J]. Nat Commun, 2017, 8(1): 98. |