

组织缺氧、缺血、再灌注、氧化应激、高渗应激等刺激因素,诱发心肌细胞凋亡[1]。阿霉素(doxorubicin,DOX)临床使用时经常诱发患者心脏毒性,主要通过引起终期分化心肌细胞和心脏祖细胞凋亡,进而导致心肌组织或固有的再生能力缺失[2-4]。DOX也影响心肌细胞与肝细胞生长因子、胰岛素样生长因子等的反应[5]。心肌肽(cardiomyopeptide,Car)是从乳猪心脏中提取的多肽类活性物质,可直接作用于心肌细胞,预防和保护心脏缺血/再灌注等多种因素下心肌损伤的修复[6],临床试验也表明,其具有良好的心肌保护作用[7]。2005年,心肌肽被国家食品药品监督管理局批准为一类化学药,用于心脏外科手术围术期心肌保护的辅助药物。本实验采用DOX损伤H9c2心肌细胞,研究心肌肽的保护作用及对胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF-1R)、胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein 3,IGFBP-3)等蛋白表达的影响,揭示其可能的作用机制。
1 材料 1.1 细胞系大鼠心肌细胞株H9c2细胞,购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 药物与试剂心肌肽(大连珍奥药业有限公司,批号:20170401、20170302、20170103);盐酸阿霉素(美国MCE公司);胰蛋白酶、增强化学发光液(北京全式金生物技术有限公司);MTT、二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Solarbio公司);DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)(美国Gibco公司);BCA蛋白浓度测定试剂盒、IP细胞裂解液、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(碧云天生物技术研究所);兔源一抗Bax、Bcl-2、caspase-3、IGF-1R、IGFBP-3、β-actin(美国Proteintech公司);兔源二抗(武汉三鹰生物技术有限公司)。
1.3 仪器H-1650离心机(长沙湘仪离心机仪器有限公司);超纯水装置(美国Cascada);CF16RX高速冷冻离心机、U-3010紫外可见分光光度计(日本HITACHI);酶标仪(美国Thermo);DYCZ-40D转印电泳仪(北京市六一仪器厂);JM-250型电泳仪(大连竞迈生物科技有限公司);UVP凝胶成像系统(美国BioSpectrum);TE2000-U显微镜(日本Nikon);CCL-170B-8型CO2培养箱(新加坡ESCO)。
2 方法 2.1 细胞培养H9c2细胞培养于含10% FBS的DMEM高糖培养基中,37 ℃、5% CO2、饱和湿度条件下培养,待细胞密度达到80%~90%时,用0.25%胰蛋白酶消化传代,取对数生长期细胞进行实验。
2.2 MTT法测定心肌细胞存活率取对数生长期细胞,0.25%胰蛋白酶消化后,以1×108·L-1细胞浓度接种于96孔板内,每孔100 μL,孵育24 h后分组,各组均设6个复孔。实验组加入心肌肽使浓度分别为0、10、20、40 mg·L-1,预处理6、8、12 h后,与模型组同时加入DOX(终浓度为1 μmol·L-1),继续培养24 h后,每孔加入5 g·L-1 MTT溶液10 μL,4 h后吸除培养基,加入DMSO 150 μL,摇床上低速振摇10 min,使结晶充分溶解后,在570 nm处测定吸光度,计算细胞存活率。同时考察40 mg·L-1心肌肽预处理8 h,对DOX半抑制浓度(IC50)的影响。按照以下公式计算细胞存活率:细胞存活率=实验组吸光度值/正常对照组吸光度值×100%。
2.3 Western blot测定蛋白表达以1×108·L-1浓度将细胞接种到6孔板中,24 h后,加入心肌肽(0、10、20、40 mg·L-1)预处理8 h,再分别加入DOX(终浓度为1 μmol·L-1),24 h后吸除细胞培养基,用冷PBS洗涤2次,吸除残留液体;胰酶消化,将收集到的细胞置1.5 mL离心管内,PBS洗涤2次,每孔加入IP裂解液100 μL,充分吹打,置于4 ℃下裂解15 min后,10 000 r·min-1离心10 min,取上清液,蛋白含量测定后,用质量分数为7.5%和12.5%的SDS-PAGE分离。湿转膜法转到PVDF膜上,封闭3 h,TBS-T洗涤3次,每次10 min。加入一抗,4 ℃冰箱孵育过夜后,TBS-T洗涤3次,每次10 min。加入相应的二抗孵育3 h,TBS-T洗涤3次,每次10 min,用ECL Western blot检测系统对蛋白条带进行分析,检测蛋白表达情况。
2.4 统计学分析实验数据以x±s表示,采用GraphPad Prism 7软件进行统计学分析,各组间比较采用单因素方差分析,各组间两两比较采用配对t检验。
3 结果 3.1 心肌肽对H9c2心肌细胞存活率的影响如Fig 1所示,与DOX组相比,心肌肽10 mg·L-1预处理12 h,细胞存活率提高(10.1±3.8)%;心肌肽浓度为20 mg·L-1时,细胞存活率提高(13.9±3.7)%(8 h)和(25.5±3.3)%(12 h);心肌肽浓度为40 mg·L-1时,细胞存活率提高(12.6±2.4)%(6 h)、(25.6±2.0)%(8 h)和(34.3±6.0)%(12 h),均可明显提高细胞存活率(P < 0.05)。结果表明,心肌肽可以保护受损的心肌细胞,对细胞保护作用呈时间和剂量依赖性。
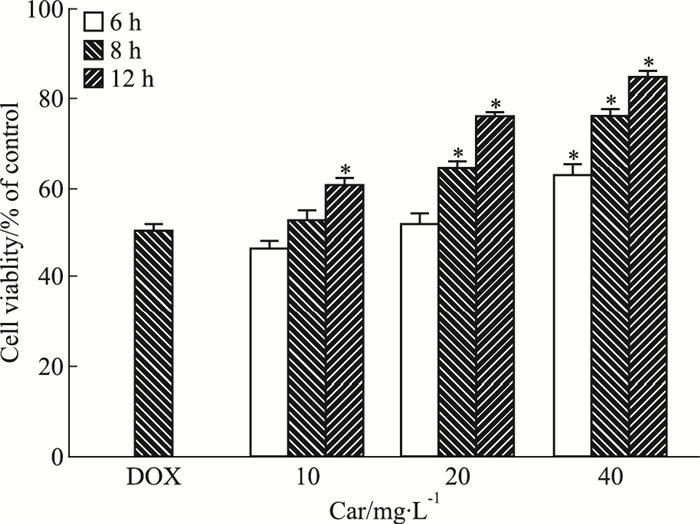
|
| Fig 1 Effect of cardiomyopeptide on DOX-induced apoptosis in H9c2 cardiac cells(x±s, n=6) *P < 0.05 vs DOX group |
如Fig 2所示,心肌肽40 mg·L-1预处理8 h,可使DOX的IC50值由(1.2±0.4)μmol·L-1右移至(2.3±0.2)μmol·L-1(P<0.01)。提示心肌肽预处理可减轻DOX的细胞毒性,并促进细胞增殖。
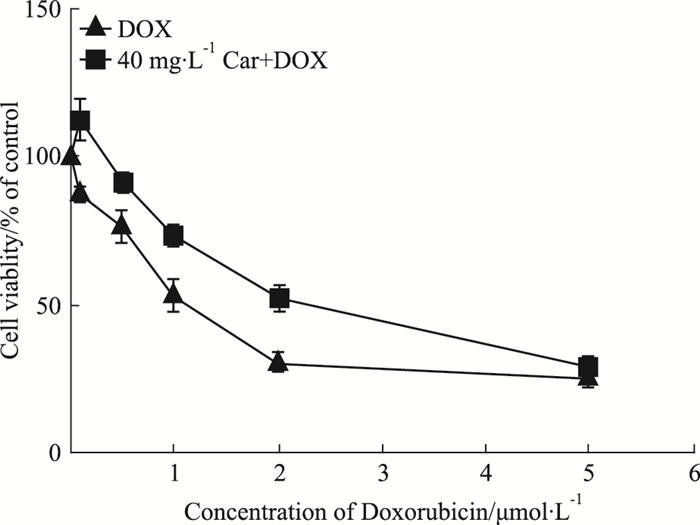
|
| Fig 2 Effect of cardiomyopeptide on dose-dependent DOX-induced H9c2 cytotoxicity(x±s, n=6) |
如Fig 3结果显示,与对照组相比,DOX组Bax和caspase-3蛋白表达量增加(P < 0.01)。心肌肽(20、40 mg·L-1)预处理H9c2细胞8 h,随着药物浓度的增加,Bax和caspase-3蛋白表达量降低,Bcl-2蛋白表达量增加(P < 0.01)。表明心肌肽通过增加Bcl-2表达,抑制caspase-3活性发挥抗凋亡活性。

|
| Fig 3 Effect of cardiomyopeptide on the expression of Bcl-2, Bax and caspase-3 under doxorubicin treatment in H9c2 cells(x±s, n=3) **P < 0.01 vs control group; ##P < 0.01 vs DOX group |
如Fig 4所示,与对照组相比,DOX组IGFBP-3蛋白表达量增加,而IGF-1R蛋白表达量减少(P < 0.05)。心肌肽40 mg·L-1预处理8 h,可明显增加IGF-1R表达(P < 0.05),而经心肌肽(20、40 mg·L-1)预处理8 h的H9c2细胞,IGFBP-3蛋白表达减少(P < 0.05),且呈剂量依赖性。表明心肌肽保护DOX引起的心肌细胞损伤作用可能与调节IGF-1系统有关。
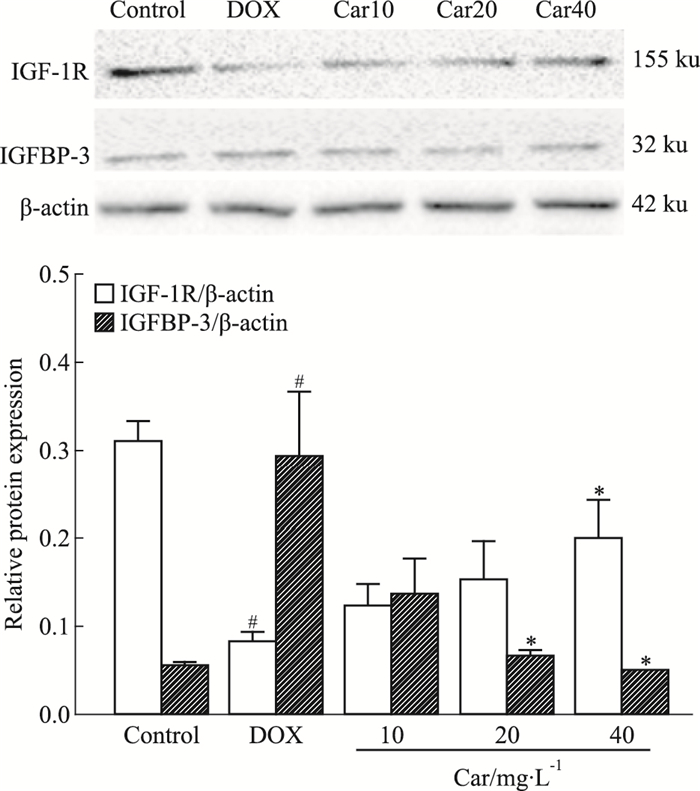
|
| Fig 4 Effect of cardiomyopeptide on the expression of IGF-1R and IGFBP-3 caused by doxorubicin in H9c2 cells(x±s, n=3) #P < 0.05 vs control group; *P < 0.05 vs DOX group |
细胞凋亡通常是由于线粒体渗透性改变,导致细胞色素C释放,caspase-3被激活引起。大量结果表明,Bcl-2和Bax在凋亡通路中有重要作用[8],Bcl-2可与Bax形成异源二聚体,阻止Bax向线粒体移位,减少线粒体通透性,抑制Bax的促凋亡作用[9]。Bcl-2作为抗凋亡因子,其同源二聚体可以维持线粒体的稳态,而且Bax同源二聚体可以直接激活caspase-3。Bcl-2和Bax基因在凋亡过程中是功能对立的重要调控基因,caspase-3是凋亡过程中重要的执行蛋白酶,Bcl-2、Bax通过调控caspase-3活性而发挥抗凋亡作用[10]。IGF-1具有多重细胞生物学作用,包括促细胞生长、分化及抗凋亡作用,是心肌细胞重要的生长、生存因子,能调节人或实验动物的心脏功能,如改善DOX引起的心肌病变和在心肌缺血、心衰实验模型中减少心肌细胞死亡。
IGF-1减少0.5 μmol·L-1 DOX引起的细胞凋亡[11],但对1 μmol·L-1 DOX无效[12]。在无血清培养基或DOX诱导的H9c2细胞凋亡实验中,IGF-1抗凋亡作用与Bax表达、caspase-3活性和DNA裂解有关,IGF-1通过减少Bax表达和抑制caspase-3活性,提高细胞存活率[13]。IGF-1缺氧引起的新生心肌细胞抗凋亡因子Bcl-2蛋白表达水平增加[14]。DOX通过影响IGF-1系统,使H9c2细胞的IGF-1R蛋白表达下调、IGFBP-3上调,IGFBP-3也通过IGF-1非依赖机制引起细胞凋亡[13]。N-乙酰半胱氨酸、右丙亚胺和卡维地洛等抗氧化剂预处理后,也通过调节IGF-1系统,发挥抗凋亡作用[15]。
本实验结果表明,心肌肽40 mg·L-1预处理8 h,可明显对抗1 μmol·L-1 DOX引起的细胞凋亡,使细胞存活率提高(25.6±2.0)%。Western blot结果显示,与正常组相比,DOX组的促凋亡蛋白Bax表达量明显增加,而抑制凋亡蛋白Bcl-2的表达量减少;心肌肽组可下调DOX诱导的Bax蛋白表达,上调Bcl-2蛋白的表达,抑制caspase-3蛋白活性。进一步观察了IGF-1R和IGFBP-3蛋白表达,发现心肌肽可改变DOX对IGF-1系统的影响,使IGF-1R蛋白表达增加,IGFBP-3蛋白表达减少。以上结果提示,心肌肽可能通过调节IGF-1系统,保护DOX所致的心肌细胞损伤。
| [1] |
Troncoso R, Díaz-Elizondo J, Espinoza S P, et al. Regulation of cardiac autophagy by insulin-like growth factor 1[J]. IUBMB Life, 2013, 65(7): 593-601. doi:10.1002/iub.1172 |
| [2] |
Minotti G, Menna P, Salvatorelli E, et al. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity[J]. Pharmacol Rev, 2004, 56(2): 185-229. doi:10.1124/pr.56.2.6 |
| [3] |
De Angelis A, Piegari E, Cappetta D, et al. Anthracycline cardiomyopathy is mediated by depletion of the cardiac stem cell pool and is rescued by restoration of progenitor cell function[J]. Circulation, 2010, 121(2): 276-92. doi:10.1161/CIRCULATIONAHA.109.895771 |
| [4] |
Piegari E, De Angelis A, Cappetta D, et al. Doxorubicin induces senescence and impairs function of human cardiac progenitor cells[J]. Basic Res Cardiol, 2013, 108(2): 334. doi:10.1007/s00395-013-0334-4 |
| [5] |
Esaki M, Takemura G, Kosai K, et al. Treatment with an adenoviral vector encoding hepatocyte growth factor mitigates established cardiac dysfunction in doxorubicin-induced cardiomyopathy[J]. Am J Physiol Heart Circ Physiol, 2008, 294(2): 1048-57. doi:10.1152/ajpheart.01102.2007 |
| [6] |
杨立平, 陈良万, 张贵灿, 等. 注射用心肌肽预处理对大鼠未成熟心肌缺血/再灌注损伤的保护作用及其机制[J]. 吉林大学学报(医学版), 2011, 37(6): 1037-42. Yang L P, Chen L W, Zhang G C, et al. Protective effect of cardiomypeotidin for injection preconditioning on immature myocardial ischemia-reperfusion injury in young rats and its mechanism[J]. J Jilin Univ(Med Ed), 2011, 37(6): 1037-42. |
| [7] |
阮鹏, 潘志锋, 舟玲善, 等. 心肌肽素在心脏手术中对心肌的保护作用[J]. 中华胸心血管外科杂志, 2001, 17(5): 288-90. Ruan P, Pan Z F, Zhou L S, et al. Protective effect of cardiomyopeptidin on myocardial injuries during open heart operation[J]. Chin J Thorac Cardiovasc Surg, 2001, 17(5): 288-90. doi:10.3760/cma.j.issn.1001-4497.2001.05.012 |
| [8] |
周宇, 李晶, 鲍翠玉. 姜黄素纳米粒对高脂诱导的心肌细胞损伤的作用[J]. 中国药理学通报, 2018, 34(9): 1283-8. Zhou Y, Li J, Bao C Y. Effects of curcumin nanoparticles on hyperlipid-induced cardiomyocyte injury[J]. Chin Pharmacol Bull, 2018, 34(9): 1283-8. doi:10.3969/j.issn.1001-1978.2018.09.019 |
| [9] |
张军, 谷翔, 黄问银, 等. GLP-1对AGEs诱导H9C2心肌细胞凋亡的保护作用研究[J]. 中国药理学通报, 2017, 33(1): 120-6. Zhang J, Gu X, Huang W Y, et al. Protective effect of GLP-1 against AGEs-induced H9C2 myocardial cell apoptosis[J]. Chin Pharmacol Bull, 2017, 33(1): 120-6. doi:10.3969/j.issn.1001-1978.2017.01.021 |
| [10] |
董雅洁, 高维娟. bcl-2、Bax、caspase-3在细胞凋亡中的作用及其关系[J]. 中国老年学杂志, 2012, 32(21): 4828-30. Dong Y J, Gao W J. Reciprocal effect of bcl-2, bax and caspase-3 on apoptosis[J]. Chin J Gerontol, 2012, 32(21): 4828-30. doi:10.3969/j.issn.1005-9202.2012.21.123 |
| [11] |
Wang L, Ma W, Markovich R, et al. Regulation of cardiomyocyte apoptotic signaling by insulin-like growth factor I[J]. Circ Res, 1998, 83(5): 516-22. doi:10.1161/01.RES.83.5.516 |
| [12] |
Morales M P, Galvez A, Eltit J M, et al. IGF-1 regulates apoptosis of cardiac myocyte induced by osmotic-stress[J]. Biochem Biophys Res Commun, 2000, 270(3): 1029-35. doi:10.1006/bbrc.2000.2550 |
| [13] |
Wang L, Ma W, Markovich R, et al. Insulin-like growth factor I modulates induction of apoptotic signaling in H9C2 cardiac muscle cells[J]. Endocrinology, 1998, 139(3): 1354-60. doi:10.1210/endo.139.3.5801 |
| [14] |
Jogie-Brahim S, Feldman D, Oh Y. Unraveling insulin-like growth factor binding protein-3 actions in human disease[J]. Endocr Rev, 2009, 30(5): 417-37. doi:10.1210/er.2008-0028 |
| [15] |
Patrizia F, Paolo S, Silvano G, et al. Doxorubicin impairs the insulin-like growth factor-1 system and causes insulin-like growth factor-1 resistance in cardiomyocytes[J]. PLoS One, 2015, 10(5): e0124643. doi:10.1371/journal.pone.0124643 |

