

肥胖以脂肪组织过度堆积和脂质代谢失调为特征,与多种代谢疾病的发生有关,如2型糖尿病、高脂血症、高血压、心血管疾病等,是全球面临的重要的公共卫生问题[1]。一项来自200个国家的1 920万人的实验研究表明,到2025年,全球男性肥胖患病率将达18%,女性患病率将超过21%[2]。
在哺乳动物中,脂肪组织主要以两种形式存在:白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)。WAT主要以甘油三酯的形式储存葡萄糖和脂肪酸中所含的能量,并以游离脂肪酸的形式释放能量;BAT含有大量线粒体,具有通过脂肪酸的氧化以热量的形式消散能量的能力。随着研究深入发现,人体内除了WAT和BAT外,还存在一种叫作“米色脂肪”的脂肪组织类型[3]。当机体交感神经兴奋时(如冷刺激、β3肾上腺素受体激活),原本具有白色脂肪细胞特征的脂肪细胞高表达线粒体解偶联蛋白1(uncoupling protein 1,UCP1)蛋白,耗能增加,减少脂质在脂肪细胞中的堆积,具有类似经典的棕色脂肪细胞的功能,这个过程称为“脂肪棕色化”,同时研究证明皮下腹股沟白色脂肪比附睾脂肪更容易转化[4]。C57BL/6J小鼠喂食高脂饲料一段时间后,易出现白色脂肪细胞过度堆积及脂质代谢异常,是研究肥胖及相关代谢疾病的较佳模型[5]。因此,本研究以C57BL/6J小鼠为研究对象,观察冷暴露对肥胖模型小鼠脂肪棕色化的影响。
1 材料与方法 1.1 实验动物8周龄♂SPF级C57BL/6J小鼠32只,体质量(20±2)g,由斯贝福(北京)生物技术有限公司提供[SCXK(京)2016-0002],合格证号:11401500032946。小鼠饲养于北京中医药大学屏障环境动物实验室[SYXK(京)2016-0038],室温(25±2)℃、45%相对湿度,12 h/12 h光暗周期,饲养期间小鼠自由进食及饮水。本研究通过北京中医药大学医学与实验动物伦理委员会审批准许可,编号:BUCM-4-2018030701-2063。
1.2 试剂高脂饲料(D12492,5.24 kcal·g-1)、普通饲料(3.24 kcal·g-1),购于北京华阜康生物科技股份有限公司[SCXK(京)2014-0008];血糖试纸,购于强生(中国)医疗器材有限公司,批号为4334014;总胆固醇(total cholesterol,TC)测试盒、甘油三酯(triglyceride,TG)测试盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测试盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测试盒、游离脂肪酸(free fatty acid,FFA)测试盒,均购于南京建成生物工程研究所,批号分别为20180816、20180816、20180810、20180814、20180817;瘦素(leptin peptide,LEP)、脂联素(adiponectin,ADPN)ELISA试剂盒,购于美国Cloud-Clone Corp,批号分别为L180809637、L180712071;UCP1、抗增殖蛋白(prohibitin,PHB)抗体,购于Abcam公司,批号分别为GR3188478-6、GR248742-21。
1.3 仪器全波长酶标仪BMG SPECTROstar Nano (江苏万科科教仪器有限公司);血糖仪(强生医疗器材有限公司);UH5300双光束分光光度计(日本日立公司)。
1.4 方法 1.4.1 实验动物分组及造模将32只8周龄♂SPF级C57BL/6J小鼠随机分为2组,即正常组、模型组,模型组小鼠喂食高脂饲料,正常组小鼠喂食普通饲料。干预8周后,将模型组、正常组小鼠各随机分为2组,即高脂5 ℃冷暴露(HFD+5 ℃)干预组、高脂室温(25±2)℃(HFD+RT)干预组、正常5 ℃冷暴露(Normal+5 ℃)干预组、正常室温(25±2)℃(Normal+RT)干预组,每天不同温度干预2 h,连续干预8周,每周监测小鼠体质量、体温、进食量。
1.4.2 空腹血糖及口服葡萄糖耐受量的测定连续冷暴露干预8周后,小鼠在禁食不禁水12 h后,采用剪尾取血的方法,用血糖仪试纸法测定小鼠血糖(blood glucose,BG)。用50%葡萄糖按2 g·kg-1剂量灌胃,测定灌胃前(0 min)及灌胃后30、60、90、120 min小鼠血糖,绘制糖耐量(oral glucose tolerance test,OGTT)时间曲线图,并采用近似梯形方法计算曲线下面积(area under curve,AUC),计算公式如下:AUC=0.5 h[1/2(BG0 min+BG30 min)+1/2(BG30 min+BG60 min)+1/2(BG60 min+BG90 min)+1/2(BG90 min+BG120 min)][6]。
1.4.3 Lee′s指数的测定连续冷暴露干预8周后,称量小鼠体质量,精确测量小鼠体长(鼻尖至肛门的距离),计算其Lee′s指数,Lee′s指数=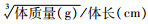
连续冷暴露干预8周后,禁食12 h,麻醉取血约1 mL,3 500 r·min-1离心10 min,分离血清。取血后,解剖分离皮下腹股沟白色脂肪及肩胛区棕色脂肪,并称重,皮下腹股沟白色脂肪及肩胛区棕色脂肪组织放在10%中性福尔马林固定液中固定。
1.4.5 脂肪重量/体质量的测定精确称重小鼠皮下腹股沟白色脂肪重量及肩胛部棕色脂肪重量,计算腹股沟白色脂肪重量(iWAT)/体质量(WB)、肩胛区棕色脂肪重量(BAT)/体质量(WB)的比值。
1.4.6 血脂的检测按照说明,采用生化试剂盒测定血清中TC、TG、LDL-C、HDL-C、FFA、LEP及ADPN的含量。
1.4.7 脂肪组织HE染色将固定在10%中性福尔马林固定液中的iWAT、BAT取出,石蜡包埋、切片后,常规HE染色,正置显微镜观察脂肪细胞形态学变化。
1.4.8 脂肪组织免疫组织化学染色将iWAT、BAT切片常规脱蜡、脱水;抗原修复;阻断内源性过氧化物酶;封闭;切片分别加UCP1、PHB一抗4 ℃过夜;过夜后,PBS清洗,滴加二抗;DAB显色;终止显色后,苏木精复染,流水返蓝;常规脱水、透明、中性树胶封片。棕黄色着色即为阳性细胞抗原存在位置。
1.4.9 脂肪组织UCP1、PHB蛋白的表达使用图像分析软件Image-Pro Plus 6.0,选取棕黄色处为阳性着色,对阳性表达处进行平均光密度(average optical density,AOD)分析。
1.5 统计学处理实验数据采用SAS 8.2软件进行统计,结果用x±s表示,多组间数据比较采用单因素方差分析法(One-way ANOVA),两组间比较采用独立样本t检验。
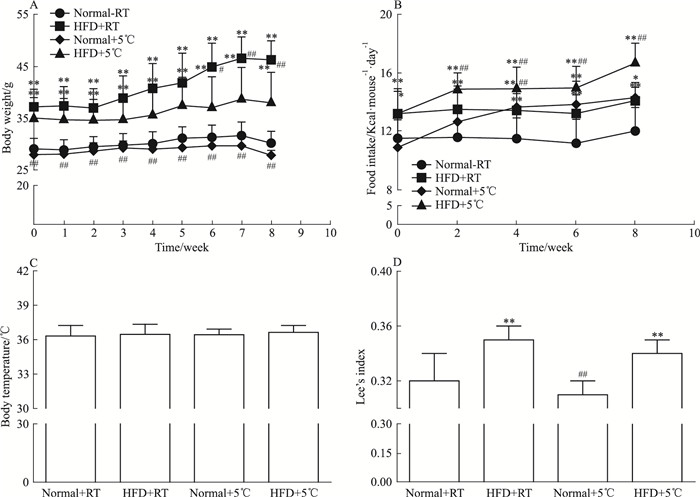
2 结果 2.1 冷暴露对C57BL/6J小鼠体质量、进食量、体温及Lee’s指数的影响如Fig 1A所示,实验期间,各组小鼠体质量呈现增长趋势。与Normal+RT组比较,在整个冷暴露干预期间,HFD+5 ℃组、HFD+RT组小鼠体质量明显增加;在冷暴露第8周时,Normal+5 ℃组小鼠体质量明显降低;与HFD+RT组比较,在冷暴露第6周至实验结束,HFD+5 ℃组小鼠体质量明显降低。结果提示冷暴露可抑制高脂饲料喂养致体质量快速增长。如Fig 1B所示,与Normal+RT组比较,在整个实验期间,HFD+5 ℃组、HFD+RT组小鼠进食量明显增加;在冷暴露第4周至实验结束,Normal+5 ℃组小鼠进食量明显增加;与HFD+RT组比较,在冷暴露第2周至实验结束,HFD+5 ℃组小鼠进食量明显增加。结果显示冷暴露条件下,小鼠的进食量增加。如Fig 1C所示,在冷暴露干预下,Normal+RT、HFD+RT、Normal+5 ℃、HFD+5 ℃四组小鼠体温差异无显著性,提示冷暴露对小鼠核心体温基本无影响。如Fig 1D所示,与Normal+RT组比较,HFD+5 ℃组、HFD+RT组小鼠Lee’s指数明显增加;Normal+5 ℃组小鼠Lee’s指数差异无显著性;与HFD+RT组比较,HFD+5 ℃组小鼠Lee’s指数有降低趋势,但差异无显著性。结果提示冷暴露对降低小鼠Lee’s指数无明显作用。
|
| Fig 1 Effect of cold exposure on body weight, food intake, body temperature and Lee's index in C57BL/6J mice(x±s, n=8) *P < 0.05, **P < 0.01 vs Normal+RT group; #P < 0.05, ##P < 0.01 vs HFD+RT group |
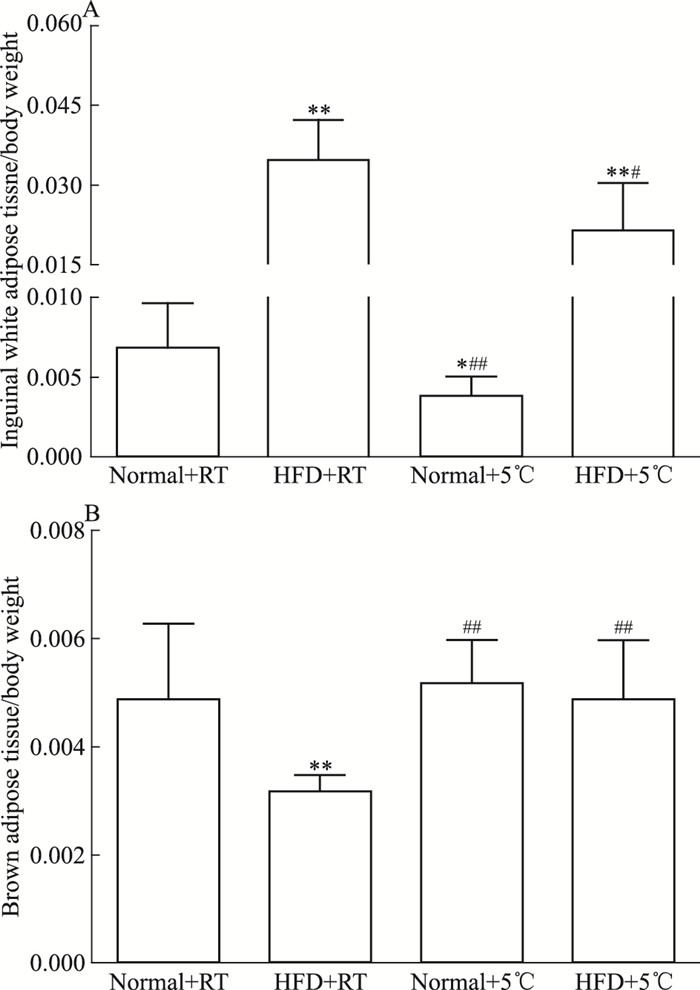
如Fig 2A所示,与Normal+RT组比较,HFD+5 ℃组、HFD+RT组小鼠iWAT重量/体质量的比值明显增加,Normal+5 ℃组小鼠明显降低;与HFD+RT组比较,HFD+5 ℃组小鼠iWAT重量/体质量的比值明显降低。如Fig 2B所示,与Normal+RT组比较,HFD+RT组小鼠BAT重量/体质量的比值明显降低,HFD+5 ℃、Normal+5 ℃组小鼠BAT重量差异无显著性;与HFD+RT组比较,HFD+5 ℃组小鼠BAT重量/体质量的比值明显增加。上述结果提示,冷暴露具有降低高脂饮食小鼠iWAT重量/体质量比值的作用,增加其BAT重量/体质量的比值。
|
| Fig 2 Effect of cold exposure on adipose tissue weightto body weight ratio in C57BL/6J mice(x±s, n=8) *P < 0.05, **P < 0.01 vs Normal+RT group; #P < 0.05, ##P < 0.01 vs HFD+RT group |
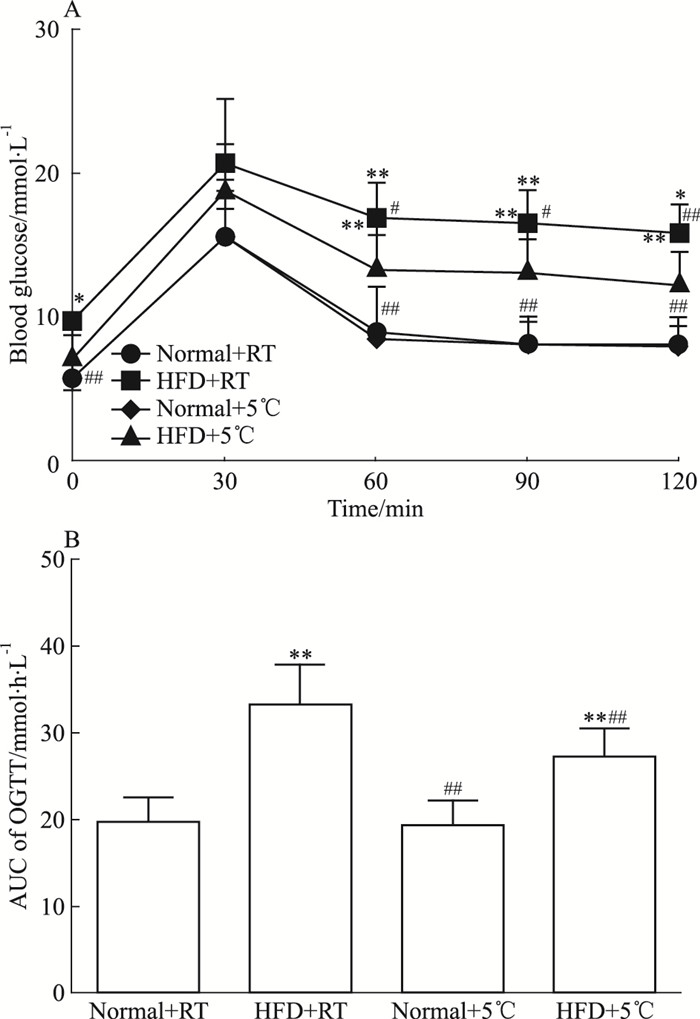
Fig 3A口服葡萄糖耐受量结果显示,与Normal+RT组比较,在第0 min时,HFD+RT组小鼠空腹血糖明显升高;HFD+ 5℃、Normal+5 ℃组小鼠血糖差异无显著性;与HFD+RT组比较,在第0 min时,HFD+5 ℃组小鼠空腹血糖明显降低。在用50%葡萄糖按2 g·kg-1剂量灌胃30 min后,与Normal+RT组比较,HFD+5 ℃组、HFD+RT组小鼠血糖明显升高;与HFD+RT组比较,灌胃30 min后,HFD+5 ℃组小鼠血糖差异无显著性。从灌胃后60 min至实验结束,与Normal+RT组比较,HFD+5 ℃组、HFD+RT组小鼠血糖明显升高;与HFD+RT组比较,从灌胃后60 min至实验结束,HFD+5 ℃组小鼠空腹血糖明显降低。如Fig 3B所示,与Normal+RT组比较,HFD+5 ℃组、HFD+RT组小鼠AUC明显升高;Normal+5 ℃组小鼠AUC差异无显著性;与HFD+RT组比较,HFD+5 ℃组小鼠AUC明显降低。上述结果提示冷暴露能改善其葡萄糖耐受量。
|
| Fig 3 Effect of cold exposure on blood glucose, oral glucosetolerance, and AUC in C57BL/6J mice(x±s, n=8) *P < 0.05, **P < 0.01 vs Normal+RT group; #P < 0.05, ##P < 0.01 vs HFD+RT group |
如Tab 1所示,与Normal+RT组比较,HFD+5 ℃组、HFD+RT组小鼠血清中TC、TG、LDL-C及HDL-C含量明显升高;Normal+5 ℃组小鼠清中TC、TG、LDL-C含量明显降低,HDL-C含量差异无显著性;与HFD+RT组比较,HFD+5 ℃组小鼠血清中TC、TG、LDL-C含量明显降低,HDL-C含量差异无显著性。结果显示,冷暴露能降低高脂饮食小鼠血脂水平。
| Group | TC | TG | LDL-C | HDL-C |
| Normal+RT | 3.57±0.30 | 0.79±0.11 | 0.44±0.06 | 2.31±0.89 |
| HFD+RT | 7.46±1.46** | 0.89±0.13** | 2.53±0.44** | 5.62±1.46** |
| Normal+5 ℃ | 2.89±0.36**## | 0.63±0.10*## | 0.34±0.07**## | 2.49±0.64## |
| HFD+5 ℃ | 5.43±1.35**# | 0.58±0.09**## | 1.06±0.31**## | 4.99±1.04** |
| *P<0.05, **P<0.01 vs Normal+RT group; #P<0.05, ##P<0.01 vs HFD+RT group | ||||
如Tab 2所示,与Normal+RT组比较,HFD+5 ℃组、HFD+RT组小鼠血清中FFA、LEP含量明显升高,ADPN含量明显降低;Normal+5 ℃组小鼠血清中FFA、LEP含量明显降低,ADPN含量明显升高;与HFD+RT组比较,HFD+5 ℃组小鼠血清中LEP含量明显降低,FFA含量有降低趋势,ADPN含量有增加趋势,但差异均无显著性,提示冷暴露能降低高脂饮食小鼠血清中LEP水平。
| Group | FFA/mmol·L-1 | LEP/μg·L-1 | ADPN/ng·L-1 |
| Normal+RT | 0.73±0.10 | 9.69±4.24 | 60.81±14.72 |
| HFD+RT | 1.21±0.14** | 48.12±18.08** | 40.81±20.39* |
| Normal+5 ℃ | 0.51±0.08*## | 5.72±2.72*## | 78.29±15.2*## |
| HFD+5 ℃ | 1.01±0.07* | 27.77±13.29**# | 47.95±23.21* |
| *P<0.05, **P<0.01 vs Normal+RT group; #P<0.05, ##P<0.01 vs HFD+RT group | |||
Fig 4为iWAT、BAT的HE染色结果,在iWAT中,Normal+RT组小鼠呈现出较大空泡状,形状近似圆形,组织比较致密;HFD+RT组小鼠呈现出大空泡的脂肪室,且形状不规则,细胞核、细胞器及胞质被挤到一侧呈薄环,白色脂肪特征明显;与HFD+RT组相比,Normal+5 ℃组、HFD+5 ℃组小鼠皮下腹股沟白色脂肪细胞出现多室,细胞变小、变圆,组织变的更加致密,具有棕色化趋势。在BAT中,Normal+RT组小鼠呈现近圆形的、小的脂肪室,脂肪细胞周围具有丰富的毛细血管;HFD+RT组小鼠呈现出较大的、单个空泡脂肪室,具有棕色细胞白色化的趋势;与HFD+RT组相比,Normal+5 ℃组、HFD+5 ℃组小鼠BAT细胞变小、变圆,分布明显增多且出现多室,细胞间毛细血管更加丰富。
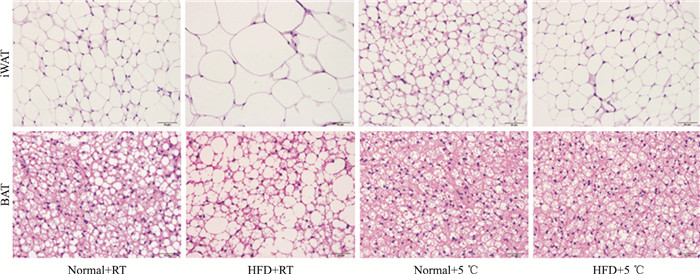
|
| Fig 4 Effect of cold exposure on morphology in iWAT and BAT in C57BL/6J mice(×400) |
UCP1蛋白具有解偶联作用,阻止ADP生成ATP,增加产热,是BAT中标志性蛋白。如Fig 5所示,在iWAT中,Normal+RT组可见少量的UCP1阳性细胞表达;HFD+RT组UCP1阳性细胞表达明显减少,与Normal+RT组比较差异有显著性;与HFD+RT组比较,Normal+5 ℃组、HFD+5 ℃组UCP1阳性细胞表达明显增多。在BAT中,Normal+RT组可见较多的UCP1阳性细胞表达;HFD+RT组UCP1阳性细胞表达明显减少,与Normal+RT组比较差异有显著性;与HFD+RT组比较,Normal+5 ℃组、HFD+5 ℃组UCP1阳性细胞表达明显增多。上述结果显示,冷暴露能增加高脂饮食小鼠iWAT、BAT中UCP1蛋白表达,具有激活BAT功能及促进脂肪棕色化的作用。
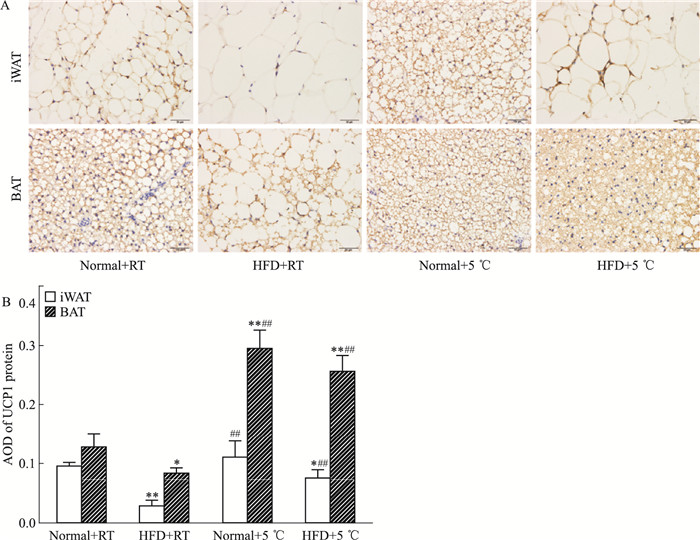
|
| Fig 5 Effect of cold exposure on expression of UCP1 protein in iWAT and BAT of C57BL/6J mice(×400) A: UCP1 protein was expressed in situ in iWAT and BAT; B: AOD of UCP1 protein in iWAT and BAT.*P < 0.05, **P < 0.01 vs Normal+RT group; ##P < 0.01 vs HFD+RT group. |
PHB蛋白主要存在于线粒体内膜上,在维持线粒体形态和功能及调节能量代谢中发挥着重要作用。如Fig 6所示,在iWAT中,Normal+RT组、HFD+RT组可见极少量的PHB阳性细胞表达,两者比较差异无显著性;与HFD+RT组比较,Normal+5 ℃组、HFD+5 ℃组PHB阳性细胞表达明显增多。在BAT中,Normal+RT组可见较多的PHB阳性细胞表达;HFD+RT组PHB阳性细胞表达减少,但与Normal+RT组比较,差异无显著性;与HFD+RT组比较,Normal+5 ℃组、HFD+5 ℃组PHB阳性细胞表达明显增多。上述结果提示,冷暴露能增加PHB蛋白在iWAT、BAT中的表达。
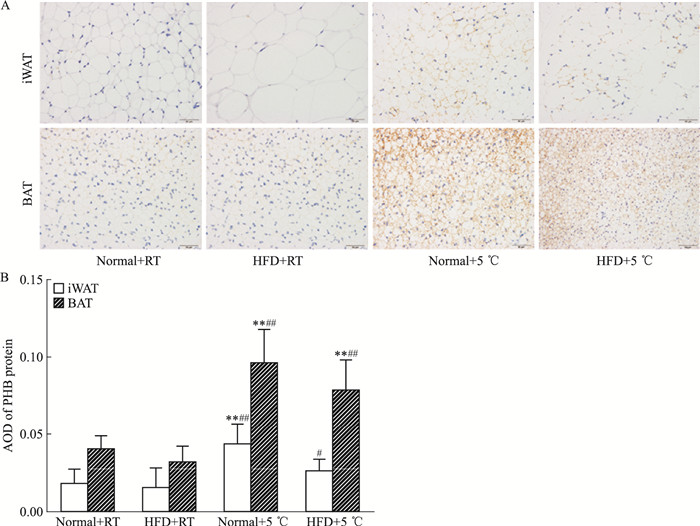
|
| Fig 6 Effect of cold exposure on expression of PHBprotein in iWAT and BAT of C57BL/6J mice(×400) A: PHB protein was expressed in situ in iWAT and BAT; B: AOD of PHB protein in iWAT and BAT.**P < 0.01 vs Normal+RT group; #P < 0.05, ##P < 0.01 vs HFD+RT group. |
脂肪组织是主要的代谢器官,在能量稳态中起关键作用。基于细胞形态和组织功能,哺乳动物的脂肪组织分为WAT和BAT两种类型。WAT不仅是能量储存的器官,同时也是功能活跃的内分泌器官,其分泌的蛋白质或脂肪细胞因子影响机体的糖脂代谢平衡、血压水平、炎症反应等,与血瘀证包括高血糖、高血压、高脂血症、动脉粥样硬化等的发生、发展密切相关。BAT在适应寒冷环境和能量消耗的调节中起重要作用,是哺乳动物非颤栗性产热的主要来源。非颤栗性产热的激活主要依赖BAT中的UCP1蛋白解偶联驱动[8]。UCP1在棕色脂肪线粒体中特异性表达,并且负责BAT的独特代谢功能,其通过线粒体内膜消散质子梯度,从而使电子传递系统与三磷酸腺苷(adenosine triphosphate,ATP)合成解偶联,使能量以热量的形式消散[9]。
研究发现,在禁食和正常室温条件下,BAT功能与WAT代谢活性相当,当机体的交感神经兴奋时(如冷刺激),BAT的功能激活及iWAT中UCP1表达明显增加,出现BAT的典型特征,增加耗能及产热[10]。PHB主要定位于线粒体内膜,少量存在于细胞核、细胞膜及胞质中,在维持线粒体形态、功能及调节能量代谢方面有着重要作用[11]。本研究结果显示,冷刺激明显降低高脂饮食小鼠体质量、iWAT重量/体质量比值,同时增加BAT重量/体质量比值,脂肪组织HE染色发现,与HFD+RT组相比,冷暴露干预组小鼠iWAT细胞出现多室、变小、变圆等类似棕色脂肪细胞表型,BAT明显增多且出现多室,细胞间毛细血管更加丰富;免疫组化结果显示,冷暴露可明显增加UCP1、PHB在iWAT和BAT中的表达。Schreiber等[12]研究证实,在冷刺激条件下,野生型小鼠通过增加摄食维持核心体温恒定。本实验结果显示,各组小鼠间核心温度无明显改变,与上述实验报道一致。
冷暴露激活的BAT和iWAT显示有调控血中TG水平的作用,其主要依赖脂蛋白脂酶(lipoprotein lipase,LPL)的活性和跨膜受体CD36,增加其对富甘油三酯脂蛋白(triglyceride-rich lipoprotein,TRL)的摄取,进而加速清除血清中TG,改善高脂血症[13]。本研究结果显示,冷刺激明显降低小鼠血清中TC、TG、LDL-C及FFA含量,可能与激活BAT及诱导iWAT棕色化有关。OGTT实验结果显示,冷暴露明显降低高脂饮食小鼠空腹血糖及改善葡萄糖耐量,可能与冷暴露增加棕色化和棕色脂肪对血中葡萄糖的摄取有关。已有报道证实,瘦素具有维持机体能量代谢和调节脂肪比例的功能,其作用于下丘脑神经肽(neuropeptide Y,NPY)/刺鼠肽基因相关蛋白(agouti-related peptide,AgRP),抑制食欲及促进能量消耗,也可与胰岛素协同作用于下丘脑的阿片-促黑素细胞皮质素原(proopiomelanocortin,POMC)神经元,使POMC神经元参与到脂肪棕色化过程中,增加耗能[14]。本研究结果显示,冷暴露明显降低高脂饮食小鼠血清中瘦素含量,增加其进食量,其机制可能与瘦素的双向调节有关。脂联素是一种脂肪组织分泌的内源性胰岛素增敏剂,具有增加胰岛素的敏感性及促进外周组织脂肪酸氧化的作用,其水平的降低是高脂血症和糖尿病的独立危险因素[15]。本研究结果显示,与室温高脂饮食组相比,高脂冷暴露组小鼠血清中脂联素含量有升高的趋势,但差异无显著性。
综上所述,冷暴露可明显抑制高脂饮食小鼠体质量增长,改善口服葡萄糖耐受量,降低iWAT重量/体质量比值、血清中TC、TG、LDL-C及瘦素含量,同时增加进食量、BAT重量/体质量比值及iWAT和BAT中UCP1、PHB蛋白表达,激活棕色脂肪组织及诱导脂肪棕色化,增加产热,减少白色脂肪堆积,在研究肥胖相关疾病时具有重要意义。
| [1] |
Georgianos P I, Zebekakis P E. General obesity, abdominal adiposity, and the risk of incident hypertension-from anthropometry to modern imaging techniques[J]. J Clin Hypertens, 2018, 20(10): 1427-9. doi:10.1111/jch.2018.20.issue-10 |
| [2] |
Di Cesare M, Bentham J, Stevens G A, et al. Trends in adult body-mass index in 200 countries from 1975 to 2014: a pooled analysis of 1698 population-based measurement studies with 192 million participants[J]. Lancet, 2016, 387(10026): 1377-96. |
| [3] |
Cousin B, Cinti S, Morroni M, et al. Occurrence of brown adipocytes in rat white adipose tissue: molecular and morphological characterization[J]. J Cell Sci, 1992, 103(4): 931-42. |
| [4] |
Boström P, Wu J, Jedrychowski M P, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]. Nature, 2012, 481(7382): 463-8. doi:10.1038/nature10777 |
| [5] |
刘芳, 高南南, 杨润梅, 等. 不同品系小鼠肥胖模型比较及C57BL/6J小鼠肥胖机制研究[J]. 中国药理学通报, 2013, 29(3): 360-5. Liu F, Gao N N, Yang R M, et al. Comparison of obesity models established in different strains of mice and mechanism of obese C57BL/6J mice[J]. Chin Pharmacol Bull, 2013, 29(3): 360-5. doi:10.3969/j.issn.1001-1978.2013.03.015 |
| [6] |
佘美华, 蒋文艳, 杨升华, 等. 新型褪黑素受体激动剂Neu-P11改善慢性睡眠限制大鼠胰岛素敏感性[J]. 中国药理学通报, 2013, 29(11): 1506-9. She M H, Jiang W Y, Yang S H, et al. Neu-P11, a novel melatonin receptor agonist, improves insulin sensitivity in chronic sleep restricted rats[J]. Chin Pharmacol Bull, 2013, 29(11): 1506-9. doi:10.3969/j.issn.1001-1978.2013.11.008 |
| [7] |
Bunyan J, Murrell E A, Shah P P. The induction of obesity in rodents by means of monosodium glutamate[J]. Br J Nutr, 1976, 35(1): 25-39. doi:10.1079/BJN19760005 |
| [8] |
Cannon B, Nedergaard J. Brown adipose tissue: function and physiological significance[J]. Physiol Rev, 2004, 84(1): 277-359. doi:10.1152/physrev.00015.2003 |
| [9] |
Lowell B B, Spiegelman B M. Towards a molecular understanding of adaptive thermogenesis[J]. Nature, 2000, 404(6778): 652-60. doi:10.1038/35007527 |
| [10] |
Orava J, Nuutila P, Lidell M E, et al. Different metabolic responses of human brown adipose tissue to activation by cold and insulin[J]. Cell Metab, 2011, 14(2): 272-9. doi:10.1016/j.cmet.2011.06.012 |
| [11] |
Artal S M, Tavernarakis N. Prohibitin and mitochondrial biology[J]. Trends Endocrinol Metab, 2009, 20(8): 394-401. doi:10.1016/j.tem.2009.04.004 |
| [12] |
Schreiber R, Diwoky C, Schoiswohl G, et al. Cold-induced thermogenesis depends on ATGL-mediated lipolysis in cardiac muscle, but not brown adipose tissue[J]. Cell Metab, 2017, 26(5): 753-63.e7. doi:10.1016/j.cmet.2017.09.004 |
| [13] |
Bartelt A, Bruns O T, Reimer R, et al. Brown adipose tissue activity controls triglyceride clearance[J]. Nat Med, 2011, 17(2): 200-5. |
| [14] |
Dodd G T, Decherf S, Loh K, et al. Leptin and insulin act on POMC neurons to promote the browning of white fat[J]. Cell, 2015, 160(1-2): 88-104. doi:10.1016/j.cell.2014.12.022 |
| [15] |
Ziemke F, Mantzoros C S. Adiponectin in insulin resistance: lessons from translational research[J]. Am J Clin Nutr, 2010, 91(1): 258S-61S. doi:10.3945/ajcn.2009.28449C |

