

魏伟(1960-),男,博士,教授,博士生导师,研究方向:抗炎免疫药理学,通讯作者,E-mail:wwei@ahmu.edu.cn
cAMP激活的交换蛋白分子(exchange protein activated by cAMP, Epac)是cAMP的直接靶向蛋白,通过激活Ras样小GTP酶Rap,参与cAMP介导的信号传导[1]。cAMP是细胞内第二信使,其在细胞应对不同刺激时起重要作用,同时也可介导免疫疾病、心脏功能障碍、癌症、纤维化[2]等疾病相关的信号通路,因此,Epac可通过cAMP信号传导而参与一系列疾病的病理过程。纤维化疾病是一类临床常见疾病,是细胞外基质(extracellular matrix, ECM)过度沉积的结果,作为正常生理学的一部分或受伤后发生,例如不同致病因素的反复或持续刺激,最终导致包括心脏、肺、肾、肝脏等组织中的瘢痕形成,严重的导致器官功能丧失[3]。因此,深入探讨纤维化疾病的病理机制,寻找纤维化疾病的治疗方法显得尤为重要。近年来,已有研究表明,Epac和纤维化疾病之间存在紧密联系。因此,本文对Epac在纤维化疾病中的作用进行综述,为深入了解Epac在纤维化疾病中相关作用机制,以及寻找靶点促进药物的研究与开发提供参考。
1 Epac的结构和分型以往研究表明,cAMP只通过激活蛋白激酶A(protein kinase A, PKA)来发挥效应。PKA是cAMP依赖性蛋白激酶,其被cAMP激活后,通过磷酸化底物蛋白而发挥作用。1998年,De等[4]为了寻找包含cAMP结合域的蛋白,以证明存在cAMP不依赖于PKA的方式介导下游信号的激活,克隆了编码鸟嘌呤核苷酸交换因子的基因,将其命名为Epac。由此,这种由cAMP直接调控的鸟嘌呤核苷酸交换因子进入了公众的视野,引起研究者的广泛探讨和研究。同年,Kawasaki等[5]鉴定出Epac存在两种亚型,分别为Epac1和Epac2。
Epac1由人类Rapgef3基因编码,分子质量约100 ku,Rapgef3 mRNA广泛表达于成熟组织中,如心脏、肾脏、血管、脂肪组织、中枢神经组织、子宫、肝脏等,且几乎所有组织以及造血细胞中都发现有Epac1的表达,其在不同组织中表达高低有不同。Epac2由人类基因Rapgef4编码,分子质量约115 ku,Rapgef4 mRNA表达相对受限[1]。Epac2有3个亚型,分别是Epac2A、Epac2B、Epac2C。
Epac由N端调控区域和C端催化区域组成(Fig 1)。Epac1和Epac2两种亚型在催化区无明显区别,主要由3个结构域组成,分别是Ras交换基序结构域(Ras exchange motif, REM)、Ras结合域(Ras association, RA)以及促进GTP在Rap上进行GDP交换的CDC25同源域(CDC25-homology domain, CDC25HD)。两种亚型在N端调控区不同,如Epac2A包含两个cAMP结合域,cAMP-A和cAMP-B,而Epac1只有1个这样的结构域,但同时具有Disheveled/Egl-10/pleckstrin(DEP)结构域,其作用与Epac的亚细胞定位有关。EPAC2A是最初鉴定的Epac2亚型[5],主要表达于大脑(大脑皮层、海马体、小脑和下丘脑)、垂体和内分泌胰腺。与Epac2A相比,Epac2B缺少cAMP-A结构域,其在肾上腺、睾丸间质细胞和胰腺内分泌部有表达。Epac2C是三种亚型中最短的一个,其缺少cAMP-A结构域和DEP结构域,几乎只在肝脏中表达[6]。

|
| Fig 1 Domain structures of Epac proteins |
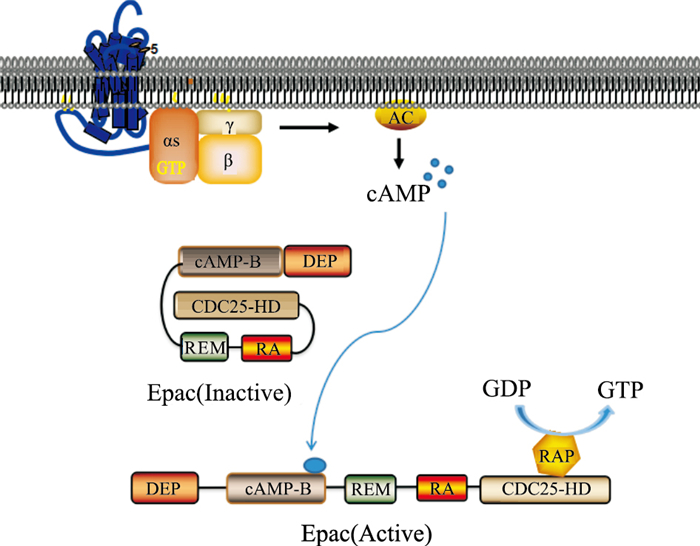
ATP经腺苷酸环化酶(adenylate cyclase, AC)催化后形成cAMP,在缺少cAMP的情况下,Epac的活性由于其调控区和催化区内分子相互作用而受到抑制,从而阻止了下游效应物Rap与CDC25结构域的结合,使Rap无法被激活。在存在cAMP的情况下,cAMP与Epac结合,诱导蛋白构象发生改变,解除交换因子蛋白N末端调控区域的自抑制作用,cAMP结构与cAMP-B结构相互作用,诱导了C末端的α-螺旋cAMP结合位点结构的运动,释放C端催化结构域,使Rap与暴露出来的CDC25结构域结合,导致Rap的激活,催化GTP与GDP的交换,随后通过GDP交换激活GTP,刺激下游信号[7](Fig 2)。
|
| Fig 2 Mechanism of Epac activation |
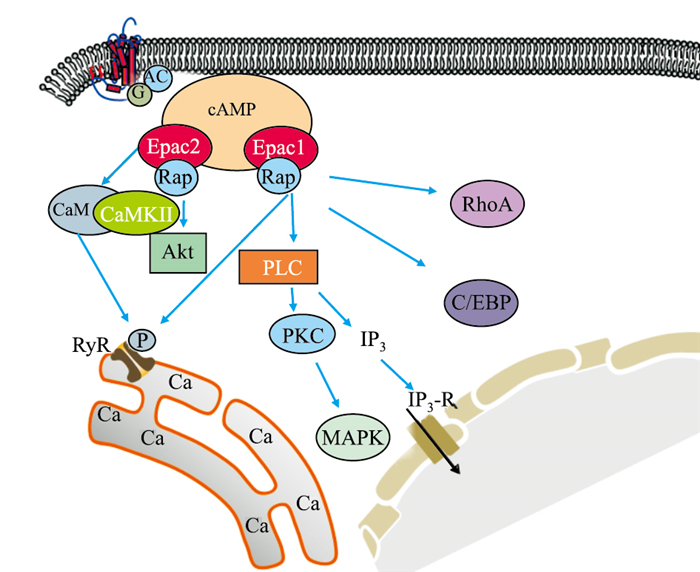
除了直接调节许多重要细胞过程之外,越来越多的研究证明,Epac通过参与不同信号通路(Fig 3),影响着许多疾病的病理过程。Epac还参与一系列的细胞内信号通路,可结合下游受体蛋白,从而发挥信号转导功能。
|
| Fig 3 Epac related signaling pathway |
Ras样小GTP酶Rap1和Rap2是Epac直接下游效应蛋白,它们在组织中传递大部分由cAMP介导的生物学效应。cAMP存在时激活Epac,进而催化Rap上的GDP转化为GTP。最经典的Epac/Rap1功能之一是对细胞黏附和细胞间连接的控制,如Epac1/Rap1通过调节Rac1来稳定内皮屏障的功能[8]; Epac2/Rap1信号抑制线粒体活性氧生成,并降低心律失常易感性[9]。
2.2.2 Epac/PLCEpac激活磷脂酶Cε(phospholipase Cε, PLCε),产生肌醇-1,4,5-三磷酸(inositol 1, 4, 5 triphosphate, IP3)。Epac通过PLCε、IP3和钙调蛋白激酶Ⅱ(calcium calmodulin protein kinase II, CaMKII)介导的信号通路,激活CaMKII,使雷诺丁受体(ryanodine receptor, RyR)关键的丝氨酸残基磷酸化,增加自发性肌质网Ca2+释放,从而增强心肌细胞兴奋性。Epac2还可通过PLCε通路刺激胰岛素分泌[10]。
2.2.3 Epac/Akt磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)和Akt是Epac的下游信号分子,Epac激活Rap1,激活后的Rap1与PI3K亚基结合并激活PI3K参与细胞活动,如通过Epac2/Rap1A/Akt途径促进H1299肺癌细胞蛋白去乙酰化酶8的表达[11]。磷酸二酯酶抑制剂可通过PDE4/cAMP/Epac/PI3K/Akt通路激活多种途径,减轻烧伤引起大鼠的骨骼肌蛋白溶解[12]。
2.2.4 Epac/Ras/MAPKRas可以被Epac激活,由无活性的Ras-GDP状态转变为Ras-GTP状态,从而发挥作用。被Epac激活后的Ras,可激活重组人相关RAS病毒(recombinant human related Ras viral, R-Ras),从而调节细胞相关功能。另外,激活后的Ras还可以激活Raf,Raf是Ras/Raf/MEK/MAPK途径的一部分,该途径是负责将细胞膜结合受体的信号传递到细胞内,协调细胞对各种环境因素的反应。如在下丘脑室旁核中Epac1可能通过MEK1/2通路参与完全弗氏佐剂模型所导致慢性疼痛的发展[13]。Epac依赖性ERK通路的激活可以保护心肌细胞不受细胞死亡的影响。肿瘤细胞依赖ADRB3/cAMP/Epac/JNK通路产生脑源性神经营养因子而促进肿瘤神经支配。Epac可介导cAMP激活p38 MAPK及调节小脑神经元中Ca2+依赖性K+通道。
2.2.5 Epac/PKCEpac可以诱导PKCα和PKCε的激活,Epac/PKC信号在瞬时感受器电位增强而引起炎症的过程中,起着至关重要的作用。另有研究表明,β-肾上腺素受体激动剂可激活cAMP/Epac/PKCδ/p38 MAPK通路,在新生小鼠心脏成纤维细胞中产生IL-6,该研究确认了Epac是cAMP与p38 MAPK信号通路之间的连接,并证明PKCδ可以作为cAMP/Epac通路的一种新的下游效应蛋白[14]。
2.2.6 Epac/C/EBP-βCCAAT/增强子结合蛋白(CCAAT/enhancer-binding protein-β, C/EBP)是DNA结合转录因子bHLH基因家族的成员。Epac可以通过影响C/EBP-β在肾小管上皮细胞线粒体生物合成而发挥重要作用,激活cAMP/Epac/C/EBP-β通路可以改善慢性肾病[15]。另外,Epac信号还可以激活C/EBP-β或C/EBP-δ,上调蜕膜催乳素的mRNA在人类胚胎干细胞中表达。
3 Epac与纤维化疾病 3.1 心肌纤维化心脏在高血压或心肌梗死等疾病损伤后,体内多种介质如血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)、内皮素1(endothelin 1, ET-1)和转化生长因子β(transforming growth factor β, TGF-β)会促进心脏成纤维细胞的活化,从而导致成纤维细胞增殖、迁移,ECM过度生成,且使成纤维细胞分化形成肌成纤维细胞,形成的肌成纤维细胞组织结构重塑导致纤维瘢痕的形成,引起一系列的心脏功能受损。腺苷是由腺嘌呤核苷酸经直接刺激、缺氧或损伤而从细胞外产生的一种小分子,通过经典的G蛋白偶联受体作用,导致cAMP的产生和下游靶点的激活。Phosri等[16]使用从新生SD大鼠心室分离培养的心脏成纤维细胞(cardiac fibroblasts, CF),证实了用腺苷A2受体刺激剂(CV1808)刺激后,其通过cAMP依赖性途径抑制胶原合成,并抑制Ang Ⅱ诱导的心脏肌成纤维细胞(cardiac myofibroblasts, CMF)分化,从而产生抗纤维化作用。当使用PKA抑制剂(PKI)阻断PKA活性时,腺苷A2受体介导的抑制Ang Ⅱ诱导的胶原合成和α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)表达的作用不受影响,而当用Epac特异性抑制剂(ESI-09)阻断Epac活性时,则明显拮抗腺苷A2受体的抗纤维化作用,提示Epac在A2受体介导的抑制Ang Ⅱ诱导的心肌成纤维细胞胶原生成中是必需的,Epac在此模型下可协同腺苷A2受体产生抗纤维化作用。
但是,Epac1在心肌纤维化中的作用存在相互矛盾的现象,如另有研究表明,Epac1有促进纤维化进程的作用。Cai等[17]选用5型腺苷酸环化酶(AC5)高表达基因小鼠(AC5TG)、Epac1敲除小鼠、AC5TG-Epac1敲除小鼠(AC5TG与Epac1敲除小鼠交配而产生的小鼠)、野生型小鼠,经微型渗透泵连续7 d给予异丙肾上腺素,心脏Masson染色结果显示,AC5TG小鼠心脏的心肌纤维化程度明显大于野生型小鼠,提示AC5过表达加剧了异丙肾上腺素诱导的心肌纤维化,在AC5TG-Epac1敲除小鼠模型中未观察到这种恶化。此实验结果表明,敲除Epac1可以减轻AC5介导的儿茶酚胺应激诱导的心肌纤维化。Ivonne等[18]分离新生大鼠的心室成纤维细胞,培养分化成为CF、CMF。与CF相比CMF可分泌更多的ECM蛋白。使用TGF-β刺激后,结果显示CMF中的Epac1水平高于CF。与CMF相比,CF具有较低的Epac1和α-SMA表达水平,Epac1蛋白含量的增加可能是CMF在心脏创伤愈合过程中完成细胞功能所必需的,如胶原的分泌、ECM的黏附和收缩等。以上实验结论不同可能是由于刺激方法不同,Epac1在不同条件下表达的不同还需大量实验来加以研究。
3.2 肾纤维化肾纤维化最初表现为血管生成异常、毛细血管闭塞、周细胞和血管周围细胞的刺激,随后通过产生促炎细胞因子,进一步刺激肾脏系膜细胞、成纤维细胞和肾小管上皮细胞,在间质间隙产生和沉积大量的ECM成分。在这些细胞类型中,肾小管上皮细胞被认为是ECM沉积的主要来源之一。Ding等[19]选用♂CD-1小鼠,通过尾静脉注射给予Epac1激动剂8-pCPT-2′-O-Me-cAMP(8-O-cAMP),于单侧输尿管梗阻手术前1天尾静脉注射,连续给药7 d。与只做单侧输尿管梗阻手术组小鼠以及用盐水处理组小鼠比较,用Epac1激动剂进行预处理的小鼠纤维连接蛋白表达明显减少,而单侧输尿管梗阻手术组和生理盐水组小鼠纤维连接蛋白表达均明显增加。细胞水平上,用不同剂量的8-O-cAMP对原代肾小管上皮细胞预处理30 min,再用TGF-β1处理48 h,结果表明,经Epac1激动剂处理后,激活的Epac1可以降低TGF-β1诱导的纤维连接蛋白的表达,同时减少肾小管萎缩、肾小管细胞脱离和间质纤维化。此实验结果提示,Epac1是肾纤维化中肾小管上皮细胞中cAMP信号转导不可或缺的效应物,激活Epac1可减轻肾纤维化的程度。
3.3 肝纤维化肝纤维化是机体对慢性损伤如病毒感染、药物诱导、代谢紊乱、脂肪性肝炎的修复反应,当肝受损时,肝星状细胞(hepatic stellate cell, HSC)受多种信号通路调节,经历了以α-SMA表达、ECM沉积为特征的肌成纤维细胞表型的活化过程,肌成纤维细胞是造成肝纤维化ECM形成的主要来源。Yang等[20]用200 μmol·L-1乙醛处理大鼠HSC 48 h造成细胞水平的酒精性肝纤维化模型,使用定量逆转录聚合酶链反应和免疫印迹法对两种Epac亚型的mRNA和蛋白水平进行了定量研究,结果显示Epac1、Epac2在大鼠HSC中均有表达。乙醛诱导的HSC中,Epac2的表达明显高于对照组,而Epac1的表达降低。这些结果提示Epac1或Epac2可能参与调节HSC的活化。沉默Epac1和同时沉默Epac1和2使乙醛刺激的HSC增殖活力上升,且α-SMA及Ⅰ、Ⅲ型胶原的表达水平升高。因此,研究者推测Epac1相对于Epac2来说可能起到一种保护性的作用。戴志娟等[21]对SD大鼠腹腔注射二甲基亚硝胺诱导肝纤维化,结果显示,在急性肝损伤时期,Epacl和Epac2蛋白总体表达水平均下降。之后随着肝纤维化逐步加重,Epacl水平升高,6周时达到高峰,而Epac2水平继续下降,4周时达到最低水平,该实验结果提示,Epac1和肝纤维化进程呈正相关,Epac2和肝纤维化进程呈负相关。以上两个研究者所得出结果不同的原因可能是所造模型不同,也可能由于体内实验复杂的信号反馈和体外实验有区别所导致,Epac在纤维化发生过程中的具体作用以及两种亚型是否存在功能差异,还需要在不同模型之中再进行研究证明。
3.4 肺纤维化肺成纤维细胞在正常组织修复和纤维化形成过程中参与胶原的分泌,成纤维细胞分泌ECM在肺损伤后创面愈合中起重要作用,但过度积聚可导致肺纤维化。ET-1已被证明参与了人类肺纤维化,Hartopo等[22]分别采用ET-1转化酶杂合子敲除小鼠(ECE-1+/-)及野生型小鼠(ECE-1+/+),建立博莱霉素诱导的肺纤维化模型,在博莱霉素滴注后d 7、14、28检测肺炎症和纤维化。结果显示,与未注射博来霉素的ECE-1+/-及ECE-1+/+相比,滴注博来霉素的ECE-1+/+小鼠细胞内cAMP、Epac1和PKA水平下降,而ECE-1+/-小鼠细胞内cAMP、Epac1和PKA水平不变。虽然不能排除其他诱导剂参与这一过程的可能性,但研究者认为,在ECE-1+/-小鼠中的降钙素基因相关肽(calcitonin gene-related peptide, CGRP)激活了cAMP/Epac1和cAMP/PKA通路。另有免疫组化结果表明,Epac1在ECE-1+/-小鼠的炎性区出现阳性表达,而在ECE-1+/+小鼠的组织中未见阳性表达。因此研究结果提示,ECE-1活性降低导致CGRP水平升高,通过激活CGPR/cAMP/Epac1信号通路,改善肺纤维化程度,提示Epac1在此肺纤维化模型中起到抑制的作用。Huang等[23]研究了Epac在细胞水平上的表达,他们采用正常和纤维化成人患者的肺成纤维细胞,蛋白免疫印迹法结果表明Epac1在这些细胞中有表达,相反,Epac2在这些细胞中无表达。进一步转染沉默Epac1的shRNA,结果证明前列腺素E2通过激活Epac1抑制细胞增殖,并通过pull-down实验进一步确定Rap1为Epac1抑制增殖的下游靶点。
3.5 囊性纤维化囊性纤维化(cystic fibrosis, CF)是由囊性纤维化跨膜调节因子(cystic fibrosis transmembrane conductance regulator, CFTR)基因突变,引起cAMP调控的氯离子通道表达、转运或功能受损的一种遗传性疾病。已知Epac1是影响微管蛋白聚合的一种cAMP信号分子,微管在CF细胞信号传递中具有重要作用。研究者们对缺乏CFTR基因的小鼠和野生型小鼠的全肺溶解物进行了检测,缺乏CFTR基因表达的小鼠肺中Rap1-GTP/Rap1总含量明显低于野生型小鼠。由于Epac1是小GTP酶Rap1的激活因子,所以Rap1-GTP含量可作为Epac1激活的指标,因此研究提示Epac1在CF小鼠中表达是降低的,CF中Epac1活性降低是导致CF细胞微管蛋白聚合速率降低的机制之一,CF细胞存在Epac1/Rap1信号转导缺陷,导致微管重构率受损,进而导致胆固醇积累[24],提示在此模型中Epac起到抑制作用。
3.6 骨髓纤维化慢性髓细胞白血病(chronic myelogenous leukemia, CML)是一种多能干细胞水平上的肿瘤性恶变疾病,其疾病发展过程中常伴骨髓纤维化。与正常人相比,CML患者的所有细胞均表达较高水平的多药耐药蛋白4(multidrug resistance protein 4, MRP4),且MRP4被认为是cAMP介导的信号通路的独立调节者。研究者采用M07e髓系白血病细胞,用MAPK/ERK抑制剂PD 98059预处理细胞后,可完全抑制cAMP激动剂(db-cAMP)导致的细胞活性增加,而PKA抑制剂KT5720以及作为PI3K和p38的抑制剂SB203580对细胞活性的影响无统计学意义。为进一步证实Epac/MEK通路参与调控,将Epac siRNA和对照siRNA转染M07e细胞,随后用db-cAMP和选择性Epac激动剂8- CPT-Me-cAMP(8-CPT)刺激,与对照siRNA相比,Epac siRNA的预处理明显降低了MRP4的表达。此结果表明Epac信号通路上调M07e的MRP4表达[25],提示在骨髓纤维化中Epac也起到了一定作用。
4 展望1998年Epac的发现丰富了cAMP信号通路,拓宽了对于cAMP诱导的信号通路及其在生理过程中作用的理解,但是对于Epac的研究还有许多不足或未涉及的领域。纤维化疾病一直都是现代医学治疗的重点和难点,因此对于Epac相关信号通路的日益了解会为纤维化性疾病的治疗提供新的方向和途径。近来发现对于Epac的深入研究,可以利用Epac条件性基因敲除鼠,特异性敲除可以提高基因研究的靶向性,也可以提高我们对哺乳动物组织中Epac的病理生理学的了解。另外目前很多学者在研究亚型特异性的激动剂和拮抗剂,这对于深入研究亚型特异性功能具有积极的作用。由于不同亚型介导的信号通路导致的生理作用可能不同,因此不同亚型的特异性激动剂或拮抗剂在各个不同细胞及生理过程中具体起到的作用是很有必要多关注的,希望将来靶向Epac小分子也可以成为对于纤维化有效的治疗方法。
| [1] |
Sugawara K, Shibasaki T, Takahashi H, et al. Structure and functional roles of Epac2 (Rapgef4)[J]. Gene, 2016, 575(2): 577-83. doi:10.1016/j.gene.2015.09.029 |
| [2] |
Schinner E, Wetzl V, Schlossmann J. Cyclic nucleotide signalling in kidney fibrosis[J]. Int J Mol Sci, 2015, 16(2): 2320-51. doi:10.3390/ijms16022320 |
| [3] |
Gu Y J, Sun W Y, Zhang S, et al. Targeted blockade of JAK/STAT3 signaling inhibits proliferation, migration and collagen production as well as inducing the apoptosis of hepatic stellate cells[J]. Int J Mol Med, 2016, 38(3): 903-11. doi:10.3892/ijmm.2016.2692 |
| [4] |
de Rooij J, Zwartkruis F J, Verheijen M H, et al. Epac is a Rap1 guanine-nucleotide-exchange factor directly activated by cyclic AMP[J]. Nature, 1998, 396(6710): 474-7. doi:10.1038/24884 |
| [5] |
Kawasaki H, Springett G M, Mochizuki N, et al. A family of cAMP-binding proteins that directly activate Rap1[J]. Science, 1998, 282(5397): 2275-9. doi:10.1126/science.282.5397.2275 |
| [6] |
Ozaki N, Shibasaki T, Kashima Y, et al. cAMP-GEFⅡ is a direct target of cAMP in regulated exocytosis[J]. Nat Cell Biol, 2000, 2(11): 805-11. doi:10.1038/35041046 |
| [7] |
Rehmann H, Rueppel A, Bos J L, et al. Communication between the regulatory and the catalytic region of the cAMP-responsive guanine nucleotide exchange factor Epac[J]. J Biol Chem, 2003, 278(26): 23508-14. doi:10.1074/jbc.M301680200 |
| [8] |
Aslam M, Tanislav C, Troidl C, et al.cAMP controls the restoration of endothelial barrier function after thrombin-induced hyperpermeability via Rac1 activation[J]. Physiol Rep, 2014 Oct 24, 2(10). pii: e12175. doi: 10.14814/phy2.12175.
|
| [9] |
Yang Z, Kirton H M, Al-Owais M, et al. Epac2-Rap1 signaling regulates reactive oxygen species production and susceptibility to cardiac arrhythmias[J]. Antioxid Redox Signal, 2017, 27(3): 117-32. doi:10.1089/ars.2015.6485 |
| [10] |
Dzhura I, Chepurny O G, Leech C A, et al. Phospholipase C-epsilon links Epac2 activation to the potentiation of glucose-stimulated insulin secretion from mouse islets of Langerhans[J]. Islets, 2011, 3(3): 121-8. doi:10.4161/isl.3.3.15507 |
| [11] |
Park J, Juhnn Y. cAMP signaling increases histone deacetylase 8 expression via the Epac2-Rap1A-Akt pathway in H1299 lung cancer cells[J]. Exp Mol Med, 2017, 49(2): e297. doi:10.1038/emm.2016.152 |
| [12] |
Joshi R, Kadeer N, Sheriff S, et al. Phosphodiesterase (PDE) inhibitor torbafylline (HWA 448) attenuates burn-induced rat skeletal muscle proteolysis through the PDE4/cAMP/EPAC/PI3K/Akt pathway[J]. Mol Cell Endocrinol, 2014, 393(1-2): 152-63. doi:10.1016/j.mce.2014.06.012 |
| [13] |
陈彬彬, 黄思婷, 花景煜, 等. 下丘脑室旁核Epac蛋白在大鼠炎性痛调节过程中的作用及其机制研究[J]. 中国药理学通报, 2018, 34(4): 517-22. Chen B B, Huang S T, Hua J Y, et al. The role and mechanism of Epac protein in the paraventricular nucleus of hypothalamus in the regulation of inflammatory pain in rats[J]. Chin Pharmacol Bull, 2018, 34(4): 517-22. doi:10.3969/j.issn.1001-1978.2018.04.016 |
| [14] |
Chen C, Du J, Feng W, et al. beta-Adrenergic receptors stimulate interleukin-6 production through Epac-dependent activation of PKCdelta/p38 MAPK signalling in neonatal mouse cardiac fibroblasts[J]. Br J Pharmacol, 2012, 166(2): 676-88. doi:10.1111/j.1476-5381.2011.01785.x |
| [15] |
Ding H, Bai F, Cao H, et al. PDE/cAMP/Epac/C/EBP-beta signaling cascade regulates mitochondria biogenesis of tubular epithelial cells in renal fibrosis[J]. Antioxid Redox Signal, 2018, 29(7): 637-52. doi:10.1089/ars.2017.7041 |
| [16] |
Phosri S, Bunrukchai K, Parichatikanond W, et al. Epac is required for exogenous and endogenous stimulation of adenosine A2B receptor for inhibition of angiotensin Ⅱ-induced collagen synthesis and myofibroblast differentiation[J]. Purinerg Signal, 2018, 14(2): 141-56. doi:10.1007/s11302-017-9600-5 |
| [17] |
Cai W, Fujita T, Hidaka Y, et al. Disruption of Epac1 protects the heart from adenylyl cyclase type 5-mediated cardiac dysfunction[J]. Biochem Bioph Res Co, 2016, 475(1): 1-7. doi:10.1016/j.bbrc.2016.04.123 |
| [18] |
Olmedo I, Muñoz C, Guzmán N, et al. EPAC expression and function in cardiac fibroblasts and myofibroblasts[J]. Toxicol Appl Pharm, 2013, 272(2): 414-22. doi:10.1016/j.taap.2013.06.022 |
| [19] |
Ding H, Bai F, Cao H, et al. PDE/cAMP/Epac/C/EBP-β signaling cascade regulates mitochondria biogenesis of tubular epithelial cells in renal fibrosis[J]. Antioxid Redox Sign, 2018, 29(7): 637-52. doi:10.1089/ars.2017.7041 |
| [20] |
Yang Y, Yang F, Wu X, et al. EPAC activation inhibits acetaldehyde-induced activation and proliferation of hepatic stellate cell via Rap1[J]. Can J Physiol Pharm, 2016, 94(5): 498-507. doi:10.1139/cjpp-2015-0437 |
| [21] |
戴志娟, 陈永平, 程瑗, 等. Epac在大鼠肝纤维化模型中的动态变化[J]. 中华传染病杂志, 2011, 29(1): 11-7. Dai Z J, Chen Y P, Cheng Y, et al. Dynamic changes of Epac in rat liver fibrosis model[J]. Chin J Infect Dis, 2011, 29(1): 11-7. |
| [22] |
Hartopo A B, Emoto N, Vignon-Zellweger N, et al. Endothelin-converting enzyme-1 gene ablation attenuates pulmonary fibrosis via CGRP-cAMP/EPAC1 pathway[J]. Am J Respir Cell Mol Biol, 2013, 48(4): 465-76. doi:10.1165/rcmb.2012-0354OC |
| [23] |
Huang S K, Wettlaufer S H, Chung J, et al. Prostaglandin E2 inhibits specific lung fibroblast functions via selective actions of PKA and Epac-1[J]. Am J Respir Cell Mol Biol, 2008, 39(4): 482-9. doi:10.1165/rcmb.2008-0080OC |
| [24] |
Rymut S M, Ivy T, Corey D A, et al. Reduced EPAC1 activity leads to slowed microtubule polymerization in cystic fibrosis epithelial cells[J]. Am J Respir Cell Mol Biol, 2015, 53(6): 853-62. doi:10.1165/rcmb.2014-0462OC |
| [25] |
Bröderdorf S, Zang S, Schaletzki Y, et al. cAMP regulates expression of the cyclic nucleotide transporter MRP4 (ABCC4) through the EPAC pathway[J]. Pharmacogenet Genom, 2014, 24(10): 522-6. doi:10.1097/FPC.0000000000000084 |

