

阿尔茨海默病(Alzheimer’s disease,AD)是一种发病过程漫长,多发生于中老年人,具有一定遗传性的神经退行性疾病。主要的临床表现为记忆力的减退以及认知功能的缺失[1-2]。关于AD的发病机制存在着多种假说,其中β淀粉样蛋白(amyloid β-protein, Aβ)沉积学说是当今的研究热点。β-分泌酶1(β-site APP cleaved enzyme-1, BACE-1)作为Aβ生成的限制酶,促进淀粉样前体蛋白(amyloid precursor protein,APP)水解成Aβ,间接控制着Aβ产生。BACE-1活性增强,Aβ生成增多,易导致Aβ异常聚集,沉积在脑内引起炎症等反应,造成神经元丢失、脑组织萎缩[3-4]。因此,抑制BACE-1表达,减少Aβ的生成,可以延缓AD的发生。
蛇床子素(osthole, OST)又名甲氧基欧芹酚(C15H16O3),是伞形科植物独活中的活性单体[5]。现代药理学发现,OST具有广泛的药理作用,包括抗炎、抗凋亡、抗氧化应激等[5-7]。中医中,独活具有温肾壮阳、燥湿、祛风、杀虫等作用。实验室前期研究发现,OST可以调控miRNA-9,并且对神经系统具有一定的保护作用[8-10]。体内实验发现,以20 mg·kg-1 OST灌胃给予APP/PS1小鼠,对AD有一定的治疗作用[11]。
MicroRNAs (miRNAs)是一种调节内源性基因的非编码小RNA,它主要通过抑制mRNA的翻译或促进其降解而发挥作用[12]。近年来研究表明,AD的发生与多种miRNAs异常表达相关。现代药理学研究中,miRNAs可以作为诊断某种疾病的标志,并且miRNAs几乎可以调控人体内每一个生理过程[13]。本实验利用基因芯片技术,筛选差异表达的miRNA,并利用生物信息学预测miRNA调控的下游靶基因,探讨OST治疗AD的作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物与细胞株9月龄的APP/PS1双转基因小鼠20只,♀♂各半,体质量(26±4)g,购自北京中科泽晟生物技术有限公司[SCXK(京)2013-0002];SPF级C57BL/6小鼠10只,♀♂各半,体质量(23±3)g,购于辽宁长生生物有限公司[SCXK(辽):2010-0001]。293T细胞株、人神经母细胞瘤细胞株SH-SY5Y,均由首都医科大学提供。
1.1.2 试剂OST,购于中药食品药品研究所(批号:110822-200407);APP595/596质粒、GFP质粒,以及辅助质粒pLP1、pLP2、pMDG,由天津医科大学提供;miRNA-9抑制剂,苏州吉玛基因股份有限公司产品;BACE-1引物,大连万泽生物技术有限责任公司产品;兔抗BACE-1、兔抗β-actin抗体,北京博奥森生物技术有限公司产品;DAPI染液,美国Sigma公司产品;Bradford法蛋白浓度试剂盒,江苏凯基生物技术股份有限公司产品。
1.1.3 仪器天平(德国赛多利斯艾科勒);Ti-S型荧光显微镜(日本尼康公司);二氧化碳培养箱(美国Nuaire公司);MG96G PCR仪(杭州朗基科学仪器有限公司);水平核酸电泳仪、半干式蛋白转膜仪(美国Bio-Rad公司);凝胶成像系统(上海天能科技有限公司)、MR-96A酶标仪(深圳迈瑞公司)。
1.2 方法 1.2.1 基因芯片技术筛选差异表达miRNA取OST16 mg,溶解于2 mL PEG400中,加入ddH2O稀释至4 mL,4 ℃备用。9月龄APP/PS1小鼠,♀♂各半,将APP/PS1小鼠随机分为模型组(APP组)和给药组(OST组),每组10只;另取C57BL/6小鼠作为空白对照组(Control)。给药组小鼠以20 mg·kg-1OST灌胃给药,每日两次,连续灌胃6周;对照组及模型组小鼠则以等剂量50% PEG400灌胃。
分别取模型组、OST组和空白组小鼠整脑,每组3只,提取总RNA,委托上海欧易生物医学科技有限公司,采用Agilent Mouse miRNA, Release 21.0芯片完成样本检测和分析。根据热图结果以及差异倍数变化值,进行差异miRNA筛选,筛选的标准为上调或者下调倍数变化值≥2.0,确定为OST调控较明显的miRNAs。
1.2.2 生物信息学预测miRNA调控靶基因利用TargetScan(http://www.targetscan.org/vert_70/)、PicTar(https://pictar.mdc-berlin.de/)、DIANA(http://diana.imis.athena-innovation.gr/DianaTools/index.php)3个miRNA靶点预测数据库,预测差异表达miRNA的下游靶基因,并利用Cytoscape关于miRNA的插件CytargetLinker验证(https://projects.bigcat.unimaas.nl/cytargetlinker/linksets/)。
1.2.3 APP高表达AD细胞模型的建立将APP595/596、GFP以及辅助质粒pLP1、pLP2、pMDG按照一定的比例[12]转染293T细胞;收集不同时间点的病毒液混合后,超滤管16 785×g离心1 h浓缩病毒液;将浓缩病毒液混合,并加入1%聚凝胺,转染人神经母细胞瘤SH-SY5Y细胞;用荧光倒置显微镜观察绿色荧光,转染3 d后,分别用RT-PCR和蛋白质印迹法检测APP mRNA及蛋白的表达量[12]。单纯GFP转染的正常SH-SY5Y细胞为空白对照组。
1.2.4 MTT法检测细胞活性将终浓度分别为25、50、75、100 μmol·L-1的OST分别加入APP高表达的SH-SY5Y细胞中,并设APP高表达的SH-SY5Y细胞为模型组,GFP转染的正常SH-SY5Y细胞为空白对照组。每组3个复孔,每孔中加入100 μL培养基,培养过夜,加入MTT试剂,避光培养4 h;弃去培养液,加入DMSO溶液,摇床震摇10 min,最后在酶标仪570 nm处测量吸光度。
1.2.5 RT-PCR检测miRNA-9和BACE-1 mRNA表达将5 μL miRNA-9抑制剂加入到45 μL基础培养基中,同时将5 μL脂质体2000加入到45 μL基础培养基,室温放置5 min,将两种混合物融合20 min后,加入到APP高表达的SH-SY5Y细胞中,即为抑制剂组;在此基础上,再加入终浓度为50 μmol·L-1的OST,即OST+抑制剂组。按照方法“1.2.4”设立OST组(50 μmol·L-1)、模型对照组和空白对照组。各组细胞内加入TRIzol提取RNA,稀释后测定各组RNA纯度,将RNA逆转录成cDNA后,-80 ℃保存。进行PCR扩增,按照以下比例配制PCR扩增体系:DreamTag PCR Master Mix 25 μL,上、下游引物各1.5 μL,样本cDNA 2 μL,水20 μL。反应条件如下:95 ℃ 2 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30个循环,72 ℃ 10 min。Image J进行光密度扫描。引物序列见Tab 1,miRNA-9引物由广州市锐博生物科技有限公司设计并合成,引物序列因涉及保密,不予公开。
| Gene | Sequence(5′-3′) | Product/bp |
| APP | F:AAAACGAAGTTGAGCCTGTTGAT | 350 |
| R: GAACCTGGTCGAGTGGTCAGT | ||
| BACE-1 | F: TGCAGTCCTGATGCCCCCGA | 300 |
| R: CATGGTGAGCCCGGGCCTTG | ||
| β-actin | F: TGC TGT CCC TGT ATG CCT CT | 385 |
| R: TTT GAT GTC ACG CAC GAT TT |
按照“1.2.5”设立分组,提取各组细胞蛋白,测定蛋白质浓度。各组蛋白上样量均为50 μg,SDS-PAGE电泳,转至PDVF膜(100 V,1 h),脱脂奶粉TBST液封闭1 h,兔抗BACE-1 (1 :200) 4 ℃孵育过夜,TBST洗膜后,与HRP标记的二抗(1 :2 000)杂交,凝胶成像系统拍照保存,并用Image J定量测定信号强度。
1.2.7 统计学方法采用SPSS 13.0软件进行数据统计,GraphPad Prim 5.0软件绘制统计图。由箱线图判断数据是否符合正态分布。符合正态分布的计量数据以表示,多组之间的比较采用方差分析,两组间比较采用t检验。
2 结果 2.1 OST干预后差异表达miRNA筛选结果经过欧易生物进行各组小鼠脑组织样本芯片筛选,结果显示,模型组中上调的miRNAs有71个,下调的miRNAs 40个;而经过OST治疗后,与模型组性比,上调的miRNAs 25个,下调的miRNAs 53个,我们将差异倍数(fold change,FC)≥2作为筛选标准,其中miRNA-9差异倍数>2。热图结果显示(Fig 1),miRNA-9在3组之间表达差异明显,可见miRNA-9是OST调控较明显的miRNA。

|
Fig 1 MicroRNA differential expression demonstrated by clustering heat map
 High expression of miRNAs; High expression of miRNAs;  Low expression of miRNAs; Low expression of miRNAs;  The expression of miRNAs was between that in APP group and control group. The expression of miRNAs was between that in APP group and control group.
|
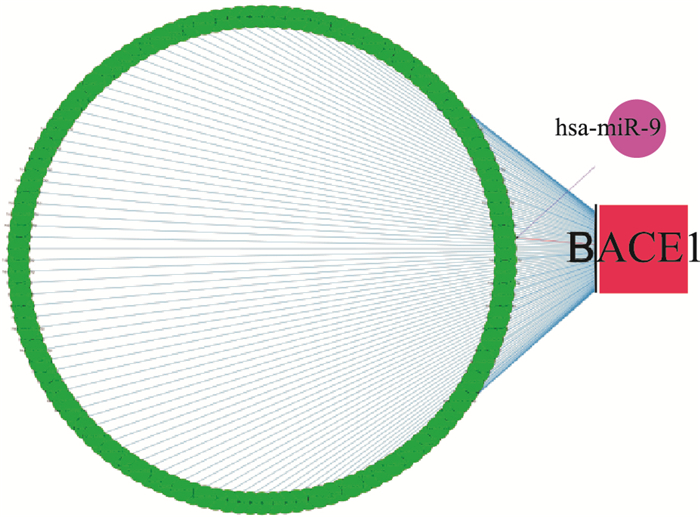
通过TargetScan、PicTar、DIANA三个数据库进行序列比对,发现miRNA-9可以与BACE-1靶向结合(Tab 2),后续利用Cytoscape验证与BACE-1结合的miRNA有miRNA-9、miRNA-15b、miRNA-195等(Fig 2)。证明miRNA-9与BACE-1的靶向调控作用。
| Position 3079-3086 of BACE-1 3’-UTR | Sequence |
| BACE-1 | 5′…AGAAGUACUUCAUUAACCAAAGA… |
| mmu-miR-9 | 3′…AGUAUGUCGAUCUAUUGGUUUCU… |
|
Fig 2 miRNA-9 binding to 3′-UTR of BACE-1 determined by bioinformatics
 BACE-1; BACE-1;  MicroRNA-9; MicroRNA-9;  Other microRNAs bind to the 3′-UTR of BACE-1 Other microRNAs bind to the 3′-UTR of BACE-1
|
GFP慢病毒与带有GFP标记的APP慢病毒感染SH-SY5Y神经细胞,成功感染GFP慢病毒与带有GFP标记的APP慢病毒的SH-SY5Y具有绿色荧光(Fig 3A)。培养3 d后,经RT-PCR和Western blot验证,感染APP慢病毒的神经细胞具有APP基因和蛋白的高表达(Fig 3B、3C), 并且APP组中APP基因的表达是空白组(GFP组)的3倍,APP组中APP蛋白的表达是空白组的2倍, 说明成功建立APP过表达的AD细胞模型。

|
| Fig 3 Establishment of AD cells with over expression of APP A:Green fluorescent picture of SH-SY5Y cells transfected with APP and GFP (scale bar=50μm); B:Expression of APP mRNA and protein in SH-SY5Y cells; C:The expression levels were semi-quantified by densitometric measurements (x±s, n=3). **P < 0.01 vs GFP group. |
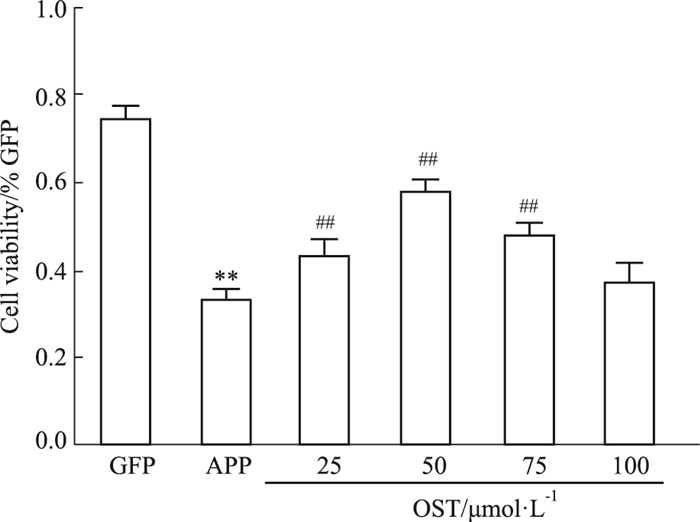
Fig 4的MTT结果显示,OST对APP过表达SH-SY5Y细胞具有一定的保护作用。OST在50 μmol·L-1时,细胞的活力最高,而在75 μmol·L-1之后细胞活力呈下降趋势。因此,后续细胞的给药浓度选择50 μmol·L-1。
|
| Fig 4 Effects of osthole on cell activity (x±s, n = 3) **P < 0.01 vs GFP group; ##P < 0.01 vs APP group |
将miRNA-9抑制剂转染到AD细胞模型中,以OST浓度50 μmol.L-1给药,建立抑制剂组、OST+抑制剂共处理组。RT-PCR结果显示(Fig 5),与空白组相比,APP组中miRNA-9的表达明显降低,给予OST治疗后miRNA-9的表达相对模型组有所提高。BACE-1 mRNA在各组中的表达与miRNA-9的表达呈现负相关关系,模型组中BACE-1表达明显增多,OST可以降低BACE-1的表达,抑制剂组BACE-1表达最多,OST与抑制剂共处理组BACE-1表达介于抑制剂组和OST组之间。

|
| Fig 5 Effects of osthole on expression of miR-9 and BACE-1 in cells (x±s, n = 3) **P < 0.01 vs GFP, ##P < 0.01 vs APP |
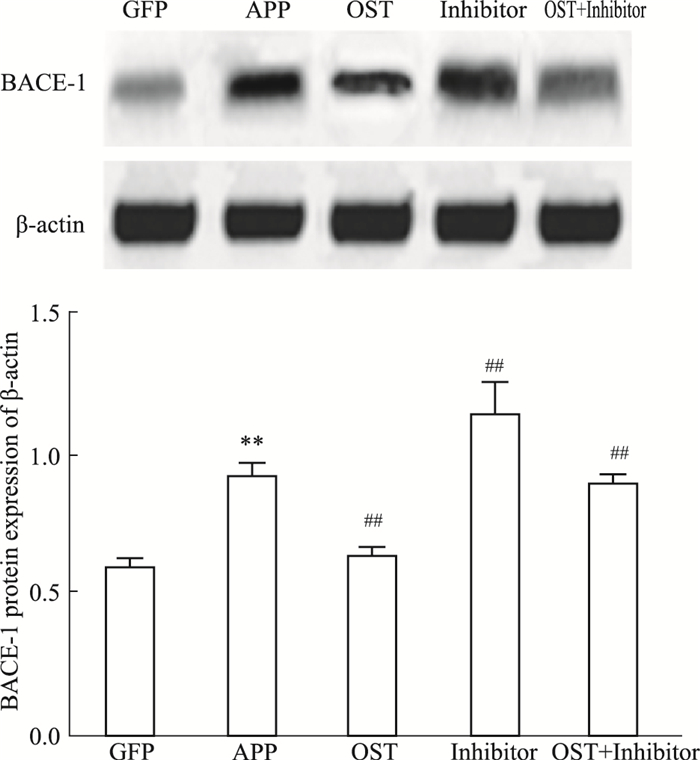
Fig 6的Western blot结果显示,与GFP组相比,APP组的BACE-1蛋白明显增多,给予OST治疗后,BACE-1蛋白表达相对APP组有所降低,而抑制剂组BACE-1蛋白表达最多,OST与抑制剂共处理组BACE-1蛋白表达介于OST组和抑制组之间。说明OST可以通过上调miRNA-9,抑制BACE-1蛋白的表达。
|
| Fig 6 Expression of BACE-1 with osthole treatment in cells (x±s, n = 10) **P < 0.01 vs GFP; ##P < 0.01 vs APP |
AD是一种常见的严重影响人们生活质量的疾病,其特征为脑内积聚老年斑及神经原纤维缠结[13],AD现已成为降低人类生活质量最严重的疾病之一。AD发生存在着多种假说,其中Aβ学说是当今的研究热点。正常人脑中Aβ的产生与降解会保持平衡,而BACE-1活性增强会加速对APP的裂解,从而大量生成Aβ,导致Aβ的沉积,产生神经毒性[14],激活一系列病理改变,进而诱导神经细胞的凋亡。因此,减少脑内APP裂解,即抑制BACE-1活性,就可以达到治疗AD的作用。
本实验室前期研究表明,OST作为一种天然香豆素类化学成分,可以通过miRNAs直接调控下游靶基因,并且可以促进神经发生,改善APP/PS1小鼠脑区内学习认知能力[15]。本研究通过基因芯片技术,筛选OST干预APP/PS1小鼠后差异表达的miRNA-9,并且通过生物信息学分析,验证miRNA-9可以调控靶基因BACE-1的表达,将miRNA-9抑制剂转入APP高表达的AD细胞模型,发现模型组与对照组相比,BACE1蛋白的表达明显增高。给药后,BACE1蛋白表达相对模型组明显降低,抑制剂组BACE1蛋白表达最高,OST与抑制剂共处理组BACE1蛋白表达在给药组与抑制剂组之间,差异皆有统计学意义。说明OST可以通过上调miRNA-9,抑制BACE-1表达,从而达到治疗AD的作用。独活抗AD的分子机制比较复杂,调控miRNA-9的内在机制以及对其他miRNA的调控作用仍是未知,后续要通过大量实验研究,为独活应用于临床治疗AD提供依据。
综上所述,OST能够靶向调节miRNA-9,抑制BACE-1表达,从而达到治疗AD的作用,本研究为治疗AD相关新药研发提供了重要的实验依据。
| [1] |
Mayeux R, Stern Y. Epidemiology of Alzheimer disease[J]. Cold Spring Harb Perspect Med, 2012, 2(8): 1-18. |
| [2] |
Aron L, Yankner B A. Neurodegenerative disorders: neural synchronization in Alzheimer's disease[J]. Nature, 2016, 540(7632): 207-8. |
| [3] |
Revett T J, Baker G B, Jhamandas J, et al. Glutamate system, amyloid peptides and tau protein: functional interrelationships and relevance to Alzheimer disease pathology[J]. J Psychiatry Neurosci, 2013, 38(1): 6-23. doi:10.1503/jpn |
| [4] |
Swomley A M, Förster S, Keeney J T, et al. Abeta, oxidative stress in Alzheimer disease: evidence based on proteomics studies[J]. Biochim Biophys Acta, 2014, 1842(8): 1248-57. doi:10.1016/j.bbadis.2013.09.015 |
| [5] |
刘爽, 吴东媛, 徐建华, 等. 蛇床子素的抗焦虑作用研究[J]. 中国医药导报, 2012, 9(29): 19-21. Liu S, Wu D Y, Xu J H, et al. Research of anti-anxiety effect of osthole[J]. China Med Herald, 2012, 9(29): 19-21. doi:10.3969/j.issn.1673-7210.2012.29.007 |
| [6] |
孔亮, 姚璎珈, 教亚男, 等. 蛇床子素对颅脑损伤模型小鼠的神经保护作用[J]. 中国药房, 2015, 26(22): 3046-9. Kong L, Yao Y J, Jiao Y N, et al. Neuroprotective effect of osthole on mice with brain injury model[J]. Chin Pharm, 2015, 26(22): 3046-9. doi:10.6039/j.issn.1001-0408.2015.22.07 |
| [7] |
孔亮, 姚璎珈, 教亚男, 等. 蛇床子素对机械性脑损伤小鼠的抗炎抗凋亡作用研究[J]. 中国药理学通报, 2015, 31(7): 999-1004. Kong L, Yao Y J, Jiao Y N, et al. Anti-inflammatory and anti-apoptotic effects of osthole on mice with mechanical brain injury[J]. Chin Pharmacol Bull, 2015, 31(7): 999-1004. doi:10.3969/j.issn.1001-1978.2015.07.022 |
| [8] |
Li S H, Gao P, Wang L T, et al. Osthole stimulated neural stem cells differentiation into neurons in an Alzheimer's disease cell model via upregulation of microRNA-9 and rescued the functional impairment of hippocampal neurons in APP/PS1 transgenic mice[J]. Front Neurosci, 2017, 11: 340. doi:10.3389/fnins.2017.00340 |
| [9] |
Li S, Yan Y, Jiao Y, et al. Neuroprotective effect of osthole on neuron synapses in an Alzheimer's disease cell model via upregulation of microRNA-9[J]. J Mol Neurosci, 2016, 60(1): 71-81. |
| [10] |
教亚男, 姚璎珈, 孔亮, 等. 蛇床子素对转染APP595/596基因的SH-SY5Y细胞的保护作用[J]. 中国病理生理杂志, 2015, 31(11): 2053-8. Jiao Y N, Yao Y J, Kong L, et al. Protective effect of osthole on SH-SY5Y cells transfected with APP595/596 gene[J]. Chin J Pathophysiol, 2015, 31(11): 2053-8. doi:10.3969/j.issn.1000-4718.2015.11.021 |
| [11] |
王雅萌, 教亚男, 闫宇辉, 等. 蛇床子素对APP/PS1双转基因AD小鼠的治疗作用[J]. 中国新药杂志, 2017, 26(21): 2573-7. Wang Y M, Jiao Y N, Yan Y H, et al. Therapeutic effect of osthole on APP/PS1 double transgenic AD mice[J]. Chin J New Drugs, 2017, 26(21): 2573-7. |
| [12] |
Tang G, Tang X, Mendu V, et al. The art of microRNA: various strategies leading to gene silencing via an ancient pathway[J]. Biochim Biophys Acta, 2008, 1779(11): 655-62. doi:10.1016/j.bbagrm.2008.06.006 |
| [13] |
McGeer P L, McGeer E G. NSAIDs and Alzheimer disease: epidemiological, animal model and clinical studies[J]. Neurobiol Aging, 2007, 28(5): 639-47. doi:10.1016/j.neurobiolaging.2006.03.013 |
| [14] |
Ling Y, Morgan K, Kalsheker N. Amyloid precursor protein (APP) and the biology of proteolytic processing: relevance to Alzheimer's disease[J]. Int J Biochem Cell Biol, 2003, 35(11): 1505-35. doi:10.1016/S1357-2725(03)00133-X |
| [15] |
Kowall N W, Beal M F, Busciglio J, et al. An in vivo model for the neurodegenerative effects of β-amyloid and protection by substance P[J]. Proc Natl Acad Sci USA, 1991, 88(16): 7247-51. doi:10.1073/pnas.88.16.7247 |

