

2. 天然药物活性物质 与功能国家重点实验室,中国医学科学院药物研究所,中国医学科学院神经科学中心,北京 100050
2. Institute of Materia Medica & Neuroscience Center, Chinese Academy of Medical Sciences, Beijing 100050, China
阿尔茨海默病(Alzheimer′s disease, AD)是一种神经系统退行性疾病,其特点是进行性认知能力下降,严重影响日常活动,进而导致过早死亡。AD为最常见的痴呆症,影响着全球数千万人,目前全世界有近4 700万AD患者,而这个数字正在急剧上升。随着世界人口老龄化的到来,AD的患病率逐年增大,预计到2050年,AD患者将达到1.315亿。AD的早期临床表现为短期记忆受损,逐渐演化成长期的记忆丧失,进而出现语言行为障碍,严重影响患者的生活质量,对其家庭和社会造成严重的心理和经济负担。
AD的病理表现包括神经细胞外β-淀粉样蛋白(β-amyloid protein,Aβ)沉积形成斑块,细胞内tau蛋白过度磷酸化形成神经纤维缠结(neurofibrillary tangle,NFT),反应性小胶质细胞活化和神经元丢失。对AD发病机制的研究主要有Aβ假说、tau蛋白异常磷酸化假说、神经元凋亡假说、自由基损伤假说、免疫异常假说、基因突变假说、胆碱能损伤假说、金属离子代谢紊乱、内分泌失调假说等理论[1]。但现有研究并未能说明AD真正的发病机制,且目前治疗AD的药物只能部分改善患者的临床症状,而不能延缓或阻断AD的病理进程。因此,寻找治疗AD的方法,探明其作用机制,找到其有效药物,仍为国内外学者的研究热点。本文主要对AD与免疫的相关机制,以及免疫治疗对AD的潜在作用进行综述,为临床研究AD的发病机制及寻找新的治疗途径提供参考。
1 免疫调控与AD的关系大量研究表明,AD的发生与免疫功能异常密切相关。已在AD的神经病变中发现抗原提呈、人类组织相容性抗原阳性、免疫调节细胞、补体成分、炎性细胞因子和急性期反应物等。AD患者与健康同龄老人相比,血清和脑脊液中T细胞、B细胞、细胞因子等出现明显差异。免疫治疗能在一定程度上抑制Aβ沉积,清除已形成的Aβ,改善AD动物模型的认知能力。这些证据说明,AD的病变与免疫调控之间有密切关系。
1.1 AD病程中的炎症进程在AD的病理中,由于Aβ特异性免疫反应机制受损,引起Aβ沉积,Aβ和细胞内NFT一起构成免疫原。这一系列免疫反应主要激活小胶质细胞,释放炎症介质,引发局部炎症反应。而局部炎症反应又可加剧Aβ沉积,形成恶性循环。
淀粉样蛋白前体蛋白(amyloid precursor protein, APP)水解产生的Aβ是老年斑的主要成分,造成AD发病和难以治愈的主要原因是Aβ清除机制发生障碍,并不是Aβ产生的数量增加。最近的研究表明,可溶性的Aβ刺激神经元致其功能障碍,并且可能参与原发性小胶质细胞的炎症效应。一方面,在炎症环境下,寡聚体Aβ制剂能在体外诱导小胶质细胞和星形胶质细胞释放促炎细胞因子;另一方面,由于小胶质细胞或星形胶质细胞倾向于促炎症状态,导致其对Aβ清除能力受损,进而引起Aβ积聚和持续的免疫激活,通过Aβ和促炎细胞因子之间的相互作用循环,引发自我增殖,从而加重AD[2]。星形胶质细胞上的水通道蛋白AQP4异常可影响脑部类淋巴系统,导致包括Aβ在内的脑内代谢物的清除异常。
AD的初始病变即伴随炎症反应,发展到一定程度则导致更多的神经元死亡,造成更多的病变,进而激发更严重的炎症反应,形成正反馈环路。故以Aβ为靶点开发抗AD的治疗药物失败的原因,很可能是忽略了AD后期慢性炎症刺激这一主要因素。
1.2 外周炎症对AD的影响外周骨髓来源的细胞渗入Aβ斑块聚集的部位,是增加细胞因子释放的最常见效应之一,而此效应主要由趋化性细胞因子和血脑屏障通透性增加所引起。浸润的单核细胞一旦到达炎症部位,它们将比常驻小胶质细胞更有效地吞噬Aβ斑块沉积物,因为它们能侵入斑块核心进行吞噬,从而减少Aβ,而脑内驻留的小胶质细胞由于细胞因子的影响使其吞噬功能失效。因此,Aβ产生的炎症反应及其潜在的机制可能为AD的治疗提供关键信息[3],例如增加脑中血液来源的单核细胞的数量。
2 免疫调控在AD中发挥的炎症效应 2.1 炎症介质对AD的影响越来越多的证据表明,神经炎症可以作为一个独立的因素在AD的发病早期产生影响,其中免疫相关基因和细胞因子是关键的参与者。它们由机体多种细胞分泌的小分子蛋白质,通过结合细胞表面的相应受体发挥生物学作用。目前研究较多的细胞因子有白细胞介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor, TNF)、干扰素(interferon, IFN)和转化生长因子(transforming growth factor, TGF)。细胞因子在AD的不同阶段发挥的作用和其治疗AD的可能性,已经引起了人们的极大关注。迄今为止,已经有13种细胞因子与AD有关,包括IL-1β、IL-6、IL-18、TNF-α等, 它们在AD患者中的表达水平较正常人差异均具有显著性。本综述主要列举以下几个重要的炎症介质并对其在AD发病过程中发挥的作用进行探讨(Fig 1)。

|
| Fig 1 Effects of inflammatory mediators on AD Pro-inflammatory cytokines(such as TNF-α) increase Aβ production by inhibiting microglia phagocytosis of Aβ, activating β-secretase and γ-secretase, thereby aggravating AD; inflammatory cytokines(such as IL-2) activate regulatory T cells and increase Aβ clearance, IL-10/STAT3 signaling pathway activation is accompanied by increased ApoE expression, and can accumulate with Aβ. This pathway is blocked and can enhance mononuclear phagocytosis, which slows down AD. |
IL-2由活化T细胞产生,可为神经元和神经胶质细胞提供营养,增强海马神经元树突发育,在神经元发育中起保护作用,其最早是在肿瘤病人的大脑中被发现。人工合成外源性IL-2临床用于治疗肿瘤和感染性疾病,但使用剂量较高,可诱发认知功能障碍和其他不良的神经精神副作用。研究表明,脑源性的IL-2在海马胆碱能神经元再生中起重要作用。在外周免疫系统中,IL-2负责免疫细胞的活化,其主要作用是激活调节T细胞(regulatory cells,Tregs)吞噬Aβ,控制炎症,从而保护神经,改善AD病程。Tregs被认为是免疫细胞以及单核细胞来源的巨噬细胞[4]。研究显示,IL-2能激活APP/PS1小鼠大脑中的Tregs,改善AD的症状[5]。在IL-2处理的APP /PS1小鼠的海马中,观察到IL-2的表达增加,但是在IL-2处理的对照组小鼠中没有观察到此现象,这可能是由于AD模型小鼠的血脑屏障通透性已经改变,导致外周产生的IL-2透过血脑屏障进入中枢神经系统(central nervous system, CNS)发挥作用,使Tregs募集到AD的脑部位,导致胶质细胞增生并吞噬Aβ,从而改善认知功能[4]。IL-2除了直接作用于脑的功能,还具有多效的免疫功能[6],Petitto等[7]提出,IL-2敲除小鼠学习和记忆障碍主要受到间接的免疫作用的影响。因此,IL-2具有双重特性,即改善记忆形成和控制炎症。已有文献报道,IL-2在AD中发挥治疗作用具有很强的理论基础:① IL-2敲除小鼠表现出学习和记忆障碍;②与健康老年和中年受试者相比,AD患者的血清中IL-2表达水平低;③低剂量的IL-2具有抗炎作用。IL-2对AD的改善作用还与星形胶质细胞活化有关[5],已有相关报道证明,Tregs和星形胶质细胞之间有密切相互作用,其中IL-2/STAT5信号通路的激活涉及星形胶质细胞介导的Tregs的激活[8]。
临床上,IL-2已被批准作为治疗转移性黑素瘤和肾细胞癌的药物,在这些适应症中,IL-2通过刺激效应T细胞起效,但其给药剂量过高(每天高达160 MIU/mL),所引起的副作用限制了其使用[6]。现已证明低剂量IL-2是安全的,并且能选择性激活Tregs而非效应T细胞,这为开发以IL-2为靶点的药物提供了新思路。IL-2正作为Tregs的兴奋剂,以1~3 MIU/mL日剂量被深入开发,在低剂量的情况下,IL-2在患有自身免疫疾病的人体中具有良好的耐受性,因此,在AD患者中使用低剂量IL-2进行长期治疗有望取得很好的疗效。
2.1.2 TNF-αTNF-α因其有在体外杀死肿瘤细胞和导致动物肿瘤出血性坏死的能力而命名。细菌或病毒感染、急性脑损伤或中风梗死、慢性神经退行性疾病等都有可能诱导TNF-α的产生和释放。近年来,TNF-α已成为各领域研究最广泛的细胞因子之一,也是目前应用最广泛的药物分子靶点之一。TNF-α参与AD病程的最早证据之一, 是在AD患者死后,其脑部Aβ斑块周围发现TNF-α的存在[9]。研究表明,健康成年人外周和中枢神经系统的TNF-α含量维持在非常低的水平,而在AD患者中明显升高,也有许多临床和动物研究已经证明脑中TNF-α的表达和AD之间的联系[9]。TNF-α是一种具有双刃剑作用的分子,对抗癌具有有益作用,但在AD等脑部疾病中具有破坏性作用。TNF-α主要由免疫细胞释放,如单核细胞和巨噬细胞,作为炎症和免疫过程中的关键细胞因子在机体的各个部位起作用。在外周免疫系统中,TNF-α由激活的巨噬细胞和单核细胞释放;在大脑中,TNF-α由神经元和神经胶质细胞表达,并通过召集小胶质细胞或星形胶质细胞到损伤部位而促进炎症反应,导致胶质细胞活化,从而加剧AD病程。AD病人脑中Aβ斑块周围的TNF-α表达水平升高,这被认为与皮层的神经元内的Aβ免疫反应相关,且已有动物实验证明这些升高的TNF-α表达与AD小鼠中的认知缺陷相关。
在AD转基因小鼠中,TNF-α一方面通过上调β-分泌酶和γ-分泌酶活性,增加Aβ的产生,导致神经元死亡;另一方面,脑中过量的TNF-α抑制小胶质细胞对Aβ的清除,引起突触功能障碍,导致认知能力下降,从而促进AD的发展进程。这些证据提示TNF-α有望成为AD的治疗靶点,抗TNF-α药物可能是AD的靶向治疗药物。
2.1.3 IL-10IL-10是一种典型的抗炎细胞因子,由T细胞、树突状细胞、外周巨噬细胞和CNS驻留小胶质细胞产生并调节其活化。早期研究表明,IL-10的表达下调是AD发病的危险因素之一,而近期综合基因组研究显示,IL-10对AD大脑的影响产生相反的结论[10]。已有文献报道,AD患者血清和大脑中的IL-10信号通路异常升高,IL-10过表达可以降低突触蛋白质丰度,并加重认知障碍[11],而IL-10缺失可以减轻AD样行为缺陷,IL-10的过量产生导致先天免疫Aβ吞噬作用缺陷,致使斑块积聚,抑制IL-10/STAT3途径可以使先天免疫系统达到正常的平衡状态,清除脑内的Aβ,从而减轻AD样病理症状[11]。另有研究报道,IL-10与载脂蛋白E(apolipoprotein E,ApoE)之间存在交叉作用。人类ApoE亚型差异调节Aβ代谢、聚集、沉积、清除以及脑血管痉挛。将人ApoE4敲入大脑淀粉样变性小鼠模型,会加剧炎症的产生和Aβ沉积,而ApoE2则可以抑制此情况。脑IL-10过表达增加小鼠ApoE与不溶性淀粉样蛋白的聚集,并促进ApoE-Aβ相互作用,抑制复合物的吞噬作用,ApoE-Aβ复合物可以降低小胶质细胞对Aβ的清除能力[12]。临床研究表明,单纯通过抑制免疫途径来达到抗AD的目的是不可取的,越来越多文献强调免疫系统再平衡在AD治疗过程中的重要性。正如IL-10,其在正常情况下发挥的是抗炎作用,而其在AD中,一方面损伤先天免疫系统导致其失去对Aβ的吞噬作用,另一方面通过促进ApoE-Aβ共沉积,加剧AD。这些研究提示我们,IL-10可以调节ApoE-Aβ相互作用,对治疗AD具有重要意义,需要在AD背景下更深入地了解IL-10和ApoE之间的交叉作用。且IL-10/STAT3途径的基因阻断有望重新平衡大脑的先天免疫系统,成为安全有效的AD治疗策略。
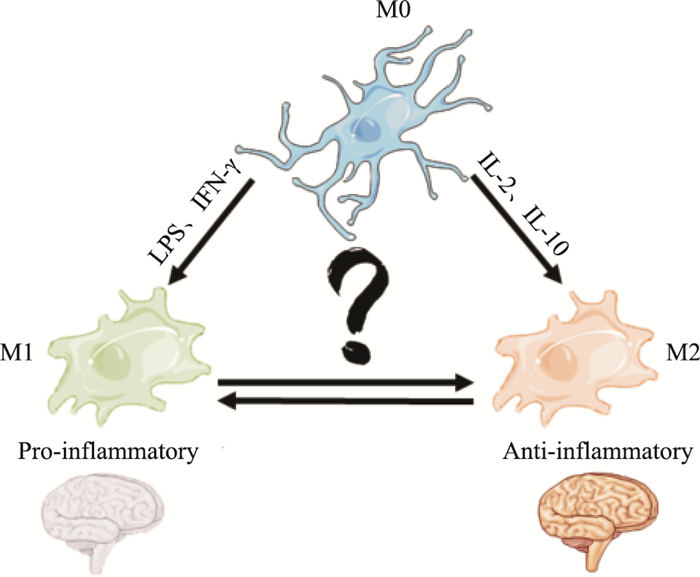
2.2 小胶质细胞不同表型对AD的影响小胶质细胞是脑内常驻免疫细胞,相当于脑和脊髓中的巨噬细胞,是大脑的第一道防线。作为中枢神经系统的免疫细胞,小胶质细胞在AD的发生、发展过程中作用具有两面性,既可以通过吞噬组织中病原体及有害物质对神经元起保护作用,又可以在致炎因子的作用下分泌炎性细胞因子对神经元起毒性作用。大多数的研究认为,小胶质细胞激活后具有两种表型变化,M1型极化和M2型极化。M1型极化:在脂多糖(lipopolysaccharide,LPS)或干扰素-γ(interferon-γ, IFN-γ)诱导下,激活产生高水平的促炎因子和氧化代谢产物,促进炎性反应。而Aβ能刺激小神经胶质细胞分泌促炎细胞分子,如TNF-α、IFN-γ,从而提高γ分泌酶的活性,进一步增加Aβ的产生。M2型极化:能诱导表达多种抗炎性因子,如IL-2、IL-4或IL-10,从而修复损伤细胞。但近年来,对于M1/M2型极化,出现了许多质疑的声音,有文献报道这种说法是过时的[12],单核吞噬细胞激活状态既不是绝对的M1型也不是M2型,相反,独特的激活表型落在M1和M2极化之间的连续体内,小胶质细胞可以假设成连续的激活状态,因其M1和M2型标记的表达是交叉进行的,这个概念通过RNA-Seq和NanoString分析IL-10依赖性炎症基因得到证实[13],且研究发现,在敲除IL-10的APP/PS1小鼠中,小胶质细胞吞噬能力增强,但其活化是远离传统的M2极化状态的[12]。在大脑淀粉样变性的转基因小鼠模型中,通过IL-10过表达或IL-10缺陷改变的基因进一步研究其免疫相关功能,发现基因通路在这两种相反的操作之间大部分重叠,且其中小胶质细胞独特的激活表型处于M1和M2极端之间,再次证明用M1/M2型极化来说明小胶质细胞在AD中的作用是不可取的,单纯的免疫抑制或免疫激活都不能在AD的病程中取得有益的效果,将AD病人大脑内被破坏的免疫系统重新平衡才是正确的研究方向(Fig 2)。小胶质细胞作为大脑的第一道防线,其在免疫调控进程中发挥的作用不可用简单的M1/M2二分法来分类,其在疾病不同阶段的确切作用和机制还需深入探究。
|
| Fig 2 Effects of different phenotypes of microglia on AD Polarization of microglia induced by LPS, IFN-γ, etc. polarizes to M1, produces pro-inflammatory cytokines, increases Aβ production, and aggravates AD. IL-2, IL-10, etc. induce microglia polarization to M2, produce anti-inflammatory cytokines, enhance phagocytosis, and slow down AD. |
尽管免疫调控参与AD的发病已经得到充分的确证,但其具体的作用机制尚未阐明。据报道,炎症反应参与AD病理与以下几个途径有关(Tab 1)。
| Signaling pathway | General effect | Effect on AD | Target |
| Notch | Cell differentiation and growth | Upregulating AD through hydrolysis of APP[23] | APP |
| IL-10/STAT3 | Ubiquitin-mediated degradation | Down-regulating AD by blocking this signaling pathway[12] | Immune system |
| NF-κB | Gene regulation and involvement in inflammation | Upregulating ADby promoting BACE1 gene expression and hydrolyzing APP[24] | Aβ |
| PI3K/AKT | Response to external stimuli | Down-regulating AD by protecting neurons[25] and associated with Aβ[15] | Aβ |
| Wnt | Participating in brain development | Down-regulating AD by improving learning memory and synaptic transmission[17] | Tau |
| MAPK | Anti-inflammation | Down-regulating AD through inhibition of Tau phosphorylation in JNK phosphorylation[16] | Tau |
Notch信号通路是在进化中高度保守的信号通路,其在生物进化早期、神经系统的起源和发育中都发挥着至关重要的作用[14],并且与AD的发病密切相关。Notch信号转导通路由Notch受体、Notch配体和DNA结合蛋白3部分组成,哺乳动物中有4个同源Notch受体是Notch1~4,所有的同源Notch受体都属于Ι型跨膜蛋白,由胞内区、跨膜区和胞外区组成。
γ-分泌酶的水解切割作用能活化Notch受体,进而释放胞内活化片段Notch1,激活下游效应,此外,γ-分泌酶能水解APP,产生Aβ。有研究证实,机体老化过程中γ分泌酶水解活化Notch受体的能力减弱,水解APP的活性增高,这可能是引起AD发生的主要原因。Numb为Notch信号通路的抑制因子,Numb表达异常,会引起类似AD的神经退行性病变。提示Notch信号通路异常与AD的发病密切相关,Notch通路抑制剂可能成为AD的治疗靶点。
2.3.2 IL-10/STAT3信号通路在经典的IL-10信号通路中,IL-10与其同源受体(IL-10R)结合后,引发Janus激酶1(Janus kinase 1,JAK1)的磷酸化,而JAK1又使STAT3磷酸化。STAT3同源二聚化并转位至细胞核,使核中的反式激活基因细胞因子信号传导抑制因子3(suppressor of cytokine signaling 3,SOCS3)被激活,然后SOCS3被Src家族激酶磷酸化,并与炎性细胞因子受体相互作用,靶向用于泛素化降解。IL-10是单核细胞基本功能的执行者,通过阻断促炎细胞因子的作用来抑制过度旺盛的炎症反应,其能辅助单核细胞吞噬作用、产生细胞因子、表达共刺激分子和抗原呈递[12]。已有研究发现,所有经典IL-10通路信号元件[即IL-10R1和下游JAK1、磷酸化JAK1(p-JAK1)、STAT3、磷酸化STAT3、SOCS3]在AD患者的海马区域都有过度积累的现象[11]。提示在AD患者体内,调节IL-10/STAT3信号通路来重新平衡大脑内天然免疫以促进有益的神经炎症,可能比传统的抗炎疗法更有效。
2.3.3 其他信号通路核因子κB(nuclear factor κB,NF-κB)信号通路在基因调控中起重要作用,并与炎症、氧化应激和细胞凋亡有关。研究发现,AD患者大脑中淀粉样前体蛋白β位点裂解酶1(β-site APP cleaving enzyme,BACE1)和NF-κB p65水平均明显增加,此外,非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)可阻断炎症诱导的BACE1转录和Aβ产生,提示抑制NF-κB介导的BACE1表达可能是治疗AD的药物靶标。
PI3K/Akt信号通路可以调节大多数细胞的行为,响应于外部刺激,如基因表达、代谢、细胞分裂、分化和存活。但这个重要的信号转导途径PI3K/Akt/糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)和PI3K/Akt/mTOR在AD患者中似乎没有引起广泛的关注,但已有证据表明,可溶性Aβ能够抑制PI3K/Akt信号通路[15]。
经典Wnt信号转导通路(Wnt/β-连接素)是已知的参与脑中神经发育早期和血脑屏障发育、成熟的信号通路。Wnt/β-连接素通路是调节突触可塑性和乙酰胆碱受体发育的重要途径。已有研究表明,该途径可能与AD的病程有关。Aβ能够促进GSK3的激活,进而促进Tau蛋白磷酸化,降低Wnt的活性。还有研究表明,WASP-1(Wnt激活小蛋白)能够明显改善学习记忆和突触传递障碍[16, 17]。
有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)途径由3个信号级联组成:JNK、p38和ERK。Orejana等[16]在患AD的快速老化小鼠中发现,JNK级联明显高于正常小鼠,而蛋白磷酸酶2A(protein phosphatase 2, PP2A)没有明显变化,该研究还表明,JNK可能通过氧化应激参与Tau蛋白调节。抑制JNK磷酸化能够降低Tau蛋白磷酸化的水平,提示JNK级联可能是一个治疗AD的潜在靶点[16]。临床研究发现,JNK在AD患者的海马和皮质的Tau磷酸化区域表达异常升高。然而,信号通路之间的串扰使得AD的机制更难以解释,在未来的研究中需要大量的研究来证明和阐述其中复杂的联系。
3 抗炎药是否有抗AD效应近年来,科研工作者们从不同角度、多个靶点,研究开发防治AD的药物,并已相继有针对AD的药物面世,但都止步于Ⅲ期临床试验。炎症作为伴随AD病程进展的重要因素,被广泛认为是AD的病因之一。基于此理论,抗炎药有着潜在的抗AD作用。
3.1 TNF-α抑制剂TNF-α抑制剂在临床上用于治疗类风湿性关节炎、强直性脊柱炎、牛皮癣性关节炎、克罗恩氏病等已近20年,而近年来,有研究提出抗TNF-α药物有望预防或治疗AD。注射用英夫利西单抗是包含人和鼠可变区的嵌合二价免疫球蛋白单克隆抗体,它通过结合TNF-α的单体和三聚体来抑制TNF-α的生物学活性。注射用依那西普是一种150 ku的重组二聚体融合蛋白,包含两个与人IgG1Fc片段连接的人p75TNF-α受体的细胞外配体结合部分,可以结合TNF-α。据报道,在对轻度至重度AD患者进行的6个月开放标记试点研究中,沿椎管内给予依那西普可以通过抑制TNF-α持续改善AD。吡咯烷二硫代氨基甲酸酯能阻止NF-κB与DNA结合,抑制TNF-α转录。可见,虽然这些抗TNF-α制剂在AD中的治疗作用尚缺乏深入的研究,但已有证据表明其有潜在的抗AD效果。
3.2 四环素类抗生素米诺环素是一种具有抗炎特性的四环素类化合物,可以抑制基质金属蛋白酶,增加一氧化氮合酶(nitric oxide synthases, NOS)和环氧合酶2(cyclooxygenase 2, COX-2)的活性,并减少细胞因子如TNF-α和IL-1β的释放。米诺环素已被发现对包括局部脑缺血、亨廷顿舞蹈病、肌萎缩侧索硬化症和AD在内的多种中枢神经系统疾病有作用。其可下调小胶质细胞的活性,减弱T细胞的活性,从而减少T细胞-小胶质细胞相互作用中的细胞因子产生。在体外,米诺环素可通过抑制N-甲基-D-天冬氨酸诱导的小胶质细胞激活,从而减轻谷氨酸对神经元产生的兴奋性毒性。在体内,米诺环素通过抑制小胶质细胞活化,在各种CNS疾病模型中起神经保护作用。米诺环素作用于小胶质细胞的同时,也能作用于其他免疫细胞亚群,这足以说明其在包括AD在内的多种CNS病症中均具有重要作用。另一个重要的发现是米诺环素在AD的早期阶段,可以促进Aβ清除,防止斑块聚集,这与米诺环素在AD早期可以直接增强小胶质细胞的吞噬作用有关[18],近期研究进一步支持了这一假设,米诺环素在AD转基因小鼠发病早期起预防作用。此外,米诺环素能够在不影响单核细胞和小胶质细胞对Aβ吞噬作用的情况下,下调其产生的促炎细胞因子。
目前,米诺环素对AD早期的疗效已在AD小鼠体内进行验证,但仍需进一步的临床试验证实米诺环素对AD的作用。综上所述,米诺环素作为一种有效的神经保护剂,能通过抑制小胶质细胞的促炎表型,同时增强其清除Aβ沉积物的能力,发挥治疗AD的作用。
3.3 中药活性成分许多中药活性成分已被证实具有抗炎、抗氧化作用。人参皂苷Rg1是人参的主要有效单体,已被证明有抗氧化、抗衰老、改善认知等作用。有研究提出,Rg1能通过增强海马体中的抗氧化和抗炎能力,改善学习记忆能力,同时,Rg1可以明显降低衰老模型大鼠脑中IL-1β、IL-6和TNF-α的表达,进而减弱星形胶质细胞的活化,提示这可能是Rg1促智和抗衰老的作用的基础。天麻根茎中的活性成分天麻素能够缓解神经衰弱、失眠和头痛,有息风止痉、祛风通络的作用。研究发现,天麻素可以减少AD转基因小鼠脑中的Aβ沉积和小胶质细胞活化,从而改善AD模型学习记忆障碍和减轻其脑中的炎症反应,这表明天麻素通过抗炎和抗Aβ发挥神经保护作用,是治疗AD的潜在药物。姜黄素为姜黄根茎提取成分,具有抗癌、抗氧化和抗炎特性。近期研究表明,姜黄素还具有神经保护和认知增强特性,可能有助于延缓或预防AD等神经退行性疾病[19]。姜黄素可能通过下调Notch信号通路,发挥抗AD作用[20],但目前姜黄素治疗AD还缺乏临床报道,其作用有待进一步研究。黄芩的主要成分黄芩苷,能通过减弱小胶质细胞和星形胶质细胞的活性,降低TNF-α、IL-6的表达,明显改善学习记忆,从而减缓AD[21]。广泛存在于掌叶大黄、山茱萸等植物中的没食子酸,可以通过激活MAPK和PI3K/Akt通路,发挥抗衰老作用,从而缓解AD[22]。综上,在中药活性成分中挖掘AD的治疗药物具有广阔的前景,目前,已有众多研究从中药的抗炎作用入手,为探索AD的免疫治疗新方法提供了新的思路与方向。
4 结语从目前的研究看来,AD的发病机制仍十分复杂,人们对它的了解依旧非常有限。笔者主要从免疫调控的角度,综述其与AD的相关性,探讨免疫调控对改善AD病理学的相关炎症效应及作用机制,从脑内炎性细胞及其释放的炎症介质角度阐述免疫对AD的双向作用。大量的文献报道及研究结果证明,炎症与AD密切相关,免疫调控在AD中确实发挥着不可替代的重要作用,然而仍有一系列问题亟待解决,如造成脑内的小胶质细胞介导的吞噬作用与外周浸润的单核巨噬细胞产生的效应差异的具体机制如何。越来越多研究表明,单纯的免疫抑制不能在AD的病程中取得有益的效果,将AD病人大脑内被破坏的免疫系统重新平衡,才是正确的研究方向。随着人口老龄化的到来,AD患者的增加已成不可逆转的事实,进一步探索AD的作用机制及找到有效治疗药物刻不容缓。科研工作者在未来可对AD神经炎症进一步研究,以期找到治疗AD的有效途径以及策略。
| [1] |
罗飘, 楚世峰, 朱天碧, 等. 趋化因子参与阿尔茨海默病的研究进展[J]. 中国药理学通报, 2017, 33(8): 1051-5. Luo P, Chu S F, Zhu T B, et al. Progress on chemokines participating in Alzheimer′s disease[J]. Chin Pharmacol Bull, 2017, 33(8): 1051-5. doi:10.3969/j.issn.1001-1978.2017.08.004 |
| [2] |
Song C, Zhang Y, Dong Y L. Acute and subacute IL-1β administrations differentially modulate neuroimmune and neurotrophic systems: possible implications for neuroprotection and neurodegeneration[J]. J Neuroinflammation, 2013, 10(1): 59. |
| [3] |
Chen G F, Xu T H, Yan Y, et al. Amyloid beta: structure, biology and structure-based therapeutic development[J]. Acta Pharmacol Sin, 2017, 38(9): 1205-35. |
| [4] |
Baruch K, Rosenzweig N, Kertser A, et al. Breaking immune tolerance by targeting Foxp3(+) regulatory T cells mitigates Alzheimer′s disease pathology[J]. Nat Commun, 2015, 6(1): 7967. doi:10.1038/ncomms8967 |
| [5] |
Alves S, Churlaud G, Audrain M, et al. Interleukin-2 improves amyloid pathology, synaptic failure and memory in Alzheimer′s disease mice[J]. Brain, 2017, 140(3): 826-42. |
| [6] |
Klatzmann D, Abbas A K. The promise of low-dose interleukin-2 therapy for autoimmune and inflammatory diseases[J]. Nat Rev Immunol, 2015, 15(5): 283-94. |
| [7] |
Petitto J M, Cushman J D, Huang Z. Effects of brain-derived IL-2 deficiency and the development of autoimmunity on spatial learning and fear conditioning[J]. J Neurol Disord, 2015, 3(1): 196. |
| [8] |
Xie L, Choudhury G R, Winters A, et al. Cerebral regulatory T cells restrain microglia/macrophage-mediated inflammatory responses via IL-10[J]. Eur J Immunol, 2015, 45(1): 180-91. |
| [9] |
Chang R, Yee K L, Sumbria R K. Tumor necrosis factor α inhibition for Alzheimer′s disease[J]. J Cent Nerv Syst Dis, 2017, 9: 1179573517709278. |
| [10] |
Li X, Long J, He T, et al. Integrated genomic approaches identify major pathways and upstream regulators in late onset Alzheimer′s disease[J]. Sci Rep, 2015, 5(5): 12393. |
| [11] |
Guillot-Sestier M V, Doty K R, Gate D, et al. IL-10 deficiency rebalances innate immunity to mitigate Alzheimer-like pathology[J]. Neuron, 2015, 85(3): 534-48. |
| [12] |
Guillot-Sestier M V, Doty K R, Town T. Innate immunity fights Alzheimer′s disease[J]. Trends Neurosci, 2015, 38(11): 674-81. doi:10.1016/j.tins.2015.08.008 |
| [13] |
Chakrabarty P, Li A, Ceballos-Diaz C, et al. IL-10 alters immunoproteostasis in APP mice, increasing plaque burden and worsening cognitive behavior[J]. Neuron, 2015, 85(3): 519-33. |
| [14] |
Gazave E, LemaÎtre Q I, Balavoine G. The Notch pathway in the annelid Platynereis: insights into chaetogenesis and neurogenesis processes[J]. Open Biol, 2017, 7(2): 160242. |
| [15] |
Tang M, Shi S, Guo Y, et al. GSK-3/CREB pathway involved in the gx-50′s effect on Alzheimer′s disease[J]. Neuropharmacology, 2014, 81: 256-66. doi:10.1016/j.neuropharm.2014.02.008 |
| [16] |
Orejana L, Barros-Miñones L, Aguirre N, et al. Implication of JNK pathway on tau pathology and cognitive decline in a senescence-accelerated mouse model[J]. Exp Gerontol, 2013, 48(6): 565-71. |
| [17] |
Vargas J Y, Fuenzalida M, Inestrosa N C. In vivo activation of Wnt signaling pathway enhances cognitive function of adult mice and reverses cognitive deficits in an Alzheimer′s disease model[J]. J Neurosci, 2014, 34(6): 2191-202. |
| [18] |
El-Shimy I A, Heikal O A, Hamdi N. Minocycline attenuates Aβ oligomers-induced pro-inflammatory phenotype in primary microglia while enhancing Aβ fibrils phagocytosis[J]. Neurosci Lett, 2015, 609: 36-41. |
| [19] |
Goozee K G, Shah T M, Sohrabi H R, et al. Examining the potential clinical value of curcumin in the prevention and diagnosis of Alzheimer′s disease[J]. Br J Nutr, 2016, 115(3): 449-65. doi:10.1017/S0007114515004687 |
| [20] |
Yoneyama T, Arai M A, Akamine R, et al. Notch inhibitors from Calotropis gigantea that induce neuronal differentiation of neural stem cells[J]. J Nat Prod, 2017, 80(9): 2453-61. doi:10.1021/acs.jnatprod.7b00282 |
| [21] |
Chen C, Li X, Gao P, et al. Baicalin attenuates Alzheimer-like pathological changes and memory deficits induced by amyloid β1-42 protein[J]. Metab Brain Dis, 2015, 30(2): 537-44. |
| [22] |
Shen C Y, Jiang J G, Yang L, et al. Anti-aging active ingredients from herbs and nutraceuticals used in TCM: pharmacological mechanisms and implications for drug discovery[J]. Br J Pharmacol, 2017, 174(11): 1395-425. doi:10.1111/bph.v174.11 |
| [23] |
Kyriazis G A, Belal C, Madan M, et al. Stress-induced switch in numb isoforms enhances Notch-dependent expression of subtype-specific transient receptor potential channel[J]. J Biol Chem, 2010, 285(9): 6811-25. |
| [24] |
Chen C H, Zhou W, Liu S, et al. Increased NF-κB signalling up-regulates BACE1 expression and its therapeutic potential in Alzheimer′s disease[J]. Int J Neuropsychopharmacol, 2012, 15(1): 77-90. |
| [25] |
Yu H J, Koh S H. The role of PI3K/AKT pathway and its therapeutic possibility in Alzheimer′s disease[J]. Eur J Pharmacol, 2011, 672(1-3): 45-55. |

