


2. 广西医科大学药学院,广西 南宁 530021;
3. 广西医科大学第一附属医院结直肠肛门外科,广西 南宁 530021;
4. 广西生物医药协同创新中心,广西 南宁 530021
 ,
WEI Li-qun1,
LI Qing2,
PAN Xiao-hang3,
HUANG Dao-hang1,
GAN Jia-liang3,
HUANG Jun-li4,
TANG Shuang-yi1
,
WEI Li-qun1,
LI Qing2,
PAN Xiao-hang3,
HUANG Dao-hang1,
GAN Jia-liang3,
HUANG Jun-li4,
TANG Shuang-yi1

2. Dept of Pharmacy, Guangxi Medical University; Nanning 530021, China;
3. Dept of Colorectal Anal Surgery, the First Affiliated Hospital of Guangxi Medical University; Nanning 530021, China;
4. Guangxi Biomedical Collaborative Innovation Center; Nanning 530021, China
美国癌症协会最新统计结果显示,2018年美国将有173万癌症病例和60多万癌症死亡病例,其中将有26 240个新增胃癌病例和10 800个胃癌死亡病例[1]。因此,胃癌是一个世界性公共卫生问题,手术和化疗是胃癌的主要治疗手段[2],在降低死亡率方面一直有效,但胃癌患者的5年生存率仍然相对较低[3]。因此,找到一种新的方法来治疗胃癌至关重要。当今各种新型的天然化合物,如足叶草毒素、紫杉醇、喜树碱和长春碱,已经被分离出来,并作为癌症治疗的有效药物,但其副作用较大[4]。迷迭香酸(rosmarinic acid,RA)是一种天然的苯酚羧酸,它是一种次生代谢物,通常被用作烹饪草药,常见于草本植物中,如迷迭香、鼠尾草、百里香和薄荷[5]。RA具有多种药理作用,包括抗癌、抗微生物、抗过敏、抗炎、抗氧化等[6]。基于RA的药理作用十分广泛,本课题组前期合成了十几种迷迭香酸类似物(rosmarinic acid analogue,RAA)[7]。通过筛选,我们发现迷迭香酸类似物-11(rosmarinic acid analogue-11,RAA-11)的细胞抗癌作用较为突出,其分子质量为377.34,化学结构式见Fig 1。本课题拟用RAA-11作用于人胃癌MGC-803细胞,了解其对细胞增殖及凋亡的影响,并探讨其可能机制,为进一步开发RAA提供理论依据。
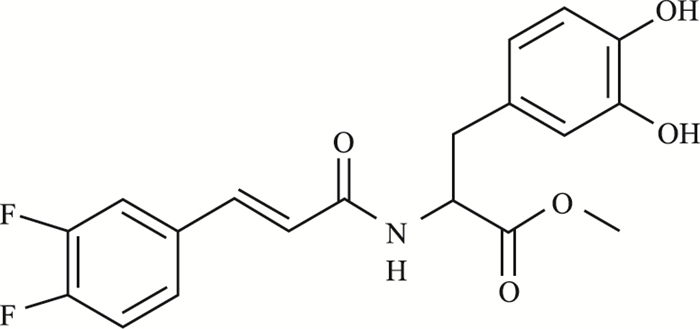
|
| Fig 1 Chemical structure of RAA-11 |
RAA-11由广西医科大学药学院李清老师合成鉴定,纯度≥98%(RAA-11溶于DMSO制成50 mmol·L-1储备液,-20 ℃避光保存,实验时用含血清RPMI 1640培养基稀释成高、中、低终浓度分别为40、20、10 μmol·L-1)。RPMI 1640培养基购自美国Gibco公司;Hoechst 33258染色液(即用型)购自北京索莱宝科技有限公司;南美胎牛血清购自依科赛生物科技(太仓)有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国BD公司;BCA蛋白浓度测定试剂盒(增强型)、SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术有限公司;ERK、p-ERK、GAPDH、Bax、Bcl-2、caspase-3兔抗人单克隆抗体,购自美国CST公司。
1.2 仪器全自动酶标仪(美国伯腾仪器有限公司);BX53荧光显微镜(日本奥林巴斯股份有限公司);流式细胞仪(美国BD公司);电泳仪、半干转印槽(美国Bio-Rad公司);LI-COR Odyssey红外荧光扫描成像系统(美国LI-COR公司)。
2 方法 2.1 细胞培养人胃癌细胞株MGC-803购自中国科学院上海细胞库(由广西医科大学第一附属医院胃肠外科肖强课题组赠予),于含5% CO2的37 ℃恒温培养箱中,用含10%胎牛血清和1%青链霉素的RPMI 1640培养基常规培养,隔天更换培养基,长满后,用0.25%胰酶消化传代、冻存。
2.2 MTT法常规培养人胃癌MGC-803细胞,待处于对数生长期时进行消化,接种于96孔板,每孔100 μL,约5 000个/孔。贴壁后弃培养液,加入200 μL用RPMI 1640培养液稀释的终浓度分别为0、10、20、40、80、160 μmol·L-1的RAA-11,每个剂量组设5个复孔。分别培养24、36、48 h后,加入20 μL MTT,置37 ℃恒温箱孵育4 h后,每孔加100 μL DMSO剧烈震荡10 min,酶标仪上490 nm波长处测定各孔的吸光度值(OD),细胞存活率=OD加药组/OD对照组×100%。
2.3 集落形成法取对数生长期的人胃癌MGC-803细胞进行消化,用完全培养基将细胞密度调整为1×106·L-1,充分吹打成单细胞悬液后置于6孔板中,每孔500 μL。贴壁后,每孔分别加入2 mL用RPMI 1640培养液稀释的终浓度为0、10、20、40 μmol·L-1的RAA-11,作用48 h后吸弃含药培养基,隔天更换完全培养基,让其生长2周(肉眼可见集落为准),结束培养。PBS洗2次,室温晾干后,用多聚甲醛固定15 min。弃多聚甲醛晾干,0.1%结晶紫染色20 min后,在倒置显微镜下拍照,集落抑制率=(集落数对照组-集落数加药组)/集落数对照组×100%。
2.4 Hoechst 33258染色法取对数生长期的人胃癌MGC-803细胞进行消化,用完全培养基将细胞密度调整为2×107·L-1,接种到内嵌有无菌处理的盖玻片6孔板中,每孔2 mL。贴壁后,每孔分别加入2 mL用RPMI 1640培养液稀释的终浓度为0、10、20、40 μmol·L-1的RAA-11。作用48 h后,每孔加入1 mL 4%多聚甲醛,室温固定20 min,每孔用0.5 mL Hoechst 33258室温避光染色15 min,弃染色液,用PBS轻轻漂洗2遍。小心轻取盖玻片,放在干净载玻片上,加1滴抗荧光淬灭封片液(甘油:PBS=1:9)封片,于显微镜观察。
2.5 流式细胞术取对数生长期的人胃癌MGC-803细胞进行消化,用完全培养基将细胞密度调整为1.5×108·L-1,接种到6孔板,每孔2 mL。贴壁后,每孔分别加入2 mL用RPMI 1640培养液稀释的终浓度为0、10、20、40 μmol·L-1的RAA-11。作用48 h后收集细胞上清液,用胰酶消化贴壁细胞,将上清液和消化下的细胞1 000×g离心5 min。弃上清,加1 mL冰PBS重悬,1 000×g离心5 min,重复2次。弃PBS,加200 μL 1×Binding Buffer重悬后,加入5 μL PI和5 μL Annexin V,室温避光孵育15 min,再加入300 μL 1×Binding Buffer,300目滤网过滤1次,于1 h内上机。
2.6 Western blot取对数生长期的人胃癌MGC-803细胞进行消化,接种于25 cm2培养瓶中,待其长到80%~90%左右,每瓶分别加入3 mL用RPMI 1640培养液稀释的终浓度为0、10、20、40 μmol·L-1的RAA-11。作用48 h后,收集细胞上清液并消化细胞,PBS缓冲液洗3次后,加裂解液(RIPA:PMSF:Cocktail=100:1:1)冰上裂解20 min,4 ℃、12 000 r·min-1离心20 min。BCA法检测蛋白浓度后,上清液加上样蛋白缓冲液煮沸变性5 min。取40 μg蛋白样品先60 V恒压电泳,待样品电泳至分离胶后,将电压换成120 V电泳至胶底部。半干转印槽将蛋白转移至PVDF膜上,TBST洗膜3次,用5% BSA室温封闭30 min,一抗冰上孵育过夜。二抗室温避光孵育1 h,TBST避光洗膜3次后,用Odyssey红外荧光扫描成像系统扫描显影。
2.7 数据分析采用SPSS 20.0统计软件进行分析,数据用x±s表示,组间均数比较采用t检验,两组以上均数比较采用单因素方差分析。所有实验均重复3次。
3 结果 3.1 RAA-11对细胞增殖的抑制作用Tab 1结果显示,RAA-11对MGC-803细胞的增殖有明显抑制作用,并存在浓度依赖性和时间依赖性。线性回归结果得出RAA-11作用MGC-803细胞24、36、48 h的IC50分别是72.781、59.979、40.625 μmol·L-1。RAA-11作用MGC-803细胞48 h后,其浓度变化对细胞增殖的抑制作用较为突出,故选择RAA-11作用MGC-803细胞48 h进行后续实验。
| Concentration/ μmol·L-1 |
Cell survival rate/% | ||
| 24 h | 36 h | 48 h | |
| 0 | 100.000±0.000 | 100.000±0.000 | 100.000±0.000 |
| 10 | 91.341±3.055** | 90.239±1.509** | 75.596±1.671** |
| 20 | 80.016±1.732** | 71.608±1.399** | 61.442±1.553** |
| 40 | 65.559±1.522** | 53.342±1.434** | 47.293±1.497** |
| 80 | 48.634±2.082** | 42.399±2.066** | 16.116±1.103** |
| 160 | 24.011±3.002** | 16.752±2.551** | 12.403±1.094** |
| **P < 0.01 vs 0 μmol·L-1 group | |||
如Fig 2所示,与对照组比较,不同浓度RAA-11作用胃癌MGC-803细胞48 h后,MGC-803细胞的克隆抑制率随着药物浓度升高而升高,RAA-11浓度0、10、20、40 μmol·L-1的克隆抑制率分别为15.8%、62.8%、81.4%、88.6%。抑制效果具浓度依赖性,与MTT法共同说明RAA-11可以有效抑制胃癌MGC-803细胞的增殖。
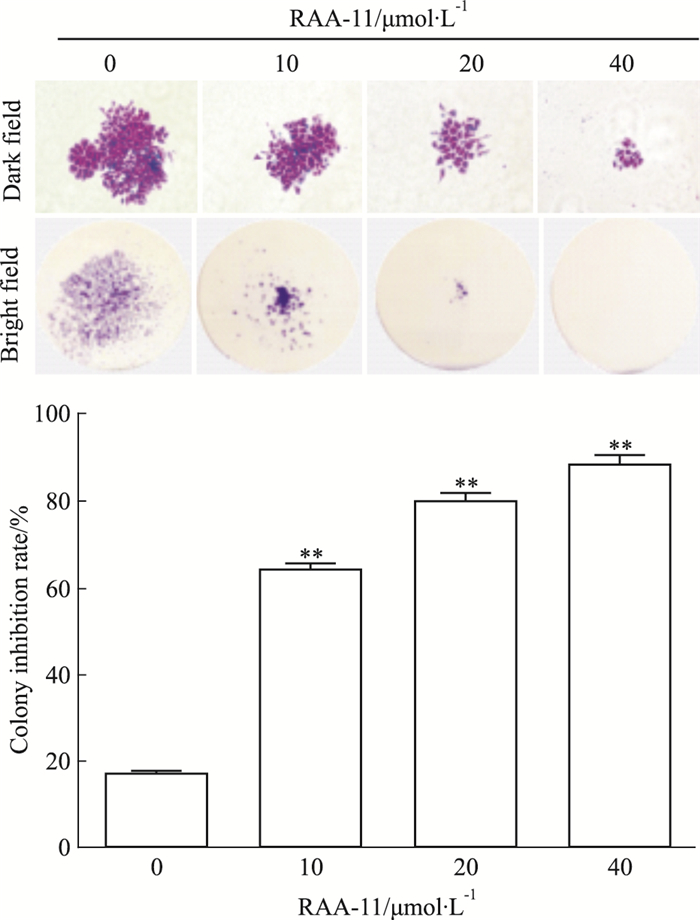
|
| Fig 2 Influence of different concentrations of RAA-11 on colony inhibition rate of human gastric cancer MGC-803 cells (x±s, n=3) **P < 0.01 vs 0 μmol·L-1 group |
如Fig 3所示,与对照组比较,RAA-11作用MGC-803细胞48 h后,细胞出现明显的凋亡特征,在荧光显微镜下呈强荧光反应,随着药物浓度增加,细胞凋亡率明显上升。结果提示RAA-11对MGC-803细胞有一定的促凋亡作用。
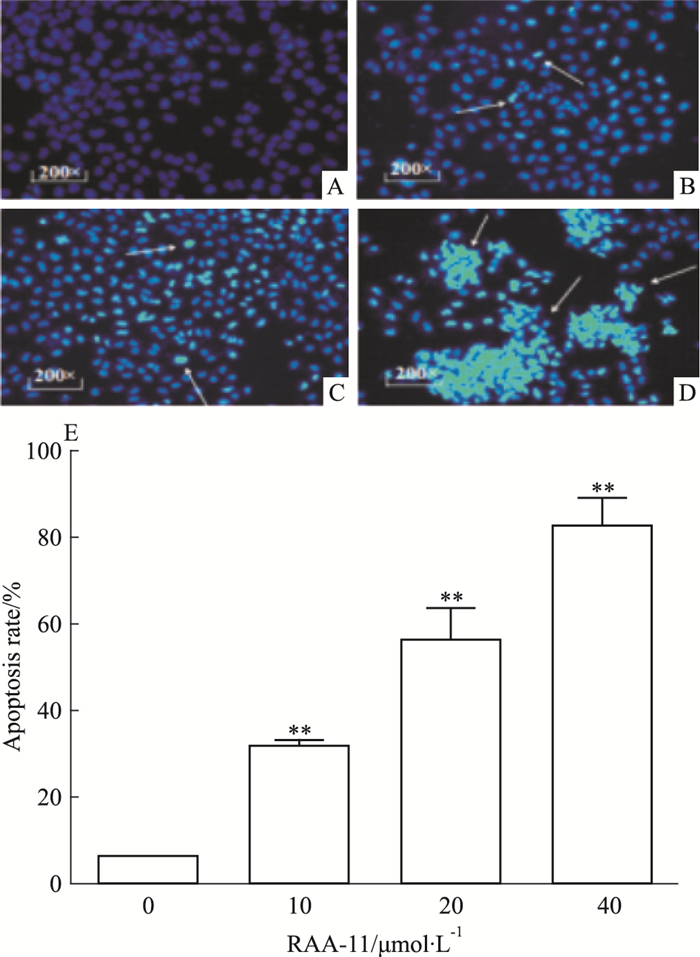
|
| Fig 3 Influence of different concentrations of RAA-11 on nucleus apoptotic morphology and apoptotic rate of human gastric cancer MGC-803 cells (×200) A:RAA-11 0 μmol·L-1; B: RAA-11 10 μmol·L-1; C:RAA-11 20 μmol·L-1; D:RAA-11 40 μmol·L-1; E:Histogram of apoptosis rate(x±s, n=3). The arrows pointed to the apoptotic nucleus.**P < 0.01 vs 0 μmol·L-1 group. |
如Fig 4所示,RAA-11(0、10、20、40 μmol·L-1)作用于MGC-803细胞48 h后,细胞凋亡率明显升高。结果表明,RAA-11能够引起MGC-803细胞的凋亡,且呈剂量依赖关系。
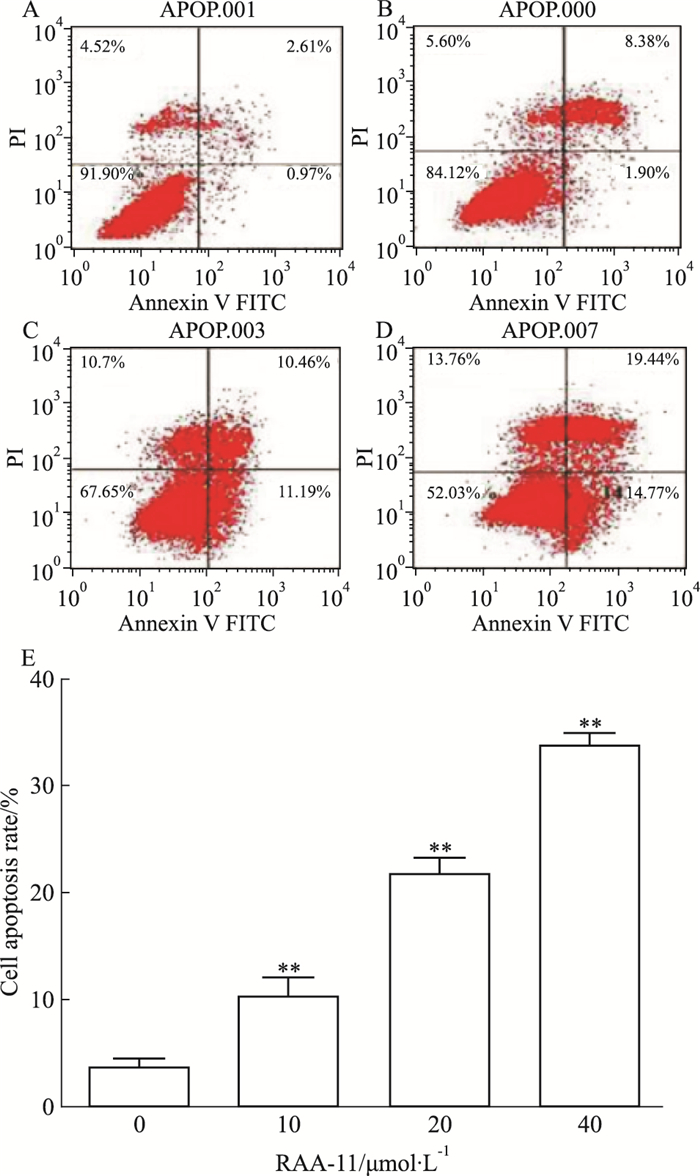
|
| Fig 4 Influence of different concentrations of RAA-11 on apoptotic rate of human gastric cancer MGC-803 cells (x±s, n=3) A:RAA-11 0 μmol·L-1; B: RAA-11 10 μmol·L-1; C:RAA-11 20 μmol·L-1; D:RAA-11 40 μmol·L-1; E:Histogram of cell apoptosis rate.**P < 0.01 vs 0 μmol·L-1 group. |
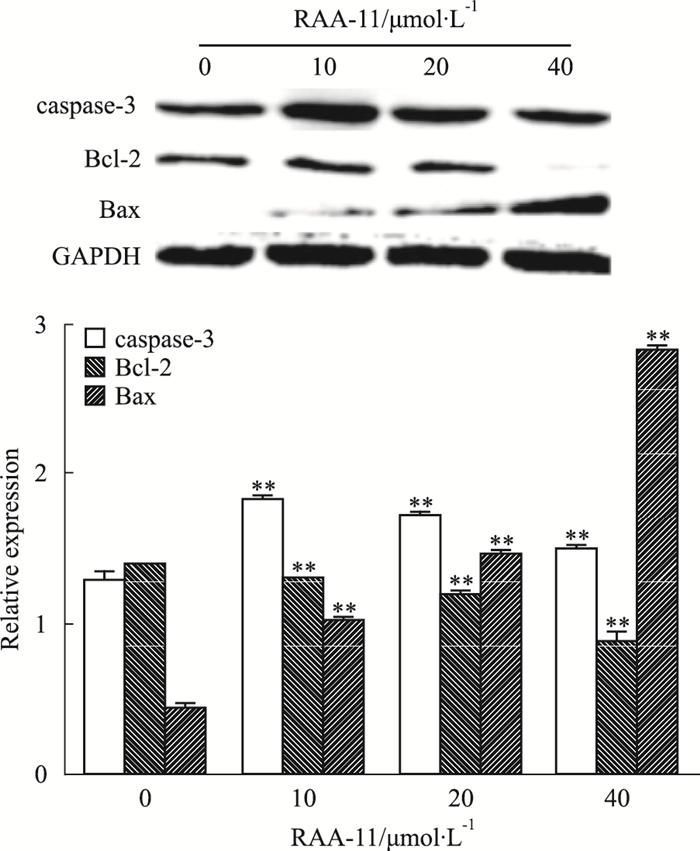
Fig 5的Western blot结果显示,RAA-11作用于MGC-803细胞48 h后,与对照组比较,抑凋亡蛋白Bcl-2表达降低,促凋亡蛋白Bax和caspase-3表达增加,提示RAA-11可诱导MGC-803细胞的凋亡。
|
| Fig 5 Influence of different concentrations of RAA-11 on apoptosis related protein expressions in human gastric cancer MGC-803 cells (x±s, n=3) **P < 0.01 vs 0 μmol·L-1 group |
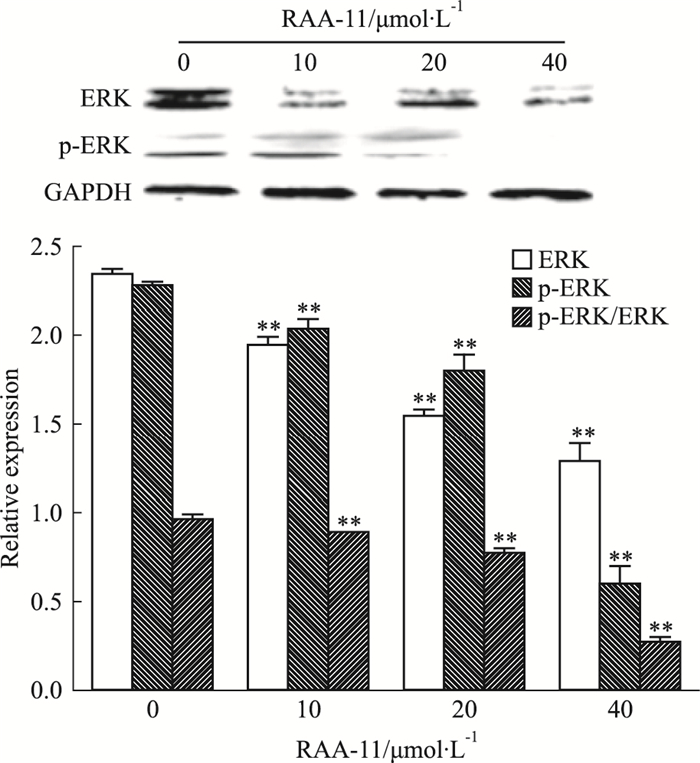
如Fig 6所示,RAA-11作用于MGC-803细胞48 h后,与对照组比较,通路蛋白ERK、p-ERK表达明显下调,提示RAA-11可能通过抑制MAPK-ERK通路来诱导MGC-803细胞凋亡。
|
| Fig 6 Influence of different concentrations of RAA-11 on ERK pathway protein expressions in human gastric cancer MGC-803 cells (x±s, n=3) **P < 0.01 vs 0 μmol·L-1 group |
RA是一种含多酚羟基的化合物,化学名称为R(t)2-[[3-(3,4-二羟基苯基)-1-氧代-2-丙烯基]氧基]-3,4-二羟基苯丙酸,由一分子咖啡酸和一分子3,4-二羟基苯基乳酸缩合而成[8],其成分主要为二萜酚类、黄酮类、三萜类、精油等。RA具有较好的水溶性和稳定性,且具有抗氧化、抗菌、美容、抗肿瘤、消炎、抗心血管疾病等诸多作用[9],近年来,其抗肿瘤效果颇受关注。RA植物来源丰富,可通过多种途径发挥抗肿瘤作用[10],作为抗肿瘤药物具有良好的应用前景。
细胞凋亡是最常见的细胞生理性死亡形式(即非病理性细胞死亡),可发生于胚胎发育、组织重建、免疫调节及肿瘤退化的各个时期[11]。caspase-3是一种含有277个氨基酸残基的蛋白酶,分子质量约32 ku,是caspase家族在细胞凋亡过程中最主要的终末剪切酶之一。其下游因子Bcl-2是一种癌基因,它具有抑制凋亡的作用,目前已经发现的Bcl-2蛋白家族按功能可分为两类:一类是像Bcl-2一样具有抑制凋亡作用,如Bcl-xL、Bcl-w、Mcl-1、A1等; 而另一类具有促进凋亡作用,如Bax、Bcl-xS、Bik/Nbk、Bid等[12]。我们的研究显示,RAA-11能够促进凋亡启动因子caspase-3和促凋亡因子Bax的表达,抑制抑凋亡因子Bcl-2的表达,提示RAA-11能够诱导人胃癌MGC-803细胞的凋亡。
ERK是一类丝/苏氨酸蛋白激酶,是传递丝裂原信号的信号转导蛋白[13]。它正常定位于胞质,当激活后转位至胞核,调节转录因子活性,产生细胞效应。已知ERK家族有5个亚族,包括ERK1~ERK5,其中ERK1和ERK2途径是ERK家族中研究最彻底的[14]。ERK调节着细胞的增殖、分化和存活,是多种生长因子(EGF、NGF、PDGF等)的下游蛋白。ERK及其信号途径在肿瘤侵袭和转移过程中起中介和放大信号的作用:一方面,接受大量来自生长因子、丝裂原、环境刺激等的信号;另一方面,通过ERK信号级联反应作用于核转录因子,如AP-1、NF-κB等,调控基因表达。在许多人类的癌症(如口腔癌、黑色素瘤、乳腺癌等)中都可发现ERK的过度激活[15]。本研究显示,RAA-11明显下调了通路蛋白ERK、p-ERK的表达量,我们猜想RAA-11可能通过抑制ERK/MAPK通路,抑制人胃癌MGC-803细胞增殖并诱导其凋亡。
综上所述,本研究显示,RAA-11能够有效抑制人胃癌MGC-803细胞的增殖,并诱导其凋亡。然而,RAA-11这些效应的确切机制仍不清楚。我们的初步研究结果表明,RAA-11诱导MGC-803细胞凋亡可能与其抑制ERK/MAPK通路有关,为RAA-11的开发与应用奠定了科学的理论基础。
| [1] |
Siegel R L, Miller K D, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. doi:10.3322/caac.21442 |
| [2] |
Wang X T, Xie Y B, Xiao Q. siRNA targeting of Cdx2 inhibits growth of human gastric cancer MGC-803 cells[J]. World J Gastroenterol, 2012, 18(16): 1903-14. doi:10.3748/wjg.v18.i16.1903 |
| [3] |
Zhu Y W, Yan J K, Li J J, et al. Knockdown of radixin suppresses gastric cancer metastasis in vitro by up-regulation of E-cadherin via NF-κB/Snail pathway[J]. Cell Physiol Biochem, 2016, 39(6): 2509-21. doi:10.1159/000452518 |
| [4] |
Li Y, Ye J, Chen Z, et al. Annonaceous acetogenins mediated up-regulation of Notch2 exerts growth inhibition in human gastric cancer cells in vitro[J]. Oncotarget, 2017, 8(13): 21140-52. |
| [5] |
Sotnikova R, Okruhlicova L, Vlkovicova J, et al. Rosmarinic acid administration attenuates diabetes-induced vascular dysfunction of the rat aorta[J]. J Pharm Pharmacol, 2013, 65(5): 713-23. doi:10.1111/jphp.12037 |
| [6] |
Zhu F, Asada T, Sato A, et al. Rosmarinic acid extract for antioxidant, antiallergic, and alpha-glucosidase inhibitory activities, isolated by supramolecular technique and solvent extraction from Perilla leaves[J]. J Agric Food Chem, 2014, 62(4): 885-92. doi:10.1021/jf404318j |
| [7] |
韦立群, 李清, 甘嘉亮, 等. 迷迭香酸衍生物RAD-9通过PI3K/Akt和p38 MAPK信号通路诱导胃癌MGC-803细胞凋亡[J]. 中国药理学通报, 2018, 34(2): 256-60. Wei L Q, Li Q, Gan J L, et al. Rosemary acid derivatives RAD-9 through PI3K/Akt and p38 MAPK signaling pathway induced MGC-803 gastric cancer cell apoptosis[J]. Chin Pharmacol Bull, 2018, 34(2): 256-60. doi:10.3969/j.issn.1001-1978.2018.02.021 |
| [8] |
李玉龙, 张雪, 廖情谊, 等. 迷迭香酸的合成途径及药理作用研究进展[J]. 现代农业科技, 2016(23): 66-7. Li Y L, Zhang X, Liao Q Y, et al. Research progress on the synthesis pathway and pharmacological action of rosemary acid[J]. Mod Agric Technol, 2016(23): 66-7. doi:10.3969/j.issn.1007-5739.2016.23.037 |
| [9] |
齐锐, 董岩. 迷迭香的化学成分与药理作用研究进展[J]. 广州化工, 2012, 40(11): 43-4, 66. Qi R, Dong Y. Research on the chemical composition and pharmacological action of rosemary[J]. Guangzhou Chem, 2012, 40(11): 43-4, 66. doi:10.3969/j.issn.1001-9677.2012.11.017 |
| [10] |
冯茹, 黄雯雯, 蒙宁, 等. 迷迭香酸抗恶性肿瘤作用研究进展[J]. 四川生理科学杂志, 2015, 37(3): 132-5. Feng R, Huang W W, Meng N, et al. Research progress on the anti-malignant tumor of rosemary[J]. Sichuan J Physiol Sci, 2015, 37(3): 132-5. |
| [11] |
Giansanti V, Torriglia A, Scovassi A I. Conversation between apoptosis and autophagy: "Is it your turn or mine?"[J]. Apoptosis, 2011, 16(4): 321-33. doi:10.1007/s10495-011-0589-x |
| [12] |
王宇锋, 陈超, 杨春, 等. 6-姜烯酚诱导人结直肠癌细胞凋亡及与Bax、Bcl-2、Caspase3和PARP1基因表达的影响[J]. 现代食品科技, 2017, 33(11): 7-15. Wang Y F, Chen C, Yang C, et al. 6-gingerol induced apoptosis of colorectal cancer cells and its effects with Bax, Bcl-2, Caspase3 and PARP1 gene expression[J]. Mod Food Technol, 2017, 33(11): 7-15. |
| [13] |
陈豫.骆驼蓬子提取物β-咔啉类生物碱对人胃癌SGC-7901细胞凋亡及PTEN, ERK mRNA表达的影响[D].乌鲁木齐: 新疆医科大学, 2015. Chen Y. Effect of β-carboline alkaloid extract of Peganum harmala L on apoptosis of human gastric cancer SGC-7901 cells and expression of PTEN and ERK mRNA[D]. Urumqi: Xinjiang Medical University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10760-1015410459.htm |
| [14] |
韦立群, 徐成飞, 李婉婷, 等. NF-κB和MAPK信号通路参与金雀异黄酮诱导乳腺癌MDA-MB-231细胞凋亡的体外研究[J]. 中国药理学通报, 2018, 34(5): 690-4. Wei L Q, Xu C F, Li W T, et al. NF-κB and MAPK signaling pathway were involved of MDA-MB-231 cell apoptosis in breast cancer induced by genistein in vitro studies[J]. Chin Pharmacol Bull, 2018, 34(5): 690-4. doi:10.3969/j.issn.1001-1978.2018.05.020 |
| [15] |
邹佩良, 张秋红, 周建甫, 等. 重楼皂苷Ⅰ通过ERK/P65/DNMT1通路抑制前列腺癌PC3细胞生长的分子机制[J]. 中华男科学杂志, 2018, 24(3): 199-205. Zou P L, Zhang Q H, Zhou J F, et al. Molecular mechanism to inhibit the growth of PC3 cells in prostate cancer with the polyphyllinⅠby ERK/P65/DNMT1 pathways[J]. J Chin Male Sci, 2018, 24(3): 199-205. |